Пути повышения эффективности и безопасности антикоагулянтной терапии у больных тромбозами глубоких вен нижних конечностей
Автор: Крылов А.Ю., Шулутко А.М., Серебрийский И.И., Верхоломова Ф.Ю., Хмырова С.Е., Манукян И.Г., Османов Э.Г., Петровская А.А., Кошатников К.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Клинические исследования
Статья в выпуске: 5 (33), 2013 года.
Бесплатный доступ
Широкое применение антикоагулянтной терапии при лечении различных ВТЭО требует контроля за ее эффективностью и безопасностью. С 2011 по 2013 гг. провели проспективное исследование с целью изучения динамики лабораторных показателей плазменного гемостаза на фоне антикоагулянтной терапии у 60 больных (23 женщин и 37 мужчин) с идиопатическими тромбозами глубоких вен нижних конечностей. Средний возраст больных составил 57,4±13,6 лет. Антикоагулянтную терапию проводили нефракционированным гепарином по стандартным схемам. Исследование системы гемостаза, наряду с общеизвестными стандартными лабораторными показателями (АЧТВ, D-димер, фибриноген, уровень протромбина, МНО, ПТИ), включало один из глобальных коагулогических тестов - метод Тромбодинамики, основным показателем которой являлась Vst (стационарная скорость роста сгустка). Результаты антикоагулянтной терапии оценивали по динамике клинической симптоматики, результатам УЗАС и динамике лабораторных параметров плазменного гемостаза. Проведенное исследование показало, что антикоагулянтная терапия НФГ с последующим переходом на варфарин является эффективным методом консервативного лечения больных с идиопатическими тромбозами и позволяет добиться лабораторно подтвержденной гипокоагуляции, сопровождаемой клиническими и УЗ-контролируемыми улучшениями. Необходимо отметить, что только динамика УЗ-картины может рассматриваться как критерий определения дальнейшей тактики лечения больных с ТГВ. Стандартные лабораторные показатели и данные теста Тромбодинамики позволили осуществлять контроль за эффективностью антикоагулянтной терапии, выявлять пациентов в состоянии повышенной тромботической готовности и опасностью развития ретромбозов. Данные теста Тромбодинамики (Vst) показали высокую чувствительность (100%) и специфичность (70%) в отношении оценки неэффективности варфаринотерапии. Отсутствие геморрагических осложнений у обследованных больных говорит о достаточном уровне контроля безопасности АКТ.
Тромбоз глубоких вен, антикоагулянтная терапия, тест тромбодинамика
Короткий адрес: https://sciup.org/142211115
IDR: 142211115 | УДК: 616.1;
Текст научной статьи Пути повышения эффективности и безопасности антикоагулянтной терапии у больных тромбозами глубоких вен нижних конечностей
Одной из наиболее частых причин развития ТЭЛА является тромбоз глубоких вен нижних конечностей [1, 2, 8, 10– 12]. Даже при выборе активной лечебной тактики у больных с тромбозами (хирургическое лечение или варианты тромболизиса) антикоагулянтная терапия была и остается осно- вополагающим видом лечения [3–5, 9, 12]. Широкое применение антикоагулянтной терапии в клинической практике предусматривает возможность всестороннего контроля ее эффективности и безопасности. Наиболее информативным является изучение лабораторных параметров системы плазменного гемостаза на этапах проведения антикоагулянтной терапии (АКТ). Однако анализ литературы выявил, что этот вопрос изучен недостаточно [1–4, 6, 7, 10, 12].
Материалы и методы
В клинике факультетской хирургии №2 лечебного факультета Первого МГМУ им. И.М. Сеченова на базе ГКБ №61 ДЗ г. Москвы с ноября 2011 года по июнь 2013 года нами впервые проведено проспективное исследование динамики основных лабораторных показателей системы плазменного гемостаза на фоне проведения АКТ у больных идиопатическими тромбозами глубоких вен нижних конечностей с использованием стандартных лабораторных показателей и метода тромбодинамики.
В исследование включили 60 больных (23 женщины и 37 мужчин) с идиопатическими тромбозами глубоких вен нижних конечностей, поступивших для лечения в хирургические отделения ГКБ №61 ДЗ г. Москвы (табл. 1).
Средний возраст больных составил 57,4±13,6 лет, т.е. в исследовании преобладали пациенты (68,3%) пожилого и старческого возраста, и у подавляющего большинства обследованных больных (у 53 из 60) выявили сопутствующие заболевания, которые могли оказывать влияние как непосредственно на антикоагулянтную терапию, так и на конечный (отдаленный) результат лечения.
У большинства больных (80%), независимо от локализации тромботического процесса, длительность заболевания не превышала 14 суток (у половины из них до 5 суток) и в среднем составила 10,13±8,3 суток от начала заболевания.
В исследование включили 32 больных с проксимальной локализацией тромбоза (53,3%) – от уровня ПБВ и выше, и соответственно 28 больных (46,7%) с дистальной локализацией тромбоза до уровня ПкВ включительно (табл. 2).
Флотирующие тромбы с различной локализацией выявили у 13 больных (21,6%). У 4 больных констатировали появление флотации тромба на фоне антикоагулянтной терапии. Таким образом, в процессе антикоагулянтной терапии флотирующие тромбы выявили у 17 больных. При выявлении флотации тромба оценивали ее протяженность. Флотацию 4 см и более определяли как опасную в плане развития ТЭЛА и в этих случаях, при отсутствии положительной динамики при выполнении ультразвукового ангиосканирования (УЗАС) в течение ближайших 1–2 суток, считали целесообразным применение хирургических методов профилактики ТЭЛА.
Протяженность тромботического процесса на пораженной конечности оценивали по шкале Marder, разра-
Таблица 1
Распределение больных по полу, возрасту
Все пациенты, доставленные в приемное отделение ГКБ № 61 ДЗ г. Москвы с подозрением на острый тромбоз глубоких вен, подвергались обязательному обследованию. Обследование включало целенаправленный сбор жалоб и
Таблица 2
Локализация и характер тромботического процесса у больных (n=60)
|
Локализация и характер тромбоза |
Мужчины |
Женщины |
Всего |
||||
|
абс. число |
% |
абс. число |
% |
абс. число |
% |
||
|
Тромбоз на голени |
окклюзия |
9 |
15,0 |
12 |
20,0 |
21 |
35,0 |
|
флотация |
– |
– |
1 |
1,7 |
1 |
1,7 |
|
|
Тромбоз ПкВ |
окклюзия |
3 |
5,0 |
– |
– |
3 |
5,0 |
|
флотация |
2 |
3,3 |
1 |
1,7 |
3 |
5,0 |
|
|
Тромбоз до ОБВ |
окклюзия |
13 |
21,6 |
7 |
11,7 |
20 |
33,3 |
|
флотация |
8 |
13,3 |
1 |
1,7 |
9 |
15,0 |
|
|
ИФТ |
окклюзия |
1 |
1,7 |
2 |
3,3 |
3 |
5,0 |
|
флотация |
– |
– |
– |
– |
– |
– |
|
|
Итого |
36 |
24 |
60 |
100 |
|||
анамнеза, клинический осмотр, исследование рутинных лабораторных показателей крови и мочи, инструментальные методы обследования (ЭКГ, рентгенографию грудной клетки), при необходимости консультацию терапевта, гинеколога. Основным диагностическим методом являлось ультразвуковое ангиосканирование (УЗАС) венозной и артериальной систем нижних конечностей.
Проведенные ранее в клинике исследования подтвердили необходимость выполнения онкопоиска у каждого пациента с тромбозом глубоких вен нижних конечностей. Для этого в обследование включали УЗИ органов брюшной полости, ЭГДС и колоноскопию.
При поступлении отек конечности различной степени выраженности выявили у большинства больных (у 52 больных – 86,7%) с тромбозами глубоких вен нижних конечностей. Болевой синдром выявили при поступлении у 50 больных – 83,3% и его выраженность зависела от длительности анамнеза заболевания – чем продолжительнее был анамнез, тем менее выражен был болевой симптомокомплекс. У 10 больных при поступлении боли в пораженной конечности практически отсутствовали. Все результаты клинических и ультразвуковых данных о пациентах заносили в специально разработанную интерактивную карту, которая позволяла впоследствии проводить их статистическую обработку.
Критериями включения и невключения больных в исследование были – отсутствие данных за новообразования, отсутствие данных за инфекционный процесс, также в исследование не включались больные, у которых тромбоз развился после перенесенной травмы или оперативного вмешательства. В протокол включали только тех больных, у которых при выполнении УЗАС было получено подтверждение диагноза магистрального флеботромбоза вен нижних конечностей.
Исследование разбили на 8 «контрольных» точек, в которых оценивали клинико-инструментальные параметры и данные лабораторных исследований.
-
1 точка – в момент поступления больного, до начала антикоагулянтной терапии;
-
2 точка – через 2 часа после первого введения НФГ (пик активности НФГ);
-
3 точка – непосредственно перед второй иньекцией НФГ;
-
4 точка – на 3–4 сутки АКТ гепарином, перед очередной инъекцией гепарина;
-
5 точка – в день начала терапии варфарином, перед очередной инъекцией гепарина;
-
6 точка – на 3–4 сутки приема варфарина, перед последней инъекцией гепарина;
-
7 точка – через 7 дней от начала терапии варфарином (через 3 дня после прекращения терапии гепарином);
-
8 точка – через месяц после выписки из стационара, на фоне терапии варфарином.
Учитывая, что формат настоящей статьи не предусматривал изучения отдаленных результатов антикоагулянтной терапии, 8 точку протокола не оценивали.
Антикоагулянтную терапию проводили нефракциони-рованным гепарином (фирмы «Вraun», Германия) по стандартным общеизвестным схемам (согласно «Российским клиническим рекомендациям по диагностике, лечению и профилактике ВТЭО) с последующим переводом всех больных на варфарин [9]. У 22 больных (36,7%) применили короткую и 38 (63,3%) больным – длинную схему АКТ.
Контрольное УЗАС выполняли всем больным при выписке из стационара и осмотре через месяц. В процессе антикоагулянтной терапии УЗАС выполняли больным по показаниям при ухудшении клинической картины или при возникновении симптомов прогрессирования ТГВ или симптомов ТЭЛА.
Лабораторные исследования системы гемостаза, наряду со стандартными показателями (АЧТВ, уровень D-димера, фибриноген, уровень протромбина, МНО, АТ-III, антиХа, протеин С), включали тест тромбодинамики, основными показателями которого являлись Tlag (время задержки роста фибринового сгустка) и Vs (стационарная скорость роста сгустка, или просто скорость роста сгустка) (рис. 1).
Результаты
Результаты антикоагулянтной терапии у 60 больных с тромбозами глубоких вен нижних конечностей оценивали по следующим критериям:
-
1. Положительная динамика клинической симптоматики (уменьшение болевого синдрома и отека конечности, отсутствие клинических признаков ТЭЛА);
-
2. Положительная динамика при УЗАС (выявление начальной реканализации тромба, отсутствие прогрессирования тромбоза в проксимальном направлении);
-
3. Динамика лабораторных параметров плазменного гемостаза (достижение эффективной гипокоагуляции на фоне гепаринотерапии и после перевода больного на варфарин).
У 60 больных, участвующих в исследовании, каких-либо геморрагических осложнений и летальных исходов зафик-

Рис. 1. Регистратор Тромбодинамики Т-2 («ООО Гемакор», Россия)
сировано не было. 8 больных с прогрессированием тромботического процесса и развитием на фоне антикоагулянтной терапии высокой угрозы ТЭЛА переведены в дежурные сосудистые стационары г. Москвы, а остальные 52 больных после прохождения курса антикоагулянтной терапии были выписаны на амбулаторное долечивание с подобранной дозой варфарина. Динамика клинических симптомов на фоне антикоагулянтной терапии в группе исследуемых больных была разнородна. В конечном итоге всех пролеченных больных разделили на три группы – с отрицательной динамикой клинической картины, без динамики клинической симптоматики и с положительной динамикой на фоне лечения.
У большинства исследуемых больных (54 больных – 90%) на фоне антикоагулянтной терапии отметили уменьшение или полное исчезновение болевого синдрома и регресс отека пораженной конечности, что характеризовали как положительную динамику. Следует отметить, что даже у 5 переведенных больных отметили как субъективную, так и объективную положительную динамику клинической картины заболевания. У 4 больных (6,7%) с отсутствием динамики на фоне АКТ сохранялись либо болевые ощущения, либо отек в пораженной конечности. И только у 2 больных (3,3%) на фоне проводимого лечения отметили отрицательную динамику клинической симптоматики, которая проявилась в виде усиления болевого синдрома или распространением отека в пораженной конечности в проксимальном направлении.
Несмотря на относительно короткий период пребывания в стационаре больных с тромбозами глубоких вен нижних конечностей, нам удалось констатировать положительную динамику тромботического процесса на момент выписки больного из стационара (на 15–18 сутки) у 15 больных. У всех этих больных выявили признаки начальной реканализации магистральной вены на участке тромбоза на голени и бедре соответственно.
В целом отсутствие динамики УЗ-картины на фоне антикоагулянтной терапии в 7 точке исследования отметили у 39 больных.
Флотацию тромба различной протяженности выявили у 17 больных, причем у 11 больных она была выявлена при УЗАС в момент поступления в стационар, а у 6 больных появилась на фоне проведения антикоагулянтной терапии.
Адекватная комплексная консервативная терапия способствовала фиксации флотирующего фрагмента тромба у 8 больных. В среднем это происходило на 3–5 сутки после выявления флотации. У 8 больных не удалось добиться перевода флотирующего тромбоза в окклюзивный, и эти больные были переведены в дежурные сосудистые стационары для проведения хирургической профилактики ТЭЛА.
Необходимо отметить, что клинические данные и данные контрольного УЗАС в ряде случаев не совпадали. На фоне субъективного улучшения состояния и регресса клинических симптомов заболевания у 6 больных констатировали отрицательную динамику УЗ-картины тромбоза, что имело решающее значение при решении вопроса о переводе больного в сосудистый стационар.
Стандартные лабораторные показатели плазменного гемостаза и глобальный коагулогический тест (тест тромбоди-намика) исследовали во всех контрольных точках антикоагулянтной терапии. Полученные данные отражены в табл. 3.
Как видно из табл. 3, все показатели плазменного гемостаза изменялись на фоне антикоагулянтной терапии по разному и, соответственно, имели разный вес при оценке эффективности лечения.
Сравнение стандартных лабораторных показателей коагулограммы и расширенных лабораторных результатов, полученных, в том числе и тестом тромбодинамики, позволили выявить следующие закономерности.
По эффективности достижения целевых лабораторных показателей на фоне антикоагулянтной терапии уже во 2 и
Таблица 3
Изменения лабораторных показателей гемостаза в контрольных точках исследования на фоне АКТ
|
Показатель и референсные значения |
1 точка |
2 точка |
3 точка |
4 точка |
5 точка |
6 точка |
7 точка |
|
D-димер (<250 нг/мл) |
792±702,6 |
743±769,8 |
679±845,2 |
501±351,3 |
351±369,2 |
276±549,8 |
220±353,6 |
|
АЧТВ (26,5–37,5 сек.) |
26,9±9,08 |
31,3±12,78 |
29,3±9,82 |
37,05±21,55 |
36,95±18,97 |
34,8±13,17 |
33,6±11,54 |
|
МНО (0,8–1,2) |
0,99±0,45 |
1,1±1,22 |
1,05±0,29 |
1,03±0,19 |
1,01±0,72 |
1,4±0,78 |
2,6±1,95 |
|
Фибриноген (1,8–3,5 г/л) |
4,15±1,19 |
4,33±1,11 |
4,13±1,19 |
4,36±0,9 |
4,38±0,98 |
4,35±1,05 |
3,99±1,15 |
|
Протромбин (75–120%) |
100±24,8 |
90±25,3 |
95,9±22,7 |
99,1±21,3 |
97,45±29,8 |
60,55±27,8 |
34,3±22,6 |
|
Протеин С (94–124%) |
100±28,6 |
100±24,2 |
97,6±25,3 |
100±25,8 |
101±27,2 |
72,3±29,5 |
39,85±31,9 |
|
АТ-III (86–116%) |
93,4±13,14 |
93,6±12,7 |
93,9±16,7 |
94,7±13,6 |
95,8±16,5 |
94,6±16,8 |
94,3±18,5 |
|
Tlag (0,6–1,5 мин.) |
1,63±1,53 |
1,38±1,81 |
1,63±1,8 |
1,38±2,21 |
1,88±2,13 |
2,38±3,58 |
3,88±4,69 |
|
Vs (20–30 мкм/мин) |
23,4±6,29 |
12,1±8,0 |
14,3±8,6 |
8,3±6,16 |
8,0±6,45 |
9,2±6,3 |
16,5±8,15 |
3 точке (через 2 часа после первой иньекции и непосредственно перед второй инъекцией НФГ) исследования , произошло разделение всех обследованных больных на три группы (рис. 2).
-
1 группа – группа эффективного лечения (эффективное достижение гипокоагуляции как по данным теста тромбодинамики, так и по АЧТВ). К этой группе отнесли 12 больных (9 м+3 ж), большинство с проксимальной локализацией тромбоза (6 до ОБВ и 2 ИФТ). Согласно стандартной схеме АКТ после перевода на варфарин, 10 больных этой группы выписаны с положительной динамикой на амбулаторное лечение, а 2 больных с отсутствием положительной динамикой при УЗАС и сохранением угрозы развития ТЭЛА впоследствии были переведены в дежурные сосудистые отделения города.
-
2 группа – неэффективного лечения по данным обоих тестов (ни тромбодинамики, ни АЧТВ не отреагировали на первую иньекцию НФГ). Из 15 больных (10 м+5 ж) этой группы у 10 диагностировали проксимальную локализацию
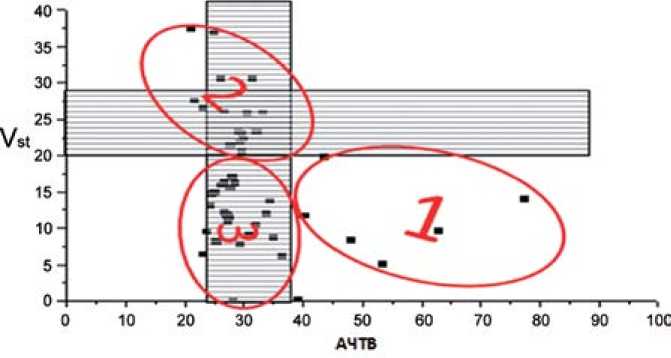
Рис. 2. Vs-AЧTВ 1 сутки терапии гепарином, перед 2 инъекцией (3 т)
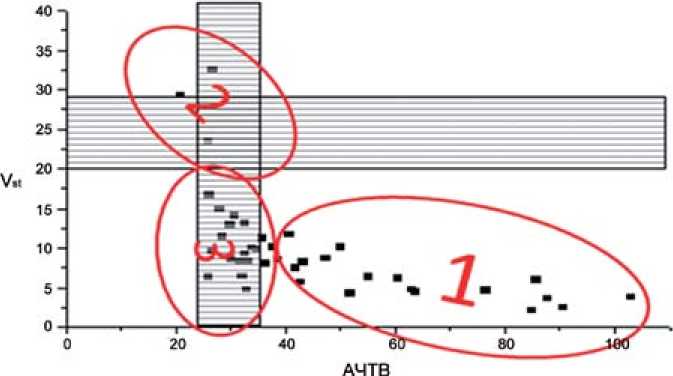
Рис. 3. Vs-AЧTВ 3-4 сутки терапии гепарином (4 точка)
тромбоза (у 2 с флотацией), у 5 больных – дистальную (у 2 с флотацией). 4 больных с отрицательной динамикой клинической картины, подтвержденной данными ультразвукового исследования (увеличение флотации) были переведены в специализированный сосудистый стационар.
-
3 группа – группа недостаточной эффективности (в которой по данным теста тромбодинамики лечение было эффективным, а показатель АЧТВ не отреагировал на АКТ) Эта группа оказалась самой многочисленной и включала 33 больных (18 м+15 ж). В этой группе проксимальный уровень тромбоза выявили у 14 больных (у 7 с флотацией) и у 19 больных – дистальный (у 2 с флотацией). На фоне гепа-ринотерапии у 2 больных с проксимальными тромбозами на фоне ухудшения клинической картины выявили увеличение флотирующего сегмента тромба, и больные были переведены в дежурный сосудистый стационар.
В дальнейшем уже к 4 контрольной точке (3–4 сутки ге-паринотерапии) у большего количества больных удалось достичь эффективной гипокоагуляции как по АЧТВ, так и по данным теста тромбодинамики, но разделение на 3 группы эффективности лечения сохранилось (рис. 3).
Большее количество больных оказались в 1 группе (это было ожидаемо), но во второй группе остались 3 больных, у которых по данным всех лабораторных показателей антикоагулянтная терапия была неэффективной. Двое больных этой группы с появлением флотации и прогрессированием тромботического процесса в проксимальном направлении впоследствии были переведены в специализированные сосудистые отделения.
Третья группа больных, в которой эффективная гипокоагуляция была достигнута только по данным теста тромбодинамики оставалась достаточно многочисленной (19 больных), но меньшей по сравнению со 2 и 3 точками.
Интересные данные по оценке эффективности антикоагулянтной терапии были получены в 7 точке – непосредственно перед выпиской больного из стационара, 5–7-е сутки приема варфарина после отмены НФГ (рис. 4).
У большинства обследованных больных на варфарине по данным Vs – скорости роста сгустка, сохранялась умеренная гипокоагуляция, однако у 12 больных Vs вернулась к нормальным значениям. При этом у 5 больных этой группы выявили резкий подъем уровня D-димера. На этом фоне у 2 больных не удалось достичь целевых значений МНО, а у 3 больных целевые значения МНО были достигнуты. Несмотря на это, все эти 12 больных были выписа- ны в субъективно удовлетворительном состоянии на амбулаторное долечивание на различных дозах варфарина.
Окончательные результаты антикоагулянтной терапии 60 больных перед выпиской из стационара (7 точка исследования) представлены в табл. 4.
По данным, приведенным в табл. 4, видно, что в целом антикоагулянтная терапия у большинства больных идиопатическими тромбозами глубоких вен нижних конечностей способствовала достижению положительного результата лечения по динамике клинической симптоматики у 54 больных (90%), по отсутствию отрицательной динамики при УЗАС – у 54 больных (90%) и по данным лабораторных показателей, по показателям которых эффективной и безопасной гипокоагуляции достигли у 50 больных (83,3%). При этом необходимо отметить, что среди переведенных 8 больных у 6 констатировали положительную динамику клинической симптоматики на фоне лечения и у 2 больных динамика отсутствовала. У 2 переведенных больных с отсутствием динамики при УЗАС высокий риск развития ТЭЛА был констатирован при поступлении и они были исключены из исследования в связи с выполнением им оперативного вмешательства, т.о. отсутствие динамики УЗ-картины может объясняться краткостью пребывания больного в стационаре. Оценить эффективность и неэффективность АКТ у переведенных больных по лабораторным анализам представлялось возможным лишь по начальным точкам исследования (2, 3 и 4 точки), при этом у 6 переведенных больных достигли эффективной гипокоагуляции как по данным стандартных лабораторных анализов, так и по данным теста тромбоди-намики.
Обсуждение
Динамика клинических симптомов и УЗ-картины тромбоза глубоких вен нижних конечностей являются объективными критериями лечения, позволяющими оценивать результат АКТ непосредственно лечащим врачом. Одновременно с этим лабораторный контроль за свертывающей системой крови в процессе гепаринотерапии, а в последствии и варфаринотерапии, многими специалистами представля-
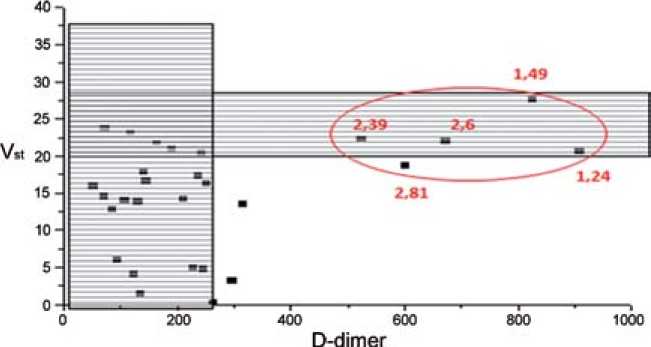
Рис. 4. Vs – D-димер 5–7 дней терапии варфарином (7 точка)
ется чем-то абстрактным, а может даже метафизическим и выполняется порой шаблонно вне зависимости от полученных данных.
Положительная динамика клинических симптомов и данных УЗАС позволяет оценить эффективность проводимого лечения, однако наше исследование показало, что положительная динамика клинической картины не является абсолютным критерием достижения желаемого результата. Из полученных данных можно предположить, что отрицательная динамика клинических симптомов может расцениваться как абсолютный критерий неэффективности консервативной терапии, а положительная нет. Иными словами, при констатации положительной динамики клинической симптоматики возможны различные варианты развития событий. Основным клиническим критерием эффективности или неэффективности АКТ является УЗАС.
Одновременно с этим оценить эффективность лечения при помощи УЗАС достаточно сложно, т.к. для выраженной динамики УЗ-картины тромбоза необходимо больше времени, чем больной находится в стационаре. Представляется возможным только констатировать отсутствие отрицательной динамики в течение антикоагулянтной терапии.
Известно, что даже при тщательном соблюдении алгоритма обследования и назначения антикоагулянтной терапии у больных с тромбозами магистральных вен нижних
Таблица 4
Результаты АКТ у 60 больных (7 точка)
|
Клинические |
Инструментальные (УЗАС) |
Лабораторные |
|||||
|
отриц. динам. |
без динам. |
полож. динам. |
отриц. динам. |
без динам. |
полож. динам. |
Эффективная гипокоагуляция |
неэффективная коагуляция |
|
2 |
4 |
54 |
6 |
39 |
15 |
50 |
10 |
|
3,3% |
6,7% |
90% |
10% |
65% |
25% |
83,3% |
16,7% |
|
0 перевод |
2 перевод |
6 перевод |
6 перевод |
2 перевод |
0 перевод |
6 (по 2 и 4 т.) перевод |
2 (по 2 и 3 т.) перевод |
конечностей прогнозировать конечный результат лечения невозможно. Даже на фоне положительной динамики клинической симптоматики и достижения эффективной гипокоагуляции в некоторых случаях выявляли распространение тромботических масс в проксимальном направлении либо появление флотации тромба. Причина этого явления не совсем понятна. Это может быть связано с индивидуальной чувствительностью к антикоагулянтам.
Известно, что любому тромбозу предшествует, пусть и кратковременное, состояние гиперкоагуляции, которое мы зачастую не фиксируем в стационаре, т.к. оно формируется значительно раньше, в начале заболевания, а больные, как правило, поступают в стационар через 5–7 суток, а иногда и через месяц от начала заболевания.
Комплексное изучение стандартных лабораторных показателей и данных теста тромбодинамика позволило заключить, что практически все участвующие в исследовании больные, независимо от длительности анамнеза, находились в состоянии нормо- или умеренной гиперкоагуляции. Это было расценено как должное у больных с тромбозом и подтвердили данными лабораторных показателей. До начала антикоагулянтной терапии уровень D-димера был повышен у всех больных и в среднем составил 792±702,6 нг/мл, АЧТВ в среднем составило 26,9±9,08 с, средний уровень фибриногена составил 4,15±1,19 г/л, протромбиновый индекс в среднем составил 100±24,8%, по данным теста тромбоди-намики Vs в среднем составила 23,4±6,29 мкм/мин.
Анализ результатов динамики отдельных лабораторных показателей, в том числе и теста тромбодинамика, на фоне АКТ позволил сделать следующие заключения.
Разделение больных на группы эффективности достижения целевых значений стандартных лабораторных показателей (главным образом по АЧТВ) и данных теста тромбодинамики (главным образом Vs), подтверждающих достижение состояния гипокоагуляции во 2 и 3 точках, показало различную (главным образом недостаточную) чувствительность пациентов к первой иньекции гепарина. Этот эффект был предсказуем, т.к. по данным литературы известно, что у большинства больных первая доза НФГ не приводит к гипокоагуляции, а молекулы гепарина идут на взаимодействие и блокировку гепариновых рецепторов на мембранах тромбоцитов, других форменных элементов крови и эндотелия. И только последующие дозы гепарина приводят к гипокоагуляции [7].
Анализ данных, полученных при клиникоинструментальном обследовании пациентов различных групп эффективности достижения гипокоагуляции, не выявил статистически достоверных различий между ними. Причина различной чувствительности к гепарину не вполне понятна, но явно кроется за пределами клиникоинструментальных данных.
Через 3–4 суток антикоагулянтной терапии гепарином сохранилось разделение всех больных по эффективности достижения гипокоагуляции на три группы, но количественный состав этих групп изменился. Если условно 4 точку рассматривать как пик гепаринотерапии, то полученные данные полностью соответствуют ожидаемым результатам. Подавляющее количество больных (57 больных) находились в состоянии гипокоагуляции. Значительно увеличилось (до 23 больных) количество пациентов 1 группы, отражающей эффективность коагуляции по обоим тестам.
В группе с неэффективной гипокагуляцией по обоим тестам осталось только 3 больных. Известно, что один из них с нарастающей флотацией в ПБВ был переведен в дежурный сосудистый стационар, один больной был оперирован в нашей клинике с жизнеугрожающей флотацией в ОБВ, и только 1 больной с локализацией тромбоза на голени был выписан на амбулаторное долечивание с подобранной дозой варфарина.
Третья группа пациентов в этой точке осталась самой многочисленной (34 больных) и показалась наиболее интересной для анализа. Общепринято эффективность гепа-ринотерапии определять по изменению показателя АЧТВ. Отсутствие его увеличения в 1,5–2 раза к 4 суткам АКТ может расцениваться как неадекватная доза НФГ, и аргументировано доза будет изменена в сторону увеличения. Однако по данным теста тромбодинамики больные этой группы находятся в состоянии эффективной гипокоагуляции, так что увеличение дозы гепарина у них могло повышать риск геморрагических осложнений.
В 7 точке исследования, т.е. к моменту прекращения ге-паринотерапии и полного перевода больных на непрямые антикоагулянты (варфарин), стандартные лабораторные показатели свидетельствовали о нахождении подавляющего числа пациентов в состоянии эффективной гипокоагуляции. Уровень D-димера снизился до 220±353,6 нг/мл, АЧТВ – 33,6±11,54 сек., уровень МНО в среднем увеличился до 2,6±1,95. Основные параметры теста тромбодинамики также подтверждали состояние гипокоагуляции. Так, время задержки роста фибринового сгустка (Tlag) увеличилось более чем в 2 раза и составило 3,88±4,69 мин. Стационарная скорость роста фибринового сгустка (Vs) после отмены гепарина имела тенденцию к увеличению, но все же не достигла референсных значений и составила у большинства больных в среднем 16,5±8,15 мкм/мин.
Однако у 12 больных Vs вернулась к нормальным значениям, т.е. анонсировало возращение этих больных в состояние нормокоагуляции. Всесторонний анализ больных этой группы не выявил каких-либо статистически аргументированных особенностей по сравнению с остальными больными.
При этом на фоне возвращения к нормокоагуляции у 5 больных выявили резкое повышение уровня D-димера (свыше 500 нг/мл). Проанализировав эту группу больных, выявили, что у 2 из них при выписке из стационара не достигли целевых значений МНО. Повышение уровня D-димера свидетельствует о возобновлении в организме процесса образования фибриновых сгустков, т.е. постфактум констатировали, что 5 больных могли быть выписаны из стационара в состоянии повышенной тромботической готовности и высоким риском развития ретромбоза, а также, что даже достижение целевых значений МНО не гарантировало больным защиты от возобновления тромбо-образования. Однако в группе с достигнутым целевым значением МНО 2–3 выявили 2 больных с сильно выраженной задержкой роста сгустка, т.е. с более выраженным эффектом гипокоагуляции, не исключаем, что эти пациенты могут быть угрожаемыми по кровотечению.
Учитывая данные, полученные при изучении лабораторных показателей в последних точках исследования (6 и 7 точки), провели статистический анализ чувствительности и эффективности стандартных лабораторных показателей (главным образом МНО) и теста тромбодинамики (главным образом Vs) после перевода больных с нефракциони-рованного гепарина на варфарин.
На фоне варфаринотерапии, после отмены гепарина, у части больных регистрировали нормализацию стационарной скорости и именно в этой группе регистрировали рост D-димера, т.е. нормализация стационарной скорости может рассматриваться как фактор риска неэффективности вар-фаринотерапии у больных с ТГВ.
Эффект терапии варфарином у большинства больных был достаточным. Уровень МНО достоверно увеличивался и медиана достигала целевых значений (МНО 2,603±1,95).
Стационарная скорость роста сгустка (Vs) демонстрировала достоверное увеличение показателей – медиана увеличилась с 8,9 до 17 мкм/мин, следовательно, по данным этого теста после отмены гепарина, несмотря на нарастание эффекта варфарина (по данным МНО), регистрировалось уменьшение антикоагулянтного эффекта, в том числе часть больных (12 из 60) вернулась по этому параметру в диапазон референсных значений (у таких больных по данным этого теста не регистрировался антикоагулянтный эффект вовсе).
Уровень D-димера демонстрировал положительную динамику в виде уменьшения, правда, недостоверно. Недостоверное уменьшение уровня D-димера было связано с тем, что у части больных (5 из 60) наблюдалась противоположная тенденция – значения этого показателя увеличились, причем значимо (более чем на 250 нг/мл), т.е. по этому параметру выделилась группа риска, которая демонстрировала увеличение темпа образования фибриновых масс и их разрушения, несмотря на продолжающуюся антикоагулянтную терапию.
Если характеризовать группу больных с отрицательной динамикой по уровню D-димера и по распределению значений МНО, то можно заметить что эти больные могли принадлежать как группе с неудовлетворительным повышением МНО (ниже 2), так и к группе в целевыми значениями этого параметра, и даже с повышенным значением этого параметра. Таким образом, можно заключить, что даже достижение целевых значений МНО не гарантировало больных от возобновления повышенного отложения фибриновых масс.
Если характеризовать группу больных с отрицательной динамикой по уровню D-димера по распределению значений Vs, то можно отметить, что они все принадлежат к группе, в которой значений этого параметра, несмотря на нарастание эффекта варфарина, вернулись в диапазон референсных значений. Один больной демонстрировал повышение до субреференсных значений (19 мкм/мин). То есть повышение уровня D-димера произошло только в группе, где по данным Vs теста тромбодинамики эффект антикоагулянта не определялся.
Если проанализировать прирост значений D-димера между 6 и 7 точками у 35 больных (рис. 5), то также мож-
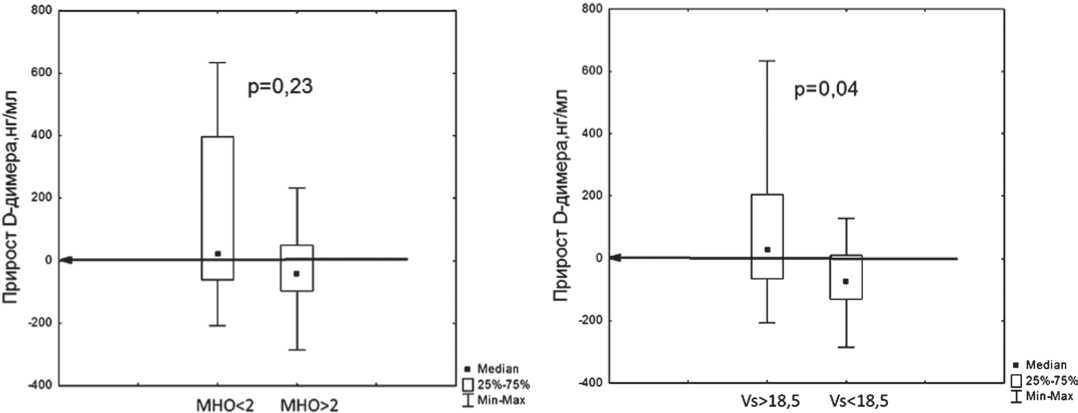
Рис. 5. Распределение прироста D-димера в подгруппах с разными значениями МНО и Vs
но заметить, что в группе с МНО ниже целевого диапазона (2,0–3,0) прирост D-димера достоверно не отличается от остальной группы (p=0,13), в то время как в группе со значениями стационарной скорости более 18,5 мкм/мин прирост D-димера достоверно выше, чем у оставшихся больных (р=0,03).
Частота повышения D-димера в группах из 35 больных с различными диапазонами МНО и Vs приведена в табл. 5, 6.
Значения МНО и Vs являются тестами, которые непосредственно могут оценивать антикоагулянтный эффект варфарина. D-димер – тест, который уже постфактум может подтвердить эту эффективность (или точнее ее отсутствие) через анализ повышенного фибринообразования и последующего фибринолиза.
На основании полученных данных было проведено вычисление чувствительности и специфичности лабораторных показателей МНО и Vs теста тромбодинамики после перевода больных с нефракционированного гепарина на варфарин.
Если мы примем повышение параметра D-димер за критерий при оценки неэффективности антикоагулянтной терапии, то тогда по отношению к этому параметру мы можем рассчитать чувствительность и специфичность этих тестов к выявлению группы больных с неэффективной антикоагулянтной терапией:
Чувствительность МНО = 2/5 ⋅ 100% = 40%, Специфичность МНО = 22/30 ⋅ 100% = 73%, Чувствительность Vs = 5/5 ⋅ 100% = 100%, Специфичность Vs = 21/30 ⋅ 100% = 70%.
Выводы
На основании полученных данных можно утверждать, что стационарная скорость роста сгустка (Vs) теста тром-
Таблица 5
Частотный анализ МНО и повышения D-димера
|
D-димер повысился (>+130) |
D-димер не повысился (<+130) |
Итого |
|
|
МНО <2 |
2 |
8 |
10 |
|
МНО >2 |
3 |
22 |
25 |
|
Итого |
5 |
30 |
35 |
Таблица 6
Частотный анализ Vs и повышения D-димера
Проведенное исследование показало, что антикоагулянтная терапия НФГ с последующим переходом на варфа-рин является эффективным методом консервативного лечения больных с идиопатическими тромбозами и позволяет добиться лабораторно подтвержденной гипокоагуляции, сопровождаемой клиническими и УЗ-контролируемыми улучшениями. Однако необходимо отметить, что только динамика УЗ-картины может рассматриваться как критерий определения дальнейшей тактики лечения больных с ТГВ. Стандартные лабораторные показатели и данные теста тромбодинамики позволили осуществлять контроль за эффективностью антикоагулянтной терапии, выявлять пациентов в состоянии повышенной тромботической готовности и опасностью развития ретромбозов. Данные теста тромбодинамики (Vs) показали высокую чувствительность (100%) и специфичность (70%) в отношении оценки неэффективности варфаринотерапии. Отсутствие геморрагических осложнений у обследованных больных говорит о достаточном уровне контроля безопасности АКТ.
Список литературы Пути повышения эффективности и безопасности антикоагулянтной терапии у больных тромбозами глубоких вен нижних конечностей
- Бокарев И.Н., Попова Л.В., Козлова Т.В. Тромбозы и противотромботическая терапия в клинической практике. М., ООО «Медицинское информационное агентство», 2009. 512 с.
- Виноградов Р.А., Завражнов А.А., Зубарева Н.А., Скрып-ник Д.А., Покровская Н.В. Профилактика венозных тромбоэмболических осложнений в хирургическом стационаре широкого профиля (по итогам проекта «Территория безопасности»)//Флебология. 2012. Т. 6, №2. С. 4-8.
- Золотухин И. А., Юмин С. М., Леонтьев С. Г., Андрияшкин A. В., Кириенко А. И. Амбулаторное лечение пациентов, перенесших тромбоз глубоких вен: как выполняются врачебные рекомендации?//Флебология. 2010. Т. 4, №2. С. 24-28.
- Кириенко А.И., Андрияшкин В.В. Стратегия профилактики острых венозных тромбозов у хирургических больных//Трудный пациент. 2004. Т. 2, №5. С. 3-7.
- Кириенко А.И., Леонтьев С.Г., Гусев Л.Л., Мамадумаров B. А., Ефремова О.И. Консервативное лечение больных с острым венозным тромбозом//Флебология. 2012. Т. 6, №2. С. 40-44.
- Момот А.П., Цывкина Л.П., Тараненко И.А. Современные методы распознавания состояния тромботической готовности. Барнаул: Из-во Алт.ун-та, 2011. 138 с.
- Пантелеев М.А., Васильев С.А., Синауридзе Е.И., Воробьев А.И. Атауллаханов Ф.И. Практическая коагулология. М.: Практическая медицина, 2011. 192 с.
- Савельев В.С., Гологорский В.А., Кириенко А.И. и др. Флебология: руководство для врачей. М.: Медицина, 2001. 664 с.
- Савельев В.С., Чазов Е.И., Гусев Е.И., Кириеннко А.И. и др. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений//Флебология. 2010. Т. 4, №2. С. 3-37.
- Шулутко А.М., Крылов А.Ю., Османов Э.Г., Хмырова С.Е., Лобанова М.В. Антикоагулянтная терапия в лечении острых проксимальных тромбозов глубоких вен нижних конечностей//Хирургия. 2011. №1. С. 52-55.
- Kahn SR, Ginsberg JS Relationship between deep venous thrombosis and the postthrombotic syndrome//Arch. Intern. Med. 2004. Vol. 164(1). P. 17.
- Partsch H. Therapy of deep vein thrombosis with low molecular weight heparin, leg compression and immediate ambulation//Vasa. 2001. Vol. 30. P. 195-204.


