Пути программируемой клеточной гибели гепатоцитов и соотношения цитотипов печени рыб и амфибий
Автор: Антонова Е.И., Омарова Д.И., Мкртчан О.З., Высокогорский В.Е., Фоменко Л.В.
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Биологические науки
Статья в выпуске: 4 (24), 2016 года.
Бесплатный доступ
При сравнительном анализе показателей тканевого гомеостаза у рыб и амфибий на первом году постэмбриогенеза установлено: в большей мере число полиплоидных гепатоцитов (PCNA-позитивных) наблюдалось в перивенулярной зоне, на фоне того, что гепатоциты этой зоны погибают по пути аутофагии (дополнительно как альтернативного источника питания и реализации программируемой клеточной гибели, когда механизм апоптоза невозможен). Апоптоз (ведущая программа реализации программированной клеточной гибели) представлена только у рыб в перипортальной зоне, а в области центральных вен и центролобулярной зоне ведущим типом гибели гепатоцитов является аутофагия. У амфибий обнаружены более сложные программы переключения путей клеточной гибели - в перипортальной зоне соотношение апоптоза и аутофагии - 68-32% соответственно, в центролобулярной 50-50% и в области центральных вен - 100% аутофагия. В группе амфибий в центролобулярной и перивенулярной зонах печеночного ацинуса выявлено бóльшее число десмин-позитивных клеток Ито и тканевых макрофагов. Результаты проведенных исследований свидетельствуют: у изучаемых видов животных ведущая форма программируемой клеточной гибели - аутофагия. В эволюционной динамике отмечается тенденция к увеличению числа клеток Ито и тканевых макрофагов печени; показатели активности генов bcl-2 и p-53 разнонаправлены, но их активность выше в группе рыб. Взаимные цитокоммуникации стромально-паренхимных цитотипов активируются как гибелью гепатоцитов по пути апоптоза, так и по пути аутофагии.
Тканевой гомеостаз, печень, регенерация, гепатоциты, пролиферация, цитокоммуникации, рыбы, амфибии, пути программируемой клеточной гибели
Короткий адрес: https://sciup.org/142199304
IDR: 142199304 | УДК: 576/3;576/5;576/7;597.6;597.5
Текст научной статьи Пути программируемой клеточной гибели гепатоцитов и соотношения цитотипов печени рыб и амфибий
Регенерация печени реализуется на тканевом уровне благодаря межклеточным коммуникациям стромальных и паренхимных цитотипов, их взаимодействие имеет первостепенное значение для понимания механизмов межтканевой кооперации. Синтезируемые ими биологически активные вещества и макромолекулы межклеточного вещества, а также деятельность барьерно-метаболических механизмов, предназначенных для охраны постоянства внутренней среды организма в процессе взаимодействия организм – среда, обеспечивают регенерацию органа в непрерывно меняющихся условиях среды [1]. Среда обитания большинства живых организмов характеризуется нестабильностью абиотических условий, в результате в течение онтогенеза организма и филогенеза вида в целом сталкиваются с воздействием стрессов различной природы. Работ, посвященных изучению количественных и качественных изменений цитокоммуникаций клеток печени позвоночных в сравнительном ряду, очень мало.
В связи с этим цель нашей работы – выявить эволюционно детерминированную динамику соотношения путей программируемой клеточной гибели, а также цитотипов печени рыб вида Cyprinus carpio и амфибий вида Rana terrestris в связи с различной экологической специализацией.
Материалы и методы исследования
Исследование проведено на 30 животных вида Cyprinus carpio и 30 животных вида Rana terrestris первого года постэмбриогенеза в двух повторностях.
Для изучения и анализа стромально-паренхимного соотношения цитотипов печени, путей ПКГ (программируемая клеточная гибель), процессов пролиферации гепатоцитов использовали метод иммунофенотипирования [2]. Подсчет числа клеток прове-
ден в трех зонах ацинуса на световом микроскопе AxioImagerA1 с помощью программного обеспечения Axiovisionrev 4.7. («CarlZeiss», Германия). Показатели пролиферации гепатоцитов определяли при выявлении антител к белкам-маркерам PCNA (Ncl-L-PCNA, Novocastra). В дальнейшем проведен подсчет на 1000 гепатоцитов и PCNA-позитивных гепатоцитов (‰). Количество и пространственную локализацию десмин-синтезирующей популяции клеток Ито – с помощью обнаружения антител к десмину (NCL-L-DES-DERIL, Novocastra); тканевых макрофагов – с помощью выявления антител к CD68 (Ab-3, KP1, Termoscientific). Анализ путей программируемой клеточной гибели проведен с использованием антител к белкам-маркерам каспазы-3 (СРР32, Novocastra), LC3А/B (ab81785, Abcam), р53 и bcl-2 (DO-7 и bcl-2 Oncoprotein, Novocastra).
Статистически обрабатывали полученные данные с помощью пакета прикладных программ «STATISTICA-6». Различия считали значимыми при р = 0,05. При проведении эксперимента руководствовались принципами гуманного отношения к животным в соответствии с Международными рекомендациями [3].
Результаты исследования
Известно, что функционирование печени осуществляется благодаря кооперативному стромально-паренхимному взаимодействию цитотипов. Эти взаимоотношения участвуют в формировании так называемого клеточного микроокружения и являются основой тканевого гомеостаза печени. В ходе исследования иммуногистохимически установлены стромально-паренхимные соотношения, пролиферативные зоны и зоны ацинуса, за счет которых осуществляется компенсаторно-приспособительная реакция, определяющая становление гомеостаза и дальнейшее развертывание репаративных процессов.
Анализируя показатели пролиферации, выявлено, что у обоих изучаемых видов животных распределение PCNA-позитивных гепатоцитов носит порто-венулярный характер (рис. 3, 4). Тем не менее, в области портального тракта у амфибий количество PCNA-позитивных гепатоцитов на 24% меньше, чем у рыб, а в области центральной вены больше на 7,5%.
Распределение органоспецифичных макрофагов в пределах ацинуса у амфибий равномерное, тогда как у рыб выражено преобладание клеток Купфера в области портального тракта (рис. 5, 6). Количество макрофагов в области портального тракта у амфибий на 12% больше, чем у рыб.
Анализируя реализацию путей клеточной гибели, выявлено, что у рыб в перипор-тальной зоне происходит активация апоптоза – I пути гибели. Это подтверждается тем, что количество СРР32-позитивных (рис. 12) больше, чем LC3A/B-позитивных гепатоцитов на 65% (рис. 8).
В свою очередь, у амфибий в перипортальной зоне реализуется I тип гибели гепатоцитов на фоне высокого количества как bcl-2-, так и р53-позитивных гепатоцитов (рис. 9).
В центролобулярной зоне наблюдается снижение экспрессии генами основных белков клеточной гибели, основным типом гибели гепатоцитов у рыб является аутофагия – II тип гибели. В частности, происходит увеличение количества LC3A/B- и уменьшение СРР-32-позитивных гепатоцитов на 27 и 25% соответственно относительно показателей перипортальной зоны ацинуса.
У амфибий в центролобулярной зоне гибель гепатоцитов в равной мере реализуется по I и II типу. Количество LC3A/B-позитивных гепатоцитов (рис. 7) у амфибий на 15% больше, чем у рыб, а количество СРР32-позитивных гепатоцитов (рис. 11) на 45% меньше.
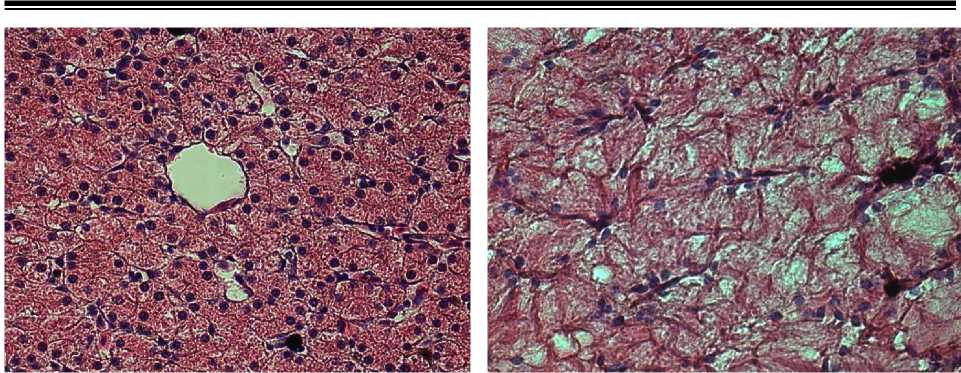
Рис. 1 . Печень амфибий вида Rana terrestris . Увеличение ок10хоб40.
Окраска гематоксилин-эозин
Рис. 2 . Печень рыб вида Cyprinus carpio . Увеличение ок10хоб40.
Окраска гематоксилин-эозин
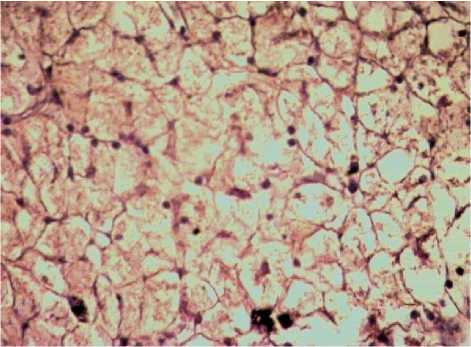
Рис. 3 . Печень амфибий вида Rana terrestris .
Увеличение ок10хоб40. Окрашивание пролиферирующих гепатоцитов антителами к PCNA
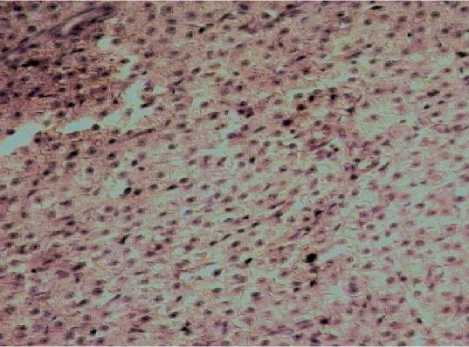
Рис. 4 . Печень рыб вида Cyprinus carpio .
Увеличение ок10хоб40. Окрашивание пролиферирующих гепатоцитов антителами к PCNA
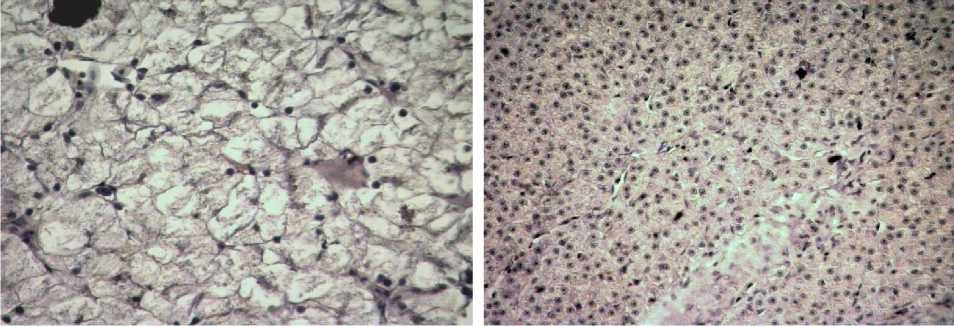
Рис. 6 . Печень рыб вида Cyprinus carpio . Увеличение ок10хоб40.
Окраска антителами к CD68
Рис. 5 . Печень амфибий вида Rana terrestris . Увеличение ок10хоб40.
Окраска антителами к CD68
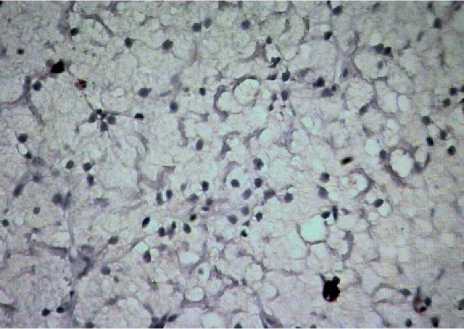
Рис. 7 . Печень амфибий вида Rana terrestris . Увеличение ок10хоб40.
Окраска антителами к LC3A/B
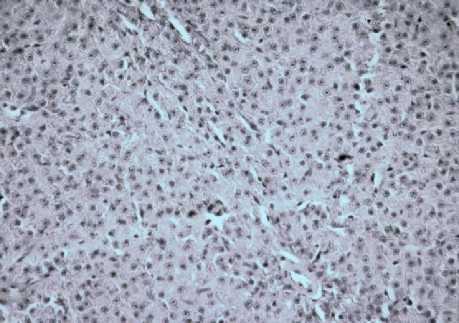
Рис. 8 . Печень рыб вида Cyprinus carpio . Увеличение ок10хоб40.
Окраска антителами к LC3A/B
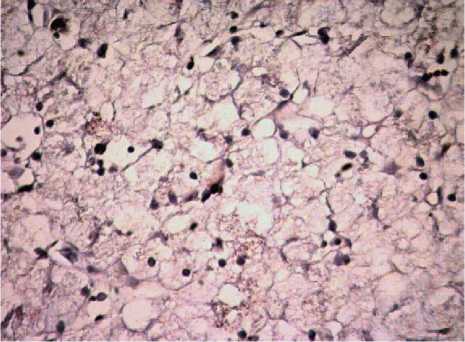
Рис. 9 . Печень амфибий вида Rana terrestris. Увеличение ок10хоб40.
Окраска антителами к р53
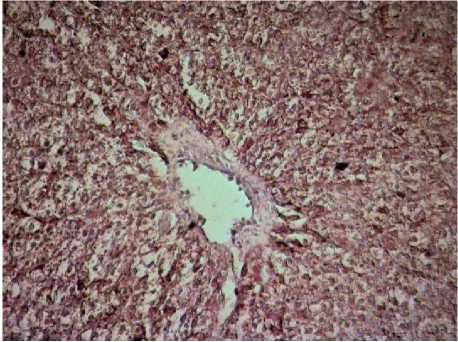
Рис. 10 . Печень рыб вида Cyprinus carpio. Увеличение ок10хоб40.
Окраска антителами к р53
Рис. 11 . Печень амфибий вида Rana terrestris. Увеличение ок10хоб40.
Окраска антителами к СРР32
Рис. 12 . Печень рыб вида Cyprinus carpio. Увеличение ок10хоб40.
Окраска антителами к СРР32
В перивенулярной зоне у рыб на фоне угнетения программы апоптоза (уменьшение числа СРР32-позитивных гепатоцитов) происходит увеличение LC3A/B-, р53-, bcl-2-позитивных гепатоцитов в сравнении с перипортальной зоной ацинуса на 19, 28 и 18% соответственно (рис. 10). Следовательно, в перивенулярной зоне в большей мере реализуется гибель гепатоцитов по пути аутофагии.
В группе амфибий в перивенулярной зоне также ведущий тип гибели гепатоцитов – аутофагия, подтверждает это увеличение количества LC3A/B-позитивных гепатоцитов на 33% в сравнении с перипортальной зоной. При этом происходит уменьшение количества СРР32- и р53-позитивных гепатоцитов на 19 и 54% соответственно (в сравнении с перипортальной зоной).
Отметим, что у амфибий в центролобулярной зоне и в области центральных вен в большей мере выявляются десмин-позитивные клетки Ито, так же как и тканевые макрофаги.
Многоклеточные животные появились на земле приблизительно 700– 1000 млн л. н. [4], их эволюция во многом определялась формированием адаптаций к условиям среды обитания [5; 6], а также к увеличению концентрации кислорода в атмосфере, которое, в свою очередь, обеспечило развитие метаболической деятельности [7], а ксенобиотики, детоксикация которых проходит в печени, стали важным фактором в формировании разнообразия физиологии многоклеточных животных [8]. Изучаемые виды животных занимают различные среды обитания. У обоих видов эволюционно сформированы такие механизмы адаптации к состоянию организма, когда гипоксия сменяется гипероксией вследствие реоксигенации, а также механизмы метаболической адаптации [9; 10].
Главным средообразующим фактором среды обитания является температура. Диапазон температурного колебания, которому подвергаются пойкилотермные организмы, очень широк – часовые, циркадные и сезонные температурные перепады (Nicole M. 2002). В этой связи печень как орган обеспечивающий поддержание гомеостаза организма, обеспечивает также и развитие организма в целом, осуществляя межсистемную кооперацию в организме, проявляя сложность структуры, полифункциональность, быструю вовлеченность в деструктивные и репаративные процессы [11].
В процессе эволюции в зависимости от среды обитания и механизма терморегуляции при становлении цитокоммуникаций клеток печени выявлены особенности у изучаемых видов животных.
В большей мере число полиплоидных гепатоцитов (PCNA-позитивных) выявлено в перивенулярной зоне, на фоне того, что гепатоциты данной метаболической зоны погибают по пути аутофагии (дополнительно как альтернативного источника питания и реализации ПКГ в условиях, когда механизм апоптоза невозможен). В то же время число р-53 и bcl-2 позитивных гепатоцитов увеличивается у рыб и снижается у амфибий.
Вторая закономерность касается реализации путей ПКГ. Ведущая программа ее реализации – апоптоз – представлена только у рыб в перипортальной зоне. Далее у данного вида животных в области центральных вен и центролобулярной зоне наиболее распространенным типом гибели гепатоцитов является аутофагия. Более сложные переключения форм ПКГ отмечены у амфибий – в перипортальной зоне соотношение апоптоза и аутофагии – 68–32%, в центролобулярной – 50–50%, в области центральных вен – 100% аутофагия.
И третья особенность, обнаруженная в ходе эксперимента – бóльшее число десмин-позитивных клеток Ито и тканевых макрофагов – в группе амфибий. К тому же, клетки Купфера играют роль активаторов звеньев неспецифического иммунитета, инициируют ранние этапы процесса регенерации печени. А синтезируемый ими TGF-β оказывает наиболее выраженное стимулирующее действие на белоксинтетическую функцию клеток Ито, проявляется это усилением синтеза десмина.
Закл ючение
У изучаемых видов животных ведущей формой ПКГ является аутофагия; в эволюционной динамике отмечается тенденция к увеличению числа клеток Ито и тканевых макрофагов печени; показатели активности генов bcl-2 и p-53 разнонаправлены, но их активность выше в группе рыб; взаимные цитокоммуникации стромальнопаренхимных цитотипов активируются как гибелью гепатоцитов по пути апоптоза, так и по пути аутофагии.
Полученные результаты исследования расширяют представления о механизмах, способах и масштабах регенерации печени как показателя уровня эволюционной пластичности органа, сформированного у позвоночных животных. Стромально-паранхим-ное соотношение цитотипов, соотношения пролиферации и полиплоидизации, способы регенерации с учетом цитокоммуникативных индукций и регенераторного потенциала гепатоцитов проявляют видовую, временнýю и пространственно-гистотопографичес-кую особенность, заданную рамками эволюционно обусловленных закономерностей, и отражают степень стабильности и лабильности биологических процессов в условиях физиологической нормы.
E.I. Antonova, D.I. Omarova, O.Z. Mkrtchan, V.E. Vysokogorsky, L.V. Fomenko
The path of the programmed cell death of hepatocytes and the ratio of citation liver of fish and amphibians
Список литературы Пути программируемой клеточной гибели гепатоцитов и соотношения цитотипов печени рыб и амфибий
- Indiani C. The replication clamp-loading machine at work in the three domains of life/C. Indiani, M. O’Donnell//Nature Reviews Mol. Cell Biology. -2006. -Vol. 7, № 10. -P. 751-761.
- Эллиниди В.Н. Практическая иммуногистохимия/В.Н. Эллиниди, Н.В. Аникиева, Н.А. Максимова. -СПб.: ВЦЭРМ МЧС России. -2002. -36 с.
- Кополадзе Р.А. Регламентация экспериментов на животных -этика, законодательства, альтернативы/Р.А. Кополадзе//Успехи физиол. наук. -1998. -Т. 29, № 4. -С. 74-89.
- Conway M.S. The Cambrian "explosion": Slow-fuse or megatonnage?/M.S. Conway//Proc. Natl. Acad. Sci. U.S.A. -2000. -Vol. 97. -P. 4426-4429.
- Little P.F. Structure and function of the human genome/P.F. Little//Genome Res. -2005. -Vol. 15, № 12. -P. 1759-1766.
- Hahn M.H. The gvalue paradox/M.H. Hahn, G. Wray//Evol. Dev. -2002. -Vol. 4. -P. 73-75.
- Das J. The role of mitochondrial respiration in physiological and evolutionary adaptation/J. Das//Bio. Essays. -2006. -Vol. 28, № 9. -P. 890-901.
- Baker M.E. Xenobiotics and the evolution of multicellular animals: emergence and diversification of ligand-activated transcription factors/M.E. Baker//Integrative and Comp. Biology. -2005. -Vol. 45(1). -P. 172-178.
- Hermes-Lima M. Animal response to drastic changes in oxygen availability and physiological oxidative stress/M. Hermes-Lima, T. Zenteno-Savin//Comp. Biochem. Physiol. -2002. -Vol. 133. -P. 537-556.
- Jackson D.C. Acid-base balance during hypoxic hypometabolism: selected vertebrate strategies/D.C. Jackson//Resp. Phys. Neur. -2004. -Vol. 141. -P. 273-283.
- Костина Л.Ю. Лимфатический регион печени и пищевода в условиях надпеченочного блока портального кровообращения и лазерного облучения печени: автореф. дис. … канд. мед. наук: 14.03.01/Костина Лариса Юрьевна. -Новосибирск, 2012. -18 с.


