Рак предстательной железы: возможности многокомпонентного лечения
Автор: Важенин А.В., Карнаух П.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (21), 2007 года.
Бесплатный доступ
Проведен анализ результатов лечения 895 больных раком предстательной железы, 743 из них имели III (49,9 %) и IV (3 3,1 %) стадии заболевания, которым проводились следующие виды лечения: лучевое, гормональное, гормонолучевое, гормонолучевое лечение с терморадио модификацией. При анализе отдаленных результатов лечения установлено, что комбинированная терапия является наиболее эффективным методом при лечении рака предстательной железы III-IV стадии. Терморадиомодификация достоверно улучшает результаты лечения больных раком простаты при III стадии заболевания, но не должна применяться при РПЖ IV стадии. Лучевое лечение оказалось более эффективным в первые годы наблюдения, но его эффективность снижается. При диссеминированном раке предстательной железы наиболее эффективна гормональная терапия.
Рак предстательной железы, комбинированное лечение
Короткий адрес: https://sciup.org/14054537
IDR: 14054537 | УДК: 616.65-006.6-08
Текст научной статьи Рак предстательной железы: возможности многокомпонентного лечения
В последнее время заболеваемость раком предстательной железы прогрессирует во всем мире [13, 16, 18]. Наиболее актуальна эта проблема в высокоразвитых странах, где максимальная частота рака предстательной железы приходится на больных в возрасте от 50 лет и cтарше, достигая своего пика к 70 годам [1, 12, 14]. Специалисты прогнозируют удвоение числа заболевших к 2030 г., ежегодный рост заболеваемости достигает 3 % [15, 17]. В зарубежных странах рак предстательной железы давно занимает лидирующие позиции. Так, в США в последние 10 лет он находится на первом месте среди онкологической патологии у мужчин. Повсеместная тенденция к старению населения приводит к росту уровня заболеваемости раком предстательной железы [7]. Анализ этого показателя по Челябинской области также свидетельствует, что за последние годы он возрос с 9,4 на 100000 мужского населения в 1991 г., до 22,6 в 2004 г., а смерт- ность – с 3,2 на 100000 мужского населения до 12,8 соответственно.
Такое положение привело к интенсивному поиску эффективных методов лечения этого грозного заболевания. За последние десятилетия, благодаря развитию и совершенствованию радиотерапевтической техники с мегавольтным излучением, лучевая терапия стала одним из основных методов лечения рака предстательной железы (РПЖ). Однако отмечается недостаточная эффективность этого метода, что связано с высокой радиорезистентностью РПЖ [2, 4, 5]. Причина кроется в анатомических особенностях аденокарциномы, каковыми, как правило, являются опухоли предстательной железы. Отличительной особенностью аденогенных опухолей является бессосудистое солидно-инфильтративное строение, вследствие чего аденокарцинома имеет большое количество гипо- и анаксических клеток в общей массе. Для ги- бели этих клеток необходимо подведение дозы излучения, в 2–3 раза большей, чем для нормально оксигенированных клеток. Однако неизбежность лучевых реакций со стороны смежных органов ограничивает применение высоких доз [3, 6, 8].
Вышеизложенное объясняет поиск новых способов, повышающих эффективность лучевой терапии без существенного повышения дозы. Одним из них является применение терморадиотерапии, т.е. использование локальной электромагнитной гипертермии в дополнение к ионизирующему излучению [2, 4, 19]. В результате проведенных экспериментальных и клинических исследований установлено, что при нагревании опухоль повреждается в большей степени, чем окружающие нормальные ткани. При этом наиболее подвержены разрушению клетки, находящиеся в стадии синтеза ДНК, и плохо оксигенированные клетки, которые в обычных условиях наиболее радиорезис-тентны. Таким образом, нагревание опухоли перед лучевой терапией существенно повышает эффективность последней [9, 10, 19]. Кроме радиомодифицирующего эффекта, нагревание опухоли приводит к прямой денатурации белка, образованию в тканях белка термального шока, который индуцирует иммунные реакции [20].
В настоящее время создан ряд радиочастотных гипертермических систем, которые отличаются не только частотой поля, но и способом нагрева тканей, основными их которых являются – излучательный, индуктивный, емкостный. Основными параметрами, определяющими функциональные возможности этих приборов, являются частота поля и способ нагрева. Наиболее популярны аппараты, основанные на емкостном способе нагрева тканей. Они широко используются при термолучевой и термохимиотерапии различных по локализации и глубине расположения злокачественных опухолей. Использование этих систем в комплексном лечении онкологических больных позволяет существенно повышать выживаемость и качество жизни излеченных пациентов, но при условии, что в очаге-мишени достигаются температуры 41–45°С и выше [11]. Для лечения РПЖ трансуретрально используются аппараты «Prostatron», «Urawave», «Prostcare», «Hypertherm Et-100», «Termex-2», «Uroterm» и др. Сеанс термотерапии обычно однократный. Объективный эффект отмечен у 40–75 % больных, субъективный – у 50–80 % [9]. Местное ле- чение проводится с помощью аппаратов «Яхта-3», «Яхта-4», «Яхта-5».
Материал и методы
Оценка результатов лечения, в том числе и термолучевого, проведена у 895 больных РПЖ, находившихся на лечении в Челябинском ООД с января 1993 г. по декабрь 2002 г. Анализу подвергнуты пациенты с морфологически верифицированным диагнозом. Большинство из них имели низко- и умереннодифференцированные формы аденокарциномы. Неадено-генные опухоли встретились в 1,9 %. Изучена структура больных по стадиям заболевания: 743 пациента имели III и IV стадии заболевания, соответственно III – 447 (49,9 %) и IV – 296 (33,1 %) (рис. 1). В связи с тем, что к IV стадии РПЖ относятся как местно-распространенные процессы, так и опухоли с отдаленными метастазами, мы посчитали необходимым разделить таких пациентов на две группы: больные местно-распространенным (T4N0M0, T1–4N1M0) и диссеминированным РПЖ (T1–4N0–1M1). В первую подгруппу был включен 161 пациент (18 %), из них лучевое лечение получили 34 (21,1 %), гормональное – 44 (27,3 %), гормонолучевое – 46 (28,6%), гормонолучевое с терморадиомодификацией – 18 (11,2 %), отказались от лечения – 19 (11,8 %) пациентов. Ко второй подгруппе были отнесены 135 (15,1 %) больных, из них лучевое лечение получил 31 (23 %), гормональное – 39 (28,9 %), гормонолучевое – 41 (30,4 %), гормонолучевое с терморадиомодификацией – 13 (9,6 %), отказались от лечения – 11 (8,2 %).
Одной из основных задач исследования было определение места терморадиомодификации в комплексе методов лечения рака предстательной железы. В зависимости от использованных клинических методик всех больных с III и IV стадиями заболевания разделили на следующие группы: 1 – пациенты, получившие гормональное лечение, 2 – получившие лучевую терапию, 3 – больные, которым проводилось комплексное лечение без терморадиомодификации, 4 – получившие комплексное лечение с использованием терморадиомодификации, 5 – не получившие лечения.
Гормонотерапия заключалась в проведении максимальной андрогенной блокады, которая обеспечивалась сочетанием хирургической или медикаментоз-
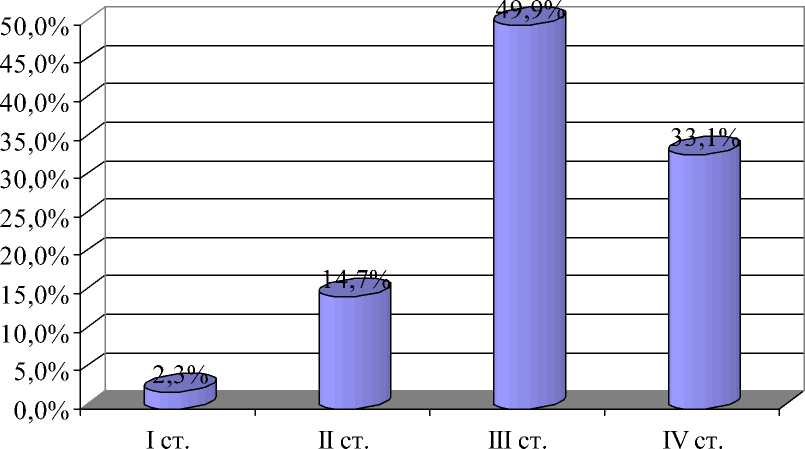
Рис. 1. Распределение больных раком предстательной железы по стадиям
ной кастрации с приемом стероидных или нестероидных антиандрогенов. Наиболее часто применялась хирургическая кастрация в сочетании со стероидными антиандрогенами – адрокур-депо по 300 мг 1 раз в 2 нед. Несмотря на наличие побочного эффекта, характерного для всех стероидов, пациенты предпочитали этот препарат в связи с удобством приема. Нестероидные антиандрогены – флутамид, флуцином – назначались ежедневно по 250 мг 3 раза. Вторая линия лечения проводилась эстрогенами. Наиболее часто применялся эстрадурин – 160–320 мг 1 раз в 28 дней. Медикаментозная кастрация осуществлялась агонистами гонадотропин-релизинг гормона: зола-декс 3,6 мг, диферелин 3,75 мг, бусерелин-депо 3,75 мг 1 раз в 28 дней.
Лучевая терапия проводилась в виде дистанционной гамма-терапии в динамическом или традиционном режиме сплит-курсом до суммарной общей дозы не менее 70 Гр. Терморадиомодификацию выполняли по разработанной и запатентованной нами методике: нагревание предстательной железы до 52– 59°С в течение 1 ч трансуретрально или трансректаль-но за 60 мин до проведения лучевой терапии.
Оценка эффективности лечения проведена путем изучения отдаленной выживаемости в зависимости от стадии процесса и использованного метода лечения.
Результаты и обсуждение
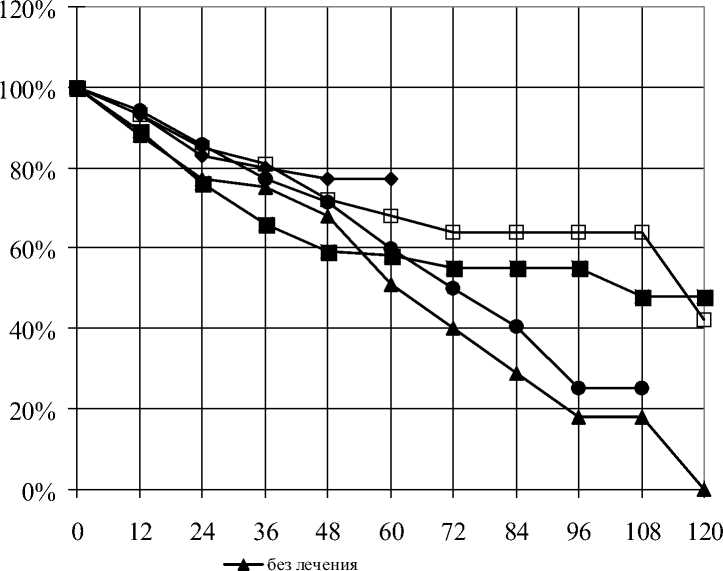
Анализ полученных 5-летних результатов показал, что при III стадии РПЖ (рис. 2) наиболее эффективным оказалось комбинированное лечение c использованием терморадиомодификации, 5-летняя выживаемость в данной группе больных была наибольшей – 76,7 %. Изучение результатов лечения в более отдаленные сроки является предметом наших дальнейших исследований.
В остальных группах больных были изучены 10-летние результаты лечения. Общепризнанно, что комплексный подход в лечении рака предстательной железы является основным. В связи с этим в настоящее время сочетанное применение гормональных препаратов с лучевой терапией является наиболее распространенным методом лечения. Анализ результатов лечения больных в этой группе подтверждает его высокую эффективность. Установлено, что 5-летняя выживаемость в этой группе составляет
гормонотерапия гормонотермолучевая терапия гормонолучевая терапия лучевая терапия
Рис. 2. Кумулятивная выживаемость больных раком простаты III ст. в зависимости от метода лечения
66,1 %, что превосходит аналогичные показатели в группах, где проводилось противоопухолевое лечение различными методами в режиме монотерапии, уступая лишь отдаленным результатам в группе больных с терморадиомодификацией – 76,7 %. К 10-му году наблюдения показатели выживаемости в группе пациентов, получивших только гормонотерапию, выше, чем при сочетанном гормонолучевом лечении. Так, если у больных с комбинированным лечением 10-летняя выживаемость составляет 42,5 %, то у больных, получивших только гормональную терапию, – 47,5 %.
У больных, получивших лучевую терапию, значения 5-летней выживаемости сопоставимы с отда- ленными результатами при гормонолучевом лечении, однако в последующем в группе 2 (лучевая терапия) этот показатель неуклонно снижается. Максимальный срок сопоставления уровней выживаемости при этих методах лечения – 9 лет. При использовании гормонолучевой терапии этот показатель составляет 63,5 %, при гормонотерапии – 47,9 % и при лучевом лечении – 24,5 % (рис. 2). Снижение уровня выживаемости к концу срока наблюдения у пациентов с лучевой терапией говорит о необходимости поддерживать противоопухолевый эффект с помощью пролонгированного гормонального лечения.
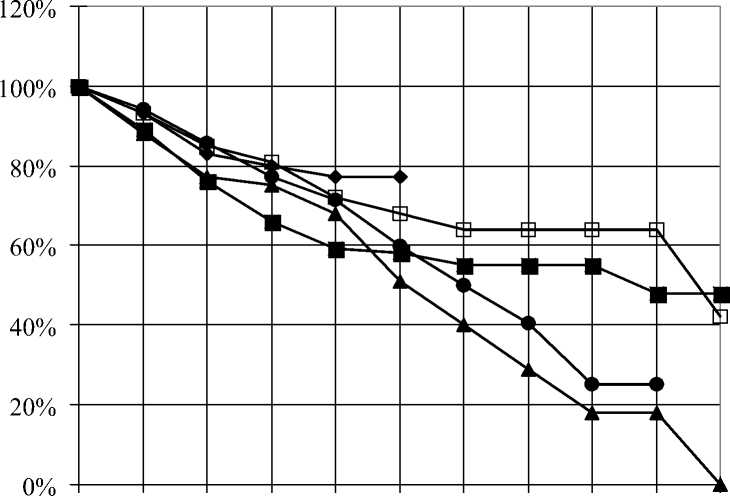
Изучение отдаленной выживаемости у больных местно-распространенным РПЖ в зависимости от
0 12
24 36 48 60 72 84
96 108 120
без лечения гормонотерапия гормонотермолучевая терапия гормонолучевая терапия лучевая терапия
Рис. 3. Кумулятивная выживаемость больных раком предстательной железы IV ст. (местнораспространенная опухоль) в зависимости от метода лечения метода лечения позволило сделать следующие выводы – наиболее эффективным вариантом лечения является гормонолучевая терапия – 10-летняя выживаемость у данной категории пациентов достигает почти 30 % (рис. 3). Наблюдение в этой группе продолжается. В то же время отмечено, что в течение первых 5 лет наблюдения выживаемость у пациентов в этой группе несколько уступает таковой у пациентов, получивших лучевую терапию в монорежиме. По-видимому, для пациентов с распространенными формами заболевания сочетание двух методов лечения, в данном случае – лучевого и гормонального, является более токсичным, чем монотерапия.
Назначение гормональных препаратов дает худшие 5-летние результаты по сравнению с группами больных, получавших гормонолучевое и лучевое лечение. При гормонотерапии в монорежиме немногим более 50 % больных доживают до 5-го года наблюдения. Однако при дальнейшем наблюдении, к 7му году после лечения уровень выживаемости у больных, получивших гормонотерапию, превосходит аналогичный показатель в группе больных, которым проводилась лучевая терапия в монорежиме. Десятилетняя выживаемость при назначении гормональных препаратов составляет 13 % (рис. 3).
Термолучевая терапия на фоне максимальной андрогенной блокады проведена всего 18 пациентам рассматриваемой группы, что недостаточно для статистически достоверных выводов. Тем не менее прослеживается тенденция, говорящая о том, что такая
120%
100%
80%
60%
40%
20%
0%
0 12 24 36 48 60 72 84 96 108 120
без лечения гормонотерапия гормонотермолучевая терапия гормонолучевая терапия лучевая терапия
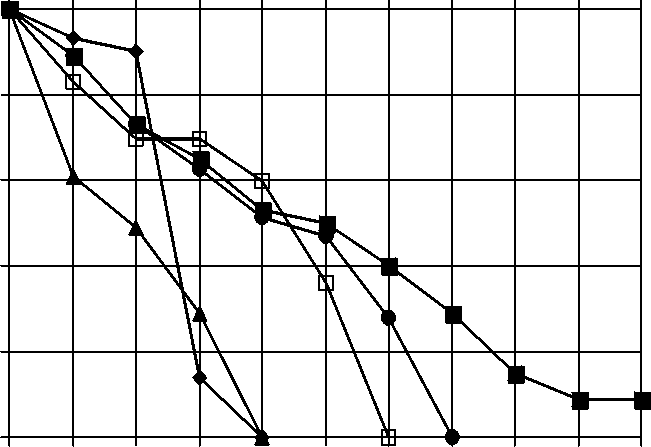
Рис. 4. Кумулятивная выживаемость больных метастатическим раком простаты в зависимости от метода лечения комбинация не приводит к увеличению отдаленной выживаемости при местно-распространенном раке простаты. Результаты лечения больных в данной группе уступают даже показателям выживаемости пациентов, не получивших лечения. Факт настораживающий, который требует более строгого определения показаний для проведения термолучевой терапии.
В результате изучения 10-летней выживаемости у больных метастатическим РПЖ в сравниваемых группах установлено, что наиболее эффективным методом лечения в данном случае является гормональная терапия – выживаемость у этих пациентов
.-А~ X х х О X ..А .XX 1 А / Т ' ' "1 — О ' ' О а Z X A Z ~ X г ....О ..ХА ainoeaaao ii-oe 10 %. laaepaaiea a yoie aOoiia iOi-aie$aadny. ladauaao fa naay afeiafea 010 oaeO, -01 ladeaiOu П aennaiefediaaffui Oaeii IdinOaOu, iieo-eaoea aOoaea aeau ea-aiey, ai 10 eao ia ai$e-aapo (oen. 4). lOe eo-aaie oaoaiee oaaeinu aiaeouny
-
7 — О X Z О Z A A ХАХ ОХАаХ X AAXXAZA-. Z .OAX-. XOXX..X..
-eaoiae au^eaaaiinoe. Ai0iineo-aaay oaOaiey iaiaa yooaeoeaia, aieuiua yoie aOoiiu $eaoo ia aieaa 6 eao. li-aeaeiiio, ni-aoaiea aaoo iaoiaia ioioeaiiiooieaaiai ai^aaenoaey iea^uaaaony aieaa oiene-fui aey iadeafoia n iaoanoaoe-aneei Dl^,
.OX AX ..AZ x z ' ~ A A X .. О .. .. ZA~ X x
-
-ai ea^aue eg ieo a ioaaeunnoe.
О X X A .. Z . О A Z 1 X О X X .. X 1 Z X A AZ О XXA~XXX.. .. ZAZ
Oa0iieo-aaop oaOaiep ia oiia iaeneiaeune aiaOiaaiiie aeieaau iieo-eee 13 iaoeaioia Oan- сматриваемой группы. В связи с этим нельзя сделать статистически достоверные выводы, однако прослеживается тенденция, говорящая о том, что сочетание гормонолучевого лечения с терморадиомодификацией не приводит к увеличению продолжительности жизни пациентов метастатическим РПЖ, так же как и при местно-распространенном раке простаты. Результаты лечения больных в данной группе идентичны данным наблюдения за больными, отказавшимися от специального лечения.
Анализ результатов различных вариантов лечения больных III–IV стадиями рака предстательной железы позволил сделать вывод о том, что наиболее эффективным является многокомпонентный подход. Нагревание предстательной железы перед лучевой терапией значительно улучшает результаты лечения при III стадии заболевания, но не должно применяться у больных с IV стадией РПЖ. Наиболее вероятной причиной этого феномена является усугубление побочных токсических эффектов терапии у больных с генерализованными формами рака простаты. Лучевая терапия оказывается более эффективной в первые годы наблюдения после лечения, но в последующем выживаемость в этой группе больных снижается, в то время как применение гормонотерапии позволяет сохранить полученный результат более длительно, несмотря на меньшую эффективность вначале. При диссеминированном раке предстательной железы проведение комбинированного лечения не оправдано, в данном случае методом выбора является гормональная терапия.


