Рак толстой кишки с микросателлитной нестабильностью у пожилых больных: роль иммунодефицита и клинические особенности
Автор: Пашков Денис Валерьевич, Венина Айгуль Рифовна, Иванцов Александр Олегович, Янус Григорий Аркадьевич, Раскин Григорий Александрович, Имянитов Евгений Наумович, Кубрина Снежана Евгеньевна, Микушина Анна Дмитриевна, Манихас Георгий Моисеевич, Пономарева Елена Васильевна, Дзидзава Илья Игоревич, Иевлева Аглая Геннадиевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.19, 2020 года.
Бесплатный доступ
Актуальность. Опухоли с феноменом микросателлитной нестабильности (microsatellite instability, MSI) представляют собой отдельную категорию рака толстой кишки (РТК). Подобные новообразования составляют до 20 % карцином этой локализации и характеризуются своеобразными молекулярными и клиническими проявлениями, в том числе высокой иммуногенностью и чувствительностью к иммунотерапии. Микросателлитная нестабильность встречается у двух разных групп пациентов - молодых больных с синдромом Линча и у пациентов старше 70 лет с ненаследственным РТК. Мы предполагаем, что развитию спорадических MSI-позитивных опухолей у пожилых пациентов может способствовать сопутствующее старению снижение иммунной защиты. Целью исследования стало изучение различных клинико-морфологических характеристик у пожилых больных с MSI-позитивным РТК. Материал и методы. Микросателлитная нестабильность и мутация V600E в гене BRAF оценивались методами, основанными на ПЦР, в группе из 384 больных РТК старше 65 лет. Сравнительный анализ клинических и патоморфологических особенностей выполнен у 23 пациентов с MSI-позитивными опухолями и 34 больных MSI-негативным РТК. Результаты. В группе больных РТК с MSI-позитивным фенотипом преобладают случаи локализации рака в правой половине ободочной кишки, низкая степень дифференцировки и наличие муцинозного компонента в опухоли (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Рак толстой кишки, микросателлитная нестабильность, мутация, резус-фактор
Короткий адрес: https://sciup.org/140254319
IDR: 140254319 | УДК: 616.345-006.6-092-053.89:575.224.2:575.113 | DOI: 10.21294/1814-4861-2020-19-1-31-39
Текст научной статьи Рак толстой кишки с микросателлитной нестабильностью у пожилых больных: роль иммунодефицита и клинические особенности
Утрата одного из компонентов системы репарации неспаренных оснований ДНК (mismatch repair – MMR) – ключевое звено патогенеза опухолей с феноменом микросателлитной нестабильности (microsatellite instability, MSI; high level microsatellite instability, MSI-H). Следствием дефекта системы репарации является накопление трансформированными клетками тысяч мутаций в микросателлитных повторах и других участках генома.
Феномен MSI-H встречается у 7–20 % пациентов с карциномами толстой кишки [1–4] и характерен для двух разных категорий пациентов. К первой группе относятся больные с наследственным неполипозным раком толстой кишки (hereditary non-polyposis colorectal cancer, HNPCC, синдром Линча). Пациенты этой группы являются гетерозиготными носителями мутации в одном из генов репарации неспаренных оснований ДНК и имеют почти фатальный риск онкологического заболевания, характеризующийся развитием карцином в возрасте 30–50 лет. Мутация BRAF в таких опухолях почти никогда не встречается. Вторая группа – пациенты в возрасте старше 70 лет с ненаследственными опухолями. Эти опухоли характеризуются соматической инактивацией генов MMR чаще гена MLH1 посредством метилирования и более чем в половине случаев содержат мутации в гене BRAF [4–11].
К известным особенностям MSI-H опухолей относятся преобладание пациентов женского пола, локализация в проксимальных отделах ободочной кишки, выраженная лимфоцитарная инфильтрация в опухоли, преобладание низкодифференцированных карцином, наличие слизеобразования и/или перстневидно-клеточного компонента, меньшая частота мутаций в генах KRAS и р53, благоприятный клинический прогноз, меньший метастатический потенциал, меньшая чувствительность к химиотерапии [4–6, 12–22].
Опухоли толстой кишки с фенотипом MSI-H содержат тысячи мутаций и отличаются высокой иммуногенностью [23, 24]. Считается, что старение практически всегда сопровождается иммунодефицитом [25]. Можно предположить, что сопутствующий старению иммунодефицит приводит к утрате способности сдерживать рост даже высокоиммуногенных новообразований. Особенности иммунитета у пожилых могут послужить причиной более частого развития MSI-H карцином толстой кишки у пациентов старшей возрастной группы. Не исключено, что опухоли с подобным патогенезом распознаются и устраняются иммунной системой у людей молодого возраста, а наличие иммунодефицита в группе больных старше 70 лет не позволяет сдерживать рост и распространение MSI-H карцином.
Целью исследования явился сравнительный анализ клинико-патологических особенностей нескольких групп больных колоректальным раком для выявления косвенных признаков иммунодефицита у пожилых пациентов с MSI-H-опухолями.
Материал и методы
В исследование включены 384 больных раком ободочной и прямой кишки, в возрасте старше 65 лет, получавшие лечение в Санкт-Петербургском городском клиническом онкологическом диспансере в 2013–15 гг. Опухолевая ДНК, выделенная из архивного патоморфологического материала, протестирована на наличие феномена микро-сателлитной нестабильности с использованием мононуклеотидного маркера BAT26 и в некоторых случаях дополнительных маркеров BAT25, BAT40, CAT25, NR22, NR27 по описанным ранее протоколам [26]. Во всех случаях с микросателлит-ной нестабильностью выполнен анализ мутации V600E в гене BRAF с использованием аллель-специфической ПЦР [26]. После генетического тестирования на основе данных историй болезни проанализированы клинико-морфологические характеристики больных с микросателлитной нестабильностью (MSI-H, n=23) в сравнении с контрольной группой пациентов без микросател-литной нестабильности (MSS, microsatellite stable, микросателлит-стабильные, MSI-негативные опухоли, n=34). Сравнивали локализацию и стадию опухолевого процесса, особенности анамнеза жизни (первично-множественный характер новообразований, наличие в анамнезе аппендэктомии), группу крови и резус-принадлежность, формулу крови и ее динамику в периоперационном периоде, послеоперационные осложнения, особенности клинического течения, морфологические характеристики опухоли (слизеобразование, степень дифференцировки). Мутации BRAF в MSI-позитивных случаях свидетельствуют о спорадическом характере опухоли, поэтому все сравнения выполнены также для подгруппы больных РТК с фенотипом MSI-H/BRAF+ (n=15).
Для оценки интра- и периопухолевой инфильтрации цитотоксическими лимфоцитами использовалось иммуногистохимическое исследование с антителами к CD8 (DAKO, разведение 1:100, клон DK25) с применением системы детекции DAKO EnVision FLEX. Количество CD8+ клеток подсчитывалось в 1 мм2 ткани.
Для сравнения частот изучаемых параметров в разных группах использовался точный тест Фишера. Сравнительная оценка количественных переменных в группах выполнялась при помощи t-критерия (в случае нормального распределения) или U-критерия Манна – Уитни.
Результаты
В группе из 384 больных РТК старше 65 лет феномен микросателлитной нестабильности выявлен у 28 (7,3 %) пациентов. Мутация BRAF V600E,
Таблица / table
Сравнение групп Msi-H/BRaF+, Msi-H/BRaF- и Mss опухолей толстой кишки Comparison of Msi-H/BRaF+, Msi-H/BRaF- and Mss colon tumors
|
Группа 1 vs Группа 2 vs Группы 1+2 Группа 1/ Группа 2/ Группа 3/ группа 3/ группа 3/ vs группа 3/ Пр изнак Group1 Group 2 Group3 Group 1 vs Group 2 vs Group 1+2 vs (переменная)/ Варианты/ group 3 group 3 group 3 Variants Sign (variable) MSI-H/ MSI-H/ BRAF+ BRAF- MSS p p p n=34 n=15 n=8 |
|
Муж/Male 2 (13,3 %) 4 (50 %) 14 (41,2 Пол пациента/ ) 0.097 0.706 0.273 Patient gender Жен/Female (861,73%) 4 (50 %) (58 2 ,8 0 %) |
|
Аппендэктомия Да/Yes 6 (40 %) 1 (12,5 %) 5 (14,7 %) в анамнезе/ 0.069 1.0 0.194 History of Нет/No 9 (60 %) 7 (87,5 %) 29 appendectomy (85,3 %) |
|
Антиген D RhD+ 7 (46,7 %) 7 (87,5 %) 30 эритроцитов/ ( 88,2 % ) 0.004* 1.0 0.024* RBC Antigen D RhD- 8 (53,3 %) 1 (12,5 %) 4 (11,8 %) |
|
ЖКТ/ Gastrointestinal 5 (33,3 %) 1 (12,5 %) 2 (5,9 %) Наличие первично- tract множественных не ЖКТ/ 0.089 1.0 0.145 опухолей/ Non- 2 (133 %) 1 (125 %) 5 (147 %) (есть vs нет/ (есть vs нет/ (есть vs нет/ Presence of multiple- gastrointestinal , , , yes vs no) yes vs no) yes vs no) primary tumors tract 27 Нет/No 8 (53,4 %) 6 (75 %) (79 2 ,4 7 %) |
|
Да/Yes 14 6 (75 %) 19 (93,3 %) (55,9 %) Наличие анемии/ 0.018* 0.439 0.020* Presence of anemia Нет/No 1 (6,7 %) 2 (25 %) (44 1 ,1 5 %) |
|
Локализация Пнаряо/кPсrиoxмiаmлaьl- 15 (100 %) 5 (62,5 %) 5 (14,7 %) опухоли/ <0.0001** 0.012* <0,0001** Tumor localization Дистальная/ 0 (0 %) 3 (37,5 %) 29 Distal (85,3 %) |
|
Токсико- анемическая/ 4 (50,0 %) 6 (17,6 %) (66,7 %) Toxicoanemic. Энтеро- 14 колитическая/ 1 (6,7 %) 2 (25,0 %) 0.002* 0.076 0.002* Клинический (,) nerocos (токсико- (токсико- (токсико- вариант опухолево- Диспепсиче- анемич. vs анемич. vs анемич. vs гопроцесса ская/ 1 (6,7 %) 1 (12,5 %) 0 (0 %) иное/ иное/ иное/ Clinical type of Dyspepsia toxicoanemic. toxicoanemic. toxicoanemic. tumor Обтурацион- vs others) vs others) vs others) ный/ 1 (6,7 %) 1 (12,5 %) 8 (23,5 %) Obstructive АтAиtпyиpчicнaыlй/ 2 (13,3 %) 0 (0 %) 6 (17,6 %) |
|
Местно- Да/Yes 8 (53,3 %) 5 (62,5 %) 26 распространённый (76,5 %) рак/ 0.177 0.412 0.150 Locally advanced Нет/No 7 (46,7 %) 3 (37,5 %) 8 (23,5 %) cancer |
|
Метастатический рак/ Metastatic cancer |
Да/Yes Нет/No |
1 (6,7 %) 14 (93,3 %) |
0 (0 %) 8 (100 %) |
5 (14,7 %) 29 (85,3 %) |
0.652 |
0.564 |
0.385 |
|
Степень дифферен- |
G1 |
2 (13,3 %) |
2 (25 %) |
13 (38,2 %) |
0.022* |
0.031* |
0.005* |
|
цировки/ Differentiation grade |
G2 |
6 (40 %) |
2 (25 %) |
17 (50 %) |
(G1+2 vs 3) |
(G1+2 vs 3) |
(G1+2 vs 3 ) |
|
G3 |
7 (46,7 %) |
4 (50 %) |
4 (11,8 %) |
||||
|
Слизеобразование в |
Да/Yes |
6 (40 %) |
6 (75 %) |
2 (5,9 %) |
|||
|
опухоли/ |
32 (94,1 %) |
0.007* |
0.0001** |
0.0001** |
|||
|
Mucus in the tumor |
Нет/No |
9 (60 %) |
2 (25 %) |
||||
|
Лихорадка после |
Да/Yes |
8 (53,3 %) |
3 (37,5 %) |
13 (38,2 %) |
|||
|
операции/ |
0.363 |
1.0 |
0.587 |
||||
|
Fever after surgery |
Нет/No |
7 (46,7 %) |
5 (62,5 %) |
21 (70,6 %) |
|||
|
Норма/Norm |
9 (60 %) |
5 (62,5 %) |
31 (91,2 %) 1 (2,9 %) |
0.016* |
0 072 |
0.009* |
|
|
Уровень лейкоцитов до операции/White blood cell count |
Лейкопения/ Leukopenia |
1 (7,7 %) |
1 (12,5 %) |
(норма vs иное/ normal vs |
. (норма vs иное/ normal vs |
(норма vs иное/ normal vs |
|
|
before surgery |
Лейкоцитоз/ Leukocytosis |
5 (33,3 %) |
2 (25 %) |
2 (5,9 %) |
others) |
others) |
others) |
|
Уровень лейкоцитов |
Норма/Norm |
2 (13,3 %) |
2 (25 %) |
3 (8,8 %) |
|||
|
после операции/ White blood cell |
Лейкоцитоз/ |
13 (86,7 |
6 (75 %) |
31 (91,2 |
0.635 |
0.237 |
0.423 |
|
count after surgery |
Leukocytosis |
%) |
%) |
||||
|
Норма/Norm |
11 (73,3 %) |
6 (75 %) |
28 (82,4 %) |
||||
|
Уровень лимфоцитов до операции/ White blood cell count before surgery |
Лимфопения/ Leukopenia |
4 (26,7 %) |
2 (25 %) |
1 (2,9 %) |
0.026* (лимфопения vs иное/ |
0.088 (лимфопения vs иное/ |
0.014* (лимфопения vs иное/ |
|
lymphopenia |
lymphopenia |
lymphopenia |
|||||
|
Лимфоцитоз/ Leukocytosis |
0 (0 %) |
0 (0 %) |
5 (14,7 %) |
vs others) |
vs others) |
vs others) |
|
|
Уровень лимфоцитов после операции/ |
Лимфопения/ Leukopenia |
15 (100 %) |
8 (100 %) |
33 (97,1 %) |
1.0 |
1.0 |
1.0 |
|
White blood cell count after surgery |
Норма/Norm |
0 (0 %) |
0 (0 %) |
1 (2,9 %) |
|||
|
Осложнения после |
Да/Yes |
2 (15,4 %) |
2 (25 %) |
3 (8,8 %) |
|||
|
операции/ Complications after surgery |
Нет/No |
13 (86,7 %) |
6 (75 %) |
31 (91,2 %) |
0.635 |
0.237 |
0.423 |
Примечание: * – статистически значимые различия;** – различия, сохраняющие достоверность при применении поправки на множественные сравнения.
Notes: * – statistically significant differences; ** – differences that remain valid when applying the correction for multiple comparisons.
характерная для спорадических MSI-позитивных опухолей, обнаружена в 17 (60,7 %) из этих 28 случаев. Средний возраст больных РТК с MSI-H (76,9 ± 1,17 года) и больных РТК с фенотипом MSI-H/BRAF+ (78,8 ± 1,23 года) достоверно выше, чем в группе с микросателлит-стабильными карциномами (74,2 ± 0,3 года) (p=0,021 и p=0,0013 соответственно). Среди пациентов с MSI-H/BRAF+ карциномами доля женщин оказалась выше (13/15, 86,6 %), чем в группе MSI-негативных новообразований (180/297, 60,6 %) (p=0,055).
В более подробный анализ клиникоморфологических параметров вошли 23 случая РТК с микросателлитной нестабильностью, включая 15 наблюдений MSI-H/BRAF+, а также 34 больных РТК без фенотипа MSI (таблица). Статистически значимые различия между группами наблюдались по признакам локализации новообразования, степени дифференцировки опухоли и наличия в опухоли муцинозного компонента. Так, у всех пациентов с MSI-H/BRAF+ карциномами опухоль локализовалась в проксимальных отделах
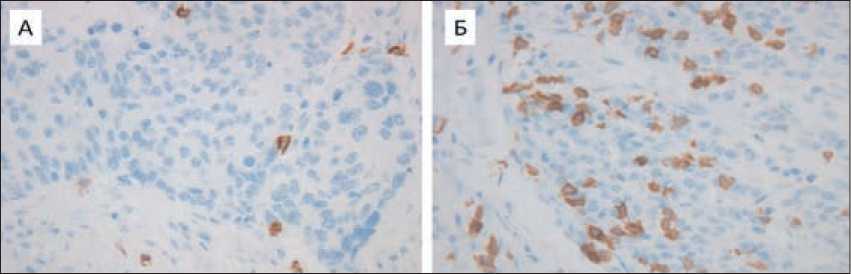
Рис. 1. Примеры иммуногистохимического окрашивания с антителами к CD8, ×400. А: микросателлит-стабильная опухоль, Б: опухоль с фенотипом MSI-H/BRAF+.
Fig.1. Immunohistochemical staining with antibodies to CD8, ×400.
A: microsatellite-stable tumor, B: tumor with the MSI-H/BRAF+ phenotype.
ободочной кишки (слепая кишка – 5, восходящая – 7, поперечно-ободочная – 3) . В контрольной группе (MSS) опухоль в 16,2 % случаев располагалась в правой половине ободочной кишки и в 83,8 % – в левой половине ободочной кишки, 53 % пациентов этой группы составили больные раком сигмовидной кишки (p<0,0001). Особенности локализации определили различия в клинических вариантах течения опухолевого процесса. У больных в группе MSI-H преобладали случаи токсико-анемического рака ободочной кишки. У пациентов с MSS опухолями, наряду с токсико-анемическими проявлениями, с равной частотой встречались энтеро-колитический, обтурационный и другие клинические варианты РТК. В соответствии с этим исходная анемия (анемия при поступлении) среди больных РТК с фенотипом MSI-H/BRAF+ отмечена у 93,3 %, в контрольной группе – у 55,9 % (p=0,018). MSI-позитивный статус опухоли чаще сопровождался низкой степенью ее дифференцировки и присутствием муцинозного компонента (p=0,005 и p=0,0001 соответственно).
Интересно, что в группах больных РТК MSI-H/ BRAF+ и MSS значительно отличалась частота резус-положительного и резус-отрицательного фенотипа эритроцитов. В группе MSI-H/BRAF+ резус-негативный (RhD-) фенотип встретился у 8 (53,3 %) пациентов из 15, тогда как в контрольной группе распределение больных по резус-принадлежности крови не отличалось от популяционного – 30 пациентов имели резус-положительный фенотип, 4 пациента – негативный (p=0,004). Также у больных с MSI-H карциномами отмечено увеличение частоты дооперационных отклонений уровня лейкоцитов (за счет лейкоцитоза или лейкопении, p=0,009) и лимфоцитов (за счет лимфопении, p=0,014) периферической крови. Среднее относительное содержание лимфоцитов при поступлении в клинику в группе MSI-H/BRAF+ случаев составило 25,39 ± 9,3, в контрольной группе – 30,78 ± 7,94 (p=0,044).
В послеоперационном периоде динамика показателей белой крови в MSI-H и MSS группах была сопоставима. У большинства пациентов в ответ на хирургическое вмешательство развивались лейкоцитоз и лимфопения. Степень повышения уровня лейкоцитов и выраженность лимфопении в сравниваемых категориях пациентов не отличались.
В 14 MSI-H/BRAF+ и 28 микросателлит-стабильных карциномах оценена инфильтрация опухолевой ткани цитотоксическими CD8-позитивными лимфоцитами. В то время как количество периопухолевых CD8+ клеток не отличалось в двух группах (средние значения составили 128,6 ± 32,8 и 150,3 ± 28,4 клеток на 1 мм2, p=0,621), то уровень внутриопухолевых лимфоцитов оказался значительно выше в MSI-H карциномах (256,4 ± 47,8 vs 27,9 ± 8,4 клеток на 1 мм2, p=0,0003) (рис. 1).
Обсуждение
Объектом настоящего исследования стала одна из категорий MSI-позитивного рака толстой кишки, а именно спорадические карциномы пожилых (старше 65 лет) пациентов. В анализ включены как новообразования, содержащие мутации BRAF, которые служат дополнительным критерием ненаследственного характера заболевания, так и BRAF-негативные случаи. Большинство из выявленных ассоциаций оказались справедливы для обеих анализируемых MSI-позитивных подгрупп и уже были описаны в литературе ранее. К таким известным свойствам MSI-H РТК относятся преимущественная локализация опухоли в проксимальных отделах толстой кишки, преобладание низкодифференцированных форм, наличие слизеобразования в опухоли и выраженная лимфоцитарная инфильтрация. Помимо этого, в ходе исследования обнаружена повышенная частота отклонений формулы крови на момент установки диагноза среди больных с MSI-H карциномами. Мы предполагаем, что в механизме развития лейкоцитоза и лимфопении в исследуемой группе может играть роль стимуляция неспецифического иммунного ответа на фоне имеющейся высокоиммуногенной опухоли. Уста- новленное преобладание в клинической картине MSI-H/BRAF+ карцином токсико-анемического синдрома, вероятно, связано с преимущественной локализацией этих опухолей в проксимальных участках толстой кишки. Известно, что у больных раком правой половины ободочной кишки анемия встречается достаточно часто.
Интересной находкой является преобладание среди больных с MSI-H+/BRAF+ опухолями резус-отрицательного фенотипа эритроцитов. Известно, что располагающийся на мембране эритроцитов RhD-белок обладает высокой иммуногенностью, однако его биологическая роль до конца не ясна. Высказываются предположения, что мембранный белковый комплекс, в который входит RhD, участвует в формировании пространственной структуры эритроцитов, транспорте токсичных продуктов белкового обмена из тканей в почки и печень, поддержании содержания кислорода
Список литературы Рак толстой кишки с микросателлитной нестабильностью у пожилых больных: роль иммунодефицита и клинические особенности
- Hatch S.B.,Lightfoot H.M.Jr., Garwacki C.P.,Moore D.T., Calvo B.F., Woosley J.T., Sciarrotta J., Funkhouser W.K., Farber R.A. Microsatellite instability testing in colorectal carcinoma: choice of markers affects sensitivity of detection of mismatch repair-deficient tumors. Clin Cancer Res. 2005 Mar 15; 11(6): 2180-7.
- Morandi L., de Biase D., Visani M., Monzoni A., Tosi A., Brulatti M., Turchetti D., Baccarini P., Tallini G., Pession A. T([20]) repeat in the 3'-untranslated region of the MT1X gene: a marker with high sensitivity and specificity to detect microsatellite instability in colorectal cancer. Int J Colorectal Dis. 2012 May; 27(5): 647-56. DOI: 10.1007/s00384-011-1365-7
- Pinol V., Castells A., Andreu M., Castellv UBel S., Alenda C., Llor X., Xicola R.M., Rodriguez-Moranta F., Paya A., Jover R., Bessa X.; Gastrointestinal Oncology Group of the Spanish Gastroenterological Association. Accuracy of revised Bethesda guidelines, microsatellite instability, and immunohistochemistry for the identification of patients with hereditary nonpolyposis colorectal cancer. JAMA. 2005 Apr 27; 293(16): 1986-94. DOI: 10.1001/jama.293.16.1986
- Vilar E., Gruber S.B. Microsatellite instability in colorectal cancer-the stable evidence. Nat Rev Clin Oncol. 2010 Mar; 7(3): 153-62. DOI: 10.1038/nrclinonc.2009.237
- Boland C.R., Goel A. Microsatellite instability in colorectal cancer. Gastroenterology. 2010; 138(6): 2073-2087. 10.1053/j. gastro.2009.12.064. DOI: 10.1053/j.gastro.2009.12.064


