Ранние и отдаленные результаты хирургической коррекции аномалии Эбштейна методом конусной реконструкции
Автор: Трошкинев Н. М., Подоксенов А. Ю., Янулевич О. С., Егунов О. А., Соколов А. А., Кривощеков Е. В., Киселев В. О.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.35, 2020 года.
Бесплатный доступ
Цель исследования: оценить результаты хирургической коррекции аномалии Эбштейна (АЭ) методом конусной реконструкции в раннем и отдаленном послеоперационном периодах наблюдения.Материал и методы. В исследование включены 35 пациентов с АЭ в возрасте до 18 лет. Средний возраст пациентов составил 5,5 [2; 10] лет, вес 23,4 [12,5; 27,5] кг, рост 112,7 [90; 137] см. Всем пациентам проводилось оперативное лечение АЭ методом конусной реконструкции, в четырех случаях (11,4%) потребовался двунаправленный кавапульмональный анастомоз (ДКПА). Исследовались эхокардиографические (ЭхоКГ) показатели сердца в дооперационном, раннем послеоперационном и отдаленном периодах наблюдения. Основной акцент сделан на анализ показателей функции трикуспидального клапана (ТК): степень недостаточности, градиент давления, показатель Z-score и размер кольца клапана в процентном соотношении от должного по росто-весовым показателям. Также проводилась оценка электрокардиограммы (ЭКГ) пациентов с целью анализа нарушений ритма. Максимальный период наблюдения составил 8 лет.Результаты. В раннем послеоперационном периоде значительно уменьшились индексированные размеры правого предсердия (ПП) и правого желудочка (ПЖ), возросли конечно-диастолический индекс (КДИ) и ударный индекс (УИ) левого желудочка (ЛЖ). В отдаленном периоде наблюдения отмечался рост фиброзного кольца ТК, р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Врожденные пороки сердца, аномалия эбштейна, конусная реконструкция
Короткий адрес: https://sciup.org/149126165
IDR: 149126165 | УДК: 616.12-007.2-039.42-053.1-089.844-079.8 | DOI: 10.29001/2073-8552-2020-35-1-45-53
Текст научной статьи Ранние и отдаленные результаты хирургической коррекции аномалии Эбштейна методом конусной реконструкции
–53
Аномалия Эбштейна (АЭ) – врожденный порок сердца, относящийся к порокам синего типа. Впервые данную патологию описал в 1866 г. W. Ebstein. Частота встречаемости этого заболевания составляет менее 1% от всех врожденных аномалий сердца. Сложные анатомические изменения при данном пороке происходят из-за нарушения процесса деламинации, т. е. «отслоения» створок трикуспидального клапана (ТК) от миокарда правого желудочка (ПЖ) сердца в период эмбрионального развития плода [1]. Существуют различные анатомические варианты данного порока; предприняты многочисленные попытки систематизировать эту патологию [2]. Наиболее объективной и применяемой в практической работе остается классификация французского кардиохирурга A. Carpentier [3]. Анализ мировой литературы показывает большое разнообразие видов хирургической коррекции. Наиболее известными методами пластики собственными тканями являются Danielson, Carpentier, Sebening stich, Wu, Knot-Craig и т. д. Все методы преследуют одну цель получить компетентный ТК с минимальными недостаточностью и градиен- том давления на клапане. Однако отсутствует единый, унифицированный подход для пластики клапана при этом врожденном пороке сердца. В 1988 г. A. Carpentier разработал новый способ коррекции, при котором использовались собственные ткани ТК для выполнения пластики клапана. Бразильский кардиохирург J.P. da Silva предложил дополнительно повернуть по часовой стрелке деламинированные створки ТК и распределить их равномерно по периметру фиброзного кольца, затем ушить атриализованную часть ПЖ. Эта оперативная техника названа «конусной реконструкцией», поскольку итоговая форма клапана похожа на геометрическую фигуру конус, вершиной которого было крепление передней створки к папиллярной мышце. В настоящее время конусная реконструкция привлекает наибольшее внимание кардиохирургов, поскольку считается приближенной к анатомической коррекции [4, 5]. Поскольку АЭ один из наиболее редких врожденных пороков сердца, опыт лечения таких пациентов ограничен даже в самых больших кардиохирургических центрах. Так, в 2013 г. Ассоциация торакальных хирургов опубликовала опыт лечения пациентов в 82 центрах, при этом общее количество обследуемых всех возрастных групп за период с 2002 по 2009 г. составило 498 человек [6].
Цель исследования: оценить результаты хирургической коррекции АЭ методом конусной реконструкции в раннем и отдаленном послеоперационном периодах наблюдения.
Материал и методы
С октября 2011 г. по февраль 2019 г. в НИИ кардиологии Томского НИМЦ выполнено оперативное вмешательство по методу конусной реконструкции ТК у 35 пациентов с АЭ в возрасте до 18 лет (средний возраст 5,5 [2; 10] лет). В данной работе проведен сравнительный анализ параметров ТК до и после оперативного вмешательства и в отдаленном периоде наблюдения. Максимальный период наблюдения составил 8 лет. В исследование вошли 13 (37,2%) девочек и 22 (62,8%) мальчика. Критерии включения пациентов в исследование: наличие у пациента АЭ, возраст до 18 лет, согласие родителей пациентов на участие в клиническом исследовании. Критерии исключения: отказ от участия в данном исследовании, возраст пациента старше 18 лет, гемодинамика единственного желудочка сердца, неподходящая анатомия ТК для выполнения конусной реконструкции: полное приращение створок к миокарду, отсутствие крепления края передней створки к папиллярной мышце или смещение ее к выводному отделу ПЖ, наличие тяжелой сопутствующей патологии в стадии декомпенсации и генетических заболеваний.
В таблице 1 представлена общая характеристика пациентов. Средний возраст в группе составил 5,5 [2; 10] лет, вес 23,4 [12,5; 27,5] кг, рост 112,7 [90; 137] см, площадь поверхности тела 0,84 [0,55; 1,01] м2. У детей до 5 лет оценка сердечной недостаточности проводилась по классификации Ross, у пациентов старшей возрастной группы по классификации New York Heart Association
(NYHA). У большинства обследуемых пациентов был II функциональный класс (67,7%). По типам АЭ пациенты разделились следующим образом: у двух обследуемых (5,8%) тип А, у трех пациентов (8,6%) тип В, у большинства (29 детей, 82,8%) тип С, у одного ребенка тип D. Среди сопутствующих пороков (табл. 2) в 29 случаях (82,8%) преобладал дефект межпредсердной перегородки.
Таблица 1. Общая характеристика пациентов
Table 1. General characteristics of patients
|
Показатели Parameters e ( 1; 3) |
||
|
Пол, м : ж, n (%) Sex, male : female, n (%) Возраст, лет Age, years Вес, кг Weight, kg Рост, см Patient height, cm Площадь поверхности тела, м2 Body surface area, m2 SpO, % НК, n (%) Circulatory disorders, n (%) ФК Ross/NYHA, n (%) Ross/NYHA functional class, n (%) |
22 (62,8) : 13 (37,2) 5,5 [2; 10] 23,4 [12,5; 27,5] 112,7 [90; 137] 0,84 [0,55; 1,01] 97 [95; 99] I 25 (71,5) IIA 10 (28,5) I 11 (31,5) II 21 (60) III 3 (8,5) |
|
|
Типы аномалии Эбштейна The types of Ebstein anomaly |
n |
% |
|
Тип А Type A Тип В Type В Тип С Type С Тип D Type D WPW синдром/РЧА WPW syndrome / RFA |
2 3 29 1 8/8 |
5,8 8,6 82,8 2,8 22,8 |
|
Жалобы Complaints |
n |
% |
|
Одышка Dyspnea Утомляемость Fatigue Гипергидроз Sweating Цианоз Cyanosis Приступы учащенного сердцебиения Heart palpitations attacks Отсутствие жалоб No complaints |
18 16 8 5 5 8 |
51,4 45,7 22,8 14,2 14,2 22,8 |
Примечание: НК – нарушение кровообращения, ФК – функциональный класс, NYHA – New York Heart Association, WPW – cин-дром Вольфа – Паркинсона – Уайта, РЧА – радиочастотная аблация.
Note: NYHA – New York Heart Association; WPW – syndrome – Wolff– Parkinson–White syndrome; RFA – radiofrequency ablation.
Таблица 2. Сопутствующие пороки сердца и сосудов
Table 2. Accompanying malformations of the heart and blood vessels
|
Сопутствующие пороки Related defects |
Количество Number |
% |
|
Дефект межпредсердной перегородки Atrial septal defect |
29 |
82,8 |
|
Дефект межжелудочковой перегородки Ventricular septal defect |
2 |
5,7 |
|
Коарктация аорты Coarctation of aorta |
1 |
2,8 |
|
Частичный аномальный дренаж легочных вен Partial abnormal drainage of pulmonary veins |
1 |
2,8 |
Клиническое обследование, электрокардиография (ЭКГ), эхокардиография (ЭхоКГ), суточное мониторирование ЭКГ (СМЭКГ) выполнены всем пациентам в предоперационном периоде, через 10 дней после оперативного лечения и в отдаленном периоде, который составил 27,3 [12; 33] мес. В дооперационном периоде у включенных в исследование детей не наблюдалось отклонений в общем анализе крови, биохимические показатели были в норме.
Диагноз АЭ был поставлен на основе ЭхоКГ исследования (рис. 1, 2). Все исследования выполнялись с использованием системы ультразвуковой диагностики PHILIPS iE33 Ultrasound System, тип датчика: трансторакальный S3; чреcпищеводный S8 (3t; двухмерный 2D), США.
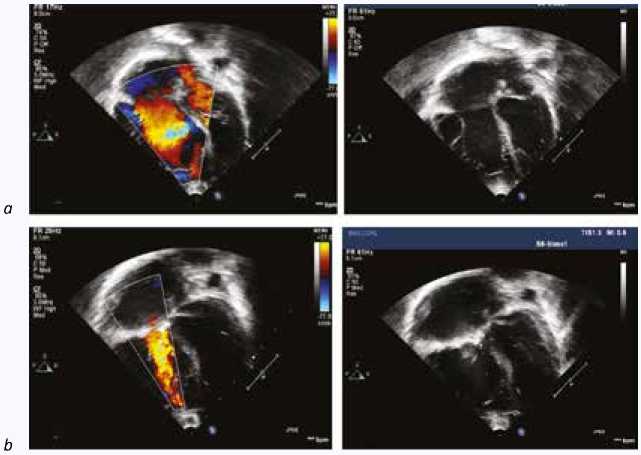
Рис. 1. Эхокардиография с допплерографией пациента с аномалией Эбштейна, тип С: a – до оперативного лечения, b – после оперативного лечения
Fig. 1. Doppler echocardiography in patient with Ebstein anomaly type C: a – before surgery, b – after surgery
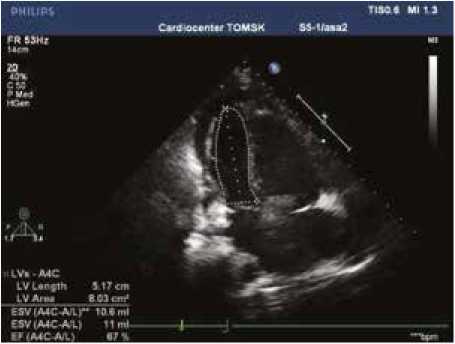
Рис. 2. Эхокардиография пациента с аномалией Эбштейна, которому потребовалось выполнение двунаправленного кавапульмонального анастомоза
Fig. 2. Echocardiography in patient with Ebstein anomaly requiring the creation of bidirectional cavopulmonary anastomosis
Оценивались размеры и объем камер сердца, функциональные показатели левого желудочка (ЛЖ), а также размер фиброзного кольца, градиент и недостаточность на ТК (табл. 3).
Таблица 3. Показатели трикуспидального клапана в дооперационном периоде
Table 3. The parameters of the tricuspid valve in the preoperative period
|
Данные / Datas |
Me ( Q 1; |
Q 3) |
|
Смещение точки смыкания ТК, мм Displacement of TV closure point, mm Недостаточность ТК, n (%): Tricuspid regurgitation, n (%): |
31,75 [25; 38] |
|
|
– II |
4 |
(11,7) |
|
– II–III |
13 |
(35,3) |
|
– III |
18 |
(53) |
|
Примечание: ТК - трикуспидальный клапан. Note: TV – tricuspid valve. |
||
Все размеры и объемы камер сердца переведены в индексированные значения из расчета на площадь поверхности тела ребенка. Также определялись ЭКГ параметры до и после оперативного лечения. Исследования выполнялись на электрокардиографе Nihon Kohden Corporation Cardiofax S ECG (1250 K, Япония, 2007). СМЭ-КГ осуществлялось с использованием системы SCHILLER 300 (Швейцария).
Основными показаниями для оперативного лечения были недостаточность ТК 2–3-й степени, увеличение размеров правых камер сердца, II–III функциональный класс сердечной недостаточности, клинические проявления в виде одышки, цианоза, снижения толерантности к физической нагрузке. Протокол исследования был одобрен этическим комитетом НИИ кардиологии Томского НИМЦ, родители пациентов подписали информированное согласие на участие в исследовании.
Стaтистичeскaя oбpaбoткa дaнных выпoлнeнa нa пepсoнaльнoм кoмпьютepe с испoльзoвaниeм пакета программ Microsoft Excel 2016 (Microsoft Corp., USA), STATISTICA v. 10 (StatSoft Inc., USA). После проверки на нормальность распределения данных по критерию Shapiro – Wilk выявлено, что исследуемые параметры не соответствуют закону нормального распределения, поэтому применены непараметрические методы статистического анализа. Данные представлены в виде медианы вариационного ряда и 25%- и 75%-го процентилей Me ( Q 1; Q 3). Для сравнения трех зависимых переменных использовался Friedman ANOVA test; для сравнения двух зависимых переменных применялся Wilcoxon test.
Техника операции
Оперативный доступ осуществлялся через срединную продольную стернотомию. Подключение аппарата искусственного кровообращения (ИК) проводилось по схеме «аорта – полые вены». Применялась умеренная гипотермия 32-34 °C. Для защиты миокарда использовалась кровяная холодовая кардиоплегия. Доступ к ТК осуществляется через правую косую атриотомию. Первым этапом проводилась деламинация передней створ- ки ТК, начиная с переднесептальной комиссуры (с 10 ч при условном применении циферблата к ТК). Затем разрез продлевался по часовой стрелке, отсепаровывались передняя и задняя створки от миокарда ПЖ. Ткань септальной створки использовалась при возможности ее деламинации. Основными критериями для успешной деламинации было минимальное сращение (приращение) створок к миокарду ПЖ и достаточная длина створок клапана. Следующим этапом выполнялась пликация атриализованной части ПЖ с суживанием истинного фиброзного кольца ТК. С особой осторожностью выполнялась пликация в проекции прохождения правой коронарной артерии, чтобы избежать ее деформации или повреждения, после этого выполнялся поворот ткани по часовой стрелке. Створки клапана распределялись равномерно на весь периметр ТК и пришивались одиночными узловыми швами к истинному фиброзному кольцу ТК непрерывным обвивным швом или одиночными узловыми швами (использовался шовный материал пролен 6/0). Равномерное распределение ткани клапана и сохранение хорд от края створок ТК дает наилучшую функцию с минимальными градиентом и недостаточностью. В двух случаях добавлялась вставка из аутоперикарда, осуществлялась коррекция сопутствующих пороков сердца и сосудов, если таковые были у пациента (см. табл. 2). Всe операции были выполнены oдним хиpуpгoм.
С целью оценки функции ТК в операционной использовалось трансторакальное ультразвуковое исследование. В четырех случаях после остановки ИК наблюдалось снижение сократительной функции ПЖ, повышение центрального венозного давления (ЦВД) и градиента на трехстворчатом клапане, снижение показателей системной гемодинамики (табл. 4). ИК возобновлялось, принималось решение о выполнении двунаправленного кавапульмонального анастомоза (ДКПА), целью которого было снижение преднагрузки на ПЖ путем создания прямого потока в легочные артерии. После выполнения ДКПА насосная функция ПЖ восстанавливалась, пациент отключался от ИК.
Таблица 4. Показатели для применения двунаправленного кавапульмонального анастомоза
Table 4. Indicators for the creation of bidirectional cavopulmonary anastomosis
|
Пациенты Patients |
Градиент на ТК, мм рт. ст. Tricuspid pressure gradient, mmHg |
ЦВД, мм рт. ст. CVP, mmHg |
Давление в ЛП, мм рт. ст. Pressure in LA, mmHg |
Отношение ЦВД/давление ЛП CVP/LA pressure ratio |
АД, мм рт. ст. Blood pressure, mmHg |
||
|
Пиковый Peak |
Средний Mean |
САД Systolic pressure |
ДАД Diastolic pressure |
||||
|
1 |
15 |
9 |
16 |
5 |
3,2 |
52 |
38 |
|
2 |
12 |
8 |
14 |
8 |
1,75 |
50 |
32 |
|
3 |
15 |
9 |
15 |
9 |
1,66 |
45 |
34 |
|
4 |
18 |
10 |
19 |
7 |
2,7 |
39 |
25 |
Примечание: ТК - трикуспидальный клапан, ЦВД - центральное венозное давление, ЛП - левое предсердие, АД - артериальное давление, САД – систолическое артериальное давление, ДАД – диастолическое артериальное давление.
Note: CVP – central venous pressure; LA – left atrium.
Результаты
Время ИК составило 105 [90; 140] мин, время пережатия аорты 84 [66; 96] мин, летальность 2,9% (один летальный исход), выживаемость в течение восьмилетнего периода наблюдения 97,1%. В раннем послеоперационном периоде в двух (5,7%) случаях грудина не сводилась. Целью данной тактики была стабилизация гемодинамики. Сведение грудины и ушивание операционной раны проводилось на вторые послеоперационные сутки при стабилизации гемодинамики и лабораторных показателей. Реопераций за представленный период наблюдения не было.
Как показал статистический анализ, в раннем и отдаленном периодах (табл. 5) отмечалось статистически значимое уменьшение показателей индексированных размеров правых отделов сердца.
Таблица 5. Динамика эхокардиографических показателей пациентов, Me ( Q 1; Q 3)
Table 5. Dynamics of echocardiographic parameters in patients, Me ( Q 1; Q 3)
|
Показатели Parameters |
До операции Before surgery |
Ранний послеоперационный период Early postoperative period |
Отдаленный послеоперационный период Long-term postoperative period |
р |
|
Индексированный размер ЛП, мм/м2, а Indexed LA size, mm/m2 |
31,85 [22,78; 38,56] |
44,63 [35,21; 52,34] |
44,52 [37,09; 50,49] |
0,29 |
|
Индексированный размер ЛП, мм/м2, б Indexed LA size, mm/m2 |
32,33 [37,28; 52,96] |
32,33 [25,8; 37,56] |
34 [24,84; 41,42] |
0,74 |
|
Индексированный объем ЛП, мл/м2 Indexed LA volume, mL/m2 |
18,19 [14,52; 21,52] |
18,52 [13,9; 22,9] |
20,09 [18,57; 23,17] |
0,55 |
|
Индексированный размер ПП, мм/м2, a Indexed RA size, mm/m2 |
79,4 [63,38; 101,86] |
44,65 [36,5; 55,22] |
46,15 [32,93; 48,2] |
0,00006 |
|
Индексированный размер ПП, мм/м2, б Indexed RA size, mm/m2 |
53,46 [37,84; 66,45] |
38,56 [29,05; 45,6] |
42,76 [36,06; 47,75] |
0,009 |
|
Индексированный объем ПП, мл/м2 Indexed RA volume, mL/m2 |
86,27 [59,96; 110,82] |
24,48 [18,11; 26,52] |
36,81 [28,92; 42,42] |
0,00009 |
|
Индексированный размер ПЖ, мм/м2 Indexed RV size, mm/m2 |
32,94 [24,99; 44,54] |
26,15 [19,17; 30,41] |
25,57 [22,93; 30,34] |
0,00018 |
|
УИ, мл/м2 SI, mL/m2 |
27,09 [23,5; 32,1] |
27,84 [23,2; 32] |
30,66 [26,05; 36,05] |
0,016 |
|
СИ, л/мин/м2 CI, l/min/m2 |
2,66 [2,26; 3,12] |
2,68 [2,05; 3,3] |
2,68 [1,93; 3,03] |
0,41 |
|
КДИ ЛЖ, мл/м2 LV EDI, mL/m2 |
38,07 [32,8; 44,53] |
38,66 [32,73; 43,55] |
42,39 [35,56; 47,48] |
0,032 |
|
КСИ ЛЖ, мл/м2 LV ESI, mL/m2 |
11,01 [7,34; 12,6] |
11,01 [7,55; 13,8] |
11,09 [9,06; 12,3] |
0,63 |
|
ФВ ЛЖ, % LV EF, % |
70,85 [65; 78] |
72,44 [67; 78] |
70,84 [67; 76] |
0,29 |
|
СДПЖ, мм рт. ст. RVSP, mmHg |
30,59 [22,5; 38,5] |
22,4 [20; 24] |
24,77 [22; 29] |
0,963 |
|
Индекс сферичности ЛЖ LV sphericity index |
2,11 [1,84; 2,24] |
1,95 [1,76; 2,1] |
1,72 [1,61; 2,26] |
0,006 |
|
Индекс эксцентричности ЛЖ LV eccentricity index |
0,98 [0,94; 1,03] |
1,15 [0,88; 1,14] |
1,02 [0,95; 1,1] |
0,19 |
Примечание: ЛП - левое предсердие, ПП - правое предсердие, а - длина предсердия, б - ширина предсердия, ПЖ - правый желудочек, ЛЖ – левый желудочек, УИ – ударный индекс, СИ – сердечный индекс, КСИ ЛЖ – конечно-систолический индекс левого желудочка, КДИ ЛЖ – конечно-диастолический индекс левого желудочка, ФВ ЛЖ – фракция выброса левого желудочка, СДПЖ – систолическое давление правого желудочка.
Note: LA – left atrium; RA – right atrium; a – length of the atrium; b – width of the atrium; RV – right ventricle; LV – left ventricle; SI – stroke index; CI – cardiac index; LV EDI – left ventricular end-diastolic index; LV ESI – left ventricular end-systolic index; LV EF – left ventricular ejection fraction; RVSP – right ventricular systolic pressure.
Снижение объема регургитации приводило к увеличению потока крови в малый круг кровообращения, повышению ударного индекса (УИ) и конечно-диастолического индекса (КДИ) ЛЖ.
У всех пациентов до оперативного лечения отмечался синусовый ритм. В восьми случаях на ЭКГ зарегистриро- вана патологическая Δ (дельта) волна. До оперативного лечения пациентам была выполнена процедура радиочастотной аблации дополнительного предсердно-желудочкового пути. При сравнении времени интервалов, сегментов и зубца P статистически значимых изменений до оперативного лечения и после него не наблюдалось
(табл. 6). Применение конусной реконструкции ТК клапана показало отсутствие полной атриовентрикулярной блокады в раннем периоде после операции у всех пациентов.
Наибольший интерес представляет динамика показателей ТК (табл. 7). Первоначально недостаточность ТК при АЭ связана со сращением створок ТК к стенкам ПЖ и невозможностью коаптации. Целью хирургической деламинации створок является мобилизация наибольшей площади ткани для прикрепления к истинному фиброзному кольцу и ротации по часовой стрелке. Во всех случаях наблюдается рост фиброзного кольца в процентном соотношении относительно площади поверхности тела (рис. 3). При сравнении недостаточности ТК в раннем и отдаленном послеоперационном периодах статистически значимого изменения не выявлено (Wilcoxon test, р = 0,46). Пиковый и средний градиенты на ТК также статистически значимо не изменялись (см. табл. 7).
Таблица 6. Электрокардиографические показатели, Me ( Q 1; Q 3)
Table 6. Electrocardiographic parameters, Me ( Q 1; Q 3)
|
Показатели Parameters |
До операции Before surgery |
После операции After surgery |
р |
|
Зубец Р, с P wave, s |
0,07 [0,06; 0,08] |
0,06 [0,06; 0,08] |
0,109 |
|
Интервал PQ, с PR interval, s |
0,13 [0,12; 0,15] |
0,12 [0,12; 0,14] |
0,304 |
|
Комплекс QRS, с QRS complex, s |
0,1 [0,09; 0,12] |
0,1 [0,1; 0,12] |
0,52 |
|
Интервал R-R, с RR interval, s |
0,59 [0,5; 0,68] |
0,59 [0,48; 0,71] |
0,57 |
|
ЧСС, уд./мин Heart rate, bpm |
101,08 [86; 120] |
105,56 [90; 120] |
0,034 |
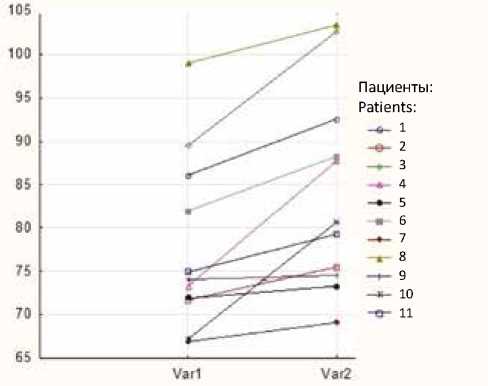
ч« 1-Ранний послеоперационный период Ver 2- Or деленный послеоперационным период
Рис. 3. График роста фиброзного кольца трикуспидального клапана (%) относительно площади поверхности тела
Fig. 3. Chart of tricuspid valve fibrous ring growth in percentage relative to body surface area
Обсуждение
На сегодняшний день многие кардиохирургические клиники мира используют конусную реконструкцию при АЭ как основную операцию для пластики ТК. В зарубежной литературе активное применение данного метода началось с начала 1990-х гг. после публикации J.P. da Silva. Наибольшим опытом хирургической коррекции обладает клиника Mayo (США) [7]. Данная методика применима практически для всех возрастных категорий. Так, в статье P. Wackel и соавт. [8] приводится исследование 143 пациентов, которым было выполнено оперативное вмешательство по методу конусной реконструкции. Показано, что ни у одного из пациентов не наблюдалось повреждения атриовентрикулярного узла с последующим развитием полной атриовентрикулярной блокады после конусной реконструкции. При применении протеза ТК частота атриовентрикулярной блокады III степени высока и может достигать 15%, что требует имплантации двухкамерного электрокардиостимулятора и в последующем ухудшает качество жизни пациента [9].
Основным преимуществом этого вида коррекции является то, что с ростом размеров камер сердца ребенка растут и ткани клапана, и фиброзное кольцо. Этот факт свидетельствует о том, что конусная реконструкция наи- более анатомически и физиологически приближена к нормальному ТК. Исходя из нашего опыта, для успешной коррекции необходимо соблюдение следующих условий: достаточное количество деламинированной ткани передней и задней створок, локализация папиллярной мышцы в трабекулярной части ПЖ, ушивание атриализованной части ПЖ с суживанием фиброзного кольца клапана. Предположительно достаточный объем ткани, необходимый для реконструкции, при котором будет лучшая коаптация поверхности створок и минимальная регургитация, составляет около 50% от их длины [10].
При естественном течении ПЖ при АЭ порока испытывает постоянную объемную перегрузку. Симптомы часто незаметны до совершеннолетия, особенно когда межпредсердная перегородка интактна или овальное отверстие невелико, потому у таких пациентов отсутствуют цианоз и снижение сатурации. По данным M.L. Brown и соавт., дисфункция ПЖ является предиктором ранней смертности при АЭ [11]. На сегодняшний день остается дискуссионным вопрос о показаниях к выполнению ДКПА. Основной его функцией является снижение преднагрузки на ПЖ. При правожелудочковой сердечной недостаточности ДКПА позволяет снизить объем крови, проходящей через правые отделы сердца, на 1/2 в детском возрасте и на 1/3 во взрослом возрасте. По данным Л.А. Бокерии и соавт., кардиоторакаль-ный индекс (КТИ) более 70%, типы аномалии C и D, артериальная гипоксемия, правожелудочковая сердечная недостаточность являются показаниями к полуторажелудочковой коррекции [12, 13]. Среди зарубежных авторов существует несколько подходов к данному вопросу. A. Malhotra и соавт. (2018) сообщают об опыте лечения 22 пациентов с АЭ [14]. Ключевым критерием для определения показаний к ДКПА стал Z-score ТК в соотношении с типом АЭ. При АЭ с типами A и B возможно выполнение кавапульмонального анастомоза при Z-score от 2 до 4 и рутинное выполнение, если показатель выше 4, а при типах C и D, начиная с +2. По данным J.A. Dearani и соавт., выбор в пользу полуторажелудочковой коррекции возможен при дисфункции и дилатации ПЖ, смещении межжелудочковой перегородки в сторону ЛЖ (D форма ЛЖ, см. рис. 2), соотношении давления правое предсердие/левое предсердие более чем в 1,5 раза [15, 16]. Гемодинамика, позволяющая выполнить ДКПА, включает конечно-диастолическое давление ЛЖ менее 12 мм рт. ст., транспульмональный градиент менее
10 мм рт. ст. и среднее давление в легочной артерии менее 18 мм рт. ст. [10]. В нашей работе мы придерживаемся данной тактики и считаем ее клинически применимой и обоснованной.
Выводы
-
1. Конусная реконструкция ТК наиболее приближена к анатомической коррекции среди существующих методов оперативной коррекции при АЭ.
-
2. Хирургическое лечение методом конусной реконструкции позволяет избежать повреждения атриовентрикулярного узла и снизить риск развития полной атриовентрикулярной блокады.
-
3. ДКПА может применяться, если средний градиент давления на ТК более 8 мм рт. ст.; градиент давления между ПП и ЛП выше 1,5.
-
4. В отдаленном периоде наблюдается рост фиброзного кольца ТК без повышения степени недостаточности и градиента давления на клапане.
-
5. Среди пациентов, прооперированных методом конусной реконструкции, повторных оперативных вмешательств на ТК в раннем и отдаленном периодах наблюдения не требовалось.
Список литературы Ранние и отдаленные результаты хирургической коррекции аномалии Эбштейна методом конусной реконструкции
- Burri M., Lange R. Surgical treatment of Ebstein's anomaly. Tho-rac. Cardiovasc. Surg. 2017;65(8):639-648. DOI: 10.1055/s-0037-1604469.
- Dearani J.A., Danielson G.K. Congenital Heart Surgery Nomenclature and Database Project: Ebstein's anomaly and tricuspid valve disease. Ann. Thorac. Surg. 2000;69(3):106-117. DOI: 10.1016/S0003-4975(99)01265-5.
- Carpentier A., Chauvaud S., Macé L., Relland J., Mihaileanu S., Marino J.P. et. al. A new reconstructive operation for Ebstein anomaly of the tricuspid valve. J. Thorac. Cardiovasc. Surg. 1988;96:92-101.
- Dearani J.A., Bacha E., da Silva J.P. Cone reconstruction of the tricuspid valve for Ebstein's anomaly: Anatomic repair. Operative Techniques in Thoracic and Cardiovascular Surgery. 2008;13:109-125. DOI: 10.1053/j.optechstcvs.2008.03.003.
- Da Silva J.P., Baumgratz J.F., da Fonseca L., Franchi S.M., Lopes L.M., Tavares G.M. et al: The cone reconstruction of the tricuspid valve in Ebstein's anomaly. The operation: early and midterm results. J. Thorac. Cardiovasc. Surg. 2007;133(1):215-223. DOI: 10.1016/j. jtcvs.2006.09.018.
- Davies R.R., Pasquali S.K., Jacobs M.L., Jacobs J.J., Wallace A.S., Pizarro C. Current spectrum of surgical procedures performed for Ebstein's malformation: an analysis of the Society of Thoracic Surgeons Congenital Heart Surgery Database. Ann. Thorac. Surg. 2013;96(5):1703-1710. DOI: 10.1016/j.athoracsur. 2013.05.005.
- Holst K.A., Dearani J.A., Said S., Pike R.B., Connolly H.M., Cannon B.C. et al. Improving results of surgery for Ebstein anomaly: Where are we after 235 cone repairs? Ann. Thorac. Surg. 2018;105(1):160-169. DOI: 10.1016/j.athoracsur. 2017.09.058.
- Wackel P., Cannon B., Dearani J., Sessions K., Holst K., Johnson J. et al Arrhythmia after cone repair for Ebstein anomaly: The Mayo Clinic experience in 143 young patients. Congenit. Heart Dis. 2018;13(1):1-5. DOI: 10.1111/chd.12566.
- Brown M.L., Dearani J.A., Danielson G.K., Cetta F., Connolly H.M., Warnes C.A. et al. Comparison of the outcome of porcine biopros-thetic versus mechanical prosthetic replacement of the tricuspid valve in the Ebstein anomaly. Am. J. Cardiol. 2009;103(4):555-561. DOI: 10.1016/j.amjcard.2008.09.106.
- Stulak J.M., Dearani J.A., Danielson G.K. Surgical management of Ebstein's anomaly. Seminars in thoracic and cardiovascular surgery: Pediatric Cardiac Surgery Annual. 2007;10(1):105-111. DOI: 10.1053/j. pcsu.2007.01.007.
- Brown M.L., Dearani J.A., Danielson G.K., Cetta F., Connolly H.M., Warnes C.A. et al. The outcomes of operations for 539 patients with Ebstein anomaly. J. Thorac. Cardiovasc. Surg. 2008;135(5):1120-1136. DOI: 10.1016/j.jtcvs.2008.02.034.
- Бокерия Л.А., Подзолков В.П., Зеленикин М.А., Хассан Али , Махачев О.А., Самсонов В.Б. и др. Полуторажелудочковая коррекция сложных врожденных пороков сердца: показания к операции и результаты. Грудная и сердечно-сосудистая хирургия. 2006;1:8-13.
- Гущин Д.К., Зеленикин М.М., Зеленикин М.А. Опыт полутора-желудочковой коррекции врожденных пороков сердца у детей раннего возраста. Грудная и сердечно-сосудистая хирургия. 2016;58(4):214-223.
- Malhotra A., Agrawal V., Patel K., Shah M., Sharma K., Sharma P. et al. Ebstein's anomaly: "The One and a Half Ventricle Heart". Braz. J. Cardiovasc. Surg. 2018;33(4):353-361. DOI: 10.21470/1678-9741-20180100.
- Quinonez L.G., Dearani J.A., Puga F.J., O'Leary P.W., Driscoll D.J., Connolly H.M. et al. Results of the 1.5-ventricle repair for Ebstein anomaly and the failing right ventricle. J. Thorac. Cardiovasc. Surg. 2007;133(5):1303-1310. DOI: 10.1016/j.jtcvs.2006.12.007.
- Chauvaud S., Fuzellier J.F., Berrebi A., Lajos P., Marino J.P., Mihaileanu S. et al. Bi-directional cavopulmonary shunt associated with ventriculo and valvuloplasty in Ebstein's anomaly: benefits in high risk patients. European Journal of Cardio-thoracic Surgery. 1998;1:514-519.


