Ранние результаты реконструкции вертлужной впадины и тазобедренного сустава модульными эндопротезами у больных с опухолевым поражением параацетабулярной области. Мультицентровое исследование
Автор: Карпенко В.Ю., Державин В.А., Щупак М.Ю., Жеравин Александр Александрович, Бухаров А.В., Бондарев А.В., Жамгарян Г.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (73), 2016 года.
Бесплатный доступ
Основной целью онкохирургии таза является не только максимально радикальное удаление опухоли, но и обеспечение адекватного функционального результата у больного после операции. При выполнении параацетабулярных резекций наиболее сложной для реконструкции анатомической зоной тазового кольца являются вертлужная впадина и тазобедренный сустав. По мнению ряда авторов, у пациентов с опухолевым поражением параацетабулярной области перспективной является реконструкция вертлужной впадины и тазобедренного сустава модульными эндопротезами на основе конической ножки. В этой работе мы делимся нашим опытом использования этой хирургической техники. методы. В период с 2011 по 2015 г. хирургическое лечение в объеме параацетабулярной резекции с реконструкцией вертлужной впадины и тазобедренного сустава модульным эндопротезом было выполнено 23 пациентам. Средний возраст больных составил 44 года (20-64 года). Мужчин - 10 (44 %), женщин - 13 (56 %). Распределение больных в зависимости от гистотипа опухоли: хондросаркома - 12 (52 %); гигантоклеточная опухоль - 4 (17 %); остеосаркома - 2 (8 %). По одному пациенту было с саркомой Юинга, со злокачественной фиброзной гистиоцитомой, синовиальной саркомой кости, cолитарным метастазом рака почки и рака желудка. Среди 14 больных с первичными саркомами костей Ib стадия установлена у 8, IIb - у 6 пациентов. результаты. В соответствии с классификацией Enneking резекции типа I-II-III были выполнены у 14 (61 %), типа II-III - у 7 (30 %), II-III-IV - у 2 (9 %) пациентов. Средняя продолжительность операции - 320 мин (240-520 мин). Средняя интраоперационная кровопотеря - 5200 мл (1000-20000 мл). По результатам планового морфологического исследования после операции отрицательные края резекции с индексом R0 были у 20 (87 %) больных. У 3 (13 %) пациентов с хондросаркомой GI был положительный край резекции с индексом R1. Средний период наблюдения - 32 мес (3-48 мес). Прогрессирование заболевания диагностировано у 7 (30 %) пациентов, в сроки от 6 до 18 мес. Функциональный результат после операции оценивали по шкале MSTS. Средний показатель составил 48 % (15-78 %). Послеоперационные осложнения диагностированы у 10 (43 %) пациентов. Заключение. Применение модульных систем эндопротезирования вертлужной впадины и тазобедренного сустава позволяет расширить показания к сохраняющей хирургии костей таза, во многих случаях достигнуть лучших функциональных результатов в послеоперационном периоде, сократить сроки послеоперационной реабилитации больных.
Опухоли костей, кости таза, реконструкция, хирургическое лечение
Короткий адрес: https://sciup.org/14056634
IDR: 14056634 | УДК: 616.718.19-006.04-089.844 | DOI: 10.21294/1814-4861-2016-15-1-11-18
Текст научной статьи Ранние результаты реконструкции вертлужной впадины и тазобедренного сустава модульными эндопротезами у больных с опухолевым поражением параацетабулярной области. Мультицентровое исследование
Первичные злокачественные опухоли костей таза являются редкой онкологической патологией и составляют не более 10 % от всех костных сарком человека [1, 2]. Отличительной особенностью этой нозологии является экспансивный рост опухоли в полость малого таза и окружающие мягкие ткани, что определяет бессимптомное течение на ранних стадиях заболевания. Значимые клинические проявления возникают при выраженной местной распространенности, сдавлении или вовлечении в опухолевый процесс корешков тазового нервного сплетения, органов малого таза и тазобедренного
сустава. Низкая выявляемость на начальном этапе опухолевого процесса, соседствующее положение в полости малого таза жизненно важных органов и магистральных сосудисто-нервных структур, а также определяющая роль тазового кольца в биомеханике походки человека определяют сложность выполнения органосохраняющих и реконструктивных операций у данной категории больных [3].
До 70-х гг. прошлого века основным методом хирургического лечения больных с местнораспространенными опухолями костей таза была ампутационная хирургия [4, 5, 6, 7]. Количество органосохраняющих хирургических вмешательств было невелико в связи с их высокой травматичностью, выраженной кровопотерей и сложностью проведения реконструкции. Совершенствование хирургической техники, анестезиологического пособия и антибактериальной терапии, внедрение реконструктивной хирургии с использованием металлоимплантов и микрохирургии в онкологию позволили расширить показания для проведения органосохраняющего лечения больных с опухолями тазового кольца [8, 9]. В настоящее время основной целью онкохирургии таза является не только максимально радикальное удаление опухоли, но и обеспечение адекватного функционального результата у больного после операции [8, 10, 11]. Для достижения поставленных задач в современной онкоортопедии разработано и используется достаточное количество разных методик реконструкции костей, формирующих тазовое кольцо.
При выполнении параацетабулярных резекций наиболее сложной для реконструкции анатомической зоной тазового кольца являются вертлужная впадина и тазобедренный сустав [12]. Проведение их реконструкции возможно при помощи алло- и аутографтов, мегаэндопротезов, седловидных эндопротезов, протезов индивидуального изготовления, а также транспозиции бедренной кости с формированием подвздошно-бедренного неоартроза [9, 13, 14, 15, 16]. Все используемые методики имеют свои преимущества и недостатки, однако характеризуются высоким риском развития послеоперационных осложнений и относительными функциональными результатами после операции, что не позволяет выделить среди них универсальную технику реконструкции параацетабулярной области [13, 17].
По мнению ряда авторов, у пациентов с опухолевым поражением параацетабулярной области перспективной является реконструкция вертлужной впадины и тазобедренного сустава модульными эндопротезами на основе конической ножки [18, 19, 20]. В этой работе мы хотим осветить наш опыт использования этой хирургической техники.
Материал и методы
Операцию проводили в положении больного на спине с валиком, подложенным под ягодицу на стороне поражения. Разрез выполняли вдоль крыла подвздошной кости дистально, далее вдоль паховой связки и переходом на внутреннюю поверхность бедра. При распространении опухоли вдоль лонной кости и в область проекции проксимального отдела бедренной кости выполняли дополнительные разрезы к лонному симфизу и латерально к передненаружной поверхности верхней трети бедра. После рассечения дермы, подкожной клетчатки и фасции мобилизовывали на протяжении паховый канатик или круглую связку матки и отводили в сторону. Волокна наружной косой мышцы живота рассекали электроножом, осуществляли забрюшинный доступ в подвздошную область. Далее пересекали паховую связку, отсекали у места прикрепления к лонной кости прямую мышцу живота с апоневрозом. Такой забрюшинный хирургический доступ обеспечивает адекватную экспозицию подвздошной области и передне-боковой поверхности вертлужной впадины, магистральных подвздошно-бедренных сосудов и бедренного нерва. Брюшной мешок и латеральную стенку мочевого пузыря отводили в сторону. Наружные и внутренние подвздошные
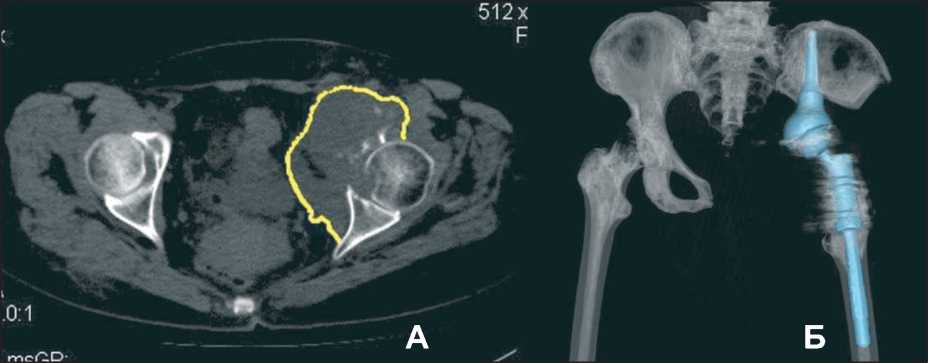
Рис. 1. А – КТ пациентки с местнораспространенной хондросаркомой GI левой параацетабулярной области;
Б – 3D КТ реконструкция после операции. Ножка тазового компонента эндопротеза фиксирована в опил крыла подвздошной кости
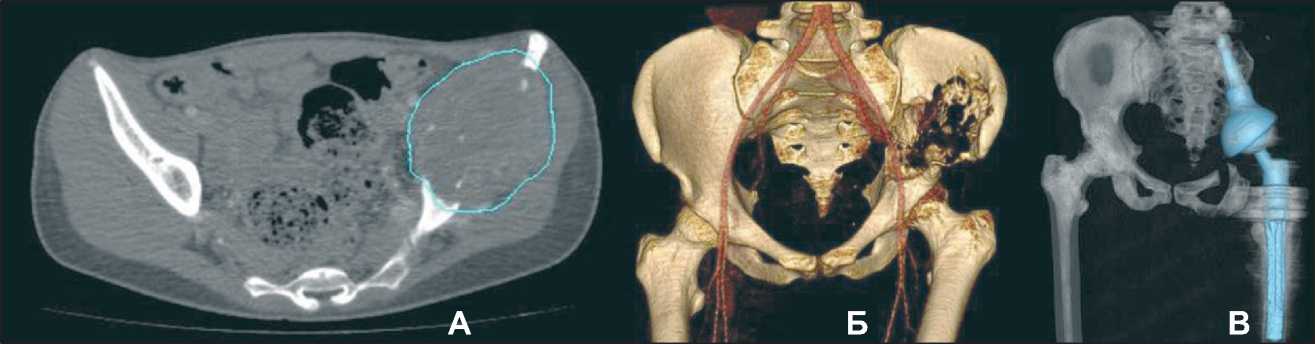
Рис. 2. А, Б – КТ и 3D КТ реконструкция пациентки с синовиальной саркомой подвздошной кости;
В – 3D КТ реконструкция после операции. Ножка тазового компонента эндопротеза фиксирована в боковые массы крестца после транссакральной резекции
сосуды мобилизовывали от места деления общей подвздошной артерии и вены до уровня их перехода в бедренные, после чего их вместе с бедренным нервом отводили в сторону. В зависимости от расположения опухоли в ряде случаев внутренние подвздошные сосуды перевязывали и пересекали. При необходимости визуализировали и выделяли мочеточник. На следующем этапе пересекали приводящие мышцы, напрягатель широкой фасции, портняжную и прямую мышцы бедра отсекали у места прикрепления к лонной и подвздошной костям. После определения уровня резекции костей таза выполняли остеотомию ветвей лонной, седалищной костей или симфиза, шейки бедренной и крыла подвздошной кости. При значительном поражении подвздошной кости резекцию выполняли с захватом боковых масс крестца. Техника пересечения костных структур может различаться в зависимости от техники оперирующего хирурга. Остеотомия может быть выполнена осцилляторной пилой или пилой Джигли. После пересечения костных структур пересекали крестцово-остистую и крестцово-бугорные связки, после чего удаляли макропрепарат, пересекая оставшиеся мягкие ткани.
Вторым этапом в толщу опила оставшейся части тела и крыла подвздошной кости или в крестец под рентгенологическим контролем по направителю устанавливали коническую ножку металлоим- планта, к которой при помощи винта фиксировали чашку эндопротеза, выполняющую функцию вертлужной впадины. Типоразмер ножки и метод фиксации (цементная или бесцементная) выбирали соответственно толщине опила подвздошной кости и клинической ситуации. Далее выполняли резекцию проксимального отдела бедренной кости с последующей установкой бедренного компонента металлоимпланта. В зависимости от объема резекции бедренной кости возможна установка онкологического или ортопедического эндопротеза. Тазобедренный сустав формировали путем фиксации головки бедренного компонента в чашку. Для скорейшего формирования фиброзной капсулы и минимизации риска вывиха металлоимплант укрывали биосинтетической манжетой, к которой подшивали края резецированных мышц (рис. 1). В случае выполнения транссакральной резекции на уровне крестцово-подвздошного сочленения ножку эндопротеза имплантировали в боковые массы крестца (рис. 2). Завершали операцию выполнением тщательного гемостаза и сшиванием краев резецированных мышц между собой и биосинтетической манжетой, с формированием ложа эндопротеза и оставлением 1–2 дренажей.
В зависимости от количества отделяемого дренажи удаляли на 2–7-е сут после операции. В послеоперационном периоде назначали анти- таблица 1
характеристика пациентов с прогрессированием заболевания после хирургического лечения
Примечание: Р – рецидив, М – отдаленные метастазы; Ж – жив, У – умер от прогрессирования заболевания.
бактериальные препараты в течение 5–7 дней. Антикоагулянтную терапию начинали на 1–3-е сут после операции и продолжали 10–15 дней. В зависимости от объема выполненной операции, интраоперационной кровопотери, соматического статуса больного и клинического течения послеоперационного периода активизацию при помощи костылей и фиксирующего ортеза выполняли в сроки от 3 дней до 2 мес.
Результаты
В соответствии с классификацией Enneking [21], резекции типа I–II–III были выполнены у 14 (61 %) пациентов, типа II–III – у 7 (30 %), типа II–III–IV с фиксацией ножки металлоимпланта в крестец – у 2 (9 %) больных. Средняя продолжительность операции составила 320 мин (240–520 мин). Средний показатель интраоперационной кровопотери – 5 200 мл (1 000–20 000 мл). Большинство операций (82 %) проводилось с использованием системы интраоперационного кровесбережения типа CellSaver или OrthoPAT. Трем пациентам перед операцией была выполнена селективная эмболизация артерий, питающих опухоль. По результатам планового морфологического исследования после операции отрицательные края резекции с индексом R0 были у 20 (87 %) прооперированных больных. У 3 (13 %) пациентов с хондросаркомой GI был положительный край резекции с индексом R1. Учитывая морфологическую структуру опухоли, степень злокачественности и расширенный объем выполненной операции, этим больным дополнительное лечение в адъювантном режиме не назначалось, и они были оставлены под строгое динамическое наблюдение.
Средний период наблюдения составил 32 мес (3–48 мес). Прогрессирование заболевания диагностировано у 7 (30 %) пациентов в сроки от 6 до 18 мес (табл. 1). Среди 17 пациентов с первичными злокачественными опухолями костей прогрессирование заболевания диагностировано в 5 (29 %) наблюдениях. Отдаленные метастазы были у 3 (17 %) больных, отдаленные метастазы и рецидив – у 1 (5,5 %) больного. Рецидив опухоли также был диагностирован у одного (5,5 %) пациента.
Всем больным с отдаленными метастазами было назначено системное лекарственное лечение, на фоне проведения которого все пациенты умерли от дальнейшего прогрессирования в сроки от 11 до 22 мес. Больному с рецидивом хондросаркомы GI проведено хирургическое лечение, и на момент проведения исследования он наблюдается без признаков заболевания. У пациента с хондросаркомой GI в процессе динамического наблюдения через 18 мес после операции диагностирован рецидив опухоли, по поводу чего было проведено хирургическое лечение. Далее, через 6 мес выявлены метастазы в легкие. Проведено системное лекарственное лечение, на фоне которого отмечена стабилизация опухолевого процесса, после чего выполнено хирургическое удаление метастазов в обоих легких. На момент проведения исследования нет данных за дальнейшее прогрессирование.
Функциональный результат после операции оценивали по шкале MSTS [22]. Средний показатель составил 48 % (15–78 %).
Послеоперационные осложнения диагностированы у 10 (43 % ) пациентов, что потребовало выполнения ревизионных операций у 3 (12 %) больных. Оценку осложнений проводили по классификации, предложенной D. Witte, которая рассматривает общее количество различных типов состоявшихся осложнений, а не количество больных, у которых были диагностированы осложнения.
К первому типу относили «раневые» осложнения, связанные с общим заживлением раны и ее инфицированием. В нашем исследовании количество таких осложнений составило 7 (30 %). Некроз краев послеоперационной раны наблюдался у 3 (13 %), глубокое инфицирование ложа эндопротеза – у 4 (17 %) больных. У трех пациентов с глубоким инфицированием ложа металлоимпланта были выполнены ревизионные операции с удалением эндопротеза в объеме межподвздошно-брюшного вычленения. У одного больного воспалительный процесс был купирован консервативно.
Осложнения, связанные с фиксацией эндопротеза, «механические», такие как перипротезный перелом, нестабильность, вывих бедренного компонента, относили ко второму типу. Вывих головки металлоимпланта был у 3 (12 %) больных. Все вывихи были вправлены «закрыто» без выполнения операции. Нестабильности и перипротезных переломов на момент проведения исследования не выявлено.
Третий тип – «системные» осложнения, связанные с общими нарушениями органов и систем на фоне проведенного хирургического лечения. Такие осложнения в виде тромбоэмболии ветвей легочной артерии с последующим развитием пневмонии были отмечены у 1 (4 %) пациентки.
К четвертому типу относили «общие» осложнения, которые не могли быть включены в перечисленные выше категории. В нашем исследовании подобные осложнения были у 4 (16 %) больных, из них у 3 пациентов – с выраженным лимфостазом нижней конечности со стороны операции, связанным с пересечением и перевязкой бедренной вены во время операции. У 1 больного в раннем послеоперационном периоде отмечено отсутствие движения и чувствительности по ходу иннервации седалищного нерва, несмотря на то, что во время операции этот нерв не был травмирован.
Таким образом, у 10 больных в послеоперационном периоде диагностировано 14 различных осложнений.
Обсуждение
В настоящее время реконструктивное хирургическое лечение пациентов со злокачественными и местнораспространенными опухолями тазового кольца в комбинации с системной лекарственной и лучевой терапией позволяет добиться адекватных онкологических и функциональных результатов после операции. Основной проблемой органосохраняющей тазовой онкохирургии являются частые послеоперационные осложнения, значимая доля которых носит инфекционный характер. Основными факторами, влияющими на частоту их возникновения, являются продолжительность операции, объем интраоперационной кровопотери и удаляемых во время резекции мягких тканей, наличие металлоимпланта [23, 24].
В нашем исследовании инфекционные осложнения диагностированы у 7 (30 %) больных, у 4 (17 %) из которых было глубокое инфицирование ложа эн- допротеза, что потребовало удаления эндопротеза. Наши результаты коррелируют с данными мировой литературы, согласно которым частота подобных осложнений составляет 21–32 % [8, 25, 26, 27].
Список литературы Ранние результаты реконструкции вертлужной впадины и тазобедренного сустава модульными эндопротезами у больных с опухолевым поражением параацетабулярной области. Мультицентровое исследование
- Jansen J.A., van de Sande M.A.J., Dijkstra P.D.S. Poor Long-term Clinical Results of Saddle Prosthesis After Resection of Periacetabular Tumors//Clin. Orthop. Relat. Res. 2013. Vol. 471 (1). P. 324-331 DOI: 10.1007/s11999-012-2631-x
- Oskouei S., Monson D., Aboulafia А. Anatomic Basis of Tumor Surgery. 2010. Springer. P. 443-482.
- O’Connor M.I. Malignant pelvic tumors: limb-sparing resection and reconstruction//Semin. Surg. Oncol. 1997. Vol. 13 (1). P. 49-54.
- Delepine G., Delepine F., Sokolov T., Delepine N. Hand-modelled composite prostheses after resection of peri-acetabular bone malignancies//Sarcoma. 2003. Vol. 7 (1). P. 19-27 DOI: 10.1080/1357714031000114174
- Higinbotham N.L., Marcove R.C., Casson P. Hemipelvectomy: A clinical study of 100 cases with five year follow-up on 60 patients//Surgery. 1966. Vol. 59 (5). P. 706-708.
- Karakousis C.P., Vezeridis M.P. Variants of hemipelvectomy//Am. J. Surg. 1983. Vol. 145 (2). P. 273-277.
- Napalkow P.N. Late Results from Extended Excision of the Ilium//Arch. f. Orthop. 1931. Vol. XXIX. P. 203-209.
- Guo W., Li D., Tang X., Yang Y., Ji T. Reconstruction with modular hemipelvic prostheses for periacetabular tumor//Clin. Orthop. Relat. Res. 2007. Vol. 461. P. 180-188.
- Falkinstein Y., Ahlmann E.R., Menendez L.R. Reconstruction of type II pelvic resection with a new peri-acetabular reconstruction endoprosthesis//J. Bone Joint Surg. Br. 2008. Vol. 90 (3). P. 371-376 DOI: 10.1302/0301-620X.90B3.20144
- Gradinger R., Rechl H., Hipp E. Pelvic osteosarcoma. Resection, reconstruction, local control, and survival statistics//Clin. Orthop. Relat. Res. 1991. Vol. 270. P. 149-158.
- Тепляков В.В., Карпенко В.Ю., Державин В.А., Франк Г.А., Буланов А.А., Бухаров А.В., Мыслевцев И.В., Анурова О.А., Рубцова Н.А., Епифанова С.В., Воробьев Н.В., Сундуй Ю.Ю., Сехина О.В. Реконструктивные операции при лечении пациентов со злокачественными опухолями костей тазового кольца//Саркомы костей, мягких тканей и опухоли кожи. 2012. № 3. C. 16-28.
- Enneking W.E., Dunham W.K. Resection and reconstruction for primary neoplasms involving the innominate bone//J. Bone Joint Surg. Am. 1978. Vol. 60 (6). P. 731-746.
- Satcher Jr.R.L., O’Donnell R.J., Johnston J.O. Reconstruction of the pelvis after resection of tumors about the acetabulum//Clin. Orthop. Relat. Res. 2003. Vol. 409. P. 209-217.
- Nagoya S., Masamichi U., Wada T., Yamashita T., Ishii S. Reconstruction and limb salvage using a free vascularised fibular graft for periacetabular malignant bone tumours//J. Bone Joint Surg. Br. 2000. Vol. 82 (8). P. 1121-1124.
- Zang J., Guo W., Yang Y., Xie L. Reconstruction of the hemipelvis with a modular prosthesis after resection of a primary malignant peri-acetabular tumour involving the sacroiliac joint//Bone Joint J. 2014. Vol. 96-B (3). P. 399-405 DOI: 10.1302/0301-620X.96B3.32387
- Gebert С., Wessling M., Hoffmann C., Roedl R., Winkelmann W., Gosheger G., Hardes J. Hip Transposition as a Limb Salvage Procedure Following the Resection of Periacetabular Tumors//J. Surg. Oncol. 2011. Vol. 103. P. 269-275.
- Aljassir F., Beadel G.P., Turcotte R.E., Griffin A.M., Bell R.S., Wunder J.S., Isler M.H. Outcome after pelvic sarcoma resection reconstructed with saddle prosthesis//Clin. Orthop. Relat. Res. 2005. Vol. 438. P. 36-41.
- Witte D., Bernd L., Bruns J., Gosheger G., Hardes J., Hartwig E., Lehner B., Melcher I., Mutschler W., Schulte M., Tunn P.U., Wozniak W., Zahlten-Hinguranage A., Zeifang F. Limb-salvage reconstruction with MUTARS hemipelvic endoprosthesis: A prospective multicenter study//Eur. J. Surg. Oncol. 2009. Vol. 35 (12). P. 1318-1325. doi: 10.1016/j. ejso.2009.04.011.
- Fisher N.E., Patton J.T., Grimer R.J., Porter D., Jeys L., Tillman R.M., Abudu A., Carter S.R. Ice-cream cone reconstruction of the pelvis: a new type of pelvic replacement: early results//J. Bone Joint Surg. Br. 2011. Vol. 93 (5). P. 684-688. X.93B5.25608 DOI: 10.1302/0301-620-
- De Paolis M., Biazzo A., Romagnoli C., Alì N., Giannini S., Donati D.M. The Use of Iliac Stem Prosthesis for Acetabular Defects following Resections for Periacetabular Tumors//Scientific World J. 2013. 2013: 717031, DOI: 10.1155/2013/717031
- Enneking W.F. The anatomic considerations in tumor surgery: pelvis. In: Enneking WF, editor. Musculoskeletal Tumor Surgery. Vol. 2. New York: Churchill Livingstone, 1983. P. 483-529.
- Enneking W.F., Dunham W., Gebhardt M.C., Malawer M., Pritchard D.J. Asystem for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system//Clin. Orthop. Relat. Res. 1993. Vol. 286. P. 241-246.
- Ozaki T., Hillmann A., Bettin D., Wuisman P., Winkelmann W. High complication rates with pelvic allografts. Experience of 22 sarcoma resections//Acta Orthop. Scand. 1996. Vol. 67 (4). P. 333-338.
- Davis A.M., Bell R.S., Badley E.M., Yoshida K., Williams K. Evaluating functional outcome in patients with lower extremity sarcoma//Clin. Orthop. 1999. Vol. 358. P. 90-100.
- Windhager R., Karner J., Kutschera H.P., Polterauer P., Salzer-Kuntschik M., Kotz R. Limb salvage in periacetabular sarcomas: review of 21 consecutive cases//Clin. Orthop. Relat. Res. 1996. Vol. 331. P. 265-276.
- Muller P.E., Durr H.R., Wegener B., Pellengahr C., Refior H.J., Jansson V. Internal hemipelvectomy and reconstruction with a megaprosthesis//Int. Orthop. 2002. Vol. 26 (2). P. 76-79.
- Dai K.R., Yan M.N., Zhu Z.A., Sun Y.H. Computer-aided custom-made hemipelvic prosthesis used in extensive pelvic lesions//J. Arthroplasty. 2007. Vol. 22 (7). P. 981-986.
- Kitagawa Y., Ek E.T., Choong P.F. Pelvic reconstruction using saddle prosthesis following limb salvage operation for periacetabular tumour//J. Orthop. Surg. (Hong Kong). 2006. Vol. 14 (2). P. 155-162.
- Guo W., Li D., Tang X., Ji T. Surgical Treatment of Pelvic Chondrosarcoma Involving Periacetabulum//J. Surg. Oncol. 2010. Vol. 101 (2). P. 160-165 DOI: 10.1002/jso.21442
- Falkinstein Y., Ahlmann E.R., Menendez L.R. Reconstruction of type II pelvic resection with a new peri-acetabular reconstruction endoprosthesis//J. Bone Joint Surg. 2008. Vol. 90 (3). P. 371-376 DOI: 10.1302/0301-620X.90B3.20144


