Ранняя диагностика рака легкого с помощью сенсорного газоаналитического комплекса: клиническое наблюдение
Автор: Родионов Е.О., Кульбакин Д.Е., Подолько Д.В., Обходская Е.В., Обходский А.В., Миллер С.В., Мох А.А., Сачков В.И., Попов А.С., Чернов В.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 6 т.23, 2024 года.
Бесплатный доступ
Актуальность. В настоящее время низкодозная компьютерная томография (НДКТ) является единственным клинически доступным скрининговым исследованием, которое снижает риск смерти от рака легкого. Однако есть ряд недостатков, таких как отсутствие широкой доступности, высокая стоимость, большая частота ложноположительных результатов и необходимость проведения исследования только в группах высокого риска, которые существенно ограничивают массовое внедрение. Анализ выдыхаемого воздуха с использованием чувствительных датчиков дыхания является многообещающим методом улучшения ранней диагностики рака легких. В НИИ онкологии Томского НИМЦ совместно с НИ ТГУ и НИ ТПУ разработан газоаналитический комплекс, способный анализировать газовый состав выдыхаемого воздуха с дистанционным отбором проб из мешков. В ходе исследования данные, полученные путем оцифровки сигналов с датчиков системы газоанализа, и метаданные пациента записываются в базу данных для последующей автоматизированной обработки и анализа с помощью нейросети. Описание клинического случая. В рамках клинической апробации разработанного газоаналитического комплекса для диагностики онкологических заболеваний у пациентки, 48 лет, с длительным стажем курения, которая обратилась в онкологическую клинику за консультацией с подозрением на патологическую инфильтрацию области чревного ствола, выявленную при СКТ органов брюшной полости, была отобрана проба выдыхаемого воздуха. При сравнении состава летучих органических соединений (ЛОС) с контрольной группой (здоровые лица) получены отклонения, характерные для рака легкого. Пациентке проведено дополнительное обследование, включающее CКТ органов грудной клетки, при котором выявлен периферический рак нижней доли левого легкого IIB стадии. Особенностью представленного клинического случая является то, что впервые в диагностике рака легкого использован оригинальный сенсорный газоаналитический комплекс, не имеющий аналогов на территории России. Полученные данные позволили заподозрить у пациентки наличие опухоли легкого, назначить своевременное обследование и выполнить радикальное оперативное лечение. Также проведена оценка состава ЛОС в выдыхаемом воздухе на 10-е сут после операции, при которой значимого изменения не обнаружено.
Рак легкого, сенсорный газоаналитический комплекс, неинвазивная диагностика, выдыхаемый воздух, нейронная сеть, летучие органические соединения
Короткий адрес: https://sciup.org/140308732
IDR: 140308732 | УДК: 616.24-006.6-07:612.22.2 | DOI: 10.21294/1814-4861-2024-23-6-168-175
Текст научной статьи Ранняя диагностика рака легкого с помощью сенсорного газоаналитического комплекса: клиническое наблюдение
Рак легкого (РЛ) является наиболее распространенным злокачественным новообразованием и основной причиной смерти от рака во всем мире [1]. Число больных раком легкого по-прежнему ежегодно растет. Несмотря на то, что существуют различные методы лечения (хирургическое, лучевое и лекарственное), прогноз в настоящее время остается неблагоприятным, поскольку у большинства пациентов заболевание выявляется на поздней стадии. Пятилетняя выживаемость варьирует от 63 % среди пациентов РЛ IA стадии до 28,7 % у больных РЛ IIIA стадии [2]. Для повышения показателей выживаемости при РЛ важно обеспечить раннюю диагностику. Среди доступных методов диагностики низкодозная компьютерная томография (НДКТ) является единственным исследованием, которое снижает риск смерти от РЛ у мужчин на 26 %, у женщин – на 39 %. Однако у НДКТ есть ряд недостатков, таких как высокая стоимость, высокая частота ложноположительных результатов и необходимость проведения исследования только в группах высокого риска, которые существенно ограничивают массовое внедрение метода [3].
Таким образом, для скрининга РЛ необходим неинвазивный, безопасный, сверхчувствительный метод, гарантирующий раннюю диагностику.
Диагностика онкологической патологии по выдыхаемому воздуху является перспективной альтернативой современным методам диагностики. Летучие органические соединения (ЛОС) в выдыхаемом воздухе, которые рассматриваются как биомаркеры, изучаются с 1985 г. В последнее время анализ ЛОС используется для диагностики рака легких, наиболее часто встречающимися биомаркерами являются 2-бутанон, 1-пропанол, этилбензол, стирол, гексаналь и т.д. [4]. Основанный на этих данных анализ ЛОС может обеспечить неинвазивную диагностику пациентов с раком легких, что привлекло внимание ученых из различных областей. В НИИ онкологии Томского НИМЦ

Рис. 1. Сенсорный газоаналитический комплекс. Примечание: рисунок выполнен авторами Fig. 1. Sensor gas analysis complex. Note: created by the authors
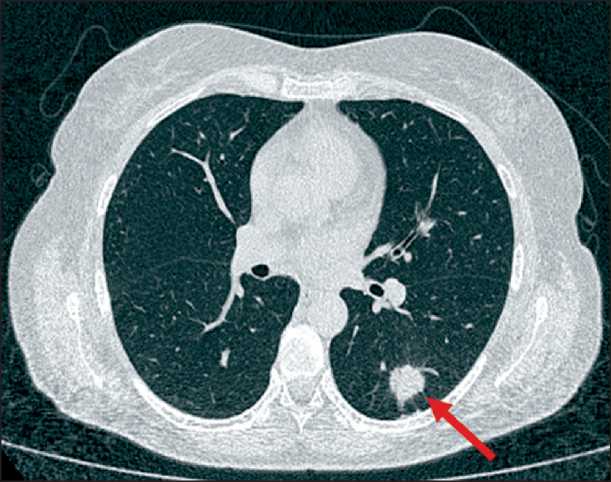
Рис. 2. КТ органов грудной клетки пациентки О. в аксиальной проекции. Сплошная стрелка – опухоль легкого. В S6 левого легкого образование округлой формы, размерами до 19×19×18 мм, с неровными контурами за счет тяжей в окружающую легочную ткань и к костальной плевре.
Примечание: рисунок выполнен авторами
Fig. 2. Computed tomography scan of patient O. in axial projection. The solid arrow is a lung tumor. A rounded lesion of 19×19×18 mm with uneven contours due to strands into the surrounding lung tissue and to the costal pleura are visualized in S6 of the left lung. Note: created by the authors совместно с НИ ТГУ и НИ ТПУ разработан газоаналитический комплекс, способный анализировать газовые пробы с дистанционным отбором проб из мешков (рис. 1). Данные, полученные путем оцифровки сигналов с датчиков системы газоанализа, и метаданные пациента записываются в базу данных для последующей автоматизированной обработки и анализа с помощью нейросети.
Представляем клинический случай ранней диагностики рака легкого с помощью разработанного газоаналитического комплекса.
Пациентке выполнена СКТ органов брюшной полости в условиях НИИ онкологии Томского НИМЦ, при которой патологии не выявлено. В рамках клинической апробации разработанного газоаналитического комплекса для диагностики онкологических заболеваний у пациентки была отобрана проба выдыхаемого воздуха натощак утром. При сравнении состава ЛОС с контрольной группой (здоровые лица) выявлены отклонения, характерные для рака легкого.
С учетом полученных данных выполнена CКТ органов грудной клетки, при которой в S6 левого легкого выявлено округлое образование, размерами 19×19×18 мм, с неровными контурами за счет тяжей в окружающую легочную ткань и к косталь-ной плевре. Структура уплотнения неоднородная за счет проходящего в нем по верхнему контуру субсегментарного бронха Б6. Плотность данного участка в нативную фазу до 32 ЕД HU, при контрастировании отмечается накопление контраста в венозную фазу до 60 ЕД HU, в отсроченную – до 90 ЕД HU. В средостении и корнях легких увеличенных лимфоузлов не выявлено (рис. 2).
При комплексном обследовании патологии со стороны других органов и систем не выявлено. 21.02.24 выполнено оперативное вмешательство в объеме: видеоторакоскопия слева, атипичная резекция нижней доли левого легкого (при сроч-
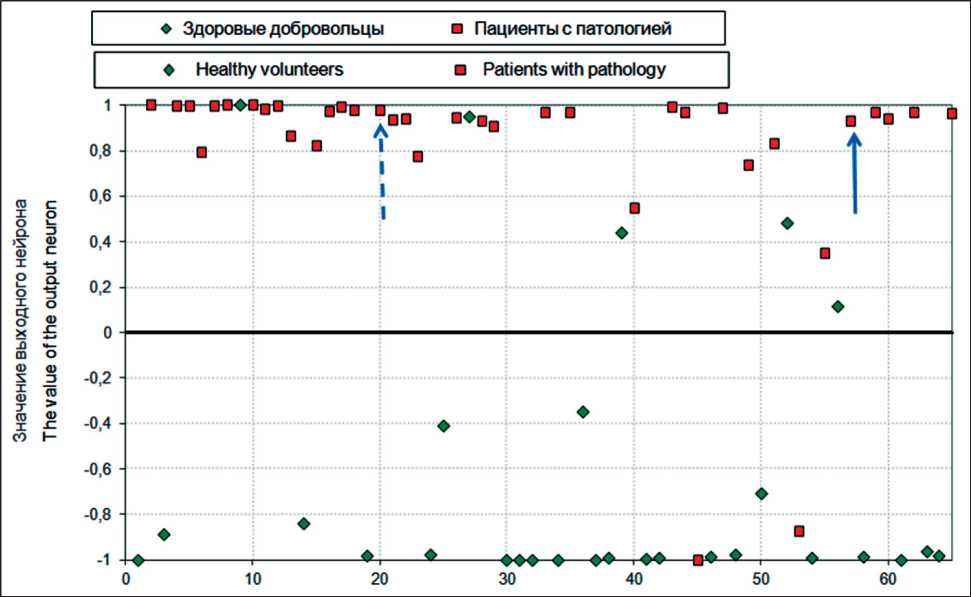
Рис. 3. Диаграмма рассеяния для здоровых пациентов и больных раком легких. Сплошной стрелкой указана проба пациентки О. до операции, пунктирной стрелкой – проба после операции на 10-е сут. Примечание: рисунок выполнен авторами
Fig. 3. Scatterplot for healthy and lung cancer patients. The solid arrow indicates the sample of patient O. before surgery. The dotted arrow indicates the sample after surgery on the 10th day. Note: created by the authors
ном морфологическом исследовании – данные за аденокарциному легкого), нижняя лобэктомия, медиастинальная ипсилатеральная лимфодис-секция. Послеоперационный период протекал без особенностей.
Данные морфологического исследования операционного материала (5.03.24): инвазивная муцинозная аденокарцинома легкого, G2 (папиллярные (40 %), ацинарные (30 %), солидные (20 %) и структуры типа lepidic (10 %)) с врастанием в плевру. Обнаруживаются фокусы перивазального роста. Фокусы периневрального роста опухоли достоверно не обнаружены. Признаки феномена STAS не обнаружены. В микропрепарате граница резекции по сосуду, граница резекции по бронху – без опухолевых клеток. В трех из семи исследованных лимфоузлов (бронхопульмональные) метастатическое поражение. ICD-O code 8253/3.
Установлен окончательный клинический диагноз: периферический рак нижней доли левого легкого pT2aN1M0, стадия IIB. Мутация в гене EGFR – отрицательная. C учетом стадии заболевания пациентке начата адъювантная химиотерапия.
С целью изучения динамического изменения состава ЛОС в выдыхаемом воздухе у пациентки в раннем послеоперационном периоде на 10-е сут после вмешательства повторно взята проба, в которой значимого изменения состава выдыхаемого воздуха не обнаружено. Отсутствие изме-нений, по-видимому, говорит о более длительном сохранении состава и концентрации ЛОС после операции, а также связано с более распростра-ненной стадией заболевания, поскольку выявлено поражение лимфатических узлов, соответствующее критерию N1 (рис. 3)
Обсуждение
Основной причиной высокого уровня смертности от рака легкого является поздняя диагностики заболевания на момент первичного обращения пациента. Несмотря на прогресс в методах лечения рака легких, таких как молекулярно-направленная терапия и иммунотерапия, важным шагом к снижению смертности от РЛ является раннее выявление с помощью неинвазивных методов диагностики. Анализ выдыхаемого воздуха с использованием чувствительных датчиков дыхания является многообещающим методом улучшения диагностики РЛ [5]. Выдыхаемый воздух содержит газовую смесь многих летучих органических соединений в низких концентрациях, которые отражают метаболические процессы на тканевом уровне [6, 7]. Анализ выдыхаемого воздуха основан на сдвигах состава ЛОС вследствие биохимических изменений в различных патофизиологических процессах. Исследования по распознаванию образов для классификации смесей ЛОС с помощью неспецифических перекрестнореактивных датчиков, имитирующих обоняние человека и животных (так называемые «электронные носы»), а также идентификация отдельных ЛОС с помощью методов разделения (например, газовая хроматография, масс-спектрометрия) показали многообещающие результаты в пилотных исследованиях по диагностике рака легкого [8, 9].
«Электронный нос» представляет собой сенсорную систему, состоящую из трех частей: отбора проб, обработки данных и распознавания образов [10]. Часть отбора проб представляет собой матрицу датчиков химических газов, обеспечивающую матрицу сигналов при тестировании ЛОС. Тестированию ЛОС с помощью электронного носа часто не хватает специфичности, поскольку различные ЛОС невозможно дифференцировать в аналитическом процессе, а различные «мешающие» соединения также могут влиять на результаты. Стоит отметить ограничения используемого метода. Платформы на основе массивов химических датчиков могут быть восприимчивы к различным факторам, включая условия измерения, такие как температура и влажность, а также факторы пациента, такие как возраст, пол, метаболические функции и привычка к курению. Таким образом, сложно четко определить информацию, касающуюся наличия или отсутствия рака, посредством измерений образцов выдыхаемого воздуха из-за вмешательства этих разнообразных факторов [11].
Точность диагностики рака легкого с помощью разработанного сенсорного газоаналитического комплекса в НИИ онкологии Томского НИМЦ составила 85,71 %, чувствительность – 95,24 %, специфичность – 76,19 % [12]. Полученные нами первые результаты были сопоставимы, а в большинстве случаев превосходили данные исследований эффективности «электронных носов» в мировой литературе, в которых чувствительность составляла 63–100 %, специфичность 32,9–100 %, точность 72–98,6 % [9]. К отличительным особенностям разработанного прибора можно отнести высокую мобильность с возможностью размещения в любых учреждениях здравоохранения и простоту диагностики.
Особенностью представленного клинического случая является то, что впервые в диагностике рака легкого был использован оригинальный сенсорный газоаналитический комплекс, не имеющий аналогов на территории России. Полученные данные позволили заподозрить у пациентки наличие опухоли легкого (несмотря на отсутствие клинической симптоматики), назначить своевременное обследование и выполнить радикальное оперативное лечение.
Для оценки динамики изменения состава ЛОС впервые был проведен забор проб выдыхаемого
Список литературы Ранняя диагностика рака легкого с помощью сенсорного газоаналитического комплекса: клиническое наблюдение
- Leiter A., Veluswamy R.R., Wisnivesky J.P. The global burden of lung cancer: current status and future trends. Nat Rev Clin Oncol. 2023; 20(9): 624-39. https://doi.org/10.1038/s41571-023-00798-3.
- Sheikh M., Virani S., Robbins H.A., Foretova L., Holcatova I., Janout V., Lissowska J., Navratilova M., Mukeriya A., Ognjanovic M., Swiatkowska B., Zaridze D., Brennan P. Survival and prognostic factors of early-stage non-small cell lung cancer in Central and Eastern Europe: A prospective cohort study. Cancer Med. 2023; 12(9): 10563-74. https://doi.org/10.1002/cam4.5791.
- Rodionov E.O., Chernov V.I., Kul'bakin D.E., Obkhodskaya E.V., Obkhodskiĭ A.V., Sachkov V.I., Miller S.V. Sensornyi gazoanaliticheskii kompleks v diagnostike raka legkogo. Voprosy onkologii. 2023; 69(5): 855-62. https://doi.org/10.37469/0507-3758-2023-69-5-855-862.
- Saalberg Y., Wolff M. VOC breath biomarkers in lung cancer. Clin Chim Acta. 2016; 459: 5-9. https://doi.org/10.1016/j.cca.2016.05.013.
- Lee B., Lee J., Lee J.O., Hwang Y., Bahn H.K., Park I., Jheon S., Lee D.S. Breath analysis system with convolutional neural network (CNN) for early detection of lung cancer. Sensors and Actuators B: Chemical. 2024; 409. https://doi.org/10.1016/j.snb.2024.135578.
- Pereira J., Porto-Figueira P., Cavaco C., Taunk K., Rapole S., Dhakne R., Nagarajaram H., Câmara J.S. Breath analysis as a potential and non-invasive frontier in disease diagnosis: an overview. Metabolites. 2015; 5(1): 3-55. https://doi.org/10.3390/metabo5010003.
- Mansurova M., Ebert B.E., Blank L.M., Ibáñez A.J. A breath of information: the volatilome. Curr Genet. 2018; 64(4): 959-64. https://doi.org/10.1007/s00294-017-0800-x.
- Kort S., Brusse-Keizer M., Schouwink H., Citgez E., de Jongh F.H., van Putten J.W.G., van den Borne B., Kastelijn E.A., Stolz D., Schuurbiers M., van den Heuvel M.M., van Geffen W.H., van der Palen J. Diagnosing Non-Small Cell Lung Cancer by Exhaled Breath Profiling Using an Electronic Nose: A Multicenter Validation Study. Chest. 2023; 163(3): 697-706. https://doi.org/10.1016/j.chest.2022.09.042.
- Vadala R., Pattnaik B., Bangaru S., Rai D., Tak J., Kashyap S., Verma U., Yadav G., Dhaliwal R.S., Mittal S., Hadda V., Madan K., Guleria R., Agrawal A., Mohan A. A review on electronic nose for diagnosis and monitoring treatment response in lung cancer. J Breath Res. 2023; 17(2). https://doi.org/10.1088/1752-7163/acb791.
- Song J., Li R., Yu R., Zhu Q., Li C., He W., Liu J. Detection of VOCs in exhaled breath for lung cancer diagnosis. Microchemical J. 2024; 199. https://doi.org/10.1016/j.microc.2024.110051.
- Saeki Y., Maki N., Nemoto T., Inada K., Minami K., Tamura R., Imamura G., Cho-Isoda Y., Kitazawa S., Kojima H., Yoshikawa G., Sato Y. Lung cancer detection in perioperative patients’ exhaled breath with nanomechanical sensor array. Lung Cancer. 2024; 190. https://doi.org/10.1016/j.lungcan.2024.107514.
- Chernov V.I., Choynzonov E.L., Kulbakin D.E., Menkova E.N., Obkhodskaya E.V., Obkhodskiy A.V., Popov A.S., Rodionov E.O., Sachkov V.I., Sachkova A.S. Non-Invasive Diagnosis of Malignancies Based on the Analysis of Markers in Exhaled Air. Diagnostics (Basel). 2020; 10(11): 934. https://doi.org/10.3390/diagnostics10110934.
- Broza Y.Y., Kremer R., Tisch U., Gevorkyan A., Shiban A., Best L.A., Haick H. A nanomaterial-based breath test for short-term follow-up after lung tumor resection. Nanomedicine. 2013; 9(1): 15-21. https://doi.org/10.1016/j.nano.2012.07.009.
- Poli D., Goldoni M., Caglieri A., Ceresa G., Acampa O., Carbognani P., Rusca M., Corradi M. Breath analysis in non small cell lung cancer patients after surgical tumour resection. Acta Biomed. 2008; 79(s1): 64-72.


