Ранняя прогрессия гипернефромы после экстракорпоральной резекции почки
Автор: Шкодкин С.В., Идашкин Ю.Б., Паричук А.С., Любушкин А.В., Невский А.А., Шушпанова К.Д.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Онкоурология
Статья в выпуске: 3, 2017 года.
Бесплатный доступ
В мире ежегодно регистрируется более 15 тысяч новых случаев почечно-клеточного рака. Это составляет 3% в структуре общей онкологической заболеваемости населения и выводит его на третье место среди онкоурологической патологии. Внедрение и разработка новых препаратов таргетной и иммунотерапии пока не обеспечивает продолжительного эффекта при диссеминированных формах болезни. Такой подход не оправдан при ее локализованных вариантах. Раннее выявление и хирургическое лечение являются единственными эффективными способами сохранения жизни пациентов и дают шанс на получение длительного контроля над опухолью. Нефрон-сберегающее лечение пациентов с почечно-клеточным раком единственной или единственно функционирующей почки обеспечивает высокое качество жизни и снижает риск системной прогрессии по сравнению с различными вариантами заместительной почечной терапии. В статье приведено клиническое наблюдение раннего рецидива и прогрессии почечно-клеточного рака у пациента с промежуточным риском и идиопатическим разрывом единственно функционирующей почки. На этапах лечения было трудно определить причину такой быстрой прогрессии почечно-клеточного рака. Выполнение трансплантатэктомии и удаление имплантационного метастаза не достигли желаемого результата. Пациент погиб от осложнений заместительной почечной терапии на фоне сопутствующей экстраренальной патологии. прогрессии почечно-клеточного рака и выбор тактики у этих пациентов требуют дальнейшего изучения. Данное клиническое наблюдение еще раз указывает на склонность почечно-клеточного рака к имплантационному метастазированию. В таких случаях отмечается большая скорость прогрессии, чем при локальном рецидиве первичной опухоли. Это является одной из причин нашего отказа от проведения биопсии при опухолях почки.
Рак почки, резекция почки, рецидив опухоли, разрыв почки
Короткий адрес: https://sciup.org/142188392
IDR: 142188392
Текст научной статьи Ранняя прогрессия гипернефромы после экстракорпоральной резекции почки
мире ежегодно регистрируется более 15 тысяч новых случаев почечно-клеточного рака, что составляет 3% в структуре общей онкологической заболеваемости населения и выво дит его на третье место среди онко-урологической патологии. Внедрение и разработка новых препаратов таргетной и иммунотерапии пока не обеспечивает продолжительного эффекта при диссеминированных формах болезни и не оправдано при ее локализованных вариантах. Раннее выявление и хирургическое лечение являются единственными эффективными способами сохранения жизни пациентов и дают шанс на получение длительного контроля над опухолью [1,2]. Немаловажным аспектом помощи этой категории больных является обеспечение вы- сокого качества жизни, что, зачастую, заключается в обеспечении сохранности почечной функции. Эффективность и приоритет неф-рон-сберегающего лечения пациентов с почечно-клеточным раком и опухолями до 4 см последние пять лет не оспаривается и рекомендуется как метод выбора ведущими урологическими ассоциациями [3-5]. Эффективность резекции почки или, так называемой парциальной нефрэктомии, показана и при опухолях большего размера. Особым контингентом всегда были пациенты с единственной или единственной функционирующей почкой, которым данный вид лечения рассматривался как обязательный [1,6]. Это объяснимо тем, что в случае перевода пациента в ре-нопривное состояние, проведение любого вида заместительной почечной терапии повышает риск прогрессии опухоли. Так в обычной популяции наличие терминальной стадии хронической почечной недостаточности (ТХПН) повышает риск развития почечно-клеточного рака в 4 раза у пациентов, находящихся на диализе, и в 3,5 раза – после трансплантации почки.
Критическим моментом при резекции почки является эффективность и время закрытия почечной раны, т.е. обеспечение гемостаза, что наибее актуально при опухолях больших размеров и имеющих инвазивный рост [4-6]. Резекция почки у таких пациентов с одной стороны требует выключения органа из кровотока, а с другой – использования нефропротективных приемов. К последним стоит отнести локальную гипотермию ледяной крошкой [1], канюляцию и локальную перфузию кустадиолом
[6,7], экстракорпоральную резекцию и ортотопическую трансплантацию [1,2], экстракорпоральную резекцию и гетеротопическую трансплантацию [1,9-11]. Каждый из перечисленных методов имеет свои преимущества и недостатки, и данное клиническое наблюдение не имеет цели их анализа. Учитывая преимущества при оценке радикальности, нами при рисках кровотечения, длительной ишемии почки, а так же в случае необходимости лимфаденэктомии или адреналэктомии используется последний вариант – экстра-корпоральная резекция и гетероскопическая трансплантация.
Клиническое наблюдение
Вашему вниманию представляем клиническое наблюдение: пациент У. 55 лет поступил с жалобами на интенсивные боли в левой поясничной области, которые развились внезапно после физической нагрузки за две недели до поступления в стационар.
В анамнезе инфаркт миокарда два года назад, страдает сахарным диабетом 2 типа, корригируется пероральными гипогликемическими препаратами. Ожирение третьей степени, при весе 140 кг индекс массы тела составлял 48,4. Лабораторно обращали на себя внимание нормохромная анемия: эритроциты – 3,1х1012/л, гемоглобин – 102 г/л, цветной показатель – 0,81; азотемия: повышение креатинина до 158 мкмоль/л, мочевины до 9,3 ммоль/л; микрогематурия до 40
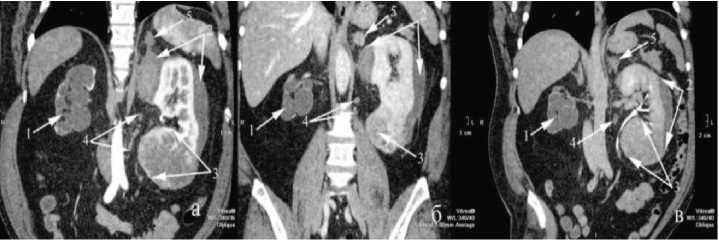
Рис. 1. СКТ а – артериальная, б – венозная и с – экскреторная фазы (пояснения в тексте)
в п/зрения. При ультразвуковом исследовании обнаружены опухоли верхнего (до 7 см) и нижнего (до 10 см) полюсов левой почки, правая почка уменьшена в размерах до 8х4х4 см, гидронефротически трансформирована, паренхима истончена до 3-5 мм, мочеточник не визуализируется. Спиральная компьютерная томография с болюсным усилением в ангиографическом режиме выявила терминальный гидронефроз слева с отсутствием отсроченной функции (рис. 1-1), разрыв верхнего полюса с подкапсульной гематомой 7х4 см (рис. 1-2), распространяющейся на опухоль нижнего полюса, последняя до 10 см компре-мирует чашечно-лоханочную систему (ЧЛС) с ампутацией нижней группы чашечек (рис. 1-3). Регионарные лимфатические узлы были увеличены до 1,5 см, четкого накопления контраста отмечено не было (рис. 1-4). В левом надпочечнике – образование до 2 см, не накапливающее активно контраст в артериальную фазу, но имеющее задержку выведения контраста в венозную (рис. 1-5). На основании проведенного обследования установлен диагноз: Разрыв, подкапсульная гематома верхнего сегмента, опухоль Т3аNxM1 (mts в ипсилатеральный надпочечник) единственной функционирующей левой почки. Постгеморрагическая анемия легкой степени. Терминальный гидронефроз справа. Хронический пиелонефрит, ремиссия ХПН I. Сахарный диабет 2 тип, средней тяжести, компенсация. ИБС, постинфарктный кардиосклероз, ХСН 2а стадия, 3 функ- циональный класс. Конституциональное ожирение 3 стадия.
Пациенту по абсолютным показаниям выполнено нефрон-сберегаю-щее лечение в объеме радикальной нефрадреналэктомии, экстракорпоральной резекция опухоли нижнего сегмента, резекции некротизированных тканей и ушивания разрыва среднего сегмента левой почки и гетеротопической аутотрансплантация в правую подвздошную область (рис. 2). Выбор объема операции и отказ от резекции in situ был продиктован как тяжестью поражения единственно функционирующей почки (идиопатическим разрывом, инвазивной формой опухоли, которые увеличивали риски интраоперационного кровотечения и продолжительного периода тепловой ишемии), так и вероятностью лимфатического поражения и метастаза в ипсилатеральный надпочечник.
Рис. 2. Вид лапаратомной раны после нефрадре-налэктомии
Визуально хирургический край был отрицателен, отступ от опухоли составил 3-7 мм. Время холодовой ишемии составило 45 минут, вторичной тепловой ишемии – 20 минут. Кровопотеря без учета подкапсульной гематомы не превысила 50 мл. Несмотря на это, в послеоперационном периоде на фоне сохранного диуреза до 1,5-2,5 л отмечался рост азотемии (креатинин 700 – 800 мкмоль/л), что потребовало 5 сеансов гемодиализа, азотовыделительная функция восстановлена, уровень креатинина стабилизировался на уровне 150 мкмоль/л. Морфоло-гочески у пациента диагностированы светлоклеточная гипернефрома
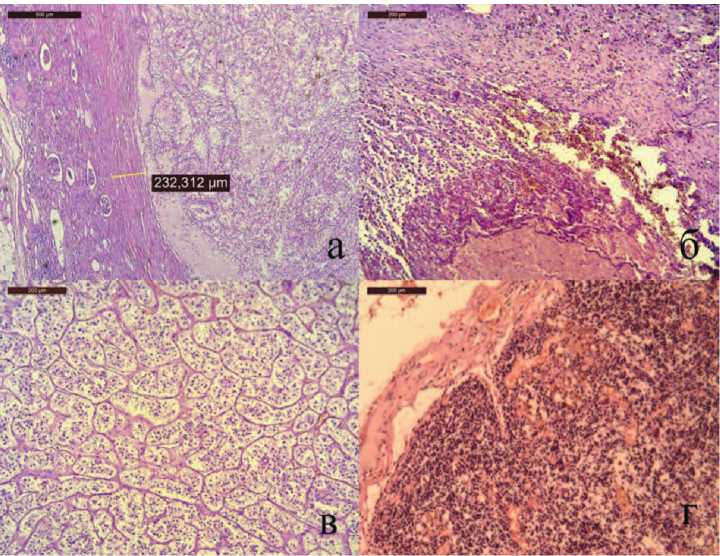
Рис. 3. Результаты морфологического исследования. Окраска гематоксилин и эозин. (пояснения в тексте)
предложена отсроченная нефрэктомия справа через 1-2 месяца, на которую больной не явился.
Пациент обратился через 10 месяцев с клиникой синдрома системной воспалительной реакции в течении недели с неправильной гекти-ческой лихорадкой, нейтрофильным (85%) лейкоцитозом 20,5х109/л, неэффективной антибактериальной терапией. Ультразвуковые исследования, выполненные через 1, 3 и 6 месяцев после операции, не выявили патологии со стороны аутотрансплантата. Ультразвуковое исследование при обращении диагностировало гидронефроз с наличием стента в правой почке. В аутотрансплантате патологии не было выявлено. Учитывая септическое состояние больного с экстрареналь-ной патологией в виде сахарного
Fuhrman 2 с отрицательным хирургическим краем (рис. 3а), в тканях из области разрыва геморрагическое пропитывание без опухолевого роста (рис. 3б), удаленный надпочечник представлен аденомой (рис. 3в), в лимфоузлах воспалительные изменения (рис. 3г). Нужно отметить, что послеоперационное стади-рование снизило прогноз прогрессии с высокого до промежуточного. Диагноз пациента после операции: Разрыв почки, подкапсульная гематома среднего сегмента, светлоклеточная гипернефрома pT2aN0M0G2 Fuhrman 2 стадия 2 единственной функционирующей левой почки стадия 2. Постгеморрагическая анемия легкой степени. Светлоклеточная аденома левого надпочечника. Терминальный гидронефроз справа. Хронический пиелонефрит, ремиссия ХПН1. Сахарный диабет 2 тип, средней тяжести, компенсация. ИБС. Постинфарктный кардиосклероз, ХСН 2а стадия, 3 функциональный класс. Конституциональное ожирение 3 стадия.
На 14 сутки послеоперационного периода на фоне снижения азотемии у пациента сохранялась лихорадка. По данным УЗИ жидкостное образование в области ауто- трансплантата 4х5 см, увеличение гидронефроза справа. Выполнена аспирационная биопсия жидкостного образования и пункционная нефростомия справа. По данным аспирационной биопсии жидкость в области трансплантата биохимически представляла лимфу с низким цитозом, результаты бактериологического исследования были отрицательными. Лихорадка купирована. Пациенту выполнено стентирование правого мочеточника, нефро-стомический дренаж удален,
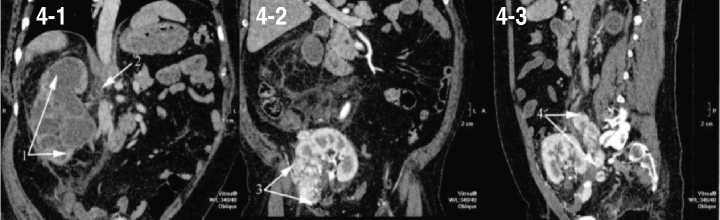
Рис. 4. СКТ (пояснения в тексте)
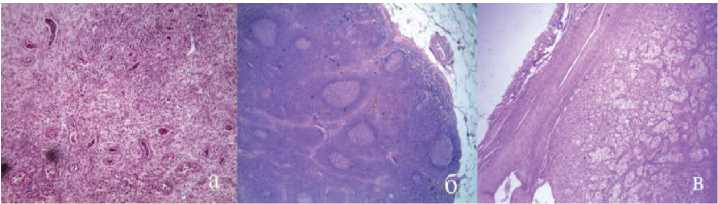
Рис. 5. Результаты морфологического исследования. Окраска гематоксилин и эозин. (пояснения в тексте)
диабета, для исключения гнойно-деструктивного поражения легких и паранефрия выполнена спиральная компьютерная томография грудной клетки и брюшной полости в ангиографическом режиме. При этом отсутствовала патология со стороны органов грудной клетки, отмечена прогрессия гидронефроза с признаками паранефрита (рис. 4-1), в воротах правой почки определялся лимфоузел до 2 см без патологического накопления контраста (рис. 4-2). Очаговое образование аутотранс- плантата в области резекции до 4 см (рис. 4-3), метастаз в правые общие подвздошные лимфатические узлы 8х2 см.
Учитывая септическое состояние пациента, от морфологической верификации поражения аутотрансплантата решено было отказаться. По жизненным показаниям пациенту выполнена нефрэктомия справа из люмботомического доступа, лимфодиссекция и подвздошная лимфаденэктомия . Гистологическое исследование выявило гнойный пиелонефрит (рис 5а) с неспецифической лимфоаденопатией в воротах почки (рис. 5б), метастаз светлоклеточного рака в подвздошные лимфатические узлы (рис. 5в). Лихорадка купирована со вторых суток, к концу недели послеоперационного периода пациент выписан.
На тот момент мы не могли объяснить ни стремительной прогрессии локального рецидива (до 4 см за 10 месяцев), ни области и объема лимфогенного метастазирования. К сожалению, провести лечение локального рецидива не удалось, пациент госпитализирован в экстренном порядке через 2 месяца после второй операции с анурией в
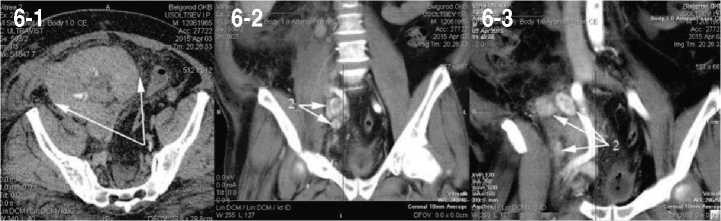
Рис. 6. СКТ (пояснения в тексте)
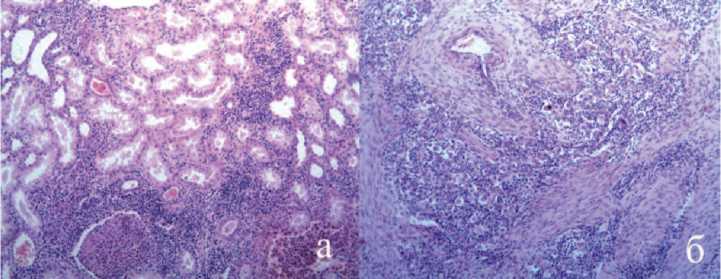
Рис. 7. Результаты морфологического исследования. Окраска гематоксилин и эозин. (пояснения в тексте)
течении 3 суток, клиникой синдрома системной воспалительной реакции в течении 10 дней с постоянной фебрильной лихорадкой, нейтрофильным (82%) лейкоцитозом 22,3х109/л и сдвигом до юных форм. При ультразвуковом исследовании отмечено увеличение объема аутотрансплантата, отек паренхимы до 25 мм, диффузное снижение перфузии с ростом индексов резистентности на дистальном русле до 0,95. После проведения диализа выполнена спиральная компьтерная томография с болюсным усилением в ангиографическом режиме, где отмечено увеличение объема, резкое снижение перфузии и выделительной функции аутотрансплантата (рис. 6-1), а так же лимфатическая прогрессия в бассейне наружных и внутренних подвздошных сосудов (рис. 6-2, 6-3). Учитывая наличие гнойного пиелонефрита аутотрансплантата, прогрессию опухоли, экста-раренальной патологии в виде сахарного диабета, принято решение о нефрэктромии аутотрансплантата, лимфодиссекции. Интраоперационно был подтвержден апостематозный пиелонефрит, с техническими трудностями из экстра- и интраперитонеального доступа удален аутотрансплантат, ушито ранение наружной подвздошной артерии. В связи с выраженным рубцовым периартериитом выполнить лимфо-диссекцию не удалось. В удаленной почке рецидива опухоли не обнаружено как при макроскопическом, так и при микроскопическом исследовании (рис. 7а). Опухолевый узел локализовался в послеоперационном рубце, узел был иссечен (рис. 7б).
В послеоперационном периоде воспалительный синдром купирован, пациент введен в программу диализа, сформирована артериовенозная фистула. На 4-й неделе послеоперационного периода отмечены четыре приступа отека легкого, требовавшие интубации и выполнения экстренной ультрафильтрации. В последнем случае клиническая смерть в течении 40 минут, что повлекло смерть мозга и стало причиной фатального исхода. При обследовании и на секции не выявлено легочного метастазирования и острого инфаркта миокарда.
ОБСУЖДЕНИЕ
Резюме:
В мире ежегодно регистрируется более 15 тысяч новых случаев почечно-клеточного рака. Это составляет 3% в структуре общей онкологической заболеваемости населения и выводит его на третье место среди онкоурологической патологии. Внедрение и разработка новых препаратов таргетной и иммунотерапии пока не обеспечивает продолжительного эффекта при диссеминированных формах болезни. Такой подход не оправдан при ее локализованных вариантах. Раннее выявление и хирургическое лечение являются единственными эффективными способами сохранения жизни пациентов и дают шанс на получение длительного контроля над опухолью. Неф-рон-сберегающее лечение пациентов с почечно-клеточным раком единственной или единственно функционирующей почки обеспечивает высокое качество жизни и снижает риск системной прогрессии по сравнению с различными вариантами заместительной почечной терапии.
В статье приведено клиническое наблюдение раннего рецидива и прогрессии почечно-клеточного рака у пациента с промежуточным риском и идиопатическим разрывом единственно функционирующей почки. На этапах лечения было трудно определить причину такой быстрой прогрессии почечно-клеточного рака. Выполнение трансплантатэктомии и удаление имплантационного метастаза не достигли желаемого результата. Пациент погиб от осложнений заместительной почечной терапии на фоне сопутствующей экстраренальной патологии.
Взаимосвязь повреждения почки с вероятностью прогрес-
Список литературы Ранняя прогрессия гипернефромы после экстракорпоральной резекции почки
- Микич, Д.Г.Д. Почечно-клеточный рак: экстракорпоральная резекция почки с последующей аутотрансплантацией при локализованной форме заболевания. Онкоурология 2007;(3):16-20.
- van der Velden JJ, van Bockel JH, Zwartendijk J, van Krieken JH, Terpstra JL. Long-term results of surgical treatment of renal carcinoma in solitary kidneys by extracorporealresection and autotransplantation. Br J Urol 1992;69(5):486-90.
- Акопян Г.Н., Алексеев Б.Я., Волкова М.И., Говоров А.В., Давыдов М.И., Матвеев В.Б., Носов Д.А., Шпоть Е.В. Рак паренхимы почки у взрослых: Российское Общество Урологов, Клинические рекомендации . Москва: Министерства здравоохранения Российской Федерации; 2016 . Available from: http://cr.rosminzdrav.ru/schema.html?id=87#/text
- Campbell S, Uzzo RG, Allaf ME, Bass EB, Cadeddu JA, Chang A, et al. Renal mass and localized renal cancer: American Urological Association Guideline . Linthicum: American Urological Association; 2017 April . 49 p. Available from: https://www.auanet.org/Documents/education/clinical-guidance/Renal-Mass-Localized-Renal-Cancer.pdf
- Ljungberg B, Albiges L, Bensalah K, Bex A, Giles RH, Hora M, et al. Renal cell carcinoma disease management: European Association of Urology, Oncology Guidelines . Arnhem: European Association of Urology; 2017 . Available from: http://uroweb.org/guideline/renal-cell-carcinoma/#7
- Комяков Б.К., Замятнин С.А., Попов С.В., Шломин В.В., Цыганков А.В., Гончар И.С. Экстракорпоральное хирургическое лечение больных с почечно-клеточным раком. Вестник хирургии им. И.И. Грекова 2014; 173(4):53-56.
- Комяков Б.К., Шломин В.В., Гулиев Б.Г., Замятнин С.А., Гончар И.С., Товстуха Д.В. Резекция опухоли in situ в условиях ее длительной ишемии. Онкоурология 2014;(2):22-25.
- Zincke H, Engen DE, Henning KM, McDonald MW. Treatment of renal cell carcinoma by in situ partial nephrectomy and extracorporeal operation with autotransplantation. Mayo Clin Proc 1985;60(10):651-62.
- Nishida H, Kanno H, Hosoya N, Sakurai T, Mashima E, Naito S, et al. Extracorporeal partial nephrectomy and auto-transplantation after presurgical targeted therapy with tyrosine kinase inhibitors for renal cell cancer. Hinyokika Kiyo 201;59(8):507-11.
- Шкодкин С.В., Татаринцев А.М., Идашкин Ю.Б., Любушкин А.В., Фиронов С.А. Экстракорпоральная резекция почки: а стоит ли? Урология 2016;(3):62-69.
- Mitsuhata N., Ito S., Watanabe Y. Renal transplantation surgery is closely linked with treatment for bilateral synchronous renal cell carcinomas or renal tumors in solitary kidney. Gan To Kagaku Ryoho 2004;31(5):735-8.


