Распределение потоков крови при формировании разных патогенетических вариантов артериальной гипертензии
Автор: Лукьянов В. Ф., Капланова Т. И., Петрова В. Д.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Кардиология
Статья в выпуске: 3 т.17, 2021 года.
Бесплатный доступ
Цель: оценка распределения объемного кровотока в формировании различных клинико-патогенетических вариантов гипертонии. Материал и методы. Обследовано 128 больных, у которых определяли показатели объемного кровотока на аорте и плечевой артерии. Результаты. При вазоконстрикторной гипертензии ударный объем в плечевой артерии и коэффициент распределения кровотока (КРК) были в 4 раза меньше аналогичных показателей больных с объемной гипертензий. У больных с гиперкинетической гипертензией энергия выброса крови и КРК более чем в 3 раза превосходили такие же показатели при других вариантах артериальной гипертензии (АГ). Заключение. Выделены характерные гемодинамические признаки распределения потоков крови, которые могут использоваться для диагностики различных патогенетических фенотипов АГ.
Патогенетические варианты артериальной гипертензии, состояние гемодинамики.
Короткий адрес: https://sciup.org/149138150
IDR: 149138150 | УДК: 616–005.2:616.13–004.6 (045)
Текст научной статьи Распределение потоков крови при формировании разных патогенетических вариантов артериальной гипертензии
1 Введение. Фундаментальной особенностью формирования системного кровотока является его распределение с увеличением объема крови в функционально активных органах и тканях, что сопровождается снижением объемного кровотока в других частях тела. Объемный кровоток формируется при непосредственном участии сердечного выброса и тонуса сосудов, что является характерной чертой артериальной гипертензии (АГ). В настоящее время большое внимание при изучении патогенеза АГ уделяется эластичности сосудов, определяемой скоростью пульсовой волны, и механизмам регуляции вну-триорганного кровотока [1, 2].
При АГ хорошо изучено состояние сердечного выброса, а перераспределение кровотока недостаточно освещено в литературе и в основном рассматривается в связи с медикаментозным воздействием.
Цель: оценка распределения кровотока у больных с различными клинико-патогенетическими вариантами течения АГ в рамках модели, учитывающей сердечный выброс и состояние объемного кровотока в плечевой артерии.
Материал и методы. Состояние гемодинамики изучено у 128 больных АГ, среди которых 66 мужчин и 62 женщины. Средний возраст обследованных составлял 45,4±10,9 года, средняя длительность заболевания 14,5±10,1 года. Преобладали больные со II стадией АГ (109 человек), АГ I стадии диагностирована у 12 пациентов, АГ III стадии зарегистрирована у 7 больных. Контрольную группу составили 20 человек (13 мужчин и 7 женщин), средний возраст обследованных контрольной группы был сопоставим с этим параметром у больных основной группы и составил 40,3±9,4 года.
Гемодинамические показатели анализировали методом ультразвукового допплер-сканирования в утренние часы, после 20-минутного пребывания пациента в горизонтальном положении. Оценивали гемодинамические показатели сердца и аорты на аппарате Apogee CX датчиком 3,5 МГц, при определении допплерографии плечевой артерии использовали датчик 7,5 МГц. Обследование осуществляли по стандартным методикам в постоянно-волновом и импульсном режимах.
Гемодинамические показатели сердца оценивали по стандартным методикам с определением размеров полостей сердца во время систолы и диастолы. Показатели сосудистой гемодинамики оценивали по максимальному и минимальному диаметру плечевой артерии при пульсаторных колебаниях. Измеряли скорость движения крови в аорте (V1) и в плечевой артерии (V2). Объемный кровоток сердца оценивали по общепринятой методике с определением ударного (УО1) и минутного (МО1) объемов левого желудочка. Рассчитывали общее периферическое сопротивление (ОПС). Показатели ударного (УО2) и минутного объема плечевой артерии (МО2) определяли по ранее описанной методике [3].
Для определения регионарного периферического сопротивления (РПС) на плечевой артерии использовалось уравнение Бернулли:
gV 2
Zrg+P+
=const.
Так как кровообращение происходит в замкнутой системе, изучаемые параметры соотносятся между собой следующим образом:
Z1+P1 /pg+V1 2 /2g=Z2+P2 /pg+V22/2g=const.
Из уравнения можно рассчитать разность давления между аортой и плечевой артерией:
AP1=pV12/2 — pV22/2=0,5p (V12 — V2 2 ) (кг/с2/м).
По соотношению разности давления и объемного кровотока на плечевой артерии определялось РПС на плечевой артерии по формуле:
PnC=DP/Q2, где РПС — регионарное периферическое сопротивление на плечевой артерии (Мнхс/м5); Q2 (УО2) — ударный объем на плечевой артерии (м3); DP — разность давления на отрезке «аорта — плечевая артерия» (Па).
Дополнительно оценивали кинетическую энергию (Wкин) выброса крови из левого желудочка.
Кинетическая энергия сердечного выброса рассчитывалась по формуле:
р х V х v2
Wкин= , где r — плотность крови; V — ударный объем; v2 — квадрат скорости движения крови.
Для оценки распределения кровотока предложен новый показатель — коэффициент распределения кровотока (КРК), который дает возможность определить сосудистую фракцию сердечного выброса в относительных величинах и рассчитывается как отношение ударного сердечного и ударного сосудистого объема по следующей формуле:
КРК=УОсер/УОсос, где КРК — коэффициент распределения кровотока; УОсер — ударный объем сердечный; УОсос — ударный объем сосудистый на плечевой артерии.
Статистическая обработка результатов проводилась с использованием программы Statistica для Windows. Рассчитывали среднюю арифметическую (М), стандартную ошибку (m), так как распределение было близким к нормальному. Для определения межгрупповых отличий использовался t-критерий Стьюдента и непараметрический критерий Вилкок-сона. Различия считались значимыми при р<0,05. Для графической обработка результатов применялась программа Excel.
Результаты. Для распределения больных на группы использованы показатели сосудистого сопротивления и объемного кровотока на плечевой артерии. Соответственно этим показателям выделено три группы больных. Первую группу составили 98 больных (76,5%) с малым РПС и большим диаметром плечевой артерии (группа ОГ). По гемодинамическим параметрами периферического кровотока и в соответствии с представлениями о патогенетическом фенотипе она соответствует представлениям об «объемной гипертензии» (ОГ). Вторую группу образовали больные с нормальным РПС и малым диаметром плечевой артерии, ее составили 13 больных (10,2%). По показателям гемодинамики данная группа соответствует представлениям о «вазоконстрикторной гипертензии» (ВГ). Третью группу составили больные с высоким РПС и малым диаметром плечевой артерии, при высокой скорости кровото- ка и большой кинетической энергии выброса крови из левого желудочка. Таких больных было 17 человек (13,3%). По гемодинамическим параметрами и в соответствии с представлениями о патогенетическом фенотипе она соответствует представлениям о «гиперкинетической гипертензии» (ГГ).
Пациенты с «объемной гипертензией» составили самую многочисленную группу. Для дальнейшего анализа все больные ОГ были распределены на четыре группы по уровню давления, с достоверным отличием по этому показателю между собой: группы А, Б, В, Г (табл. 1). Установлено, что пропорционально росту АД происходило снижение кинетической энергии выброса из левого желудочка (Wкин), увеличивался ди- аметра плечевой артерии с увеличением объемного кровотока в плечевой артерии (УО2), соответственно этому снижалось РПС в плечевой артерии с одновременным увеличением ОПС. Но при этом независимо от уровня АД характер потока крови при «объемной гипертензии» не менялся (см. табл. 1).
Для дальнейшего сравнительного анализа разных патогенетических вариантов гипертензии из группы «объемная гипертензия» взяты больные, сопоставимые по уровню АД, возрасту и стажу (группа В, см. табл. 1) с больными, имеющими «вазоконстрикторную гипертензию» (табл. 2).
Таблица 1
Показатели гемодинамики у больных «объемной гипертензией» с разным уровнем артериального давления
|
Показатель |
Контроль, n=20 |
Группа А, n=31 |
Группа Б, n=29 |
Группа В, n=26 |
Группа Г, n=12 |
|
САД, мм рт. ст. |
119,8±5,4 |
146,9±13** |
165,3±13,8** |
185±8,7** |
210±9,4** |
|
ДАД, мм рт. ст. |
69,5±7,4 |
90,9±1,9** |
102,9±4,4** |
113,3±4,9** |
118,8±9,2** |
|
СрАД, мм рт. ст |
86,3±6,1 |
109,7±3,7** |
121,4±4,0** |
132,5±5,1** |
147,5±5,4** |
|
R аорты, мм |
11,0±0,8 |
13,3±1,2** |
13,1±1,0** |
13,3±1,1** |
13,1±0,7** |
|
УО1, мл |
78,8±8,6 |
87,0±17,7 |
82,8±25,6 |
83,1±19,4 |
80,8±21,6 |
|
МО1, л/мин |
5,3±0,7 |
5,7±1,2 |
5,4±1,8 |
5,6±1,4 |
5,1±1,6 |
|
КРК |
243±40 |
129±40** |
115±60** |
99±40** |
89±51** |
|
Wкин, мДж |
25,4±7,1 |
16,2±6,3** |
15,0±8,0** |
15,0±6,8** |
14,2±8,0** |
|
РПС, Мнхс/м5 |
751±204 |
183±113** |
167±135** |
126±105** |
110±91** |
|
ОПС, Мнхс/м5 |
132±22 |
162±34** |
196±73** |
201±49** |
248±60** |
|
V1, м/сек |
0,77±0,08 |
0,58±0,11** |
0,56±0,1** |
0,56 ± 0,09** |
0,54±0,1** |
|
R Па, мм |
1,50±0,01 |
1,88±0,22** |
2,03±0,3** |
2,04 ± 0,33** |
2,1±0,4** |
|
УО2, мл |
0,33±0,05 |
0,78±0,34** |
0,82±0,34** |
0,95±0,39** |
1,14±0,51** |
|
V2, м/сек |
0,29±0,04 |
0,31±0,08 |
0,31±0,12 |
0,33±0,09* |
0,34±0,06* |
П р и м еч а н и е : САД — систолическое АД; ДАД — диастолическое АД; СрАД — среднее АД; R аорты — радиус аорты; УО1 — ударный объем левого желудочка; МО1 — минутный объем левого желудочка; КРК — коэффициент распределения кровотока; Wкин — кинетическая энергия выброса крови из левого желудочка на аорте; PПС — регионарное периферическое сопротивление; ОПС — общее периферическое сопротивление; V1 — скорость движения крови в аорте; R Па — радиус плечевой артерии; УО2 — ударный объем в плечевой артерии; V2 — скорость движения крови в плечевой артерии; * — значимость различий между показателями исследуемой и контрольной групп (* — р<0,05,** — p<0,001); группа А — САД 140–159 мм рт. ст., ДАД 90–99 мм рт. ст.; группа Б — САД 160–179 мм рт. ст., ДАД 100–109 мм рт. ст.; группа В — САД 180–209 мм рт. ст., ДАД 110–119 мм рт. ст.; группа Г — САД>210 мм рт. ст., ДАД>120 мм рт. ст.
Показатели гемодинамики в обследованных группах
Таблица 2
|
Показатель |
Контроль, n=20 |
1-я группа (ОГ), n=26 |
2-я группа (ВГ), n=13 |
3-я группа (ГГ), n=17 |
|
САД, мм рт. ст. |
119,8±5,4 |
185±8,7** |
195±22** |
158,3±6,8* |
|
^ — нд |
# р<0,05 |
& р<0,05 |
||
|
ДАД, мм рт. ст. |
69,5±7,4 |
113,3±4,9** ^ р<0,05 |
125±11** # p<0,001 |
75,8±7,5 & p<0,001 |
|
СрАД, мм рт. ст. |
86,3±6,1 |
132,5±5,1** ^ — нд |
141±11** # p<0,001 |
100,4±5,9** & p<0,001 |
|
Ra, мм |
11,0±0,8 |
13,3±1,1** ^ — нд |
12,8±1,1 # — нд |
12,2±0,6 & — нд |
|
УО1, мл |
78,8±8,6 |
83,1±19,4 ^ — нд |
76,5±13,0 # p<0,001 |
114±16,4** & p<0,001 |
|
Wкин, мДж |
25,4±7,1 |
15,0±6,8** ^ — нд |
15,2±7,0 ** # p<0,001 |
53,1±1,7** & p<0,001 |
|
V1, м/сек |
0,77±0,08 |
0,56±0,09** ^ — нд |
0,59±0,12* # p<0,001 |
0,91±0,13** & p<0,001 |
Окончание табл. 2
|
Показатель |
Контроль, n=20 |
1-я группа (ОГ), n=26 |
2-я группа (ВГ), n=13 |
3-я группа (ГГ), n=17 |
|
R Па, мм |
1,5±0,01 |
2,04±0,33** ^ p<0,001 |
1,3±0,3 # — нд |
1,2±0,2 & p <0,001 |
|
V2, м/сек |
0,29±0,04 |
0,33±0,09* ^ p<0,001 |
0,25±0,08 # р<0,05 |
0,31±0,07 & -нд |
|
КРК |
243±40 |
89±51 ** ^ p<0,001 |
384±81** # p<0,001 |
653±175** & p<0,001 |
|
УО2, мл. |
0,33±0,05 |
0,95±0,39** ^ p<0,001 |
0,20±0,05** # — нд |
0,19±0,05** & p<0,001 |
|
РПС, Мнхс/м5 |
751±204 |
126±105** ^ р<0,05 |
744±564 # р<0,05 |
1660±560** & p<0,001 |
|
ОПС, Мнхс/м5 |
132±22 |
201±49** ^ — нд |
214±39** # p<0,001 |
87,3±12,3* & p<0,001 |
По гемодинамической картине потоков крови в плечевой артерии в сравниваемых группах можно выделить определенные особенности (рис. 1).
При «объемной гипертензии» кинетическая энергия выброса (Wкин) низкая, плечевая артерия дилятирована, через нее осуществляется транспорт большого объема крови. В плечевую артерию поступает 1/89 часть сердечного выброса (КРК=89±51). Регионарное сопротивление в плечевой артерии (РПС) снижено, тогда как общее периферическое сопротивление (ОПС) повышено. Примечательно, что по мере роста АД происходит снижение сопротивления в плечевой артерии (РПС) и увеличение ОПС (см. табл. 1). Течение заболевания в данной группе отличалось стабильностью, а по своим гемодинамическим и клиническим проявлениям соответствует объемному фенотипу гипертензии.
При «гиперкинетической гипертензии» распределение потока крови имело свои характерные особенности. На фоне большой Wкин отмечается резкое ограничение поступления крови в плечевую артерию, сосудистая фракция составляет 1 / 653 часть сердечного выброса (КРК=653±175) (см. рис. 1). ОПС в данной группе был низким, диаметр плечевой артерии уменьшен с повышением РПС. Такой энергозатратный тип гемодинамики соответствует дебюту заболевания, данную группу составили больные молодого
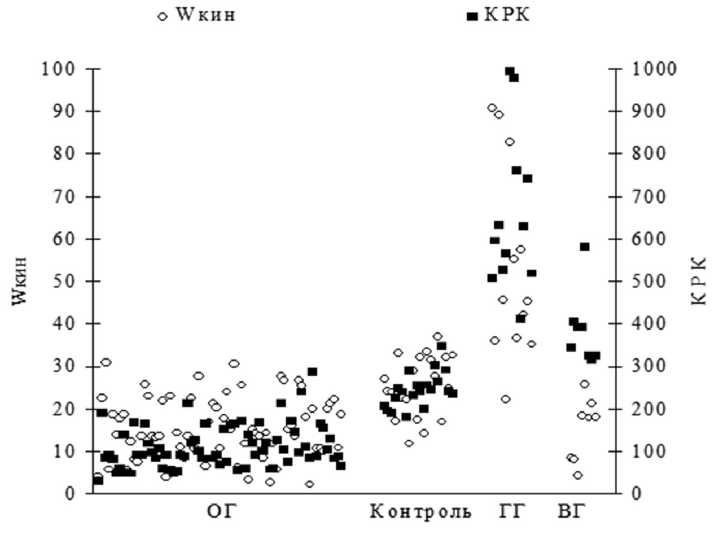
Рис. 1. Соотношение энергии выброса крови из левого желудочка (Wкин) и коэффициента распределения кровотока (КРК) у обследованных больных: ВГ — группа «вазоконстрикторной гипертензии»; ГГ — группа «гиперкинетической гипертензии»; ОГ — группа «объемной гипертензии»; Wкин — кинетическая энергия выброса крови из левого желудочка; КРК — коэффициент распределения кровотока
возраста (средний возраст 24,2±5,7 года) с малым стажем заболевания (4,5±2,7 года).
Группу «вазоконстрикторной гипертензии» составили больные с низкой энергией выброса крови (Wкин) и с ограниченным объемом крови в плечевой артерии. Сосудистая фракция составила 1 / 384 часть сердечного выброса (КРК=384±81). В этой группе отмечено значительное увеличение ОПС, при этом просвет плечевой артерии и скорость движения крови в ней уменьшены, что сопровождалось ограничением объемного кровотока без увеличения РПС. По гемодинамическим показателям присутствуют признаки, свойственные ОГ: снижение Wкин, а также ГГ: малый радиус плечевой артерии, малая сосудистая фракция сердечного выброса. Больные в группе ВГ имели значительный стаж заболевания 13,8±6,1 года) при среднем возрасте 48,7±9,4 года. Для этой группы характерен высокий уровень АД и его вариабельность.
Обсуждение. Показатели энергии считаются фундаментальными при оценке общих закономерностей биологических явлений, в том числе при АГ [4, 5]. Артериальную гипертензию можно рассмотреть в рамках модели потока крови, учитывающей энергию движения крови, обеспеченную сердечным сокращением и создаваемым потоком крови, который адаптируется транспортирующими сосудами, обеспечивая оптимальный массоперенос в разных сосудистых областях. Формирование различных патогенетических фенотипов АГ по изменения соотношений энергии сердечного выброса (Wкин) и перераспределения кровотока (КРК) можно представить в виде схемы, учитывающей эти параметры (рис. 2).
Самый энергозатратный вариант развития АГ приходится на дебют заболевания и соответствует патогенетическому фенотипу ГГ («гиперкинетическая гипертензия»). В рамках рассматриваемой модели объемный кровоток в плечевой артерии сни- жен, с перераспределением потоков крови в другие сосудистые области характерной особенностью, в частности, стресс-индуцированной гипертензии является увеличение мозгового кровотока [6]. Энергозатратный период развития заболевания не может сохраняться длительное время и носит адаптивный характер с последующей нормализацией АД или переходом в менее энергозатратный и стабильный вариант течения АГ. В рамках рассматриваемой модели происходит формирование патогенетического фенотипа ОГ («объемная гипертензия»).
При «объемной гипертензии» происходит снижение кинетической энергии сердечного выброса (Wкин) и снижение сопротивления в транспортирующем сосуде, в данном исследовании в плечевой артерии. Можно выделить несколько ключевых проблем, связанных с формированием данного патогенетического фенотипа.
Проблемы, связанные функцией сердца. При АГ страдает как систола, так и диастола. На первую треть систолы приходится до 95% объема сердечного выброса [7]. Установленное снижение кинетической энергии выброса обусловлено снижением скорости, а не связано с ударным объемом, что следует из показателей, применявшихся для расчета (Wкин). Структурные основы изменения механики миокарда возникают на ранних стадиях АГ, и их связывают с нарушением скорости продольной сократимости из-за дезорганизации Т-канальцев кардиомиоцитов и с нарушением регуляции обмена кальция [8].
Проблемы, связанные с состоянием сосудов. При ОГ снижается периферическое сосудистое сопротивление в плечевой артерии со значительным повышением ударного объем в плечевой артерии (УО2) (см. табл. 2). Изменение состояния транспортирующих сосудов в настоящее время широко обсуждается как проблема сосудистой эластичности и скорости пульсовой волны. Пульсовые волны, фор-
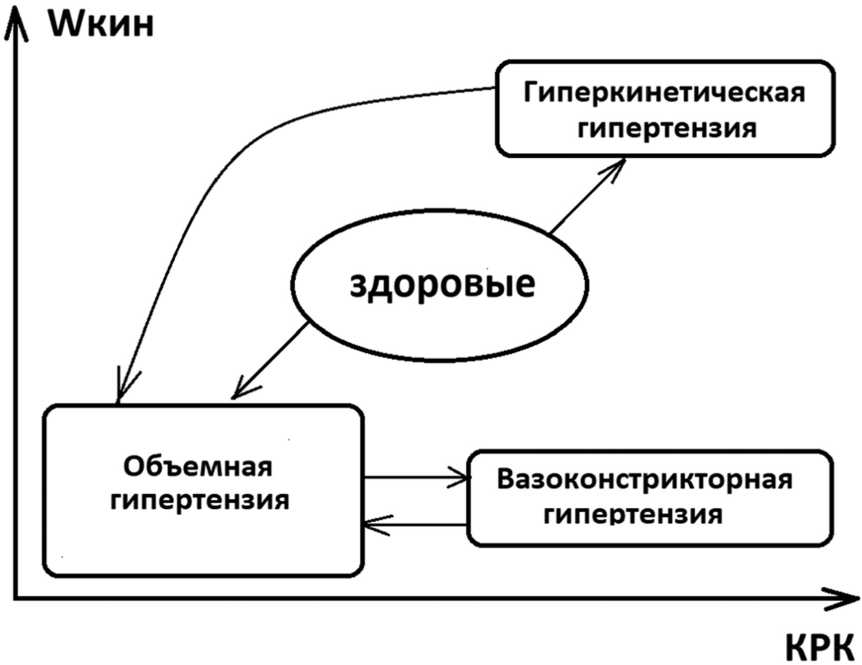
Рис. 2. Схема формирования различных патогенетических вариантов артериальной гипертензии в зависимости от энергии выброса крови из левого желудочка (Wкин) и распределения объема кровотока в плечевой артерии (КРК)
мируемые на аорте, оказывают существенное влияние на систолическую функцию сердца (на вторую и третью фазы систолы) и на формирование диастолической дисфункции, а также на перфузионное давление в коронарных артериях [7]. Скорость пульсовой волны трактуется как интегральный фактор риска и непосредственно повреждающий механизм АГ, особенно у пожилых больных [2, 5].
Проблемы, связанные с микроциркуляторным кровотоком. Увеличение объемного кровотока в де-лятированном сосуде с низким сосудистым сопротивлением предполагает перенос регуляции потока крови на сосуды микроциркуляторного русла. Подтверждением этому служат существующие данные о функциональных и морфологических изменениях в микроциркуляторном русле при АГ. Известен эффект разреживания периферических сосудов (рари-фикация) при АГ с уменьшением количества мелких артериол и капилляров в мышцах, коже, органах-мишенях. При этом уменьшение плотности сосудов не ведет к снижению объемного кровотока, и он может быть даже увеличен, что связывают с активным функционированием артериоло-венулярных анастомозов. Сосуды микроциркуляторного русла рассматриваются как ведущее звено регуляции кровотока через перераспределение потоков крови [9]. Функциональное состояние микроциркуляторного русла весьма вариабельно в зависимости от доминирующего механизма гипертензии и состояния объемного кровотока в приносящем сосуде [10]. Сопряженное вовлечение в патологический процесс крупных сосудов и сосудов микроциркуляторного русла рассматривается как один из универсальных механизмов повреждения, развивающегося при АГ, ишемической болезни сердца, цереброваскулярных заболеваниях и сахарном диабете [5, 9]. Такой механизм перераспределения объемного кровотока с увеличением нагрузки на сосуды микроциркуляторного русла можно охарактеризовать как «периферическое шунтирование». В рассматриваемой гемодинамической модели такого рода «шунтирование» с перераспределением сосудистого сопротивления с плечевой артерии на уровень капиллярного кровотока мышц плеча, очевидно, несет в себе определенные механизмы компенсации и стабилизации гемодинамической нагрузки относительно других сосудистых областей, включая жизненно важные органы мишени, определяющие прогноз течения АГ.
Для больных с «вазоконстрикторной гипертензией» распределение потоков крови имело другой характер. Больные, вошедшие в группу ВГ, имели длительный стаж заболевания и низкую кинетическую энергию выброса, малую скорость движения крови в плечевой артерии, признаки, характерные для больных с ОГ. При этом ударный объем в плечевой артерии был практически в 4 раза ниже по сравнению с этим показателем у больных ОГ и сопоставим со значениями у больных ГГ (см. табл. 2). Полученные данные свидетельствуют о снижении объемной нагрузки на сосуды микроциркуляторного русла мышечной ткани плеча у больных с ВГ и ГГ, в отличие от ОГ, где такая нагрузка возрастает. Соответственно должно происходить перераспределение объемного кровотока на другие сосудистые области, что может увеличить риски повышенной гемодинамической нагрузкой на органы-мишени. Перераспределение потоков крови в такой гемодинамической модели с ограничением поступления крови к мышцам плеча можно охарактеризовать как «центральное шунтирование» со своими особенностями течения АГ.
В случае с ГГ эффект «центрального шунтирования» с высокой энергией выброса, с большим объемом выброса крови из левого желудочка, с высокой скоростью движения крови можно рассматривать как адаптивную гемодинамическую реакцию. Фиксируемое при этом увеличение объемного кровотока в сосудах мозга не несет существенных рисков для больных. Такое состояние гемодинамики энергетически затратно и не продолжительно [11], и в последующем происходит снижение энергии выброса крови с переходом в эукинетический или гипокинетический вариант циркуляции крови, что в рамках рассматриваемой модели соответствует переходу в ОГ.
В случае с ВГ в условиях длительного стажа заболевания, высокого уровня АД, низкой энергии выброса и малого ударного объема происходит перераспределение кровотока, которое меняет характер заболевания. Течение АГ становится нестабильным, с кризовым изменением АД, увеличивается вариабельность давления. Соответственно у больных с таким вариантом течения заболевания увеличивается вероятность осложнений и риск поражения органов-мишеней. Целью лечения таких больных, наряду с контролем цифр АД, должен быть перевод заболевания в более стабильное течение из варианта «центрального шунтирования» в вариант «периферического шунтирования» с перераспределением потока крови в периферический транспортирующий сосуд в мышцах (плечевая артерия), что свойственного патогенетическому фенотипу ОГ. Рассмотренные модели распределения потоков крови в зависимости от состояния кинетической энергии выброса крови из левого желудочка представлены в виде схемы на рис. 2.
Заключение. Полученные результаты дают возможность утверждать, что в процессе развития АГ происходит перераспределение потоков крови с формированием нескольких клинико-патогенетических фенотипов.
Для начала заболевания характерна энергозатратная гемодинамика с перераспределением объемов крови преимущественно в сосуды мозга. Такой клинико-патогенетический фенотип «гиперкинетической гипертензии» несет в себе черты напряженной регуляции. В последующем заболевание переходит в менее энергозатратный клинико-патогенетический фенотип, в «объемную гипертензию».
При ОГ падает кинетическая энергия выброса крови из левого желудочка в связи с уменьшения скоростных показателей систолы, сосудистое сопротивление в транспортирующем сосуде (плечевая артерия) снижается. При этом объемный кровоток в плечевой артерии нарастает, и гемодинамическая нагрузка по регуляции потока крови переносится на сосуды микроциркуляторного русла. Такой клинико-патогенетический фенотип, очевидно, обладает достаточно высокой устойчивостью в условиях снижения энергии движения крови.
Нарушение стабильности течения АГ происходит при перераспределении потока крови из области кровоснабжения мышц (в рассматриваемой модели мышцы плеча) в другие сосудистые области с формированием клинико-патогенетического фенотипа «вазоконстрикторной гипертензии». Такого рода перераспределение кровотока несут клинические признаки декомпенсации с кризовым течением заболевания, с вариабельностью АГ и, соответственно, с высокими рисками повреждения органов-мишеней.
Предложенный подход может быть использован в качестве одной из отправных точек для выбора персонифицированного лечения больных с учетом меняющегося в процессе развития заболевания клинико-патогенетического фенотипа артериальной гипертензии.
Список литературы Распределение потоков крови при формировании разных патогенетических вариантов артериальной гипертензии
- Pires PW, Dams Ramos CM, Matin N, Dorrance AM. The effects of hypertension on the cerebral circulation. Am J Physiol Heart Circ Physiol 2013; 304 (12): H1598‑H1614.
- Murkamilov IT, Aitbaev KA, Fomin VV, et al. Clinical and functional features of arterial stiffness in the elderly. Systemic Hypertension 2021; 18 (1): 31–6. Russian (Муркамилов И. Т., Айтбаев К. А., Фомин В. В. и др. Клинико-функциональные особенности артериальной жесткости у лиц пожилого возраста. Системные гипертензии 2021; 18 (1): 31–6).
- Lukyanov VF, Golovacheva TV, Lukyanova SV. Vascular resistance in hypertension: the ratio of total peripheral and regional vascular resistance. Russian Journal of Cardiology 2001; (3): 20–4. Russian (Лукьянов В. Ф., Головачева Т. В., Лукьянова С. В. Сосудистая резистентность при гипертонической болезни: соотношение общего периферического и регионарного сосудистого сопротивления. Российский кардиологический журнал 2001; (3): 20–4).
- Pirogova GV. The heart as the leading link of the functional system of energy supply of arterial blood flow. Bulletin of the USSR Academy of Medical Sciences 1985; (2): 70–9. Russian (Пирогова Г. В. Сердце как ведущее звено функциональной системы энергообеспечения артериального кровотока. Вестник АМН СССР 1985; (2): 70–9).
- Chirinos JA, Segers P, Hughes T, Townsend R. Largeartery stiffness in health and disease: JACC state-of-the-art review. J Am Coll Cardiol 2019; 74 (9): 1237–63.
- Konradi AO. Hypertension treatment in the young age and in the elderly. Arterial Hypertension 2014; 20 (5): 406–14. Russian (Конради А. О. Молодой и пожилой пациент с артериальной гипертензией: особенности лечения. Артериальная гипертензия 2014; 20 (5): 406–14).
- Chirinos JA, Segers P. Noninvasive evaluation of left ventricular afterload. Part 2: Arterial pressure-flow and pressurevolume relations in humans. Hypertension 2010; 56 (4): 563–70.
- Shah SJ, Aistrup GL, Gupta DK, et al. Ultrastructural and cellular basis for the development of abnormal myocardial mechanics during the transition from hypertension to heart failure. Am J Physiol Heart Circ Physiol 2014; 306 (1): H88‑H100.
- Struijker-Boudier HAJ. Relationship between the macro- and the microcirculation. In: Role of macro- and the microcirculation in target organ damage in diabetes and hypertension. 2009; p. 1–14.
- Vasiliev AP, Streltsova NN. Variability of the microcirculatory picture of the skin in arterial hypertension from the perspective of distributive reactions of blood flow. Regional Blood Circulation and Microcirculation 2016; 15 (2): 32–9. Russian (Васильев А. П., Стрельцова Н. Н. Вариабельность микроциркуляторной картины кожи при артериальной гипертонии с позиции распределительных реакций кровотока. Регионарное кровообращение и микроциркуляция 2016; 15 (2): 32–9).
- Suchkov VV, Shdain VA, Sizov AD. Peculiarities of changes in systemic and regional blood circulation in the initial stages of arterial hypertension from the point of view of hemodynamic and energy coupling. In: Arterial hypertension. M., 1980; p. 110–23. Russian (Сучков В. В., Шдаин В. А., Сизов А. Д. Особенности изменения системного и регионарного кровообращения в начальных стадиях артериальной гипертензии с точки зрения гемодинамического и энергетического сопряжения. В кн.: Артериальные гипертензии. М., 1980; с. 110–23).


