Расширение возможностей противоопухолевого лечения при проведении направленной антимикробной терапии. Описание случая
Автор: Григорьевская З.В., Матвеев В.Б., Сергеев Д.А., Терещенко И.В., Винникова В.Д., Вершинская В.А., Петухова И.Н., Багирова Н.С., Дмитриева Н.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.20, 2021 года.
Бесплатный доступ
Актуальность. Рак полового члена является редкой онкологической патологией. Стандартизированный показатель заболеваемости в России равен 0,82 случая на 100 тыс. мужского населения. В среднем у 58 % больных (20–96 %) раком полового члена имеются распад опухоли, эрозии, изъязвления опухолевого узла, воспалительные изменения регионарных лимфоузлов и т. д. с присоединением вторичной инфекции. При нахождении больного в стационаре возможно инфицирование язвенных поражений госпитальными патогенами. Цель исследования – представить результаты лечения опухолевой язвы у больного раком полового члена, инфицированной мультирезистентными штаммами Acinetobacter baumannii и Klebsiella pneumoniae. Материал и методы. Дано описание случая лечения пациента 54 лет с диагнозом: рак полового члена pt4N3m0 с распадом и изъязвлением опухоли в области корня полового члена и метастатических лимфоузлов в левой паховой области и их инфицированием мультирезистентными госпитальными микроорганизмами. Результаты. Пациент получил 6 курсов полихимиотерапии паклитакселом, ифосфамидом и цисплатином c клиническим эффектом в виде значительного уменьшения размеров опухоли и iii степени лечебного патоморфоза. Была выполнена пахово-подвздошная лимфаденэктомия слева, после которой через несколько месяцев был отмечен продолженный рост опухоли. В процессе 2-й линии полихимиотерапии цисплатином, доцетакселом и капецитабином у больного отмечалась нейтропения iii–iV степени, фебрильная нейтропения. На фоне высокой лихорадки было выявлено инфицирование язвенных дефектов мультирезистентными госпитальными микроорганизмами. Проводилась комбинированная антибиотикотерапия с временным эффектом. После выделения из раны мультирезистентной K. pneumoniae, резистентной в том числе к карбапенемам, пациенту был назначен цефтазидим/авибактам 2,5 г 3 раза в сут. На фоне лечения отмечался клинический эффект в виде нормализации температуры и значительного уменьшения зон изъязвления опухолей. Заключение. Проведение направленной антибактериальной терапии инфицированной опухолевой язвы на основе данных микробиологических исследований позволило значительно уменьшить проявления инфекционного процесса и продолжить проведение лекарственной противоопухолевой терапии, а также в дальнейшем выполнить оперативное вмешательство.
Рак полового члена, Acinetobacter baumanni, Klebsiella pneumoniae, мультирезистентный штамм, карбапенем-резистентный штамм, цефтазидим/авибактам, нозокомиальные инфекции, антибактериальная терапия
Короткий адрес: https://sciup.org/140254546
IDR: 140254546 | УДК: 616.66-006.6:615.28 | DOI: 10.21294/1814-4861-2021-20-4-160-165
Текст научной статьи Расширение возможностей противоопухолевого лечения при проведении направленной антимикробной терапии. Описание случая
Рак полового члена (РПЧ) относится к редким злокачественным опухолям. Заболеваемость в странах Европы и США составляет менее 1,0 на 100 000 мужчин, но зависит от региона [1–3]. В отличие от западных стран, в Южной Америке, Юго-Восточной Азии и странах Африки заболеваемость РПЧ намного выше и может составлять до 1–2 % от всех злокачественных новообразований у мужчин [3]. В России в среднем регистрируется 554–580 случаев РПЧ в год, стандартизированный показатель заболеваемости в России равен 0,82 случая на 100 тыс. мужского населения [4].
Первичная опухоль чаще всего локализуется на головке полового члена (85 %). Локализация на крайней плоти встречается в 15 % случаев, на головке и крайней плоти – в 9 % случаев, в области венечной борозды – в 6 %, на теле полового члена – менее чем в 2 %. В 17–45 % случаев выявляется метастатическое поражение регионарных лимфатических узлов. В среднем у 58 % больных (20–96 %) раком полового члена имеется местный инфекционный процесс: распад опухоли, наличие эрозий, изъязвлений опухолевого узла, воспалительные изменения регионарных лимфоузлов и т.д. [5–10]. Часто при распаде опухоли присоединяется вторичная инфекция, а при нахождении больного в стационаре возможно инфицирование нозокомиальными (госпитальными) патогенами, которые, как правило, резистентны к большинству антибиотиков [11–13].
Представляем клиническое наблюдение, в котором этиотропная антибактериальная терапия инфицированной опухолевой язвы на основе данных микробиологических исследований позволила продолжить плановое противоопухолевое лечение.
Клинический случай
Пациент З., 54 лет, с ноября 2016 г. наблюдается в НМИЦ онкологии им. Н.Н. Блохина МЗ РФ с диагнозом: Рак полового члена pT4N3M0. На момент первичного осмотра опухоль локализовалась в области корня полового члена, имелась опухолевая язва в области лобка до 5 см в диаметре и таких же размеров изъязвление в левой паховой области.
В качестве первого этапа лечения с ноября 2016 г. по май 2017 г. проведено 6 курсов химиотерапии по программе: Паклитаксел 175 мг/м2 – в 1 день + Ифосфамид 1,2 г – в 1–3 дни + Цисплатин 25 мг/м2 – в 1–3 дни. Был отмечен выраженный положительный эффект в виде рубцевания описанных раневых дефектов. При УЗИ-контроле в левой паховой области лимфоузлы не визуализируются, на внутренней поверхности гребня левой подвздошной кости определяется лимфоузел 4,5×2,0 см (метастаз). В правой паховой области имеется несколько лимфоузлов до 2,0×1,0 см с ги-поэхогенным ободком, вероятно, реактивное воспаление. Забрюшинные и подвздошные лимфоузлы не определяются.
В мае 2017 г. выполнена пахово-подвздошная лимфаденэктомия слева. При гистологическом исследовании операционного материала в 3 лимфоузлах – метастазы высокодифференцированного плоскоклеточного ороговевающего рака с пато-морфозом III степени и кальцификатами.
После заживления послеоперационной раны планировалась лучевая терапия на паховую и подвздошную область слева, однако пациент уехал домой для долечивания после операции и в течение нескольких месяцев наблюдался районным онкологом. Со слов пациента в июле 2017 г. в проекции паховой складки слева на границе с послеоперационным рубцом вновь сформировался язвенный дефект размерами до 1,0×1,0 см, что ретроспективно было расценено как продолженный рост опухоли.
По данным контрольного МРТ органов малого таза с внутривенным контрастированием (17.08.17) в правом пещеристом теле и в области основания полового члена выявлен опухолевый узел размером 3,5×2,5 см. В лобковой области – множественные внутрикожные и подкожные опухолевые узлы размерами 1–2 см, максимально до 2,5 см. В левой паховой области, в зоне оперативного вмешательства определялся дефект мягких тканей по типу «кратера» с неравномерно утолщенными до 1,5–2,0 см стенками – послеоперационные грануляции. По периферии определялись узловые образования, накапливающие контраст, размерами от 0,7 см до 1,2 см. В правой паховой области – единичные лимфоузлы 0,7–1,0 см.
Пациент повторно обратился в НМИЦ онкологии им. Н.Н. Блохина лишь в сентябре 2017 г. К этому моменту отмечалось увеличение размеров раневого дефекта в проекции левой паховой складки до 6,5×5,0 см и формирование язвенного дефекта в проекции мягких тканей лобковой области справа размерами около 2,0×3,0 см (рис. 1).
Пациент повторно консультирован химиотерапевтом, рекомендовано 6 курсов 2-й линии химиотерапии по схеме: Цисплатин 75 мг/м2 в/в капельно – в 1 день, Доцетаксел 75 мг/м2 в/в капельно – в 1 день, Капецитабин 1700 мг/м2 в день
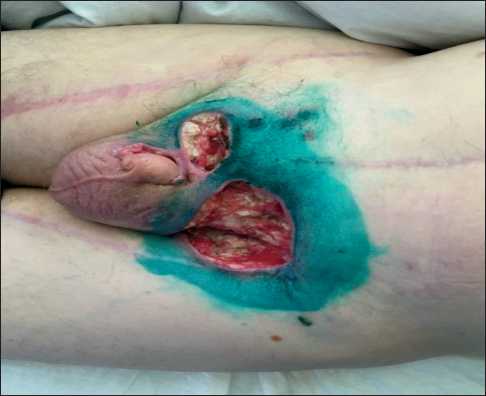
Рис. 1. Опухолевые язвы в мягких тканях левой паховой области 6,5×5,0 см и лобковой области 2,0×3,0 см
Fig. 1. Ulcerative defect in the projection of the soft tissues of the groin area 6.5×5.0 cm и pubic region 2.0×3.0 cm внутрь в 1–14 дни. Интервал между курсами 21 день, начиная с 1 дня курса химиотерапии. Оценка эффекта каждые 2 курса.
Учитывая наличие обширных язвенных дефектов с подозрением на их инфицирование и умеренного лейкоцитоза (12,5×109/л), больному эмпирически была начата антибактериальная терапия левофлоксацином в дозе 500 мг 1 раз в сут. Эффекта не отмечено. На 3-и сут 1-го курса химиотерапии у пациента отмечено повышение температуры тела до 38,5–41,0 °С. Произведена смена антибактериальной терапии: эмпирически начато введение цефоперазона/сульбактама в дозе 4 г 2 раза в сут. Отмечался кратковременный эффект в виде нормализации температуры в течение нескольких суток, затем вновь появилась гипертермия.
По данным микробиологического исследования материала с язвенных поверхностей был выделен мультирезистентный штамм Acinetobacter bau-mannii (рис. 2), чувствительный к гентамицину, тобрамицину, триметоприму-сульфаметоксазолу (бисептолу). Микроорганизм был нечувствителен к карбапенемам, что, вероятнее всего, было связано с выработкой ферментов карбапенемаз.
Больной был обсужден на консилиуме, включавшем онкологов и клинических микробиологов, и было решено начать проведение комбинированного режима антибактериальной терапии: меропе-нем 6 г/сут (3-часовые инфузии) + тигециклин 100 мг/сут. На фоне проведения комбинированной антибактериальной терапии через 3 сут температура тела нормализовалась, однако в последующем, учитывая развитие нейтропении III–IV степени, курс антибиотикотерапии был продолжен еще в течение 10 дней. Купирование проявлений инфекции позволило онкологам продолжить проведение 2-й линии химиотерапии в том же режиме.
Отд: 04.21.00.00. Отделение урологическое
1. Acinetobacter baumannii »> Обильный рост
|
№ |
Наименование |
4 |
№ |
Наименование |
4 |
|
1 |
Amikacin |
R |
9 |
Imipenem |
R |
|
2 |
Amp/Sulbactam |
R |
10 |
Levofloxacin |
R |
|
3 |
Cefepime |
R |
11 |
Meropenem |
R |
|
4 |
Cefotaxime |
R |
12 |
Piperacillin |
R |
|
5 |
Ceftazidime |
R |
13 |
Tetracycline |
S |
|
6 |
Ceftriaxone |
R |
14 |
Tlcar/K Clav |
R |
|
7 |
Ciprofloxacin |
R |
15 |
Tobramycin |
S |
|
8 |
Gentamicin |
S |
16 |
Trimeth/Sulfa |
S |
Рис. 2. Результаты определения чувствительности Acinetobacter baumannii к антибиотикам Fig. 2. Data of sensitivity to Acinetobacter baumannii
После 4 курсов химиотерапии размер язвенного дефекта в левой паховой области сократился до 3,5×2,5 см (рис. 3). Язва на лобке зарубцевалась. Проведение последующих 5-го и 6-го курсов ПХТ также осложнялось нейтропенией III–IV степени, в связи с чем проводились курсы антибактериальной терапии, включавшие карбапенемы, и применялись Г-КСФ. Вновь отмечался постепенный рост размеров опухолевой язвы в паховой области слева и появление гнойного отделяемого.
В посеве из раны наряду с мультирезистент-ным Acinetobacter baumannii (скудный рост) стала высеваться мультирезистентная Klebsiella pneumoniae, резистентная к карбапенемам и большинству тестируемых антибиотиков и чувствительная только к гентамицину и тобрамицину. По современной классификации она может быть отнесена к экстремально-резистентным (англ. – extreme-drug-resistant, XDR). Пациенту был назначен цефтазидим/авибактам в дозе 2,5 г 3 раза в сутки в/в капельно.
Через 10 дней был произведен контрольный забор отделяемого из области язвенного дефекта. Роста микрофлоры не получено. Отмечалось значительное очищение раны и ее сокращение до 3,0×2,0 см Полученный клинический и бактериологический эффект сделал возможным последующие оперативное вмешательство в объеме экстирпа-
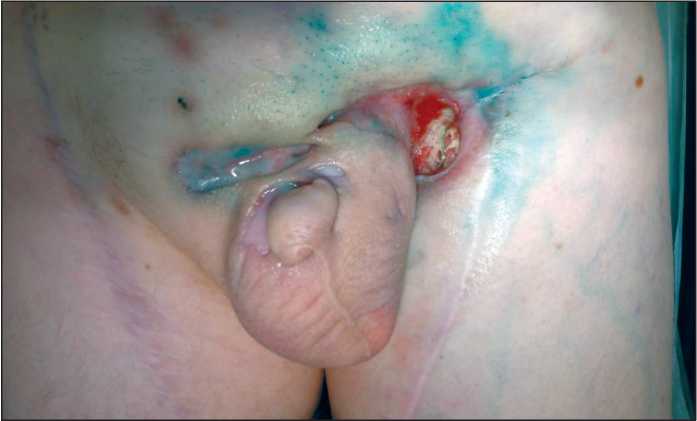
Рис. 3. Опухолевая язва в мягких тканях левой паховой области после курса этиотропной антибактериальной терапии и последующей противоопухолевой химиотерапии (3,5×2,5 см) Fig. 3. Ulcerative defect in the projection of the soft tissues of the groin area (3.5×2.5 cm)
ции полового члена, промежностной уретросто-мии, паховой лимфаденэктомии слева, которое выполнено в мае 2018 г.
Представленное клиническое наблюдение раскрывает возможности антибактериальной терапии с использованием современных, тщательно подобранных согласно выделенной микрофлоре, антибиотиков в качестве сопроводительной терапии у больных с инфицированными опухолями различных локализаций, включая рак полового члена.
В данном случае у пациента последовательно были выделены мультирезистентные нозокомиальные микроорганизмы – Acinetobacter baumannii и Klebsiella pneumoniae . На момент исследования в лаборатории не проводилось исследование механизмов резистентности к карбапенемам и определения видов карбапенемаз. В связи с этим для лечения карбапенем-резистентных штаммов использовалась эмпирическая терапия согласно принятым в стране и в мире рекомендациям.
Терапия Acinetobacter baumannii c использованием комбинации тигециклина и высоких доз и продолженных инфузий карбапенемов в настоящее время является одним из общепринятых подходов к лечению инфекций, вызванных данным микроорганизмом. Известно, что включение в комбинацию карбапенемов, даже если к ним имеется умеренная устойчивость, способствует лучшей эффективности лечения, чем монотерапия тигециклином. Кроме того, наличие глубокой нейтропении и фебрильной нейтропении требовало антимикробной терапии с включением карбапенемов. Полимиксин В, используемый для лечения инфекций, вызванных мультирезистентным ацинетобактером, не применялся в виду его отсутствия в клинике.
Смена возбудителя с выделением из области изъязвления еще одного мультирезистентного нозокомиального микроорганизма – Klebsiella pneumoniae (XDR) – способствовала применению нового ингибитор-защищенного цефалоспорина Цефта-зидима/авибактама, который является препаратом выбора для лечения карбапенем-резистентных энтеробактерий, в том числе K. pneumoniae. Цефтазидим/ авибактам использовался в монотерапии в стандартном режиме и способствовал быстрому очищению инфицированной опухолевой язвы и уменьшению ее размеров, таким образом, показав клиническую и микробиологическую эффективность.
Проведение рациональной антибактериальной терапии, основанной на данных микробиологи- ческих исследований, позволило значительно уменьшить проявления инфекционного процесса у больного и в полном объеме осуществить противоопухолевую терапию.
Список литературы Расширение возможностей противоопухолевого лечения при проведении направленной антимикробной терапии. Описание случая
- Robinson R., Marconi L., MacPepple E., Hakenberg O.W., Watkin N., Yuan Y., Lam T., MacLennan S., Adewuyi T.E., Coscione A., Minhas S.S., Compérat E.M., Necchi A. Risks and Benefits of Adjuvant Radiotherapy After Inguinal Lymphadenectomy in Node-positive Penile Cancer: A Systematic Review by the European Association of Urology Penile Cancer Guidelines Panel. Eur Urol. 2018 Jul; 74(1): 76-83. https://doi.org/10.1016/j.eururo.2018.04.003.
- Backes D.M., Kurman R.J., Pimenta J.M., Smith J.S. Systematic review of human papillomavirus prevalence in invasive penile cancer. Cancer Causes Control. 2009 May; 20(4): 449-57. https://doi.org/10.1007/s10552-008-9276-9.
- Chaux A., Netto G.J., Rodríguez I.M., Barreto J.E., Oertell J., Ocampos S., Boggino H., Codas R., Xavier Bosch F., de Sanjose S., Muñoz N., Hildesheim A., Cubilla A.L. Epidemiologic profile, sexual history, pathologic features, and human papillomavirus status of 103 patients with penile carcinoma. World J Urol. 2013 Aug; 31(4): 861-7. https://doi.org/10.1007/s00345-011-0802-0.
- Kaprin A.D., Starinskii V.V., Petrova G.V. Zlokachestvennye novoobrazovaniya v Rossii v 2014 g. (zabolevaemost' i smertnost'). M., 2016. 208 c.
- d'Ancona C.A., de Lucena R.G., Querne F.A., Martins M.H., Denardi F., Netto N.R.Jr. Long-term followup of penile carcinoma treated with penectomy and bilateral modified inguinal lymphadenectomy. J Urol. 2004 Aug; 172(2): 498-501; discussion 501. https://doi.org/10.1097/01.ju.0000132239.28989.e1.
- Ornellas A.A., Seixas A.L., Marota A., Wisnescky A., Campos F., de Moraes J.R. Surgical treatment of invasive squamous cell carcinoma of the penis: retrospective analysis of 350 cases. J Urol. 1994 May; 151(5): 1244-9. https://doi.org/10.1016/s0022-5347(17)35222-9.
- Ravi R. Correlation between the extent of nodal involvement and survival following groin dissection for carcinoma of the penis. Br J Urol. 1993 Nov; 72(5 Pt 2): 817-9. https://doi.org/10.1111/j.1464-410x.1993.tb16273.x.
- Solsona E., Algaba F., Horenblas S., Pizzocaro G., Windahl T.; European Association of Urology. EAU Guidelines on Penile Cancer. Eur Urol. 2004 Jul; 46(1): 1-8. https://doi.org/10.1016/j.eururo.2004.03.007.
- Stancik I., Holtl W. Penile cancer: A review of the recent literature. Curr Opin Urol. 2003; 13(6): 467-72.
- The European Association of Urology (EAU). Guidelines Methodology. 2008; r. 58-69.
- Grigor'evskaya Z.V., Petukhova I.N., D'yakova S.A., Dmitrieva N.V. Epidemiologiya vnutribol'nichnykh infektsii v onkologicheskom statsionare, vyzvannykh vysokorezistentnymi (XDR) shtammami A. baumannii. Sibirskii onkologicheskii zhurnal. 2016; 15(3): 62-66. https://doi.org/10.21294/1814-4861-2016-15-3-62-66.
- Grigor'evskaya Z.V., Petukhova I.N., Bagirova N.S., Shil'nikova I.I., Tereshchenko I.V., Grigor'evskii E.D., Dmitrieva N.V. Nozokomial'nye infektsii u onkologicheskikh bol'nykh: problema narastayushchei rezistentnosti gramotritsatel'nykh mikroorganizmov. Sibirskii onkologicheskii zhurnal. 2017; 16(1): 91-97. https://doi.org/10.21294/1814-4861-2017-16-1-91-97.
- Grigor'evskaya Z.V. Aktual'nost' problemy gospital'nykh infektsii v onkologicheskoi klinike. Vestnik RONTs im. N.N. Blokhina RAMN. 2013; 24(3-4): 46-49.


