Растворимые соединения алюминия и нанокомпозитные материалы на их основе. Часть II
Автор: Кудрявцев П.Г., Кудрявцев Н.П., Фиговский О.Л.
Журнал: Нанотехнологии в строительстве: научный интернет-журнал @nanobuild
Рубрика: Зарубежный опыт
Статья в выпуске: 2 т.10, 2018 года.
Бесплатный доступ
Настоящая статья посвящена применению растворимых соединений алюминия для получения нанокомпозитных материалов. Проведен анализ состояния ионов алюминия Al3+ в водных растворах. Простые соединения алюминия являются прекурсорами по всех процессах получения нанокомпозиционных материалов на основе оксидов алюминия. Состояние ионов Al3+ в водных растворах определяет механизм и структуру получаемых нанокомпозитов. Проведен анализ фазовых превращений в системах солей алюминия, гидратированных оксидов и оксидов. На основе этих данных определены основные режимы получения конечных материалов. Сделан анализ различных методов получения коллоидных растворов гидратированных оксидов алюминия как основного прекурсора при получении нанокомпозиционных материалов на основе оксидов алюминия. В качестве таких методов изучены процессы получения алюмозоля методом осаждения–пептизации. Также для синтеза алюмозолей рассмотрены методы ионного обмена и контролируемого гидролиза соединений алюминия. Для получения смешанных оксидных материалов в системе SiO2–Al2O3 проведен анализ процессов взаимодействия кремне- и алюмозолей. Изучена возможность применения метода «гомогенное осаждение гидратированного оксида алюминия» для получения нанокомпозитов на основе оксида алюминия.
Алюмозоль, аквакомплексы алюминия, гидроксоком-плексы алюминия, алкоксиды алюминия, гидролиз соединений алюминия, гидратированные оксиды алюминия, бемит, псевдобемит, гидраргиллит, алюмо-кремнезоль, гомогенное осаждение
Короткий адрес: https://sciup.org/142211924
IDR: 142211924 | УДК: 69.001.5+ 696.1 | DOI: 10.15828/2075-8545-2018-10-2-63-85
Текст научной статьи Растворимые соединения алюминия и нанокомпозитные материалы на их основе. Часть II
org/dc/terms/" href="" property="dct:title" rel="dct:type">The soluble aluminum compounds and nanocomposite materials based on them. Part II. is licensed under a org/licenses/by/4.0/">Creative Commons Attribution 4.0 International License.
Based on a work at
Настоящая статья посвящена применению растворимых соединений алюминия для получения нанокомпозитных материалов. Проведен анализ состояния ионов алюминия Al3+ в водных растворах. Простые соединения алюминия являются прекурсорами по всех процессах получения нанокомпо-зиционных материалов на основе оксидов алюминия. Состояние ионов Al3+ в водных растворах определяет механизм и структуру получаемых нанокомпозитов. Проведен анализ фазовых превращений в системах солей алюминия, гидратированных оксидов и оксидов. На основе этих данных определены основные режимы получения конечных материалов. Сделан анализ различных методов получения коллоидных растворов гидратированных оксидов алюминия как основного прекурсора при получении нанокомпозиционных материалов на основе оксидов алюминия. В качестве таких методов изучены
М ашиночитаемая информация о CC- лицензии в метаданных статьи (HTML- код ):
Произведение «Растворимые соединения алюминия и нанокомпозитные материалы на их основе. Часть II » созданное автором по имени Кудрявцев П.Г., Кудрявцев Н.П., Фиговский О.Л. , публикуется на условиях ...
3. Получение алюмозоля методом осаждения–пептизации
В дальнейших исследованиях в качестве связующего для формования композиционных материалов предполагается использовать золи более тугоплавких оксидов металлов, таких, как оксид алюминия.
Пептизация – расщепление агрегатов, возникших при коагуляции дисперсных систем, на первичные частицы под действием жидкой среды (например, воды) или специальных веществ – пептизаторов. Пеп-
МЕЖДУНАРОДНЫЙ ОПЫТ тизация – один из способов получения коллоидных растворов, применяется в технике при получении высокодисперсных суспензий глин и других веществ.
Пептизация, самопроизвольный распад агрегатов (комочков, хлопьев, сгустков), образованных скоплением слипшихся коллоидных частиц на агрегаты меньших размеров или отдельные первичные частицы. Особенно наглядно выглядит пептизация студенистых осадков (коаге-лей), возникающих вследствие коагуляции золей и высокодисперсных суспензий. Пептизация – это обратный коагуляции процесс, а оба этих процесса, строго говоря, обратимы. При пептизации происходит «коллоидное растворение» осадка – из коагулята вновь образуется золь. Термин «пептизация» произошел от внешнего сходства этого явления с растворением белков, расщепленных ферментом пепсином. Пептизацию можно наблюдать при повышении температуры и при удалении коагулирующих реагентов промыванием осадка. Наиболее характерна пептизация при введении в дисперсионную среду пептизаторов – веществ, способствующих дезагрегированию, то есть разъединению слипшихся частиц. Пептизаторами могут быть электролиты и поверхностно-активные вещества, вызывающие лиофилизацию поверхности частиц дисперсной фазы. Так, пептизация геля гидроокиси железа в водной среде возможна при добавлении небольших количеств хлорного железа, а каолин пептизируется гуминовыми кислотами. Перемешивание обычно ускоряет пептизацию. Процессы рекристаллизации и коалесценции, которые часто протекают в коллоидных осадках при старении, препятствуют пептизации, так как приводят к сращиванию частиц. Затруднена также пептизация осадков, выпавших при коагуляции золей поливалентными ионами и полиэлектролитами. Пептизацию используют для получения жидких дисперсных систем из порошков или паст в химической и пищевой технологии.
Большинство из практически нерастворимых в воде осадков переходят в коллоидные растворы при воздействии на них некоторых веществ. Это старый классический метод получения коллоидных растворов, который был впервые разработан биохимиками для белков. Они назвали его пептизацией, а прибавляемое вещество – пептизатором. В отличие от других методов получения коллоидных растворов, при пептизации не происходит изменение степени дисперсности частиц, при этом процессе наблюдается только их разрыхление.

МЕЖДУНАРОДНЫЙ ОПЫТ
В процессе пептизации происходит удаление коагулирующих ионов из осадка, или молекула пептизатора адсорбируется коллоидными частицами осадка. Это ведет к образованию двойных электрических слоев или сольватных оболочек вокруг коллоидных частиц, что, в свою очередь, приводит к подавлению сил сцепления между частицами. Затем частицы равномерно распределяются во всем объеме жидкости. Таким образом, пептизация является процессом, обратным коагуляции.
Пептизация протекает при достаточном количестве пептизатора, причем в начальный период быстро, затем замедляется. Скорость пептизации возрастает при перемешивании, так как при этом ускоряется проникновение пептизатора внутрь агрегатов. Повышение температуры также ускоряет пептизацию.
При пептизации наблюдается зависимость между количеством пептизированного вещества, взятого осадка и пептизатора. Эта закономерность, называемая правилом осадка, заключается в том, что при постоянном содержании пептизатора с возрастанием количества, взятого для пептизации осадка, количество осадка, перешедшего в раствор, сначала увеличивается, а затем уменьшается.
Объяснение правила осадка заключается в следующем. Для пептизации одной части осадка требуется некоторое минимальное количество пептизатора. При введении первых порций осадка в системе пептизато-ра много, а осадка мало, и он легко переходит в золь. При дальнейшем добавлении осадка на одну его часть приходится все меньше пептизато-ра, и коллоидное растворение замедляется. Когда количество пептизируемого вещества в системе превысит критическую величину, осадок не только перестает растворяться, но даже повторно выпадает уже растворившийся осадок. Это связано с недостаточным количеством пептиза-тора для того, чтобы все частицы осадка находились в растворе.
Различают следующие виды пептизации: пептизация промыванием осадка; пептизация осадка электролитом; пептизация поверхностно-активными веществами; химическая пептизация.
Пептизация промыванием осадка сводится к удалению из него электролита, вызвавшего коагуляцию. В результате этого оставшийся двойной электрический слой расширяется, силы отталкивания начинают преобладать над силами притяжения. Это приводит к отделению мицелл друг от друга. Под действием броуновского движения мицеллы равномерно распределяются в дисперсионной среде, таким обра-
МЕЖДУНАРОДНЫЙ ОПЫТ зом вновь получается коллоидный раствор. При этом в систему нет необходимости вводить пептизатор, так как стабилизатор присутствует в осадке, и промывание лишь увеличивает его активность. Этот вид пептизации хорошо известен в аналитической химии. Например, при промывании полученного осадка водой он начинает проходить через фильтр, это указывает на увеличение его дисперсности и образование гидрозоля. Увеличение заряда и радиуса иона коагулянта затрудняет коагуляцию промывкой, так как такие ионы прочнее удерживаются осадком и тем самым затрудняют пептизацию.
Пептизация электролитами наблюдается при введении в осадок электролита, один из ионов которого может встраиваться в кристаллическую решетку дисперсной фазы или адсорбироваться на ее поверхности. Предварительная промывка осадка чистым растворителем способствует реализации такого варианта пептизации.
Примером пептизации с помощью электролита является метод получения золя оксида алюминия. Он заключаются в предварительном осаждении гидроксида алюминия из раствора его соли аммиаком с последующим введением в свежеполученный и промытый водой осадок гидроксида алюминия, раствора пептизатора, которым может являться раствор кислоты или соли алюминия. Исходными веществами могут служить нитраты и хлориды алюминия, в качестве осадителя обычно используют растворы аммиака или едкого натра. Предпочтительным является получение гидроксида алюминия в форме псевдобемита (плохо окристаллизованного бемита), так как установлено, что он легко растворяется кислотой. Такие условия, как pH и температура, оказывают существенное влияние на структуру осадка, на скорость гидролиза основных солей алюминия, тем самым на степень загрязненности осадка основными солями. Свежие осадки гидроксида алюминия нестабильны, с течением времени в них протекают процессы, называемые «старением» осадка, которые особенно ускоряются при повышенной температуре. Эти процессы определяют химический состав и пористую структуру образующихся осадков гидроксида алюминия. Для отделения осадка от жидкой фазы и отмывки растворимых солей применяется фильтрование. Отмывку осадка от растворимых солей производят горячей водой, отсутствие следов аммиака в фильтрате определяют по фенолфталеину.
Полученный продукт сушат, измельчают до порошкообразного состояния. Для получения алюмозоля порошкообразный псевдобемит
МЕЖДУНАРОДНЫЙ ОПЫТ растворяют в кислоте при соотношении Al/An, равном (15^6):1. Порошок добавляется в горячую и хорошо перемешиваемую кислоту.
Золи оксида алюминия также получали путем осаждения аммиаком из растворов неорганических солей. В качестве пептизаторов использовали соли алюминия или кислоты, гелеобразование происходило при комнатной температуре или нагревании [73].
Золь оксида алюминия может быть также получен из водорастворимых солей алюминия с применением метода ионного обмена. В качестве ионообменника используют среднеосновный анионообменник «Вофа-тит». Данный метод синтеза может быть реализован как в статическом, так и в динамическом варианте. К недостаткам ионообменного способа получения золя гидроксида алюминия следует отнести длительность процесса, большие объемы регенерационных вод, малые концентрации получаемого золя (менее 1%) [74,75].
Существует способ получения гидрозоля оксида алюминия путем выпаривания раствора, получаемого при взаимодействии оксида алюминия и металлического алюминия в соляной кислоте. Концентрация соляной кислоты в этом процессе поддерживается в диапазоне 10 ^ 30%. Алюминий добавляется для получения золей 10 ^ 15% концентрации, отношений Al/Cl от 0,6 до 2,0, температура выпаривания 70 ^ 105оС, время 6 ^ 10 час . В этом процессе используется повышенное давление. Недостатками данного способа являются сложность аппаратурного оформления, большое содержание анионов, в связи с чем получаемые золи имеют невысокую устойчивость [76].
Большинство способов получения гидрозоля гидроксида алюминия включают в себя приготовление геля гидроксида алюминия из водорастворимых солей алюминия. По одному из способов, старение полученного геля ведут после отмывки от маточного раствора при нагревании до 60 ^ 100оС. С целью упрощения процесса осадок гидроксида алюминия переводят в гидрозоль с использованием ультразвукового диспергирования при интенсивности излучении 2 ^ 25 Вт/см2 в течение 10 ^ 80 минут [77]. Однако в описываемом процессе получается байерит, который обладает очень низкой растворимостью, и, соответственно, не удается достичь высокой концентрации получаемых золей. Этот факт был подтвержден нашими экспериментами, однако в описании этого изобретения ничего не говорится об этом его недостатке.
МЕЖДУНАРОДНЫЙ ОПЫТ
Также в патенте [78] описан способ получения алюмозоля, который заключается в пептизации свежеосажденного гидроксида алюминия (бемита) при длительном кипячении. Мольное отношение гидроксида и кислоты составляет 10 ^ 30. При этом для повышения устойчивости гидрозоля гидроксида алюминия перед пептизацией гидроксида алюминия осуществляется его предварительное длительное кипячение в дистиллированной воде. Мольное отношение воды к гидроксиду алюминия поддерживается на уровне 100 ^ 1000. В результате такой обработки он переходит в форму псевдобемита. Недостатками этого способа является невысокая устойчивость золя и низкая концентрация получаемого продукта.
Целью работ по получению гидрозолей алюминия является повышение их устойчивости. Поставленная цель может быть достигнута введением стабилизирующих добавок. Разработанный нами способ получения гидрозоля гидроксида алюминия включает нейтрализацию солей алюминия раствором аммиака, отмывку водой свежеосажденно-го бемита от солей, его сушку и последующую пептизацию в растворах сильных одноосновных кислот. При пептизации в реакционную смесь добавляется диуретанэпоксид (ДУЭ) при молярном соотношении ДУЭ/ Аl2O3 от 0,01 до 0,1 [73]. В качестве диуретанэпоксида используется соединение следующего строения:
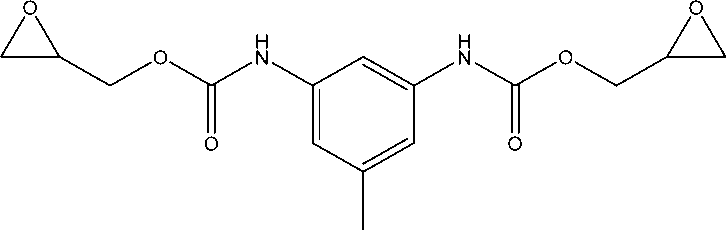
bis(oxiran-2-ylmethyl) (5-methyl-1,3-phenylene)dicarbamate
Это соединение представляет собой продукт взаимодействия 2,4-то-луилендиизоцианата (ТДИ) с глицидолом (oxiran-2-ylmethanol). Для получения таких соединений возможно использование и других подобных диизоцианатов.
В качестве примера конкретного выполнения синтеза можно привести следующую методику. 100 г АlСl3•6H2O растворяют в 100 cм3

МЕЖДУНАРОДНЫЙ ОПЫТ горячей дистиллированной воды. К полученному раствору приливают 160 см3 концентрированного раствора аммиака при перемешивании. Смешивать реагенты необходимо быстро. Получаемая суспензия должна иметь рН ~ 9. Затем после добавления к суспензии – 200 см3 горячей дистиллированной воды. Для фильтрования полученный осадок переносят на воронку Бюхнера при включенном вакуумном насосе. Отмывка осадка от растворимых солей производится горячей водой в количестве 6:8 литров. Отмытая и отжатая гидроокись алюминия сушится в сушильном шкафу при 80:90оС. После сушки до постоянного веса высушенный продукт подвергают помолу для получения частиц размером менее 125 мкм. Порошок бемита добавляют в горячую кислоту при интенсивном перемешивании. Молярное соотношение компонентов при синтезе золя поддерживают на уровне Al3+/An– = 5. Концентрация золя составляет 3% в расчете на Аl2О3. В полученный золь добавляют диуретанэпоксид при соотношении ДУЭ/Аl2O3 = 0,01. В присутствии диу-ретанэпоксида время жизни золя увеличивается в 2 раза. Аналогично проводились испытания способа при других соотношениях ДУЭ/Al2O3, а также при отсутствии диуретанэпоксида (рис. 10).
При соотношениях ДУЭ/Аl2О3 больше 0,1 и меньше 0,01 эффект стабилизации отсутствует. При отсутствии диуретанэпоксида время жизни золя с концентрацией, равной 3%, примерно сопоставимо с описанными в литературе продуктами, при учете равенства концентраций. При самой высокой концентрации алюмозоля (2%) в описанных продуктах он сохраняет устойчивость примерно 100 : 120 сут. Диуретанэпоксид увеличивает время жизни продукта в 1,8 : 2,0 раза.
Повышению рН среды способствует повышению дисперсности получаемых золей. Переход в кислую область влечет за собой рост размера частиц. Пептизация протекает быстрее при использовании солей и кислот, содержащих одноименные ионы. Гель, получающийся из таких золей, содержит 5 : 10 мас. % твердой фазы. Интересно, что во всех случаях гели, полученные из неорганических солей, имеют конечное значение рН = 3,5.
Устойчивые золи с достаточно высокой концентрацией гидроксида алюминия образуют только оксигидроксид алюминия с кристаллической структурой у -бемита. В зависимости от природы растворимого соединения алюминия и условий проведения гидролиза можно получить золь, гель или осадок.

МЕЖДУНАРОДНЫЙ ОПЫТ
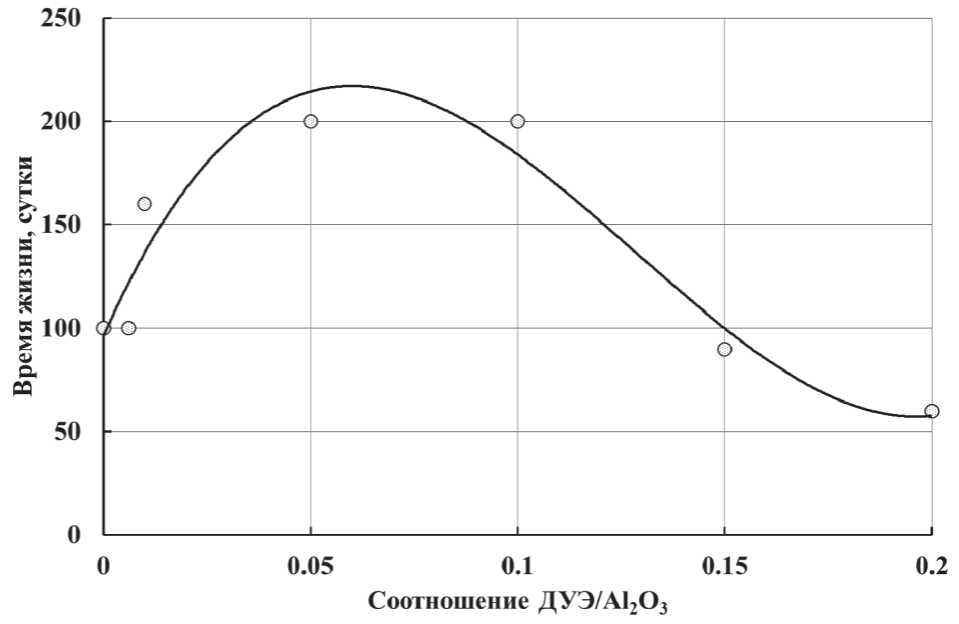
Рис. 10. Влияние количества добавки диуретанэпоксида на время жизни золя гидроксида алюминия при его получении
Также одним из основных способов синтеза гидрозоля γ -окси-гидроксида алюминия является гидролиз спиртового раствора алкоксида алюминия в водной среде. Обычно используется вторичный бутоксид или изопропоксид алюминия при отношении вода : алкоксид алюминия, близком к 100, и при температуре >80оС. Реакция соответствует схеме:
Al(OR)3 + 2H2O → AlOOH + 3ROH,
где R – углеводородный радикал.
Гидролиз алкоксида алюминия проводят в водно-спиртовой среде, при этом образуется гелеобразный осадок, который далее пептизируют добавлением кислоты. Важным фактором синтеза, определяющим свойства золя, является соотношение кислота : алкоксид (или кис-

МЕЖДУНАРОДНЫЙ ОПЫТ лота : бемит) R, которое обычно находится в диапазоне от 0,01 до 0,6. Агрегативно устойчивые прозрачные золи с концентрацией дисперсной фазы от 0,3 до 5 масс.% можно получить при R = 0,03^0,1, pH 3,8^4,2 и введении в качестве стабилизатора азотной кислоты.
Псевдобемит состоит из анизодиаметричных кристаллитов размером менее 10 нм. Анизодиаметричные кристаллические частицы обладают одним или двумя размерами, пренебрежимо малыми по сравнению с остальными размерами. Между кристаллами находятся водные прослойки, обеспечивающие возможность пептизации гелеобразных осадков в кислой среде. Первичные кристаллиты ассоциируются в более крупные агрегаты размером от нескольких сотых до 0,1 мкм [46].
Для получения более устойчивых золей осадок бемита пептизируют в присутствии стабилизаторов. В качестве стабилизаторов используют сильные кислоты и соли сильных кислот. Анионы таких кислот должны иметь слабую комплексообразующую способность по отношению к катионам алюминия (НСl, HNO3 HClO4) [44, 45].
Ионы H+ и ОН– играют роль потенциалопределяющих ионов на межфазной поверхности гидроксид/водный раствор. Например, при pH < рНиэ появление положительного заряда на частицах золя бемита обусловлено адсорбцией ионов водорода, поскольку в этой среде они являются потенциалопределяющими ионами. На рис. 11 представлены результаты измерения электрокинетического Z -потенциала для двойного электрического слоя и среднего измеряемого размера частиц в алюмозоле в зависимости от pH среды. Эти данные были получены на приборе The NanoPlus фирмы Micromeritics Instrument Corp. [115].
Представленные на рис. 11 данные показывают, что при pH вблизи изоэлектрической точки происходит слипание частиц алюмозоля, что выражается в увеличении измеряемых размеров частиц в золе. При этом избыточная адсорбция одного из этих ионов определяет плотность и знак электрического заряда на поверхности частиц твердой фазы, что вызывает два эффекта. Первый эффект обеспечивает рост электростатического отталкивания, а второй приводит к понижению межфазного натяжения. Оба этих эффекта способствуют снижению энергии Гиббса, что способствует протеканию процессов пептизации.
Нами были проведены исследования влияния состава жидкой фазы алюмозоля, а именно соотношения Аl/Аn, природы пертизиру-
МЕЖДУНАРОДНЫЙ ОПЫТ
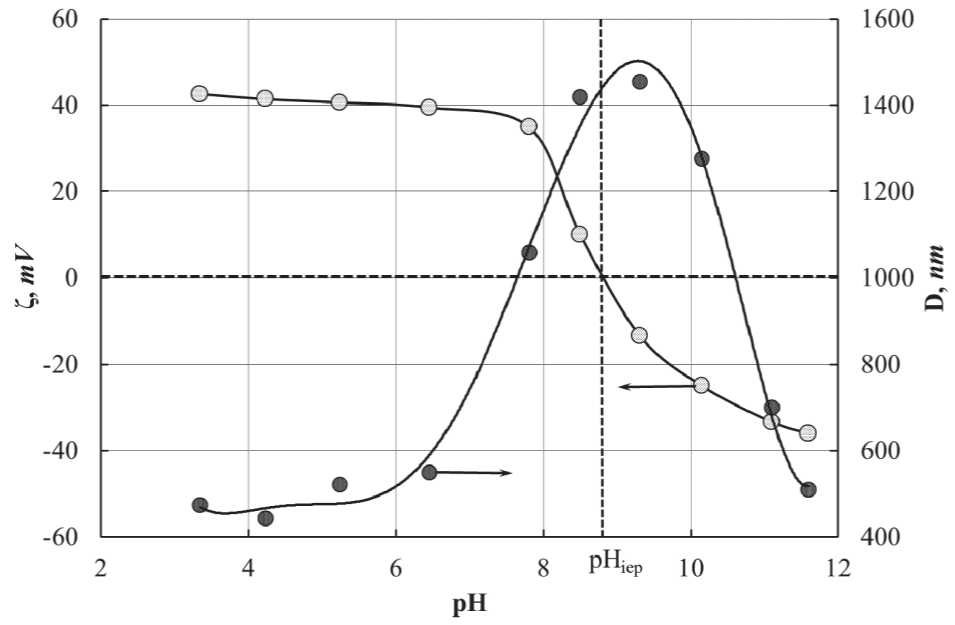
Рис. 11. Изменение величины электрокинетического Z -потенциала для двойного электрического слоя и среднего измеряемого размера частиц в алюмозоле гидроксида в зависимости от pH. pHiep – изоэлектрическая тока (pHiep = 8,87) [115]
ющей кислоты и содержания Аl2O3 в золе на его устойчивость. В качестве поэтизирующих кислот применялись как неорганические (НСl; HNO3), так и органические (СН3СООН) кислоты. Получен набор алюмозолей с содержанием A12O3 - 3 ^ 9% и мольными соотношениями Al/NO3 от 1 до 12.
Полученные результаты представлены на рис. 12. Из этих данных видно, что устойчивость золей увеличивается в интервале от нескольких часов до 30 ^ 40 суток при уменьшении концентрации алюмозоля и с увеличением мольного отношения Аl/Аn. pH полученных золей колеблется в диапазоне от 3,4 до 3,9. В этих условиях частицы несут на себе положительный заряд. При использовании азотной кислоты золи образуются легче, и они более прозрачные, чем в случае с соляной кислотой и, тем более, с уксусной кислотой.
МЕЖДУНАРОДНЫЙ ОПЫТ
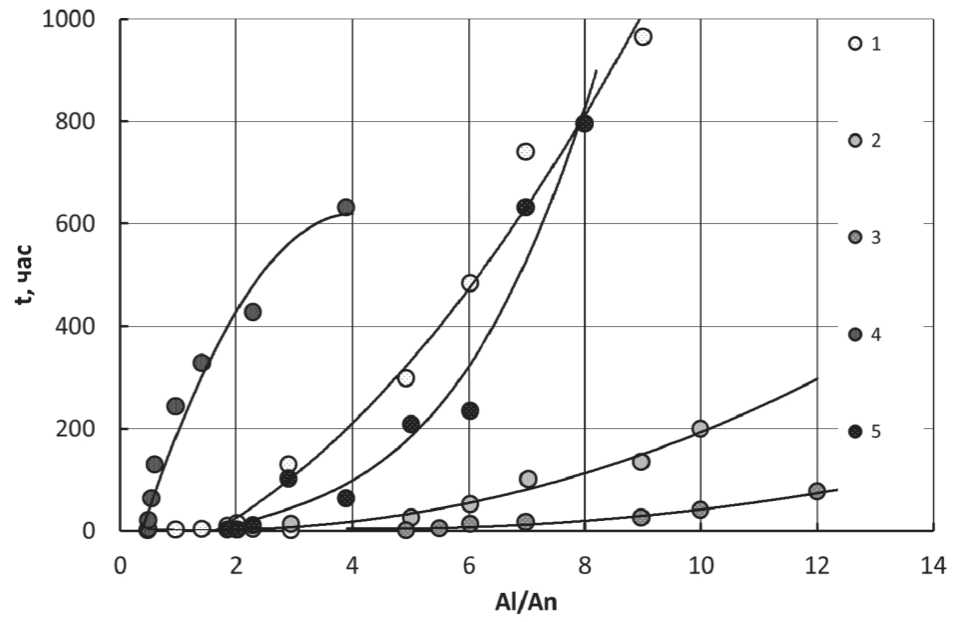
Рис. 12. Влияние концентрации, типа аниона и соотношения Аl/Аn на время гелирования алюмозоля:
1 – 3%, NO3–; 2 – 6%, NO3–; 3 – 9% NO3–; 4 – 3%, СН3СОО–; 5 – 3%, Сl–
Размер коллоидных частиц составляет примерно 10 ^ 12 нм. С соляной кислотой получены менее прозрачные золи (концентрация < 3%), с уксусной кислотой золи получены только с соотношениями Al/Аn < 1. Пептизация при больших анионных соотношениях осуществляется только при повышенной температуре.
4. Ионообменный синтез алюмозолей
Гидроокиси алюминия, хрома(III) и железа(III) имеют очень похожие свойства и наравне с кремнекислотой были в числе первых объектов ионообменного синтеза. Поэтому при рассмотрении методов ионообменного синтеза алюмозолей рассмотрим также и методы синтеза подобных им золей гидратированных оксидов хрома(III) и железа(III).
МЕЖДУНАРОДНЫЙ ОПЫТ
Когда эти гидроксиды осаждаются из растворов солей при добавлении щелочи или аммиака, они образуют дисперсные системы. Однако их одинаково трудно полностью удержать в коллоидном состоянии и полностью коагулировать. Рыхлые аморфные осадки являются обычно основными солями с переменным содержанием аниона; в состав осадков входят также адсорбированные катионы и захваченный маточный раствор.
Например, на анионитах протекает следующая реакция:
3R'OH + MeX3 → 3R'X + Me(OH)3 ↓ . (7)
Эта реакция позволила, во-первых, получить систему, не содержащую второй растворимой соли и, следовательно, полностью избежать загрязнения осадка посторонним катионом. Во-вторых, благодаря выводу аниона исходной соли в фазу ионита оказалось возможным выделять осадки практически чистой гидроокиси либо с минимальным содержанием аниона.
Растворимость гидроксидов Al(OH)3, Сr(OH)3 и Fe(OH)3 составляет 10–8 – 10–9 M. Однако основные соли этих металлов также труднорастворимы, и поэтому в умеренно разбавленных растворах в течение ограниченного времени не удается осуществить полную конверсию. Имеющиеся данные позволяют сделать заключение, что ионообменный синтез гидратированных оксидов состоит из двух стадий. Первая, быстропро-текающая стадия, представляет собой переход металла в состав золя или осадка основной соли, содержащей от 1 до 2 г-экв аниона кислоты на 1 г-экв металла. Вторая стадия представляет собой взаимодействие, которое протекает по механизму контактного обмена, при котором анион с убывающей скоростью переходит из осадка в ионит. Практически чистые гидроксиды могут быть получены с применением сильноосновных анионитов путем многократной обработки золя или осадка свежими порциями ионообменной смолы и продолжительным контактом. Также возможно осуществление процесса в динамических условиях при достаточном разбавлении исходного раствора. С другой стороны, при получении устойчивых золей необходимо, чтобы они содержали некоторое количество соли как стабилизатора.
Исследования по ионообменному получению золем гидроксидов алюминия и железа были начаты в работе [75], где, пользуясь слабоос-
МЕЖДУНАРОДНЫЙ ОПЫТ новными анионитами, авторами были получены золи основных солей, содержащие до 1 масс. % Ме2О3.
В работе [103] растворы хлоридов алюминия, хрома(III) и желе-за(III) контактировали с полиаминным анионитом МD средней основности в ОН-форме. Образование золя происходило в растворах FeCl3 при pH 1,6 ^ 1,8, а в растворах A1C1 3 и СгС1 3 — при pH 3,5 ^ 4,5, что соответствует области существования основных солей.
С использованием сильноосновных анионитов в гидроксильной и карбонатной формах авторами [104–106] были получены золи гидроксидов железа(III) и алюминия, практически не содержащие исходного аниона. Согласно патенту [107], при пропускании раствора, содержащего 0,1 М AlCl3, через слой анионита в HClO3-форме с группами четвертичного аммониевого основания образуется золь с pH 6,1, в котором присутствует 0,6% Сl– от исходного содержания (5•10–4 масс. %).
В работе [112] показана возможность получения сравнительно концентрированных золей, содержащих 15 ^ 20 г/л Fe2O3 и стабилизованных декстраном. При взаимодействии раствора FeCl3 с анионитом Амберлит IRA-410 в ОН-форме образующиеся золи имеют pH « 6 и содержат около 3% Cl– от исходного содержания в растворе. При повышении pH до 6,5 с добавлением избытка анионита наступает коагуляция. Было обнаружено, что применение анионообменного метода синтеза позволяет уменьшить размер частиц золя до 5 ^ 15 нм против 30 ^ 90 нм при действии растворимых оснований. Аналогичная ситуация была обнаружена при синтезе алюмозолей. Разбавленные золи, полученные любым методом, могут быть также очищены в колонне с анионитом от свободной кислоты; для этой цели пригодны и слабоосновные аниониты [108].
Золи Al(OH)3 могут быть получены и катионообменным методом из растворов алюминатов, однако для этого требуется подробное исследование конкретных условий синтеза, поскольку взаимодействие катионита с алюминатом может либо сопровождаться сорбцией алюминия как катиона, либо приводить к разложению алюмината с образованием осадка Al(OH)3. Также при этом возможно образование содержащей натрий фазы P -A1 2 O 3 . Последнее наблюдалось и исследовалось в работе [109], где установлено, что катиониты в H-форме (КУ-1, КУ-2), введенные в концентрированные алюминатные растворы (с модулем Na2O/ A1 2 O 3 ~ 1,8), вызывают их разложение. Скорость и конечный результат
МЕЖДУНАРОДНЫЙ ОПЫТ такого процесса соответствуют введению равного количества обычной затравки Al(OH)3. Так, в работе [110] отмечается, что при взаимодействии катионита КУ-2 в H-форме с водной суспензией труднорастворимого диалюмината лития происходило его частичное разложение с переходом Li+ в ионообменную смолу. Процесс представлял собой типичный контактный обмен, в ходе которого отношение Li+/Аl3+ в осадке алюмината снижалось от 0,45 до 0,15.
В результате катионного обмена могут быть получены стабильные концентрированные золи Al2O3 совместно с гораздо более устойчивой коллоидной кремнекислотой из смесей силиката и алюмината. Однако в этой системе происходит химическое взаимодействие компонентов с образованием алюмосиликатов.
Возможно также получение золя Al(ОН)3 из AlCl3 с помощью жидкого анионита с сильной основностью экстрагирующего HCl [102].
В ряде случаев с помощью катионитов были получены основные соли заданного состава без введения в систему новых растворимых электролитов. Так, например, для получения основных солей Cr(III), используемых в кожевенном производстве, предложено вводить в раствор сульфата или хлорида хрома дозированное количество сильноосновного анионита [111].
5. Контролируемый гидролиз соединений алюминия
Другим способом получения золей оксида алюминия является контролируемый гидролиз алкоксидов алюминия с углеродными цепями четного ряда от C6 до C20. На скорость их гидролиза влияет рН среды. В кислой среде гидролиз протекает быстрее, при переходе в щелочную среду процесс замедляется (рис. 13, 14, 15). Повышение температуры ускоряет гидролиз, но одновременно происходит заметное увеличение размера частиц (рис. 16). Мелкие частицы образуются в щелочной области при мольном отношении MH O/MAOC < 1,5, дальнейшее увеличение количества воды в реакционной смеси не влияет на размер частиц.
Торможение процессов гидролиза алкоксидов алюминия (рис. 14) с повышением pH их растворов обусловлено, прежде всего, увеличением энергии активации этого процесса (рис. 15). В свою очередь повышение энергии активации процесса их гидролиза в щелочной среде, по-видимому, связано с наличием процессов ассоциации и образованием
МЕЖДУНАРОДНЫЙ ОПЫТ
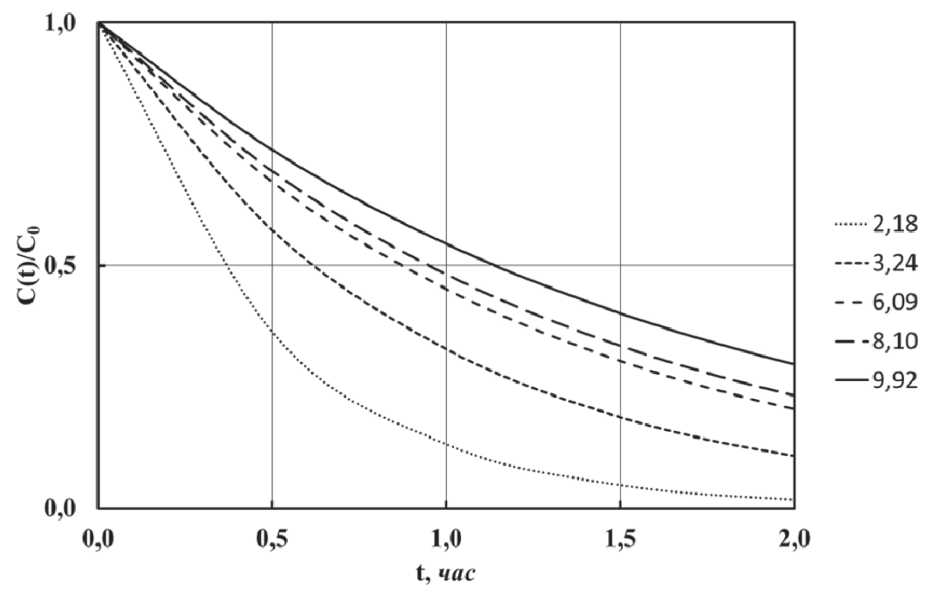
Рис. 13. Кинетические кривые гидролиза i -пропоксида алюминия при различных значениях pH среды
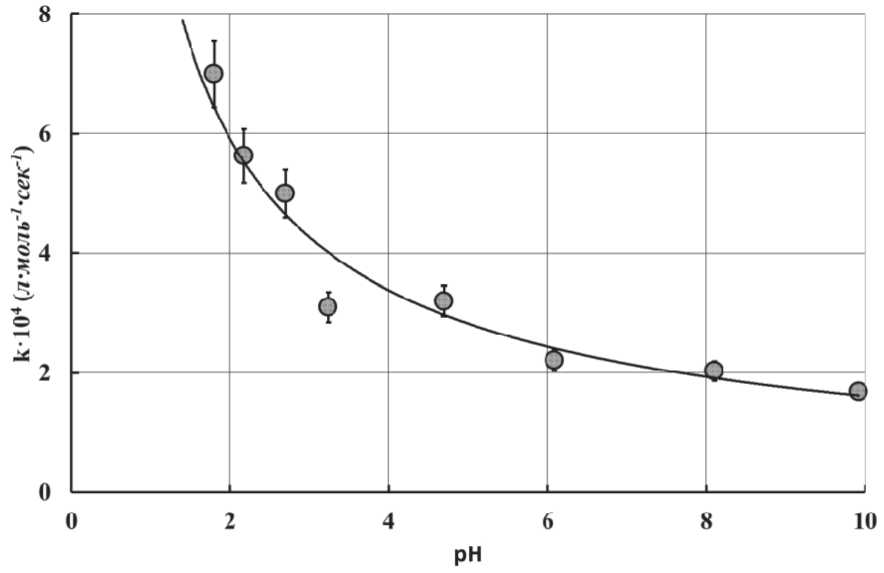
Рис. 14. Константа скорости процесса гидролиза i -пропоксида алюминия в зависимости от pH реакционной среды

МЕЖДУНАРОДНЫЙ ОПЫТ
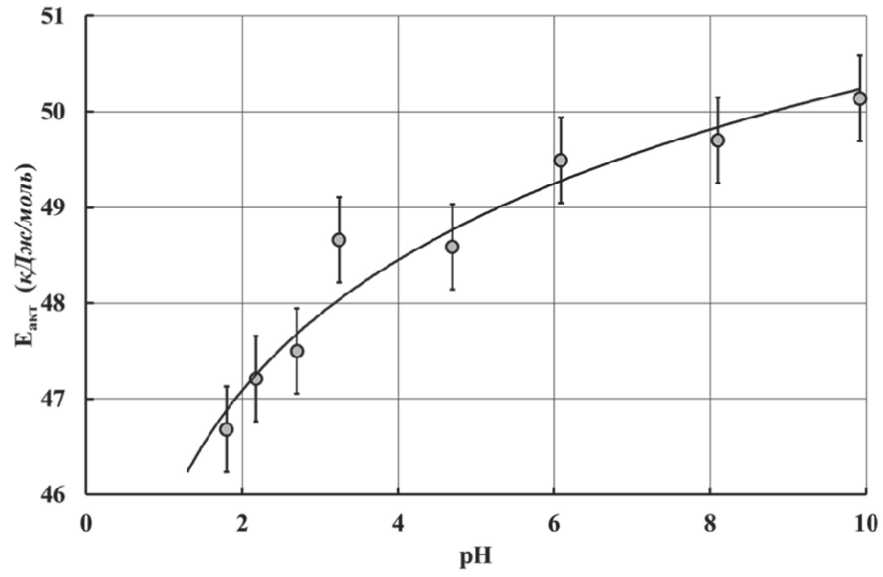
Рис. 15. Энергия активации процесса гидролиза i-пропоксида алюминия в зависимости от pH реакционной среды димерных и олигомерных форм соединений алюминия с мостиковыми связями Al–O–Al.
Процессы гелеобразования находят свое отражение в ИК-спектрах. Изучение спектров [79] позволило установить, что общей чертой является наличие широкой полосы в области 3600 ^ 2 700 см-1, отвечающей валентным колебаниям группы ОН в органических и неорганических оксосоединениях [80–83]. В органоминеральных гелях отсутствует полоса 1680 см–1, имеющаяся в неорганическом геле. Эта полоса обусловлена деформационными колебаниями ОН-групп в кристаллогидратных формах [80]. Наличие отчетливой полосы 1055 см–1 в органоминеральном геле говорит в пользу наличия в нем преимущественно бемитной формы оксида алюминия [64]. При этом в неорганическом геле данная полоса явно слабая. Также можно утверждать, что в гелях отсутствуют байерит и гиббсит как возможные формы гидроксида алюминия. Полоса 1680±10 см–1 в спектрах неорганического геля подтверждает присутствие в нем кристаллогидратных форм оксида алюминия. В длинноволновой области полосы поглощения появляются только в спектрах
МЕЖДУНАРОДНЫЙ ОПЫТ
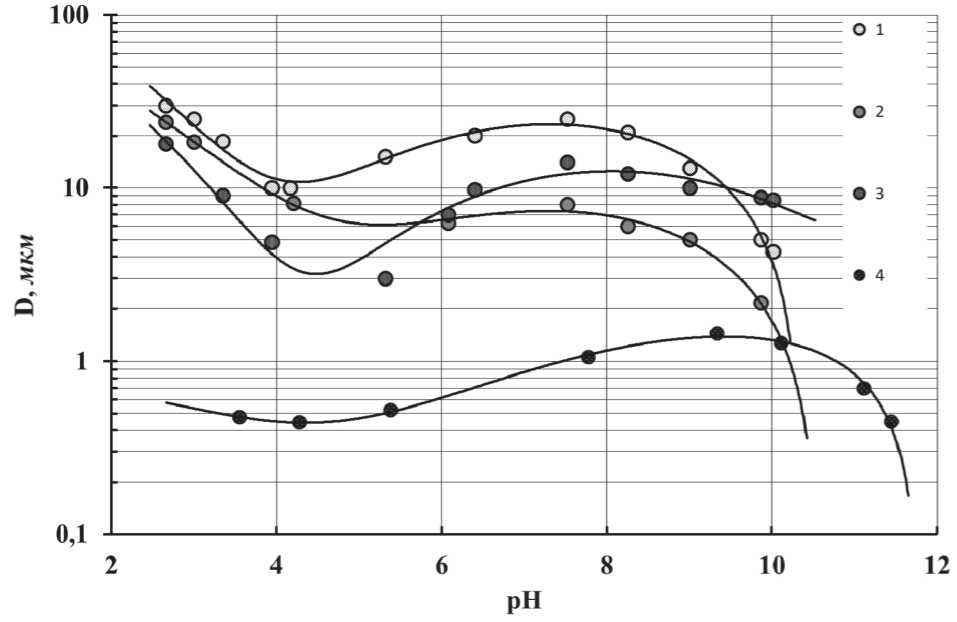
Рис. 16. Изменение размера частиц золя оксида алюминия в зависимости от рН среды при гидролизе i-пропоксида алюминия (кривые 1, 2, 3) под действием различных реагентов и хлорида алюминия (кривая 4):
1 – нитрат алюминия; 2 – хлорид алюминия; 3 – сульфат алюминия;
4 – самостоятельный гидролиз хлорида алюминия ксерогелей, подвергнутых термообработке, что доказывает аморфную природу частиц геля.
Другим интересным эффектом при гидролизе i -пропоксида алюминия является сложный, экстремальный вид зависимости размера образующихся частиц от pH реакционной среды. Данные по влиянию различных гидролизующих агентов на процесс образования частиц золя оксида алюминия представлены на рис. 16. В качестве гидролизующих агентов использованы различные соли алюминия. Для сравнения представлена аналогичная зависимость для гидролиза индивидуального хлорида алюминия.
Из представленных данных видно, что самостоятельный гидролиз солей алюминия приводит к образованию частиц с размерами значи-
МЕЖДУНАРОДНЫЙ ОПЫТ тельно меньшими, чем при гидролизе алкоксидов алюминия, и, в частности, i-пропоксида алюминия. Такой эффект можно объяснить различием механизмов процессов полимеризации гидроксокомплексов алюминия в растворе в случае гидролиза различных соединений алюминия. Процесс гидролиза алкоксидов – медленный процесс, который сопровождается постепенным ростом алюмокислородных цепей и, соответственно, ростом размеров образующихся частиц. Гидролиз индивидуальных солей алюминия представляет собой более быстрый процесс, сопровождающийся массовым образованием зародышей твердой фазы в объеме реакционной среды, что, соответственно, затрудняет рост частиц.
Присутствие солей алюминия оказывает существенное воздействие на процесс гидролиза алкоксидов алюминия. Их наличие в реакционной среде приводит к изменению режима процесса гидролиза, что связано с эффектом процессов образования комплексных соединений. Процессы гидролиза i -пропоксида алюминия в присутствии нитрата и хлорида алюминия оказались наиболее близки между собой. Это может быть связано с достаточной простотой строения этих ионов в растворах и их минимальной склонностью к образованию комплексных соединений с ионами алюминия.
При изучении процессов гидролиза алкоксидных соединений алюминия был обнаружен интересный факт, что скорость гидролиза уменьшается с ростом длины углеродной цепи. Полученные данные представлены на рис. 17.
Гидролиз алкоксидов алюминия, образованных спиртами, имеющими длину цепи больше, чем у гексанола, протекает с самой минимальной скоростью. Такое торможение с наибольшей вероятностью можно объяснить стерическими факторами. Для данного случая была проведена проверка возможности применения корреляционной зависимости, аналогичной уравнению Тафта [84]. Уравнение Тафта было предложено для количественного описания влияния соседних заместителей на реакционную способность химического соединения по исследуемой функциональной группе. Это уравнение часто используется для определения механизма реакции. В данном случае наличие линейной корреляции (рис. 18) подтверждает предположение о стерическом затруднении при гидролизе алкоксидов алюминия, образованных спиртами с длинными углеродными цепями.
МЕЖДУНАРОДНЫЙ ОПЫТ
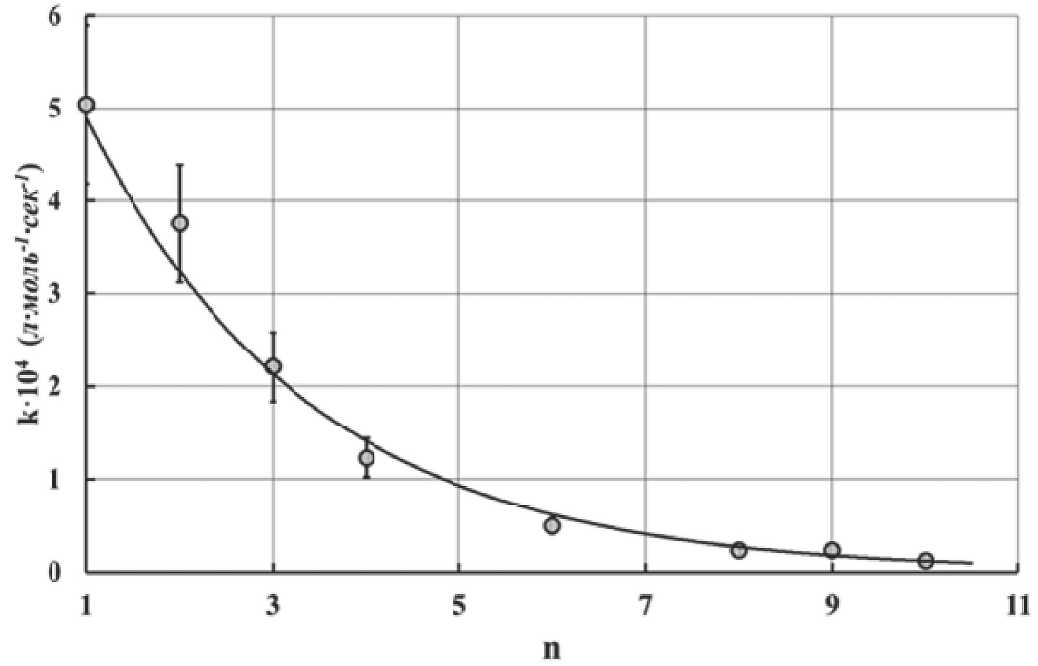
Рис. 17. Константа скорости гидролиза алкоксидов алюминия в зависимости от длины цепи n , его алифатического спиртового остатка
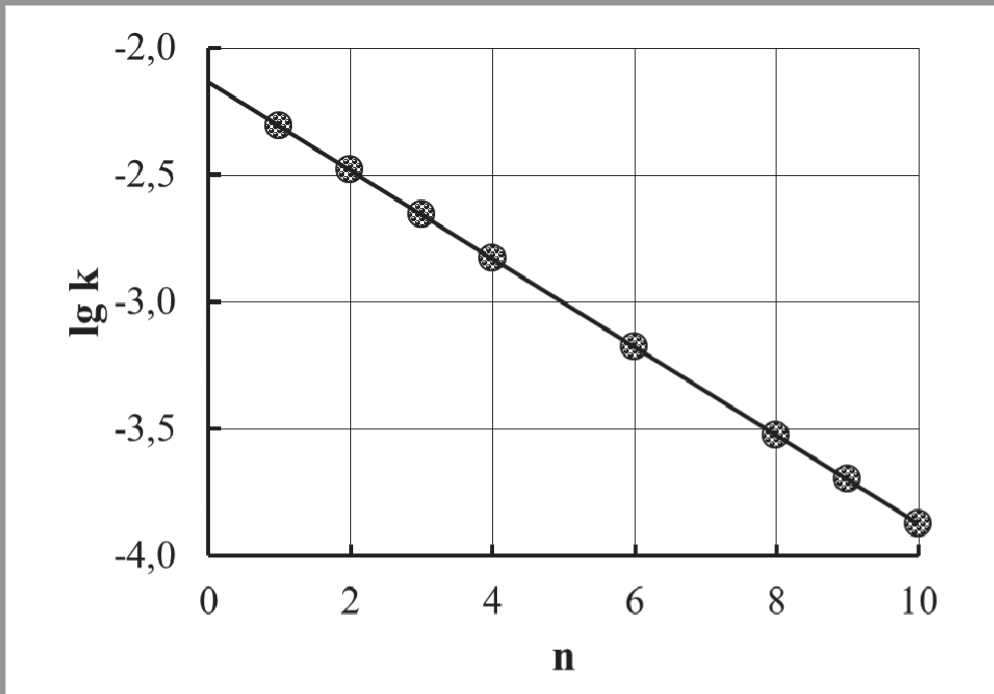
Рис. 18. Проверка применимости уравнения Тафта для стерического влияния заместителей. Логарифм константы скорости гидролиза алкоксидов алюминия в зависимости от длины цепи n , его алифатического спиртового остатка

МЕЖДУНАРОДНЫЙ ОПЫТ
Влияние рН среды на природу и строение ксерогелей отмечается только в длинноволновой ИК области. Для гелей, полученных при низком значением рН, интенсивность полос поглощения ниже, что связано со степенью аморфизации частиц. Влияние мольного соотношения MH O/MAl(OR) проявляется только в коротковолновой области 4000 : 2500 см-1, то есть в том диапазоне, где существуют линии поглощения воды и высших спиртов.
Таким образом, гели оксида алюминия, образованные золями, полученными в результате гидролиза алкоксидов алюминия, состоят в основном из частиц безводного бемита, в то время как гели, образованные золями, полученными из неорганических солей алюминия, содержат, преимущественно, кристаллогидратные формы гидратированного оксида алюминия.
Части 1 и 3 статьи Кудрявцева П.Г., Кудрявцева Н.П., Фиговского О.Л. «Растворимые соединения алюминия и нанокомпозитные материалы на их основе» читайте в номерах 1/2018 и 3/2018 Интернет-журнала «Нанотехнологии в строительстве».
Список литературы к частям 1, 2 и 3 статьи Кудрявцева П.Г., Кудрявцева Н.П., Фиговского О.Л. «Растворимые соединения алюминия и нанокомпозитные материалы на их основе» будет опубликован также в номере 3/2018 Интернет-журнала «Нанотехнологии в строительстве».
У важаемые коллеги !
П ри использовании материала данной статьи просим делать библиографическую ссылку на неё :
D ear colleagues !
T he reference to this paper has the following citation format :


