Разделение смеси 1-пропанол - 1-пропил формиат с помощью глубокого эвтектического растворителя (хлорид холина: глутаровая кислота) при 313,15 К
Автор: Голикова А.Д., Смирнов А.А.
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Химические науки
Статья в выпуске: 11-5 (74), 2022 года.
Бесплатный доступ
В работе представлены данные о фазовом равновесии в системе 1-пропанол - 1-пропилформиат - глубокий эвтектического растворитель (ГЭР) на основе хлорида холина и глутаровой кислоты. Равновесие жидкость-жидкость для системы 1-пропанол - 1-пропилформиат - ГЭР изучено при 313,15 К и атмосферном давлении. Составы равновесных фаз были определены с помощью метода ядерного магнитного резонанса. Эффективность разделения системы 1-пропанол - 1-пропилформиат с помощью ГЭР на основе хлорида холина (ChCl) и глутаровой кислоты (Glu) осуществлена помощью расчета коэффициентов распределения и значений селективности. Корреляция экспериментальных результатов проводилась с помощью уравнения NRTL.
1-пропанол, глубокий эвтектический растворитель, экстракция растворителем, хлорид холина
Короткий адрес: https://sciup.org/170196875
IDR: 170196875 | DOI: 10.24412/2500-1000-2022-11-5-119-124
Текст научной статьи Разделение смеси 1-пропанол - 1-пропил формиат с помощью глубокого эвтектического растворителя (хлорид холина: глутаровая кислота) при 313,15 К
Вопросы экологии становятся все более актуальными в связи с вредоносным влиянием химического производства на окружающую среду, а также с неизбежным истощением природных ископаемых ресурсов. Дальнейшее развитие науки и технологии происходит с акцентом на поиск и переход к альтернативным более экологичным методам химического производства. Одними из таких альтернативных экологичных растворителей являются глубокие эвтектические растворители (ГЭР).
ГЭР претендуют на роль более экологичных и экономически выгодных растворителей по сравнению с традиционными органическими растворителями и ионными жидкостями [1, 2].
эвтектический растворитель, экстракция
Глубокие эвтектические растворители (от английского DES – deep eutectic solvents) представляют из себя смесь двух или более веществ (доноров и акцепторов водородной связи), смешанных в определенном соотношении, при котором наблюдается значительное понижение температуры плавления смеси по сравнению с чистыми компонентами. Данное явление объясняется образованием водородной связи между компонентами ГЭР.
В данной работе было проведено исследование по оценке эффективности разделения смеси 1-пропанол – 1-пропилформиат с помощью ГЭР на основе хлорида холина и глутаровой кислоты.
Экспериментальная часть
Все реагенты, используемые в данном исследовании, приведены в таблице 1. 1- пропанола осушали с помощью молекулярных сит с размером пор 3 Å.
Таблица 1. Чистота реактивов
Гидрофильный хлорид холина предварительно был осушен от воды. Виалу с ~ 1,0 г вещества выдерживали под вакуумом (7 мбар) при нагревании до постоянства массы состава. Далее сухой хлорид холина смешивали с глутаровой кислотой в мольном соотношении 1:1 и выдерживали в ультразвуковой ванне при 50 °С до образования прозрачной гомогенной жидкости. При данном мольном соотношении наблюдается максимальное падение температуры плавления системы [3].
Для исследования равновесия жидкость-жидкость были приготовлены системы 1-пропанол – 1-пропилформиат –
ГЭР в различных соотношениях, при которых система оставалась гетерогенной. Полученные смеси перемешивали при 313,15 K в течение двух часов, а затем выдерживали в термостате при этой же температуре в течение суток до наступления фазового равновесия. Далее составы равновесных фаз анализировали методом 1Н ЯМР-спектроскопии и на основании полученных спектров рассчитывали мольные доли компонентов смеси.
Обсуждение результатов
Данные о равновесии жидкость-жидкость, полученные в ходе исследования, представлены в Таблице 2.
Таблица 2. Экспериментальные данные о равновесии жидкость-жидкость в системе 1-пропанол – 1-пропилформиат – ГЭР при 313,15 K и атмосферном давлении
Органическая фаза Фаза ГЭР w1 w2 w3 w1 w2 w3 β спирт β эфир S
1-пропанол (1) – 1-пропилформиат (2) – Хлорид холина (3) – Глутаровая кислота (4)
|
0,000 |
0,977 |
0,001 |
0,000 |
0,090 |
0,485 |
- |
- |
- |
|
0,055 |
0,907 |
0,001 |
0,048 |
0,109 |
0,455 |
0,873 |
0,120 |
7,26 |
|
0,100 |
0,848 |
0,003 |
0,086 |
0,133 |
0,425 |
0,860 |
0,157 |
5,48 |
|
0,143 |
0,788 |
0,010 |
0,128 |
0,171 |
0,388 |
0,895 |
0,217 |
4,12 |
|
0,175 |
0,728 |
0,027 |
0,172 |
0,236 |
0,327 |
0,983 |
0,324 |
3,03 |
|
0,211 |
0,593 |
0,088 |
0,211 |
0,366 |
0,228 |
1,000 |
0,617 |
1,62 |
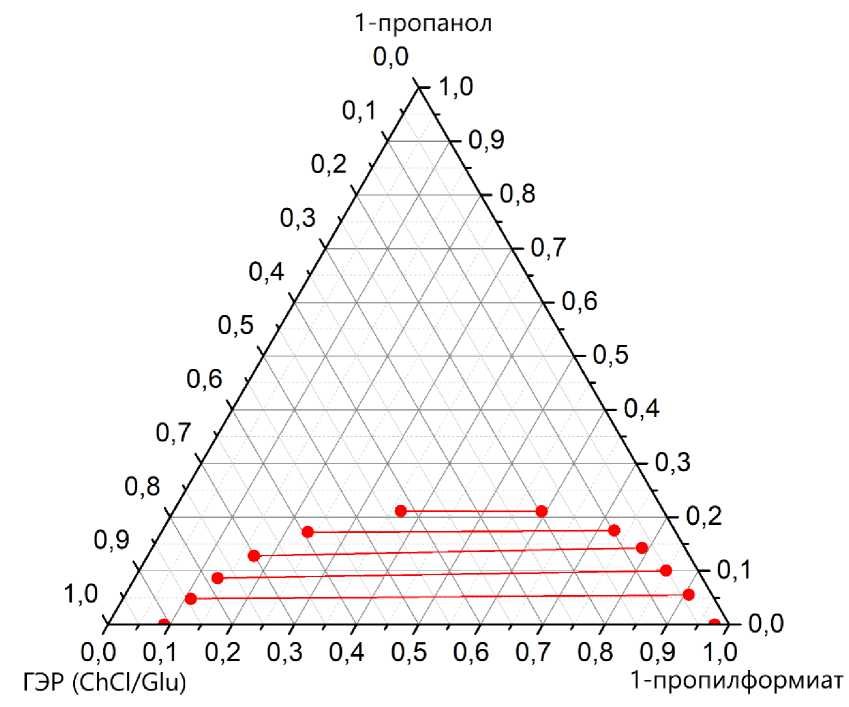
Рис. 1. Равновесие жидкость-жидкость в системе 1-пропанол – 1-пропилформиат – ГЭР (ChCl/Glu) при 313,15 K и атмосферном давлении
Была проведена проверка полученных экспериментальных данных на внутренюю согласованность с использованием моде-
где w 1 , w 2 , w 3 – мольные доли 1-пропанола, 1-пропилформиата и ГЭР соответственно. Верхние индексы I и II обозначают органическую и обогащенную ГЭР фазы соответственно. Результаты
лей Отмера-Тобиаса [4], Хэнда [5] и Бахмана [6], формулы 1,2 и 3 соответственно:
108 (15г) = a + b*l°fl (15#)- los($) = a + b*lo9(5) + c, w!,=a+b» (^т) + с ,(3)
корреляции представлены в таблице 3. Полученные результаты подтверждают хорошую внутреннюю согласованность экспериментальность данных.
Таблица 3. Корреляция экспериментальных данных о равновесии жидкость-жидкость в системе 1-пропанол – 1-пропилформиат – ГЭР по уравнениям Отмера-Тобиаса, Хэнда и Бахмана
|
Отмер-Тобиас |
|||||
|
ГЭР |
T, K |
a |
b |
c |
R2 |
|
ChCl/Glu |
313,15 |
0,1876 |
1,5616 |
0,9005 |
0,9979 |
|
Хэнд |
|||||
|
ГЭР |
T, K |
a |
b |
c |
R2 |
|
ChCl/Glu |
313,15 |
-5,6967 |
2,7725 |
-1,8709 |
0,9999 |
|
Бахман |
|||||
|
ГЭР |
T, K |
a |
b |
c |
R2 |
|
ChCl/Glu |
313,15 |
23,372 |
-58,969 |
37,327 |
0,9889 |
По полученным экспериментальным данным была построена фазовая диаграмма. Ноды, соединяют составы равновесных сосуществующих фаз. По полученной диаграмме был сделан вывод, что область ге-
терогенности в данной системе относительно небольшая, а система становится гомогенной в любых соотношениях эфира к ГЭР при массовой доле спирта выше 0,25.
Для оценки эффективности разделения смеси спирт – сложный эфир был произведен расчет коэффициентов распределения 1-пропанола (βспирт) и (βэфир) 1- пропилформиата между фазами, а также показания селективности разделения (S). Расчет производился по формулам:
/^спирт
II ^ спирт 37 '
^ спирт
&фир =
^ эфир
^ эфир
_ /^сПирт^ /^эфирА \^ с7пирт/ \^э 7фир/
Результаты расчетов представлены в таблице 2. Зависимости коэффициентов распределения и значений селективности от массовой доли спирта в системе представлены на рисунках 2 и 3 соответственно.
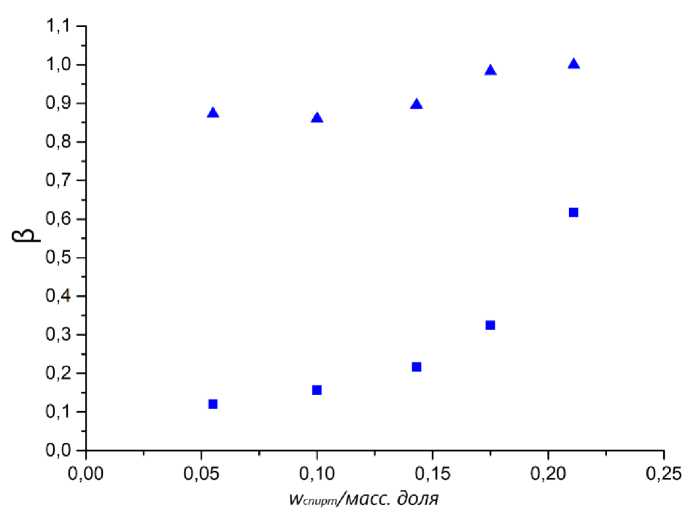
Рис. 2. Зависимость коэффициентов распределения β спирт ( ▲ ) и в эфир ( ■ ) от массовой доли 1-пропанола в системе
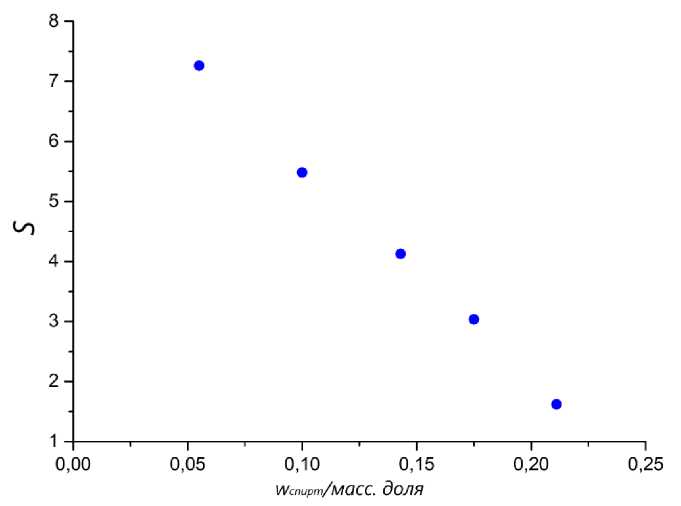
Рис. 3. Зависимость значений селективности S ( • ) от массовой доли 1-пропанола в систе-
ме
Селективность разделения системы 1-пропанол – 1-пропилформиат уменьшается с увеличением содержания спирта в системе. Коэффициент распределения спирта при росте его доли в системе остается практически неизменным. Однако коэффициент распределения эфира увеличивается с увеличением количества спирта. На основании полученных зависимостей можно сделать вывод, что эффективность экстракции эфира из системы растет относительно экстракции спирта, при увеличении содержания 1-пропанола.
Моделирование
Было произведено моделирование фазового равновесия по уравнению NRTL (Non-Random Two-Liquid) [7]. Уравнение NRTL является наиболее проверенной и популярной моделью для описания термодинамических свойств расслаивающихся растворов. Она относится к моделям локального состава, суть которых состоит в том, что локальная концентрация вокруг молекулы отличается от объемной.
Данная модель основана на расчете коэффициентов активности γ i компонента i в фазе x i . Расчет коэффициентов активности в растворе из n компонентов производиться по следующей формуле:
Zn/ i =
T.lj=i X j T ji G jj w x j G j j (
T^X k G ji ^^Z^iXfcGfcA ij
—
T.l=1xl T ljGlj
2 fc=1 xkGkj
9 ij -g jj ij RT ,
Gij = exp(—azij) ,
где х – мольная доля компонента системы, g ji – энергетический параметр бинарного взаимодействия, характеризующий взаимодействие между молекулами компонентов j и i , R – универсальная газовая постоянная, Т - температура (K). a - параметр «неопределенности», характеризующий степень упорядоченности распределения молекул в системе.
Параметры бинарного взаимодействия для системы 1-пропанол – 1-пропилформиат – ГЭР (ChCl/Glu), полученные в результате моделирования приведены в таблице 4. Полученные расчетные данные имеют хорошую сходимость с экспериментом. Стандартное отклонение σ составило 0,33 %.
Таблица 4. Энергетические параметры g ij полученные в результате моделирования равновесия жидкость-жидкость по уравнению NRTL
|
i-j |
∆g ji |
∆g ij |
α ji |
|
1-пропанол (1) – |
1-пропилформиат (2) |
– ГЭР (ChCl/Glu) (3) при 313,15 K |
|
|
1-2 |
7623 |
-35096 |
0,3 |
|
1-3 |
-24839 |
-37203 |
0,3 |
|
2-3 |
30451 |
10678 |
0,3 |
|
σ = 0,33 % |
|||
Список литературы Разделение смеси 1-пропанол - 1-пропил формиат с помощью глубокого эвтектического растворителя (хлорид холина: глутаровая кислота) при 313,15 К
- Oliveira M. et al. (Eco)toxicity and biodegradability of protic ionic liquids // Chemosphere. - 2016. - №147. - С. 460-466.
- Dai Y., van Spronsen J., Witkamp G. et al. Natural deep eutectic solvents as new potential media for green technology // Analytica Chimica Acta. - 2013. - №766. - С. 61-68.
- Abbott A.P., Harris R.C., Ryder K.S., D'Agostino C., Gladden L.F., Mantle M.D. Glycerol eutectics as sustainable solvent systems // Green Chem. - 2011. - №13. - С. 82-90.
- Othmer D.F., Tobias P.E. Liquid -Liquid Extraction Data -Toluene and Acetaldehyde Systems // Ind. Eng. Chem. - 1942. - №34. - С. 690-692.
- Hand D. B. Dineric Distribution //j. Phys. Chem. 1930. №34. С. 1961-2000.
- Bachman, I. Convergence of Tie Lines in Ternary Liquid Systems // Ind. Eng. Chem. - 1940. - №12. - С. 38-39.
- Renon H., Prausnitz J.M. Local compositions in thermodynamic excess functions for liquid mixtures // AIChE Journal. - 1968. - №14. - С. 135-144.


