Размножение Larix sibirica Ledeb. в культуре in vitro через соматический эмбриогенез и влияние микоризы на их рост в почве
Автор: Энхчимэг Ванжилдорж, Нандин-Эрдэнэ Ундарьяа, Гоомарал Алтансух
Журнал: Природа Внутренней Азии @nature-inner-asia
Рубрика: Биология
Статья в выпуске: 3-4 (16), 2020 года.
Бесплатный доступ
В статье приведены результаты анализа размножения Larix sibirica Ledeb. в культуре in vitro через соматический эмбриогенез и влияние микоризы на их рост в почвенной среде. На основе метода показано, что для получения микроклональной лиственницы сибирской эффективно использовать в качестве регуляторов роста 1 мг/л 2,4-Д (2,4-дихлорфеноксиуксусную кислоту) и 2 мг/л 6-БАП (6-бензиламиноперемедин) с показателем среды pH-5,8. Дозировка для приготовления микоризы в соответствии с инструкциями производителя составляла 3,25 мл с добавлением 15 мл воды. У микро-клональных растений, которые были заражены микоризой, боковые корни образовывались из основных корней растений, и среднее число разветвленных корней у 15 растений составляло 8,8 см. Средняя длина основного корня была на 6,7 см и на 3,4 см больше, чем у растений, которые не были заражены микоризой. Процент выживаемости микро-клональных растений составлял 64. Таким образом, микоризы увеличивают количество поглощаемой воды и питательных веществ у корня растения и создают связь между корнями и почвой, разветвляя корни растений на более широкой территории.
Питательная среда msgm, соматический эмбриогенез, лиственница сибирская, микроклональные растения, микориза
Короткий адрес: https://sciup.org/148318051
IDR: 148318051 | УДК: 58.085 | DOI: 10.18101/2542-0623-2020-3/4-77-83
Текст научной статьи Размножение Larix sibirica Ledeb. в культуре in vitro через соматический эмбриогенез и влияние микоризы на их рост в почве
Леса Монголии занимают переходную полосу между горно-таежными лесами Сибири и пустынями Центральной Азии и сосредоточены главным образом в горных районах на севере и западе страны. Это лесные массивы по северным склонам Хангая и Хэнтэя. С точки зрения вида и видового состава древесные растения в стране составляют лиственница — 78,7%, кедр — 9,3%, береза — 6,1%, сосна — 5,0%, ель — 0,23%, пихта — 0,02%, тополь — 0,2%, осина — 0,05%, вяз — 0,01%, ива — 0,28% и саксаул — 0,15%1. Лиственница сибирская ( Larix sibirica Ledeb.) — один из наиболее распространенных и важнейших лесообразующих видов рода Larix . В мире насчитывается более 20 видов лиственницы, а в Монголии произрастают три вида лиственницы: Larix sibirica Ledeb, Larix sukaczewii и Larix gmelinii . Это самые распространенные деревья в лесу, занимающие более 70% [Дугаржав Ч., 2006]. Лесная экосистема страны сильно пострадала от деятельности человека, технологии лесозаготовок. В дополнение к вышеперечисленным факторам это зависит от биологических характеристик дерева, климатических условий, засухи, а также воздействия болезней и вредителей [Цогт З., 2012, Доржсурэн Ч., 2009]. Например, когда семена лиственницы прорастают, корневая шейка высыхает, основной стебель разлагается и 60–70% семян лиственницы становятся недееспособными из-за грибковых заболеваний и насекомых.
Соматический эмбриогенез является перспективным направлением в создании сортового плантационного лесовыращивания. В Монголии был разработан зиготический эмбриогенез Larix sibirica Ledeb у лиственницы сибирской в 2015 г. [Даваажаргал М., 2015]. Размножение larix sibirica ledeb. в культуре in vitro через соматический эмбриогенез и влияние микоризы на их рост в почвенной среде изучено недостаточно. При микроклональном размножении наблюдаются большие потери растений на этапе пересадки в другие условия. Приживаемость к новым условиям зависит от субстрата. Установлено, что для пробирочных растений необходим субстрат объемом пор 25% [Kim, 1988]. Большую роль в приживаемости растений к новым почвенным условиям играет его фитосанитарное состояние. Обогащение субстрата микоризой увеличивало приживаемость и рост растений [Чекурова Г. В., 1990]. Таким образом, растения, которые высаживают в другую почву, должны адаптироваться к новым условиям.
Объекты и методы исследования
В качестве материала для исследований использовались семена, собранные в 2017 г. с Биндер сум Хэнтийского аймака. Координаты GPS: N 48020'54,9 " ; E 108040'07,0, высота над уровнем моря 1578 м. Собранные семена имели ширину — 1,5–1,7 мм, длину — 3,5–5 мм, от темно-коричневого до желтоватого цвета. Очищенные семена замачивают в дистиллированной воде в течение 24 часов, обрабатывают раствором 70%-ным этанолом в течение 1 минуты. Затем семена стерилизовали в течение 15 минут раствором, содержащим 2,5% гипохлорита натрия (NaOCI), и тщательно промыли дистиллированной водой.
Питательная среда готовится заранее. Готовят базовую среду, включающую микро- и макроэлементы, витамины, железо, органические вещества в заданном количественном содержании компонентов в соответствующей модификации состава среды по MSGM. В качестве регуляторов роста использовали 1 мг/л 2,4-Д (2,4-дихлорфеноксиуксусную кислоту) и 2 мг/л 6-БАП (6-бензиламиноперемедин). Водородный показатель среды доводили до 5,8 перед автоклавированием. Проводится автоклавирование при 121ºС, 110 кРа в течение 20 минут. В полученную среду вводят экспланты зародышей семян. В каждой чашке Петри культивируют по 5 зародышей на 20 мл индукционной среды в темноте при 25 ± 2°С.
Микоризный субстрат для увеличения приживаемости и роста растений. Культивируемые in vitro микроклональные лиственницы сибирской пересаживают в горшок с субстратом, а на корни наносят препараты микоризы, сделанные в Словакии (Symbiom). Они были использованы в исследовании и включали следующие компоненты. Эктомикориза: Amanita rubescens, Hebeloma velutipes, Paxillus involutus, Coenococcum geophilum Эндомикориза: Claroideoglomus etunicatum Claroideoglomus claroideum Rhizophagus irregularis Funneliformis geosporum Funneliformis mosseae. Дозировка для приготовления микоризы в соответствии с инструкциями производителя: эктомикориза и эндомикориза по 3,25 мл с добавлением 15 мл воды. Почву просеивали через мелкое сито и стерилизовали в автоклаве в течение 20 минут, после чего стерилизованную почву помещали в столбчатый контейнер с микоризой. 35-дневные микроклональные лиственницы сибирской пересаживали в микоризную почву. Растения поливали 10 мл воды и регулярно опрыскивали, чтобы увлажнить их. В качестве контроля использовали микроклональные лиственницы сибирской, выращенные в почвах без микоризы.
Результаты исследований
В течение 14 дней пересаженные 5 эмбрионов в один контейнер зародыши прорастают через 2–4 дня (рис. 1А). Через 7 дней образуются почки и первичные корни (рис. 1Б). Однако 35-дневные микроклональные лиственницы морфологически сходны с лиственницей из семян и готовы к пересадке в почву (рис. 1В, 1Г). Тем не менее растения in vitro , особенно лиственничные микроклональные растения, имеют недостаток, заключающийся в невозможности адаптации непосредственно к внешней среде. Внешне эти растения тонкие и не закрываются края листьев, поэтому их необходимо адаптировать. Мы наполовину открыли крышку чашки Петра на 5–7 дней, накрыв пластиковым пакетом, и постепенно адаптировали к внешней среде. Перед тем как посадить в почву, корни микроклональной лиственницы промывали теплой водой, удалив питательную среду. Очищенные от питательной химической среды растения посадили в почву. В течение первой недели накрывали растения пластиковыми пакетами, чтобы предотвратить потерю влаги, и постепенно адаптировали микрорастения к внешней среде. Затем их пересаживали в почву с микоризой (рис. 1Д). Наблюдая за стадией микроклональной лиственницы сибирской, мы можем сделать вывод, что для получения лиственницы из зародышей семян требуется около 30–40 дней.
В результате у микроклональных растений, выращенных в почве без микоризы, корни не были заражены микоризой. Из основных корней растения не возникало разветвленных боковых корней (Рис 2А). Средний рост 15 растений составил 3,3 см, а средняя длина основного стебля — 4,3 см. Однако у микроклональных растений, которые были заражены микоризой, боковые корни образовывались из основных корней растений и среднее число разветвленных корней у 15 растений составляло 8,8 (табл. 1).

Рис. 1. А. Эмбриогенез, Б. Семидневный зародыш,
В. Микроклональное растение после 35 дней Г. 35-дневное микроклональное растение с главным корнем, Д. Растение, пересаженное в почву
Таблица 1
Рост инфицированных микоризой корней и растений
|
Число разветвленных корней,ш |
Длина разветвленных корней, см |
Рост растений, см |
Длина главного корня, см |
|
|
Без микоризы |
0 |
0 |
3,3±0,4 |
4,3±1,3 |
|
С микоризой |
8,8±4,5 |
2,0±0,6 |
4,4±0,8 |
6,7±1,2 |
Кроме того, средняя длина разветвленных корней составляла 2 см, а средний рост растений — 4,4 см, что на 1 см выше, чем у растений, которые не были заражены микоризой, тогда как средняя длина основного корня была на 6,7 см и на 3,4 см больше, чем у растений, которые не были заражены микоризой (Рис 2Б). Микоризообразование на рис. 2В показывает, что гриб обволок корни растений.

Рис. 2. Корень лиственницы А. без микоризы. Б. с микоризой В. микоризообразование
Из этого можно сделать вывод, что заражение микоризой микроклональной лиственницы усиливает рост верхней части лиственницы и рост корней.
Коэффициент выживаемости деревьев, зараженных микоризой, определяли путем сравнения количества живых деревьев с общим количеством деревьев, выраженным как 100%.
На рис. 3 процент выживаемости микроклональных растений после сто два-цати дней составляет 64, процент выживаемости контроля составляло 42 после шестидесяти дней. Приживаемость к новым условиям контроля после шестидесятидневного роста показала неспособность выжить.
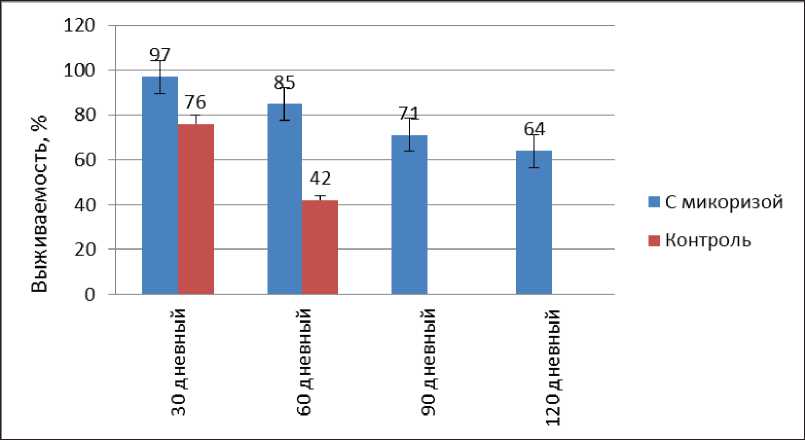
Рис. 3. Коэффициент выживаемости микроклональной растений
Обсуждение
И. Н. Третьякова, А. В. Барсукова [2012] использовали комбинацию БАП и гормонов 2.4-D в питательной среде MSGm для образования почек каллуса in vitro путем соматического эмбриогенеза из зародышей зигот лиственницы Larix sibirica, L. gmelinii и L. sukaczewii . Из зародышей трех видов лиственницы образовались 50–81% каллуса из L. gmelinii , 53–93% лиственницы Larix sibirica и 98% лиственницы L. sukaczewii . В исследовании мы опирались на работу Цэрэндэ-жид Л., Энхчимэг В. [2019], которые объединили гормоны MSGm 2.4-D и BAP in vitro , чтобы сформировать почки из эмбриона. В Монголии использование микоризы после культуры in vitro на Larix sibirica изучено мало. Исследования Pinus sylvestris в теплицах показали, что высота проростков, диаметр шейки и длина корня определяются тем фактом, что эктомикориза ускоряет рост проростков [Ган-туяа Б., Бүрэнжаргал О., 2019]. P.D. Khasa и другие [2001] изучили на проростке Larix sibirica шесть видов эктомикоризных грибов. Для лучшего роста сеянцев и улучшения качества окружающей среды снизили уровень удобрений в питомниках до 33%, используя отобранные микоризные грибы. Колонизация эктомикоризы во всех проростках не зависела от уровня удобрений. Растения формировали хорошо развитую эктомикоризу. В наших исследованиях микроклональные проростки Larix sibirica Ledeb всходят с 9 видами микориз, что привело к росту корней на 6.7 см больше, чем без микоризного контроля. Таким образом мы видим, что микоризы увеличивают количество поглощаемой воды и питательных веществ у корня растения и создают связь между корнями и почвой, разветвляя корни растений на более широкой территории (Gerdemann, 1974).
Заключение
Таким образом было определено, что для получения микроклональной лиственницы сибирской эффективно использовать в качестве регуляторов роста 1 мг/л
2,4-Д (2,4-дихлорфеноксиуксусную кислоту) и 2 мг/л 6-БАП (6-бензиламинопе-ремедин). У микроклональных растений, которые были заражены микоризой, боковые корни образовывались из основных корней растений и среднее число разветвленных корней у 15 растений составляло 8,8 см. Средняя длина основного корня была на 6,7 и 3,4 см больше, чем у растений, которые не были заражены микоризой. Исходя из этого видно, как микоризы увеличивают у растения корни, которые разветвляются на более широкой территории.
Авторы выражают огромную признательность и благодарность германской государственной компании (GIZ) за оказанную помощь в проведении данного исследования.
Список литературы Размножение Larix sibirica Ledeb. в культуре in vitro через соматический эмбриогенез и влияние микоризы на их рост в почве
- Gerdemann J. W. The Endogonaceae of the Pacific Northwest // Mycologia Memoir № 5. The Mycological Society of America, 1974. P. 38.
- Даваажаргал М., Ариунаа М., Буянчимэг Б., Оюунбилэг Б. Разможение Larix sibirica Ledeb in vitro через зиготический эмбриогенез (на монгольском языке). Улан-Батор, 2014. 202 с.
- Доржсурэн. Ч Антропогенные сукцессии в лиственничных лесах Монголии. Биологические ресурсы и природные условия Монголии // Тр. совместной российско-монгольской комплексной биологической экспедиции. М., 2009. Т. 50. 260 с
- Дугаржав Ч. Лиственничный лес Монголии (на монгольском языке). Улан-Батор, 2006. С. 9.
- Khasa P. D., Sigler L., Chakravarty P., Dancik B. P., Erickson L, Curdy D. Mc Effect of Fertilization on Growth and Ectomycorrhizal Development of Container-Grown and Bare-Root Nursery Conifer Seedlings // New Forests. 2001. No. 22. P. 179-197.
- Kim K. Wetal. Effect of ABA and Agar in Preventing Verification of Carnation Plantlets Cultured in vitro // J. of Korean Soc. for Hort. Sci, 1988. Vol. 29, № 3. P. 208-215
- Нандинцэцэг М. Исследование факторов, влияющих на микроклональные растения Larix sibirica Ledeb in vitro. Улан-Батор, 2015. С. 3.
- Оюунбилэг Ю., Мунхцэцэг Ц., Даваажаргал М. Растения in vitro. Улан-Батор, 2003. 44 с.
- Tretyakova I. N., Barsuliova A. V. Somatic Embryogenesis in in vitro Culture of Three Larch Species // Russian Journal of Developmental Biology. 2012. Vol. 43, No. 6. P. 353-361.
- Цэрэндэжид Л., Энхчимэг В. Влияние регуляторов роста на Larix sibirica Ledeb in vitro (на монгольском языке) // Mongolian Journal of Agricultural Sciences. 2019. No. 26(01). P. 108-116.
- Чекурова Г. В. Размножение клюквы крупноплодной в культуру in vitro // Бюлл. Г. 1990. Вып. 157. C. 90-95.
- Цогт З., Данилин И. М. Process of Young Larch Forests Emerging Formation and Some Growth Development Characteristics in Mongolian // Proceedings of the Mongolian Academy of Science. 2012. Vol. 52. No. 3(203). P. 34-39.


