Разнообразие микробных сообществ мелководных и прибрежных экосистем озера Байкал в летний период 2021-2022 гг
Автор: Зайцева С.В., Дагурова О.П., Цыренова Д.Д.
Журнал: Природа Внутренней Азии @nature-inner-asia
Рубрика: Биология
Статья в выпуске: 4 (26), 2023 года.
Бесплатный доступ
Структура микробного сообщества мелководных прибрежных участков тесно взаимосвязана с экологическими условиями и гидрохимическими параметрами, а также быстро меняется в ответ на негативные изменения экологического состояния водоемов, определяемые гидрологическими колебаниями. Исследована таксономическая структура микробных сообществ воды прибрежных мелководных участков оз. Байкал в период повышенной водности. На уровне филумов доминировали Proteobacteria, Actinobacteriota, Bacteroidota, Firmicutes, Cyanobacteria, Verrucomicrobiota и Deinococcota, составляя от 98,55 до 99,46 % общего микробного разнообразия. Выявлено значительное сходство таксономического состава микробных сообществ воды прибрежных мелководных участков оз. Байкал в определенные летние месяцы 2021-2022 гг. Сходные микробные сообщества формировались в июне 2021-2022 гг.; в июле 2022 г. на участках Энхалук и Сухая; в августе 2022 г. на участках Горячинск и Сухая.
Микробная экология, озеро байкал, изменение уровня воды, микробное сообщество, гидрохимические параметры озера
Короткий адрес: https://sciup.org/148328094
IDR: 148328094 | УДК: 579.2(517.3) | DOI: 10.18101/2542-0623-2023-4-12-22
Текст научной статьи Разнообразие микробных сообществ мелководных и прибрежных экосистем озера Байкал в летний период 2021-2022 гг
Влияние изменения уровня воды на микробные сообщества озер — один из наименее исследованных аспектов в знаниях об экологии пресных водоемов. Негативные изменения, связанные с гидрологическими колебаниями, могут оказывать сильное влияние на микробный состав и функционирование микробных сообществ воды и донных отложений и, следовательно, изменять биогеохимические циклы и потоки энергии в экосистеме [Weise et al., 2016; Ren et al., 2019]. Микробное сообщество тесно связано с экологическими условиями и гидрохимическими параметрами, а также способно быстро реагировать на негативные изменения экологического состояния водоемов, связанные с изменчивостью гидрологических и физико-химических характеристик [Li et al., 2017; Liu et al., 2019; Wang et al., 2021]. Прибрежная зона в озерных экосистемах особенно затронута увеличением колебаний уровня воды [Zohary and Ostrovsky, 2011; Evtimova & Donohue 2014] и экологические последствия изменения уровня, вероятно, будут наибольшими именно в мелководных прибрежных зонах [Wantzen et al., 2008]. В прибрежной зоне оз. Байкал особо выделяют заплесковую зону — район побережья, подверженный значительному воздействию ветро-волновой активности [Тимошкин и др. 2011]. Верхней границей зоны на пологом восточном побережье оз. Байкал принято считать границу максимального влияния ветро-волновой активности. Увеличение колебаний уровня воды отражается на гидрохимических и микробиологических показателях качества прибрежных и интерстициальных (воды из лунок) вод заплесковой зоны [Тимошкин и др., 2011]. Мелководные прибрежные участки озер тесно связаны с наземными экосистемами за счет поступления значительного количества аллохтонного органического вещества. На границе раздела суша и вода водный режим в значительной степени контролирует микробную трансформацию углерода и во время эпизодических гидрологических потоков может происходить интенсификация биогеохимических процессов [McClain et al., 2003; Gerull et al., 2011]. Были предложены соответствующие концептуальные схемы воздействия изменений уровня воды на микробные сообщества прибрежной зоны Байкала и выявлены некоторые возможные негативные изменения в структуре микробных сообществ прибрежных экосистем, связанные с гидрологическими колебаниями [Борисова и др., 2022]. Целью данного исследования было определить таксономическое разнообразие микробных сообществ воды мелководных участков оз. Байкал в многоводный период.
Материалы и методы исследования
Исследования были проведены в летние месяцы 2021–2022 гг., которые по значению уровня оз. Байкал характеризуются как многоводный период. Пробы были отобраны на участках восточного побережья с протяженными песчаными пляжами и с характерными гидрологическими и климатическими условиями. Участок у с. Гремячинск — это часть побережья, расположенная вне заливов и бухт в средней котловине оз. Байкал, с условиями, характерными для протяженной части восточного побережья озера. Типичным участком бухт восточного побережья можно рассматривать исследуемый участок у с. Горячинск. Участки у сел Энхалук и Сухая в дельте р. Селенги характерны для дельтовых прибрежных террасных участков. Пробы были отобраны в 1 м от уреза воды. Для проведения молекулярных исследований отбирали пробы воды объемом 1 л, фильтровали через мембранные фильтры (диаметр пор — 0,22 мкм) до забития. Выделение ДНК, создание библиотек ДНК для секвенирования согласно рекомендациям Illumina Sample Preparation Guide и секвенирование на платформе MiSeq («Illumina», США) проводились на оборудовании центра коллективного пользования «Геномные технологии, протеомика и клеточная биология» федерального государственного бюджетного учреждения «Всероссийский НИИ сельскохозяйственной метеорологии». Для амплификации использовали набор праймеров Ferier_F515: 5’-GTGCCAGCMGCCGCGGTAA-3’ и Ferier_R806: 5’-GGACTACVSGG GTATCTAAT-3’. Для биоинформационного анализа применяли программы QIIME version 1.9.1 и SILVA [Quast et al., 2013].
Статистическую и математическую обработку данных выполняли в программе XLSTAT (Addinsoft, Франция) и пакета программ MatLab (MatWorks, США). Анализ главных координат (PCoA) проводился в пакете MatLab11 с кластеризацией образцов по первым двум главным координатам. Предварительная обработка данных для стандартизации проводилась согласно рекомендациям Zuur et al. [2007]. Относительная численность микробных таксонов суммировалась на уровне филу-мов, классов, семейств и родов и включала только те микробные таксоны, которые представляли >1% общего микробного разнообразия хотя бы в одном образце. Микробные филумы, классы, семейства и рода с относительной численностью <1% во всех образцах были сгруппированы как «другие» соответственно.
Результаты и обсуждение
За последние пять лет уровень оз. Байкал характеризовался значительными перепадами (рис. 1). В 2018–2019 гг. показатели притока были в пределах средней водности [Бычков, Никитин, 2022], однако зимой-весной 2018 г. были отмечены низкие значения уровня в озере 455,73–455,94 м. Внутригодовая амплитуда (dH) превышала допустимые 0,85 м и составляла 1,09 м. В 2019 г. диапазон регулирования 456–457 м ТО соблюдался.
В 2020 г. при среднем годовом притоке, который соответствует обеспеченности 25 % и является верхней границей средней водности или нижней границей многоводного года по классификации Росстата, при высоких притоках в августе и сентябре, несмотря на повышенные расходы через Иркутскую ГЭС, уровень озера повысился до 457,07 м ТО [Бычков, Никитин, 2022]. Затем в 2021 г. наступил многоводный период, средний годовой приток имел обеспеченность 3–4 % и в третьей декаде сентября уровень озера достиг отметки 457,23 м ТО [Бычков, Никитин, 2022]. При этом негативные последствия отмечались как на восточном побережье оз. Байкал, так и в нижнем бьефе Иркутской ГЭС [Плюснин, Перязева, 2022]. В 2022 г. диапазон регулирования по постановлению № 234 [2001] 456–457 м ТО соблюдался.
Таксономическое разнообразие микробных сообществ воды прибрежных мелководных участков в летний период значительно варьировало (рис. 2).
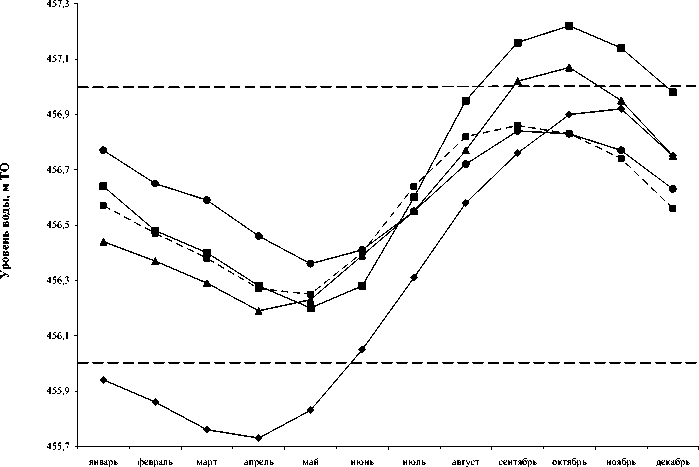
Рис. 1. Динамика изменений уровня оз. Байкал 2018-2022 гг. Представлены данные на первое число каждого месяца. Предельные значения уровня по постановлению № 234 [2001].
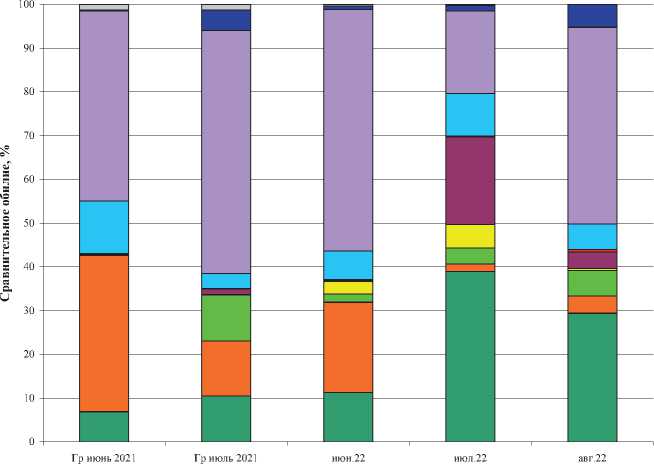
□ Другие
□ Verrucomicrobiota
□ Gammaproteobacteria
□ Alphaproteobacteria
□ Planctomycetota
□ Firmicutes
□ Deinococcota
□ Cyanobacteria
□ Bacteroidota
□ Actinobacteriota
Рис. 2. Таксономическое разнообразие микробных сообществ воды в летний период 2021–2022 гг.
На уровне филумов доминировали Proteobacteria , Actinobacteriota , Bacteroi-dota , Firmicutes , Cyanobacteria , Verrucomicrobiota и Deinococcota (от филума с наибольшей численностью далее по уменьшению), составляя от 98,55 до 99,46 % общего микробного разнообразия. Наиболее представленными среди протеобак-терий были Gammaproteobacteria (19–56 % общего разнообразия). Среди многочисленных представителей этого класса можно выделить семейство Comamona-daceae , которые достигали обилия до 27,5 % в июне 2021 г. Кроме них, в микробных сообществах доминировали гамма-протеобактерии родов Acinetobacter (4–38 %), Pseudomonas (до 17,5 %), Polynucleobacter (до 1,9 %), а в июльских пробах 2021 г. в микробных сообществах отмечено значительное количество (до 3,75 %) неклассифицированных представителей семейства Enterobacteriaceae , что свидетельствует об интенсивном антропогенном влиянии. Из представителей Alphaproteobacteria практически во всех пробах присутствовал р. Sphingomonas , который составлял до 9 % микробного разнообразия в июне 2021 г. Бактерии р. Brevundimonas составляли 10,9 % в микробном сообществе на участке Сухая в июле 2022 г. и 4,7 % на участке Горячинск в конце августа 2022 г. Филум Actinobacteriota в микробных сообществах в 2022 г. был в основном представлен неклассифицированными на уровне рода бактериями семейства Micrococcaceae (2–22 %) и кладой hgcI (0,5–5,5 %). Летом 2021 г. преобладали типичные пресноводные актинобактерии клады hgcI (0,5–5,5 %). Из представителей филума Bacte-roidota доминировали рода: Flavobacterium , Pseudarcicella , Sediminibacterium и Algoriphagus , однако их сравнительное обилие значительно варьировало. Интересно отметить, что в воде в июне 2021 г. отсутствовали представители филума Cyanobacteria , хотя в июльских пробах в составе микробного сообщества доминировали цианобактерии (до 10,5 %), представленные р. Cyanobium PCC-6307. Летом 2022 г. сравнительное обилие цианобактерий варьировало от 1,8 в июне до 6,9 % в августе, достигая максимального разнообразия и обилия в воде у с. Горя-чинск, отмечались токсичные цианобактерии Aphanizomenon NIES81 и Dolicho-spermum NIES41, которые способны формировать обильные цианобактериальные цветения [Cao et al. 2014]. Ранее сообщалось, что представители рода Dolichospermum NIES41 вызывали бурное цветение в литоральных участках в южной части Байкала в июле-августе 2019 г. [Белых и др., 2020].
Альфа-разнообразие микробных сообществ оценивали через индекс разнообразия Шеннона. Микробные сообщества воды мелководных участков были достаточно разнообразными. Индекс Шеннона варьировал от 3,63 до 3,86 летом 2021 г. и от 3,12 до 4,1 в летних пробах 2022 г. Наибольший индекс разнообразия был получен для микробного сообщества у с. Сухая в конце августа 2022 г. Для оценки бета-разнообразия микробных сообществ на уровне родов был проведен анализ главных координат (PCoA) с кластеризацией образцов по первым двум главным координатам. Анализ включал данные по 43 родам бактерий, которые представляли >1% общего микробного разнообразия хотя бы в одном образце (рис. 3).
Бактерии Nocardioides , unclassified_ Micrococcaceae , Exiguobacterium , Marmo-ricola , Phycicoccus , unclassified_ Intrasporangiaceae , Deinococcus и Sediminibacte-rium имели наибольший вклад в распределение по первой главной координате (РСо1). Актинобактерии группы CL500-29 и клады hgcI, веррукомикробии
Luteolibacter , цианобактерии Cyanobium PCC-6307, протеобактерии Comamo-nadaceae , Methylobacterium-Methylorubrum , Acinetobacter и Sphingomonas , а также представители филума Bacteroidota бактерии р. Pseudarcicella и Flavobacterium в большей степени определяли распределение по второй главной координате (РСо2). По результатам проведенного анализа можно сделать заключение о формировании сходных микробных сообществ в прибрежных мелководных участках в определенные летние месяцы: июнь 2021/июнь 2022; в июле 2022 г. на участках Энхалук и Сухая; в августе 2022 г. на участках Горячинск и Сухая; пробы ‘Гремячинск июль 2021’ и ‘Горячинск2 август 2022’ образовывали отдельный кластер на графике главных координат (рис. 3).
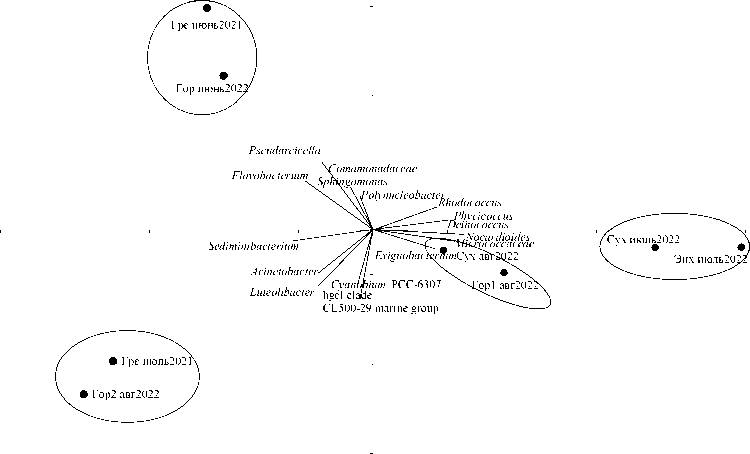
РСо1 28%
Рис. 3. Анализ главных координат (PCoA) с кластеризацией образцов по первым двум главным координатам
Сходный состав микробных сообществ выявлен в июньских пробах прибрежной воды в 2021 г. и 2022 г. Топ 10 таксонов (>1 % сравнительного обилия) в пробе ‘Гремячинск июнь 2021’ составляли unclassified_Comamona-daceae (27,8 %), Flavobacterium (23,4 %), Sphingomonas (9,0 %), Pseudarcicella (9,0 %), Pseudomonas (5,3 %), Acinetobacter (4,1 %), Polynucleobacter (1,9 %), unclassified_Oxalobacteraceae (1,4 %), Methylobacterium-Methylorubrum (1,2 %) и Sediminibacterium (1,2 %). Бактерии семейства Comamonadaceae представлены метаболически разнообразными водными и почвенными микроорганизмами, которые включают аэробных органотрофов, анаэробных денитрификаторов, водородокисляющих и Fe3+-восстанавливающих бактерий, фотоавтотрофных и фотогетеротрофных бактерий [Decleyre et al., 2015] и, возможно, свидетельствуют о распространении почвенных микроорганизмов при изменении гидрологических условий. Большинство Flavobacterium являются хемоорганотрофами и способны использовать сложные органические вещества в качестве источника углерода [Parulekar et al., 2017]. Кроме того, показано разнообразие и высокое обилие Flavobacterium в эвтрофных озерах и выявлены взаимосвязи их распространения с цианобактериальными цветениями и трофностью пресных водоемов [Eiler, Bertilsson 2007; Parulekar et al., 2017; Özbayram et al., 2020]. Flavobacterium (29 %) и бактерии семейства Comamonadaceae (14 %) доминировали в микробном сообществе прибрежной воды в крупном пресном озере Сапанджа (Турция) во время интенсивного цианобактериального цветения [Özbayram et al 2020]. Напротив, бактерии р. Pseudarcicella, которые составляли 9 % микробного разнообразия в прибрежном мелководье оз. Байкал в июне 2021 г., рассматриваются некоторыми исследователями как значимый индикатор благополучного состояния пресноводных экосистем [Li et al., 2017; Salmaso et al., 2018; Guo et al., 2021]. Flavobacte-rium (9,5 %), бактерии семейства Comamonadaceae (6,7 %) и Pseudarcicella (2,2 %) сохраняли свое доминирующее положение и в составе микробного сообщества прибрежной воды оз. Байкал в июне 2022 г. Другими доминирующими таксонами в этой пробе были рода: Acinetobacter (22,6 %), Stenotrophomonas (14,9 %), Comamonas (5,5 %), Empedobacter (4,2 %), unclassified_Enterobacteriaceae (3,7 %), Deinococcus (2,8 %), Methylobacterium-Methylorubrum (2,8 %), Rhodoluna (2,5 %), unclassified_Micrococcaceae (2,2 %), Flectobacillus (1,4 %) и Aphanizomenon NIES81 (1,4 %). Обращает на себя внимание присутствие значительного количества последовательностей, связанных с потенциально токсичными цианобактериями Aphanizomenon NIES81, и доминирование р. Stenotrophomonas, некоторые представители которого способны к деградации микроцистинов, образуемых во время цианобактериального цветения [Yang et al., 2014]. Высокое относительное обилие р. Stenotrophomonas (6,4%) также было определено в пробе ‘Гор2’ в конце августа 2022 г. В оз. Байкал цианобактерии, продуцирующие цианотоксины группы сакситоксина и микроцистина выявляются с 2010 г. в планктоне прибрежной зоны около пос. Турка, в Баргузинском и Чивыркуйском заливах [Belykh et al., 2017]. В планктоне этих мелководных районов выявлены Aphanizomenon flosa-quae, Dolichospermum flosaquae, D. lemmermannii, D. macrosporum, D. solitarium, D. mucosum, D. planctonicum, D. smithii, Gloeotrichia echinulata, Merismopedia sp., Microcystis sp., M. aeruginosa, Chamaesiphon sp., Phormidium sp., Tolypothrix sp. [Белых и др., 2020]. Микроскопический и генетический анализ обрастаний, отобранных в 2014–2017 гг. с различных субстратов, выявил массовое развитие бентосных цианобактерий с доминированием видов Symplocastrum sp., Tychonema sp., Tolypothrix distorta, Pseudanabaena spp., Oscillatoria curviceps, Kamptonema formosum, Leptolyngbya spp., а также содержащие гены синтеза цианотоксинов [Belykh et al., 2017]. Массовое увеличение биомассы фитопланктона в мелководных прибрежных участках, способное оказать существенное влияние на круговорот питательных веществ и устойчивость экосистемы озера Байкал, выявлялось в условиях маловодного периода 2014–2017 гг. [Борисова и др., 2022]. Доминирование цианобактерий в микробных сообществах прибрежной воды оз. Байкал может служить индикатором неблагоприятных изменений при изменении уровня.
Выводы
-
1. Были выявлены особенности таксономического состава бактериальных сообществ мелководных прибрежных участков оз. Байкал в многоводный период. На уровне филумов доминировали Proteobacteria , Actinobacteriota , Bacteroidota , Firmicutes , Cyanobacteria , Verrucomicrobiota и Deinococcota . Среди представителей самого многочисленного класса Gammaproteobacteria можно выделить семейство Comamonadaceae , которые присутствовали во всех образцах и достигали максимума в июне 2021 г. Кроме них, в микробных сообществах доминировали рода Acinetobacter (4–38 %), Flavobacterium (0,3–23,4 %), unclassified_ Micrococcaceae (до 22 %), Exiguobacterium (до 15,5 %), Pseudomonas (до 17,5 %) и Cyanobium PCC-6307 (до 10 %). Альфа-разнообразие микробных сообществ различалось незначительно.
-
2. Важным фактором структуры микробных сообществ воды в период многоводья является значительное количество микроорганизмов семейства Comamona-daceae , занимающих до 27 % общего микробного разнообразия, что, возможно, обусловлено распространением почвенных бактерий в прибрежных мелководных участках при повышении уровня воды.
-
3. Представители филума Cyanobacteria не были выявлены в составе микробного сообщества воды в июне 2021 г. Цианобактерии р. Cyanobium PCC-6307 доминировали (до 10,5 %) в июльских пробах. Летом 2022 г. сравнительное обилие цианобактерий варьировало от 1,8 до 6,9 %, достигая максимального разнообразия и обилия в воде у с. Горячинск, где отмечались токсичные цианобактерии Aphanizomenon NIES81 и Dolichospermum NIES41.
-
4. Выявлено значительное сходство таксономического состава микробных сообществ воды прибрежных мелководных участков оз. Байкал в определенные летние месяцы 2021–2022 гг.
Список литературы Разнообразие микробных сообществ мелководных и прибрежных экосистем озера Байкал в летний период 2021-2022 гг
- Белых О.И., Федорова Г.А., Кузьмин А.В. и др. Микроцистины в цианобактериальных биопленках литорали озера Байкал. Вестник биологических наук Московского университета . 2017 год; 72: 225–231. DOI: 10.3103/S0096392517040022
- Цао Х., Шимура Й., Масанобу К., Инь Й. Проект последовательности генома цианобактерии, образующей токсичное цветение, Aphanizomenon flos-aquae NIES-81. Геномные объявления. 2014 г.; 2(1):e00044-14. DOI: 10.1128/геномA00044-14
- Деклейр Х., Хейлен К., Ван Колен К. и Виллемс А. Диссимиляционное восстановление азота в приливных отложениях устья умеренного пояса: мелкомасштабная гетерогенность и новые восстановители нитрат-аммония. Передний. Микробиол. 2015 г.; 6: 1124. DOI: 10.3389/fmicb.2015.01124.
- Эйлер А., Бертилссон С. Цветение флавобактерий в четырех эвтрофных озерах: связь динамики популяций пресноводного бактериопланктона с наличием ресурсов. Прикладная и экологическая микробиология. 2007 г.; 73: 3511–3518. DOI:10.1128/АЕМ.02534-06
- Евтимова В.В., Донохью И. Количественная оценка экологической реакции на усиленные колебания уровня воды в стоячих водах: экспериментальный подход. Журнал прикладной экологии. 2014 г.; 51: 1282–1291. DOI: 10.1111/1365-2664.12297.
- Герулл Л., Фроссар А., Гесснер М.О., Мутц М. Изменчивость гетеротрофного метаболизма в малых речных коридорах раннего сукцессионного водораздела. Дж. Геофиз. Рез. Биогеология. 2011 г.; 116: Г0201210. DOI: 1029/2010JG001516
- Го Д., Лян Дж., Чен В. и др. Анализ бактериального сообщества двух соседних пресноводных озер, происходящих из одного озера. Пол. Дж. Энвайрон. Стад. 2021 год; 30: 111–117. DOI: 10.15244/pjoes/119094
- Ли З., Лу Л., Го Дж. и др. Реакция пространственно-временной динамики сообщества бактериопланктона на эксплуатацию крупномасштабного водохранилища: пример водохранилища «Три ущелья», Китай. Научный представитель 2017; 7: 42469. DOI: 10.1038/srep42469.
- Лю Дж., Чен Ю., Ли М. и др. Колебания уровня воды являются ключевыми для таксономических сообществ и функциональных групп фитопланктона в озере Поянге. Экол. Индия, 2019 г.; 104: 470–478. DOI: 10.1016/j.ecolind.2019.05.021
- Макклейн М.Э., Бойер Э.В., Дент К.Л. и др. Биогеохимические горячие точки и горячие моменты на стыке наземных и водных экосистем. Экосистемы. 2003 г.; 6: 301–312. DOI: 10.1007/s10021-003-0161-9
- Озбайрам Э.Г., Кокер Л., Акчаалан Р. и др. Состав бактериального сообщества озера Сапанджа во время цветения цианобактерий. Водные науки и инженерия. 2020; 35 (2): 52–56. DOI: 10.26650/ASE2020652073
- Парулекар Н.Н., Колекар П., Дженкинс А. и др. Характеристика бактериального сообщества, связанного с цветением фитопланктона в эвтрофном озере в Южной Норвегии, с использованием анализа последовательности ампликона гена 16S рРНК. ПЛОС ОДИН. 2017 год; 12(3): e0173408. DOI: 10.137/журнал. поне.0173408
- Кваст С., Прюсс Э., Йылмаз П. и др. Проект базы данных генов рибосомальной РНК SILVA: улучшенная обработка данных и веб-инструменты. Нукл. Кислоты Рез. 2013; 41: Д590–Д596.
- Жэнь З., Цюй С., Чжан М., Ю Ю. и Пэн В. Отличительные бактериальные сообщества во влажные и засушливые сезоны во время сезонных колебаний уровня воды в крупнейшем пресноводном озере (озере Поян) в Китае. Передний. Микробиол. 2019 год; 10: 1167. DOI: 10.3389/fmicb.2019.01167.
- Салмазо Н., Альбанезе Д., Капелли К. и др. Разнообразие и циклические сезонные переходы бактериального сообщества большого и глубокого периальпийского озера. Микробная экология. 2018 год; 76: 125–143. DOI: 10.1007/s00248-017-1120-x.
- Ван С., Ян Г., Цзюньцзе Дж. и др. Уровень воды как ключевой контролирующий регулятор, связанный с изменениями питательных веществ и валовой первичной продуктивности в большой пойменно-озерной системе (озеро Поян), Китай. Журнал гидрологии. 2021 год; 599:126414 DOI: 10.1016/j.j Hydrol.2021.126414.
- Ванцен К.М., Ротхаупт К.-О., Мёртл М. и др. Экологические последствия колебаний уровня воды в озерах: актуальная проблема. Гидробиология. 2008 г.; 613: 1–4. DOI: 10.1007/с10750-008-9466-1
- Вайзе Л., Ульрих А., Мореано М. и др. Изменения уровня воды влияют на круговорот углерода и состав микробного сообщества в отложениях озера. ФЭМС Микробиология Экология. 2016 г.; 92(5): fiw035. DOI: 10.1093/femsec/fiw035
- Ян Ф., Чжоу Ю., Инь Л. и др. Микроцистин-деградирующая активность местного бактериального штамма Stenotropomonas acidaminiphila MC-LTH2, выделенного из озера Тайху. ПЛОС ОДИН. 2014 г.; 9(1): e86216. DOI: 10.1371/journal.pone.0086216
- Зохарий Т. и Островский И. Экологические последствия чрезмерных колебаний уровня воды в стратифицированных пресноводных озерах. Внутренние воды. 2011 г.; 1 (1): 47–59. DOI: 10.5268/IW-1.1.406
- Зуур А.Ф., Иено Э.Н., Смит Г.М. Анализ экологических данных. Нью-Йорк: Спрингер, 2007, стр. 672.
- Токсин-продуцирующие цианобактерии в озере Байкал и водоемах Байкальского региона (обзор) / О. И. Белых, И. В. Тихонова, А. В. Кузьмин [и др.] // Теоретические проблемы экологии. 2020. № 1. С.21–27. DOI: 10.25750/1995-4301-2020-1-021-027. Текст: непосредственный.
- Концептуальные схемы изменений уровня озера Байкал на биоту прибрежных экосистем / Н. Г. Борисова, О. А. Аненхонов, С. В. Зайцева [и др.] // География и природный ресурс. 2022. № 5. С. 133–142. DOI: 10.15372/GIPR20220514. Текст: непосредственный.
- Бычков И. В., Никитин В. М. Современные проблемы регулирования уровня озера Байкал // География и природные ресурсы. 2022. № 5. С. 13–24. DOI: 10.15372/ГИПР20220502. Текст: непосредственный.
- Плюснин А. М., Перязева Е. М. Воздействие подъема уровня Байкала на инженерные сооружения прибрежных поселений // География и природные ресурсы. 2022. № 5. С. 74–82. DOI: 10.15372/GIPR20220508ю Текст: непосредственный.
- О предельных значениях уровней воды в озере Байкал при прекращении хозяйственной и иной деятельности: постановление правительства Российской Федерации от 26 марта 2001 г. № 234 // Собрание законодательства РФ. 2001. № 14. 1366 с. Текст: непосредственный.
- Тимошкин О. А., Сутурин А. Н., Бондаренко Н. А. [и др.] Биология прибрежной зоны озера Байкал. Сообщение 1. Заплесковая зона: первые результаты междисциплинарных исследований, направляющих для экосистемы // Изв. Иркут. гос. ун-та. Сер. Биология. Экология. 2011. Т. 4, № 4. С. 75–110. Текст: непосредственный.


