Разработка и апробация экспериментальных серий вакцин против некробактериоза
Автор: Хузин Д.А., Мельник Н.В., Латфуллин Д.Н., Макаев Х.Н., Самуйленко А.Я., Мельник Р.Н., Гринь С.А.
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 4 (36), 2019 года.
Бесплатный доступ
Ранняя диагностика болезней конечностей крупного рогатого скота и квалифицированный уход за копытцами - залог продуктивного долголетия животных. Разработка и внедрение новых, эффективных методов профилактики заболеваний позволяет увеличить срок хозяйственного использования коров и повысить рентабельность сельхозпредприятий. Болезни дистального отдела конечностей развиваются вследствие первичного механического повреждения, деформации, мацерации рога и дальнейшего их инфицирования. У крупного рогатого скота в подавляющем большинстве случаев возбудителями хирургических инфекций являются различные микробные ассоциации. Вследствие изменения условий внешней среды, под воздействием физических нагрузок и стресса защитные функции организма значительно снижаются. Это способствует стимуляции жизнедеятельности патогенных микроорганизмов, в том числе возбудителя некробактериоза. Цель данной работы - подбор антигенов и адъювантов для изготовления экспериментальных серий вакцин против некробактериоза и их апробация в условиях неблагополучных по некробактериозу хозяйствах...
Некробактериоз, антиген, адъювант, вакцина, крупный рогатый скот
Короткий адрес: https://sciup.org/142223221
IDR: 142223221 | УДК: 619:616.98:686.2
Текст научной статьи Разработка и апробация экспериментальных серий вакцин против некробактериоза
Животноводство – важнейшая и многогранная отрасль народного хозяйства [6]. В обеспечении потребностей населения животноводческой продукцией важно повышение объемов производства молока [1; 13]. Разведение высокопродуктивного молочного скота и внедрение промышленных технологий его содержания и эксплуатации на сельхозпредприятиях страны в настоящее время – определяющее направление развития молочного скотоводства [7].
Молочное скотоводство – процесс, при котором главным средством производства служит корова [9]. При длительном стойловом содержании у коров сильно отрастает копытцевый рог, приводя к появлению трещин, развитию воспалений и хромоты. У заболевших животных ухудшается аппетит и снижается продуктивность, их приходится выбраковывать [2]. В числе основных факторов заболеваемости и выбытия из стада высокопродуктивных племенных животных – неполноценное и несбалансированное кормление, гиподинамия, скученность, травматизм, невыполнение зоогигиенических и ветеринарно-санитарных требований, а также отсутствие планового и систематического ухода за копытцами. Слишком твердый и недостаточно упругий копытцевый рог подвержен растиранию, расслаиванию, а при чрезмерном отрастании – заломам, это в свою очередь приводит к инфекционным процессам в области копытец. Одной из распространенных форм проявления болезней конечностей коров является некробактериоз [8].
Применение отечественных моно- и поливалентных вакцин против некробакте-риоза крупного рогатого скота значительно снижает заболеваемость животных, однако не всегда позволяет полностью решить проблему [3; 10].
Несмотря на противоречивые точки зрения об иммунитете при некробактериозе и иммуногенности существующих вакцин, результаты производственных испытаний многих авторов свидетельствуют: вакцинация КРС – важное звено в профилактике этого заболевания [4; 11]
Одним из методов усовершенствования иммунопрофилактики заболевания является испытание новых антигенных комплексов и адъювантов, оптимальных методов, доз и кратности вакцинации животных против некробактериоза [5; 12].
В связи с этим наши исследования были направлены на дальнейшее изучение антигенной активности, реактогенности и профилактической эффективности экспериментальных серий вакцин в сравнении с зарегистрированной в Российской Федерации формол-эмульсионной вакциной (ФЭВ) против некробактериоза крупного рогатого скота.
Объекты и методы
Испытания экспериментальных серий вакцин против некробактериоза проводили в трех неблагополучных по некробактериозу КРС хозяйствах на территории Республики Татарстан. В опытах использовали 76 быков старше 8-месячного возраста живой массой 350–400 кг и 30 дойных коров 1–2-й лактации живой массой 450–500 кг.
Вакцины вводили безыгольным инъектором БИ-7 по 0,2 мл в область средней трети шеи с двух сторон, предварительно выстригая и обрабатывая место введения спиртом-ректификатом.
Контрольные группы иммунизировали ФЭВ против некробактериоза внутримышечно в область средней трети шеи в дозе 2,0 мл.
Часть животных не иммунизировали и использовали в качестве контроля. Антигенную активность препаратов испытывали в РА с гомологичными антигенами (8TS630501 и 12TSK630501 соответственно вариантам вакцины).
Перед применением вакцины испытывали по показателям:
-
– стерильности – на мясо-пептонном агаре (МПА), мясо-пептонном бульоне (МПБ), среде Китта – Тароцци и среде Сабуро;
-
– безвредности – на 32 белых мышах.
-
– антигенной активности и реактогенности – на 32 кроликах.
Стабильность эмульсии серии вакцины проверяли, используя методы:
-
– центрифугирования;
-
– «холод – тепло» (-20°С – 1 час; +37°С – 1 час);
-
– «быстрого старения» (помещали флаконы с вакциной в термостат на 14 сут).
Экспериментальная часть
В качестве антигена для изготовления ФЭВ использовали антигеные комплексы маркированных производственных штаммов 8TS630501 и 12TSK630501. В качестве адъюванта – вакцинное масло ПЭС-3 + ланолин (7 : 1).
Для изготовления экспериментальных серий вакцин в качестве антигена использовали полевые изоляты («МРТ», «ТВТ» и «САТ»), выделенные из трех неблагополучных по некробактериозу хозяйств Республики Татарстан. Использованы адъюванты (№ 1, № 3), предоставленные ассоциацией «Ветбиопром», г. Москва.
Антигены для изготовления вакцины готовили на основе инактивированных водорастворимых цитоплазматических фракций эндотоксина бактерийных клеток и экзотоксина культуральной жидкости.
Для получение стабильной эмульсии к охлажденному до 4°С адъюванту при перемешивании (1000 об/мин) медленно вводили водную фазу (антиген). Соотношения антигена к адъюванту были 50 : 50 и 65 : 35. Полученную смесь гомогенизировали при 7 тыс. об/мин в течение 30 мин. Полученные серии экспериментальных вакцин маркировали как 1/1; 1/2 и, соответственно, 3/1; 3/2.
Также нами были испытаны три серии вакцины (М1, М2, М3), изготовленные во Всероссийском научно-исследовательском и технологическом институт биологической промышленности (ФГБНУ ВНИТИБП).
Результаты исследований
Испытания на стерильность, безвредность, антигенную активность и реактоген-ность экспериментальных серий вакцин и ФЭВ против некробактериоза представлены в табл. 1.
Как видно в табл. 1, при высеве экспериментальных серий вакцин и ФЭВ на элективные питательные среды рост бактериальной микрофлоры и грибов не отмечался. Подкожная инъекция вакцин белым мышам не вызывала их гибели. При постановке РА на 30-й день после вакцинации зафиксировано антителообразование, отвечающее требованиям иммуногенности препарата. На месте введения наблюдали депо вакцины в виде пуговки размером от 0,5 × 0,5 до 1,5 × 1,5 см, постепенно оно рассасывалось. У некоторых кроликов отмечали гнойнички, которые вскрывались с образованием струпа. Регистрировали индивидуальную чувствительность некоторых кроликов к внутрикожному введению вакцины.
Таблица 1
Испытания экспериментальных серий вакцин и ФЭВ против некробактериоза
|
Показатель |
Объект исследования |
Варианты вакцины |
|||||||
|
1/1 |
1/2 |
3/1 |
3/2 |
М1 |
М2 |
М3 |
ФЭВ |
||
|
Стерильность + (пророст)/ – (отсутствие пророста) |
МПА |
— |
— |
— |
— |
— |
— |
— |
— |
|
МПБ |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
Китта – Тароцци |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
Сабуро |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
Безвредность (пало/выжило) |
Белые мыши – инъекция подкожно в обл. спины по 0,5 мл |
0/5 |
0/5 |
0/5 |
0/5 |
0/5 |
0/5 |
0/5 |
0/5 |
|
Антигенная активность, титр антител в сыворотке крови в РА |
Кролики, вакцинированные внутрикожно в область спины по 0,2 мл безыгольным инъ-ектором БИ-7 |
1 : 320 |
1 : 160 |
1 : 160 |
1 : 80 |
1 : 160 |
1 : 80 |
1 : 320 |
1 : 80 |
|
Реактогенность (размер припух лости в см) |
1,0 × 1,0 |
0,6 × 0,6 |
0,7×0,7 |
0,5× 0,5 |
0,8× 0,8 |
1,0 × 1,0 |
1,5 × 1,5 |
0,5 × 0,5 |
|
Наиболее активными по антигенности оказались варианты вакцины 1/1 и М3 (1 : 320), однако они же давали более выраженную кожно-алергическую реакцию (1,0 × 1,0 см и 1,5 × 1,5 см соответственно). ФЭВ при внутрикожном введении показала низкую антигенную активность и реактогенность, кроме того, она плохо вводилась безы-гольным инъектором БИ-7.
Положительные исследования разных вариантов вакцин на лабораторных животных позволили нам испытать их в производственных условиях на ограниченном поголовье КРС (откормочных быках и коровах).
Результаты клинико-иммунологического обследования быков и коров, вакцинированных экспериментальными сериями и ФЭВ, представлены в табл. 2.
По показателям табл. 2, у быков, иммунизированных экспериментальными сериями, изготовленными в ФГБНУ ВНИТИБП, наиболее активной в антигенном отношении оказалась вакцина М3 – титр антител в РА у быков и коров – 1 : 200 ± 2,07 и 1 : 320 соответственно. Среди опытных образцов вакцин с включением производственных и местных изолятов «МРТ», «ТВТ» и «САТ» наиболее активные в антигенном отношении у быков серии 1/1(1 : 266 ± 2,42), 3/1(180 ± 2,25), 1/2(106,6 ± 2,02) и 3/2(120 ± 2,07).
Самая реактогенная среди трех серий вакцин, изготовленных в ФГБНУ ВНИТИБП, М3, при внутрикожном введении быкам вызывала местную реакцию в пределах 36 × 38 мм через месяц после вакцинации, через три месяца была 44 × 44 мм и сохранялась до шести месяцев в диаметре 16,67 × 18,3 мм. Менее реактогенные вакцины М1 и М2. При введении опытных образцов вакцины, изготовленных по нашей технологии, местная реакция на месте введения через месяц была в пределах 25 × 25…26 × 30 мм и на шестой месяц сохранялась у отдельных животных в пределах 7 × 8…12 × 13 мм. У быков, привитых ФЭВ внутрикожно, местная реакция на введение вакцины менее выражена и достигала 25 мм, рассасывалась к четвертому месяцу. У животных, иммунизированных ФЭВ внутримышечно, местная реакция не отмечена. Через месяц после вакцинации они реагировали в РА с гомологичным антигеном в титре 1 : 280 ± 0,0; через три месяца – 1 : 120 ± 2,07; через шесть месяцев – 1 : 93,3 ± 1,96.
На 7–14 сут у двух бычков в группах 1/1, М1 отмечали хромоту. В последующие сроки при наблюдении животных с хромотой:
-
– через три месяца в группе М1 и 1/2 – по одному животному;
-
– через шесть месяцев – по одному в группе 3/1 и М1.
Результаты испытания экспериментальных серий вакцин против некробактериоза в хозяйствах
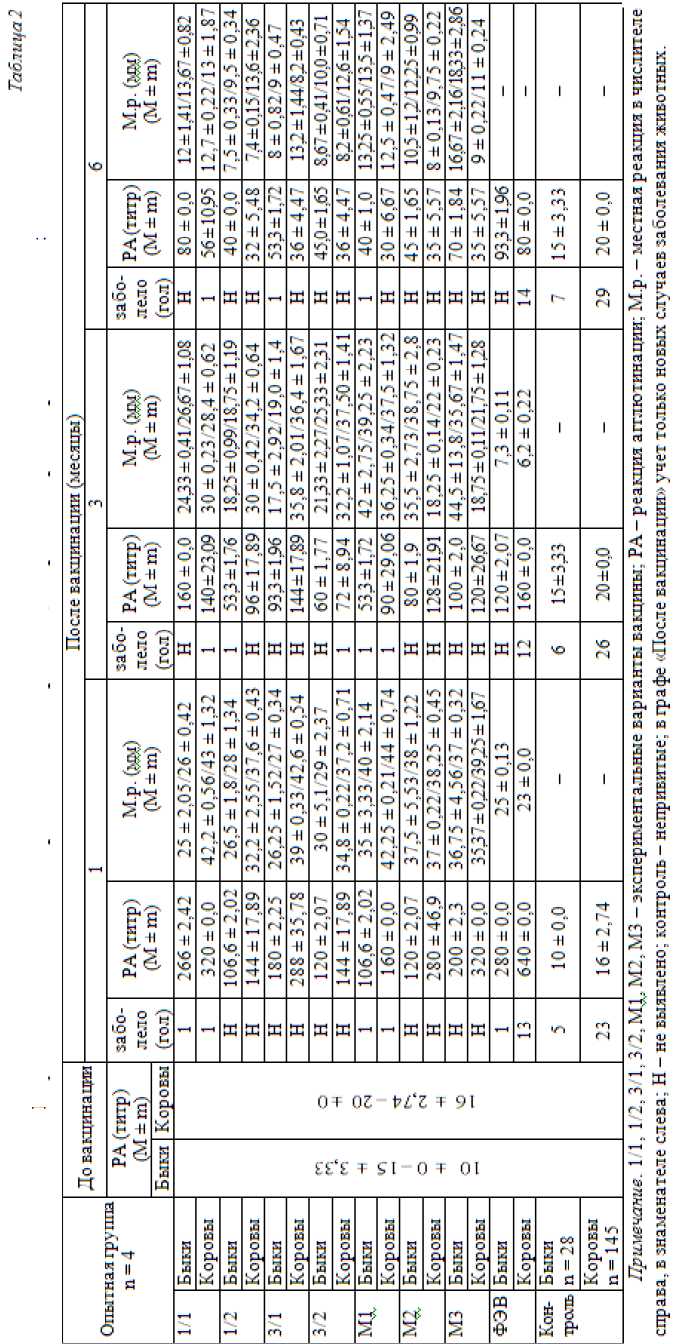
За указанный период в контрольной группе у непривитых животных болезни разной степени тяжести выявляли через месяц – у пяти, через три – у шести, через шесть месяцев – у 7 быков. Среди быков, вакцинированных ФЭВ, выявлен один с поражением конечностей в первый месяц осмотра, в последующие месяцы наблюдения новые случаи некробактериоза не отмечены.
Среди коров фоновые показатели титра антител на антигены из штаммов 8TS630501 и 12TSK630501 не превышали 16 ± 2,74–20 ± 0,0. Через 30 дн. после вакцинации наиболее высокие титры антител в РА отмечали у животных, привитых вакцинами 1/1(1 : 320 ± 0,0), 3/1(1 : 288 ± 35,78), а вакцинами 1/2 и 3/2 в титре 1 : 144 ± 1,89. Вакцина М3 вызывала антителообразование в титре РА – 1 : 320 ± 0,0, М2 – 1 : 280 ± 46,9, М1 – 1 : 160 ± 0,0, а ФЭВ в первый месяц – 1 : 640 ± 0,0 с последующим понижением до 1 : 80 ± 0,0.
На месте внутрикожного введения опытных вариантов вакцин образовалась припухлость – депо вакцины, в диаметре до 44 мм. Некоторые гнойнички больших размеров вскрывались с образованием струпа. У большинства животных они рассасывались через 5–7 мес. Наиболее реактогенной среди серий вакцины, изготовленных в ИБВМ, выявлена М1. Местная реакция через месяц на ее введение была в пределах 42 × 44 мм, через три месяца – 36 × 37 и сохранялась до шести месяцев в диаметре 12,5 × 14,25 мм. У опытных образцов, изготовленных по нашей технологии, местная реакция на месте введения через месяц – в пределах 32 × 39…42 × 43 мм, на шестой месяц отмечена лишь у отдельных животных в пределах 7 × 8…12 × 13 мм. В первый месяц после иммунизации среди коров, привитых экспериментальными сериями вакцины, выявлены единичные случаи хромоты, а привитых ФЭВ на 30-й день заболевания – у 3,1%, на третий месяц – у 2,8%, на шестой месяц – у 3,3%, в контроле непривитых коров соответственно заболело 15,8, 17 и 20% голов.
Заключение
В результате испытаний экспериментальных серий вакцин, при двукратном внутрикожном введении, установлена более высокая анти- и иммуногенная активность у изготовленных с включением производственных и местных изолятов возбудителя некробактериоза. При испытании экспериментальных серий вакцин на быках и коровах с включением местных изолятов выявлены лишь единичные случаи заболевания. При внутримышечном введении ФЭВ среди вакцинированного скота количество заболевших на протяжении шести месяцев не превышало 3,3%, тогда как среди контрольных животных поражения копытец достигли 20%.
Испытание стерильности, безвредности, реактогенности, антигенной и иммуногенной активности экспериментальных серий вакцин свидетельствует о перспективности дальнейших исследований по разработке и внедрению технологии изготовления вакцины с включением производственных и местных изолятов возбудителя и иммунизации крупного рогатого скота против некробактериоза.
D.A. Khuzin2, N.V. Mel’nik1, D.N. Latfullin2, Kh.N. Makaev2, A.Ya. Samuylenko3,
R.N. Me’lnik3, S.A. Grin’3
-
1National Association “Vetbioprom”, Moscow
-
2Federal Center for Toxicological, Radiation and Biological Safety, Kazan
-
3All-Russian Research and Technological Institute of Biological Industry, Moscow Region, settlement of Biokombinat
Development and testing of experimental lots of vaccine against necrobacillosis
Список литературы Разработка и апробация экспериментальных серий вакцин против некробактериоза
- Аширов М.Э. Продуктивные качества коров в зависимости от типа телосложения / М.Э. Аширов, У.Р. Соатов // Зоотехния. - № 8. - 2015. - С. 19-20.
- Ганущенко О. Готовим пастбище и скот к выпасу / О. Ганущенко // Животноводство России. - № 1. - 2018. - С. 43-46.
- Опыт борьбы с некробактериозом животных / Ю.Д. Караваев [и др.] // Ветеринария. - 2003. - № 7. - С. 7-9.
- Лопатин С.В. Оптимизация системы контроля эпизоотического процесса некробактериоза крупного рогатого скота: дис. … д-ра вет. наук / С.В. Лопатин. - Новосибирск. - 2006. - 311 с.
- Производственные испытания рекомендаций и системы ветеринарно-санитарных мероприятий по профилактике некробактериоза крупного рогатого скота / Н.В. Мельник [и др.] // Вестн. рос. с.-х. науки. - 2019. - № 2. - С. 62-64.
- Мысик А.Т. Развитие животноводства в мире и России / А.Т. Мысик // Зоотехния. - № 1. - 2015. - С. 2-5.
- Нежданов А. Ветеринарные аспекты сохранения репродуктивного потенциала молочного скота / А. Нежданов, К. Лободин // Ветеринария сельскохозяйственных животных. - № 2. - 2019. - С. 3-8.
- Руколь В. Болезнь Мортелларо / В. Руколь // Животноводство России. - № 3. - 2018. - С. 57-59.
- Саморуков Ю. Сохранить молочное скотоводство России / Ю. Саморуков, В. Иванов, Н. Марзанов // Животноводство России. - № 7. - 2017. - С. 35-38.
- Сидорчук А.А. Поиск протективных антигенов фузобактерий - F. necrophorum / А.А. Сидорчук // Актуальные вопросы инфекционных и инвазионных болезней животных; Тр. МГАВМ. - М., 2000. - Т. 6. - С. 88-92.
- Соломаха О.И. Некробактериоз - комплексное решение проблемы / О.И. Соломаха // Аграрная Россия. - 2001. - № 3. - С. 38-42.
- Болезни пальцев и копытец у коров, их профилактика и лечения / Д.А. Хузин [и др.] // Вет. врач. - 2014. - № 5. - С. 24-28.
- Young N.R. Effect of management of white clover in seeded hill. N.R. Young. Forage Legumes. - 1984. - Р. 201-202.


