Разработка и доклиническое исследование парамагнитных контрастных препаратов на основе органических комплексов марганца (II) для магнитно-резонансной томографии
Автор: Усов В.Ю., Белянин М.Л., Првулович М., Бородина Е.Е., Евтушенко А.В., Бородин О.Ю., Павлюкова Е.Н., Филимонов В.Д.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.22, 2007 года.
Бесплатный доступ
Осуществлена разработка, производство и проведены доклинические и клинические испытания контрастного препарата - парамагнетика для МР-томографии - 0,5М раствора комплекса Mn (II)- диэти- лентриаминпентаацетата (ДТПА) - Пентаманга. Релаксивность R1, (при B0=0,20 Т) Mn-ДТПА составила 4,21±0,03 ммоль-1*с-1(у гадопентетата - Gd-ДТПА 3,93±0,02). При внутривенном введении крысам LD50 = 14,1±4,5 мл/кг. Визуализирующие свойства Mn-ДТПА при МРТ близки таковым у гадопентетата.
Магнитно-резонансная томография, парамагнитное контрастирование, mn-диэтилен- триаминпетаацетат, ™пентаманг
Короткий адрес: https://sciup.org/14918743
IDR: 14918743 | УДК: 616-073.756.8
Текст научной статьи Разработка и доклиническое исследование парамагнитных контрастных препаратов на основе органических комплексов марганца (II) для магнитно-резонансной томографии
Применение парамагнитных контрастных препаратов составляет сегодня одно из важнейших направлений повышения диагностической эффективности магнитно-резонансной томографии (МРТ). Наиболее популярными с начала 90-х – годов ХХ века и до сегодняшнего дня являются соединения – парамагнетики на основе комплексов Gd с производными диэтилентриаминпентаацетата (ДТПА) и сходных с ДТПА по хелатирующим свойствам соединений, в частности гадопентетата [1]. Однако принципиальным недостатком гадолиния как парамагнетнетика, используемого in vivo, является то, что в несвязанном виде как ион Gd3+ в растворе он представляет собой сильный ксенобиотик – токсин и в организме естественного метаболизма не имеет [2], тогда как близкий к нему по парамагнитным свойствам марганец (II), наоборот, является одним из важнейших микроэлементов в организме, а в чистом виде примерно на полпорядка менее токсичен, чем гадолиний [3]. До нашего исследования попыток создать и изучить in vivo парамагнитный контрастный препарат на основе такого комплекса, как Mn (II)-ДТПА, до сих пор не предпринималось. Поэтому мы разработали технологию производства, провели доклинические испытания парамагнитного контрастного препарата для МРТ – 0,5М раствора Mn (П)-ДТПА (зарегистрированное название ™ Пента-манг , химическое название мангапентетат), и провели оценку визуализирующих свойств препарата, в том числе и прямое сравнение визуализирующих свойств мангапентетата и гадопентетата.
МАТЕРИАЛ И МЕТОДЫ
Mn-ДТПА был получен по оригинальной стандартизированной патентованной технологии с использованием оксида или карбоната марганца (II) и NaН2ДТПА, с получением 0,5М раствора Mn-ДТПА при отсутствии обнаружимых количеств свободного марганца, токсических примесей и небольшом избыточном количестве свободного ДТПА (до 2%), при pH готового раствора фармацевтической формы в пределах 6,5–6,8. Полученные растворы автоклавировались при температуре 140°C и затем фильтровались через мембранные микрофильтры «Millipore», США; (размер пор менее 0.22 μм, диаметр сечения фильтра 30 мм). В качестве препарата сравнения использовался парамагнетик на основе Gd(III) – Гадопентетат (Магневист, Шеринг-Байер, Германия). При напряженности магнитного поля 0,2 Т релаксивность R1, (ммоль-1 * с-1) определялась по данным исследования фантомов, содержащих различные концентрации препаратов в бидистиллированной деионизированной воде, для которой Т1 практически не зависит от напряженности магнитного поля и составляет с практически приемлемой точностью Т1H O = 3000 мс, из соотношения : (1/T1) = (1/ Т1H O)2+ R1*C, где С – концентрация препарата в фантом2е. Фантомные исследования проводились при времени повторения Т1-взв. исследования в пределах TR=400 мс -1000 мс.
При сравнении мангапентетата и гадопентетата в качестве диагностических парамагнитных контрастных средств МР-томографические исследования с тем и другим препаратами были проведены с интервалом не более 12 и не менее 4 дней (в среднем 7,2±1,1 дня). Дозировка была идентична и составила 0,2 мл/кг массы тела (0,1 мМ/кг), скорость внутривенного введения препарата 1 мл/10 с. В исследование было включено 12 пациентов с опухолевой патологией ЦНС [2 – с краниофарингиомами, 5 – с низкодифференцированными глиомами и глиобластомами и 5 – с менингиомами конвекситальных поверхностей (четыре) и серповидного отростка (один)]. Исследования у пациентов проводились в Т1- и в Т2- взвешенных спин-эхо режимах, до и спустя 10-15 минут контрастирования парамагнетиком, с использованием низкопольных МР-томографов с напряженностью магнитного поля 0,15Т – 0,4Т. Во всех случаях было получено информированное согласие пациента в соответствии с требованиями Хельсинской декларации.
Кроме того, исследование было выполнено также у 15 пациентов с гипертрофией миокарда левого желудочка вследствие перегрузки давлением (аортальный стеноз – 8, артериальная гипертензия – 7 пациентов). Всем им до и после введения парамагнитного контрастного препарата в дозировке 2 мл/10 кг веса пациента выполнялась ЭКГ-синхронизированная МР-томогра-фия грудной клетки с полным охватом объема сердца (время повторения 800 мс, время эхо 20 мс, толщина среза 7 мм, ЭКГ-синхронизация на конец диастолы). Группой контроля служили 12 пациентов эквивален- тной тяжести недостаточности кровообращения, без признаков ЖЭС по данным суточного мониторирования ЭКГ. Для всех участков патологического накопления парамагнетика в миокарде рассчитывались величины индекса усиления интенсивности Т1-взве-шенного скана как {ИСконтраст / ИСисходн}.
Оценка контрастирующего эффекта Mn-ДТПА и гадопентетата в клинических исследованиях осуществлялась по величине индексов усиления Т1-взв. изображения, которые рассчитывались как отношение интенсивности Т1-взв. изображения после контрастирования к исходной: ИУ=(Интенсивность_Т1-взв. МРТMn-ДТПА)/(Интенсивность_Т1-взв.МРТИсходная ).
Одновременно у всех обследованных до и после введения мангапентетата был выполнен общий анализ периферической крови по общепринятым показателям [4]. При этом забор крови осуществлялся через отдельную внутривенную канюлю-бабочку (№23-25), через которую контрастные препараты ни в одном случае не вводились.
Статистическая обработка и межгрупповое сравнение средних величин проводилось с использованием t критерия Стъюдента для парных выборок.
РЕЗУЛЬТАТЫ
Биофизические параметры. При определении показателей продольной релаксивности R1 для манга-пентетата и гадопентетата в условиях низкопольного МР-томографа (0,2 Т) оказалось, что для этих препаратов релаксивность R1 практически не отличалась, но была для Mn-ДТПА даже незначительно выше, чем для гадопентетата, составив в частности 4,21±0,03 ммоль-1*с-1 и 3,93±0,02 ммоль-1*с-1, соответственно. Осмоляльности препаратов также статистически значимо не отличались : 1947±12 мОсмоль / (кг H2O) для мангапентетата и 1955±15 мОсмоль / (кг H2O) – для гадопентетата, при 37 °С.
Показатели периферической крови . При исследовании у пациентов с опухолевой патологией никаких клинически значимых осложнений или побочных действий при введении мангапентетата мы ни в одном из случаев не наблюдали. В частности показатели системы периферической крови (таблица) у обследованных пациентов были совершенно неизменными, причем вне зависимости, были ли показатели периферической крови в пределах нормальных границ или отражали патологические изменения в связи с тяжестью основного опухолевого процесса. Говоря о субъективных ощущениях пациентов, следует отметить, что введение мангапентетата в 7 случаях из 12 сопровождалось легким чувством потепления лица или ушей, проходившим в течение менее одной минуты (по данным хронометрии – за 1,6±0,3 мин), и никаких других субъективных последствий, тем более осложнений, не имелось. Неизменными оставались показатели ЧСС и АД, в частности ни у одного из обследованных не происходило изменений ЧСС более чем на 7 уд./мин, а АД (как систолического, так и диастолического) – более чем на 10 мм рт.ст. Это объяснимо скорее не какими-либо особенностями действия мангапентетата, а реакцией пациента на болевое ощущение от пункции вены.
МРТ-визуализация субэндокардиальной ишемии при гипертрофии левого желудочка . При исследовании миокарда пациентов с гипертрофией левого желудочка вследствие перегрузки давлением при ЭКГ-синхронизированной МРТ у 11 из 15 пациентов были выявлены субэндокардиальные зоны накопления контраста – парамагнетика объемом 1.87±0,32 куб. см, во всех случаях нетрансмуральные и не превышавшие толщины миокарда ЛЖ. Типичный случай визуализации нетрансмурального повреждения миокарда, визуализированного с помощью манга-пентетата, представлен на рис.1. В 7 случаях наличие
Таблица
Показатели периферической крови пациентов при введении 0,5М мангапентетата, из расчета 2 мл/10 кг веса тела
|
Показатель |
До введения мангапентетата |
После введения мангапентетата |
|
Эритроциты, 106/мм3 |
4,19±0,23 |
3,93±0,11, p>0,05 |
|
СОЭ, мм/ч |
23,25±7,02 |
23,58±7,17 , p>0,05 |
|
Гемоглобин, г/100 мл |
11,83±0,53 |
11,67±0,50, p>0,05 |
|
Гематокрит, % |
34,22±1,39 |
33,64±1,27, p>0,05 |
|
Лейкоциты общ., 103/мм3 |
7,11±0,62 |
7,01±0,70, p>0,05 |
|
Нейтрофилы, 103/мм3 |
4,73±0,51 |
4,62±0,55, p>0,05 |
|
Моноциты, 103/мм3 |
0,39±0,07 |
0,38±0,07, p>0,05 |
|
Лимфоциты, 103/мм3 |
1,98±0,15 |
2,01±0,19, p>0,05 |
|
Тромбоциты, 103/мм3 |
317±23,31 |
317±25,9, p>0,05 |
|
Тромбокрит, % |
0,27±0,02 |
0,27±0,02, p>0,05 |
Достигнутый уровень значимости p критерия различных показателей периферической крови до и после введения манга-пентетата – по t-критерию Стъюдента для парных выборок.
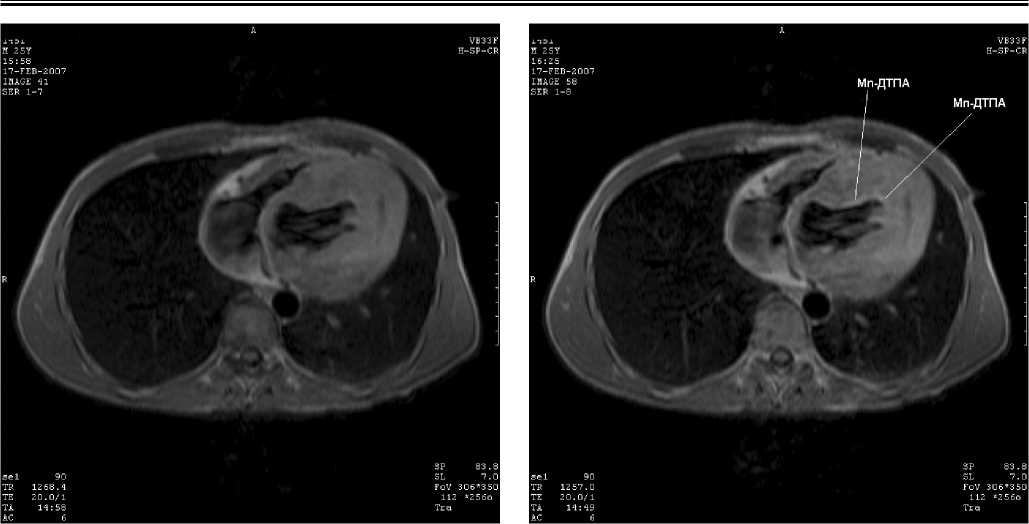
Рис 1. Случай визуализации субэндокардиального ишемического повреждения у пациента с гипертрофией левого желудочка вследствие аортального стеноза. На бесконтрастном исходном МРТ исследовании в аксиальной плоскости (рис. 1а) отмечается достоверная гипертрофия левого желудочка, сопровождающаяся включением мангапентетата (рис.1б) в регионах субэндокардиальной ишемии, указаны белыми линиями
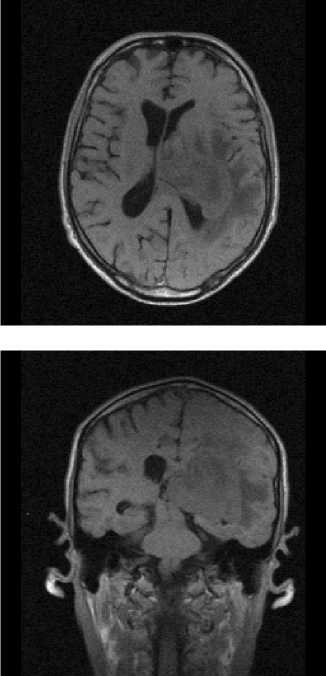
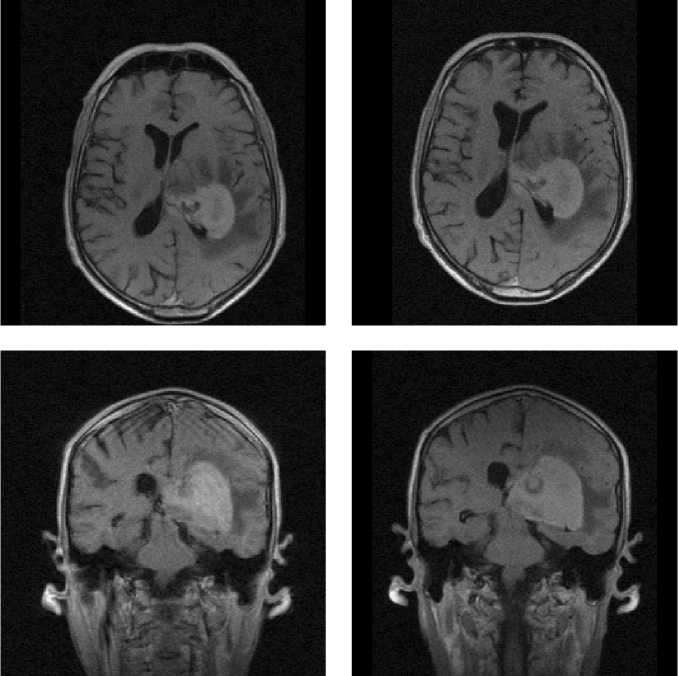
Рис. 2. Случай визуализации эпендимоглиомы в области заднего рога левого бокового желудочка с парамагнитным контрастированием гадопентетатом и мангапентетатом. Левый столбец – исходные неконтрастированные изображения в Т1-взв. режиме в аксиальной (рис. 2а) и фронтальной (рис. 2г) плоскостях. Средний столбец – (рис. 2б и рис. 2д) – Т1-взвешенные изображения в тех же плоскостях, усиленные гадопентетатом в качестве контраста-парамагнетика.
Правый столбец – (рис. 2в и рис. 2е) – Т1-взвешенные изображения в неизменных плоскостях, усиленные мангапентетом. Интервал между исследованиями с мангапентетатом и гадопентетатом – 8 дней
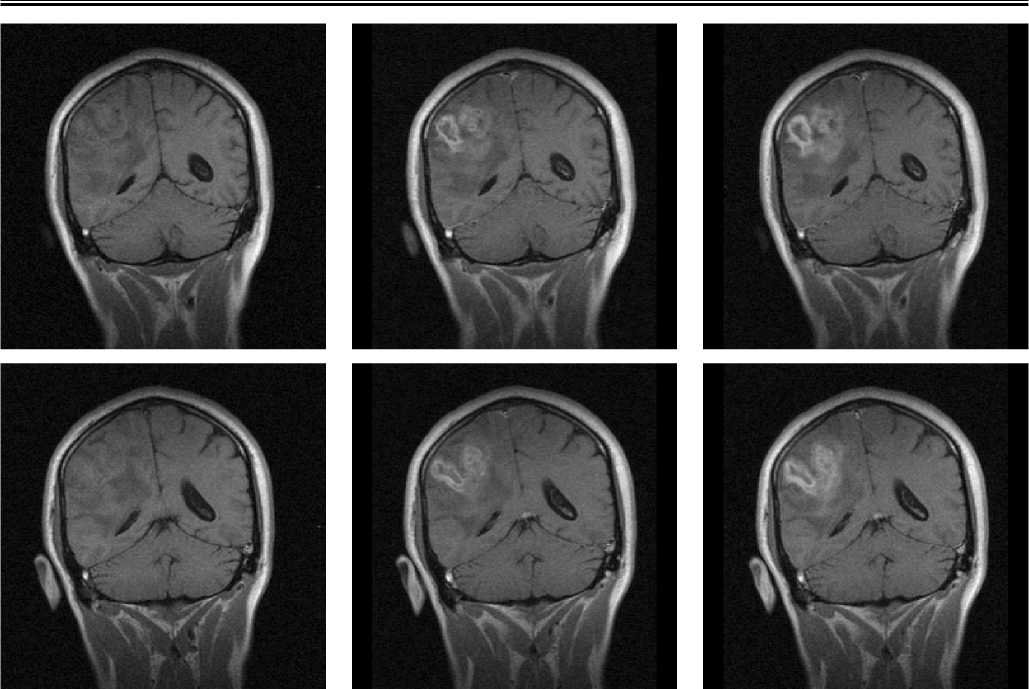
Рис. 3. Случай парамагнитного контрастирования низкодифференцированной глиальной опухоли правого полушария с усилением гадопентетатом и мангапентетатом. Правый столбец – фронтальные срезы – Т1-взвешенные изображения на уровне задних рогов боковых желудочков и середины мозжечка до парамагнитного контрастирования. Средний столбец – изображения в тех же плоскостях после контрастирования гадопентетатом. Левый столбец – изображения тех же отделов после контрастирования мангапентетатом. Интервал между исследованиями с гадопентетатом и мангапентетатом – 7 дней
очага аккумуляции контраста сочеталось с наличием у пациента одиночных желудочковых экстрасистол, соответствовавших по локализации области включения контрастного препарата. Степень усиления интенсивности патологического очага в Т1-взвешенном режиме при контрастировании составила у этих лиц: {ИС контраст / ИС исходн } = 1,22±0,05. Таким образом, применение парамагнитного контрастирования в сочетании с ЭКГ синхронизированной МРТ в Т1-взве-шенном режиме позволяет с высокой вероятностью выявить очаги нетрансмурального (субэндокардиального) повреждения у лиц с гипертрофией миокарда левого желудочка.
Визуализация злокачественных новообразований с помощью пентаманга. При оценке непосредственных результатов применения мангапентетата для визуализации новообразований головного мозга оказалось, что величины размеров опухолей, определенные при визуализации с помощью этого вновь исследуемого препарата и гадопентетата, статистически высокозначимо и сильно коррелировали (r=0,97, p<0,0002). Размеры новообразований (считая по максимальному поперечнику опухоли при контрастированном исследовании) при этом составляли от 12 мм до 49 мм для менингиом, и от 19 мм до 57 мм – для глиом и глиобластом, считая по их максимальному попе- речнику. Визуальная картина для того и другого препарата практически не отличались, как представлено на рис. 2-4. Ни в одном случае не было отмечено такого положения, чтобы какая-либо существенная анатомическая деталь опухолевого процесса, визуализированная с помощью гадопентетата, осталась бы не усилена при использовании мангапентетата. В двух случаях Т1-взв. изображение опухолевого процесса, полученное с усилением его мангапентетатом, было даже несколько ярче, чем с гадопентетатом (рис.3). Величины индекса усиления в перфузируемой ткани опухоли при исследовании на низкопольном МР-томографе составили, при глиомах и глиобластомах, соответственно, для мангапентетата ИУ=1,51±0,27, для гадопентетата ИУ=1,55±0,25 (p>0,05), корреляция между результатами того и другого: r=0,95, p<0,0001; при менингиомах для мангапентетата ИУ= 1,68±0,29, для гадопентетата ИУ=1,71±0,31 (p>0,05), корреляция между результатами двух парамагнетиков: r=0,96, p<0,0001. Результаты корреляционного сравнения величин ИУ, достигаемых при использовании манга-пентетата и гадопентетата, представлены на рис.5.
Таким образом, результаты использования двух комплексов ДТПА – мангапентетата и гадопенте-тата были в клинических условиях практически идентичными.
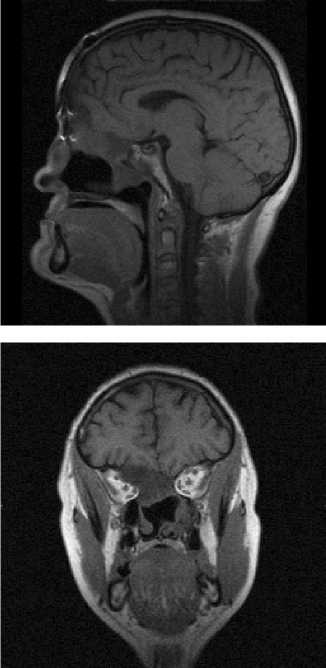
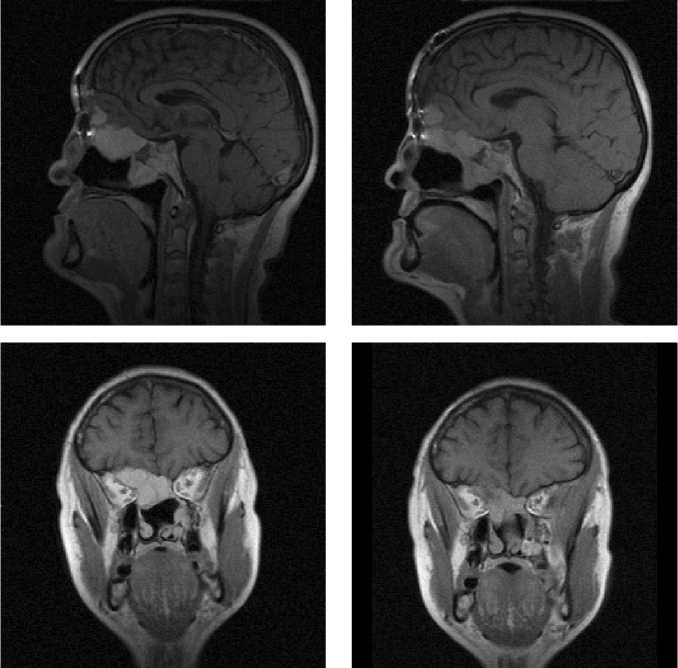
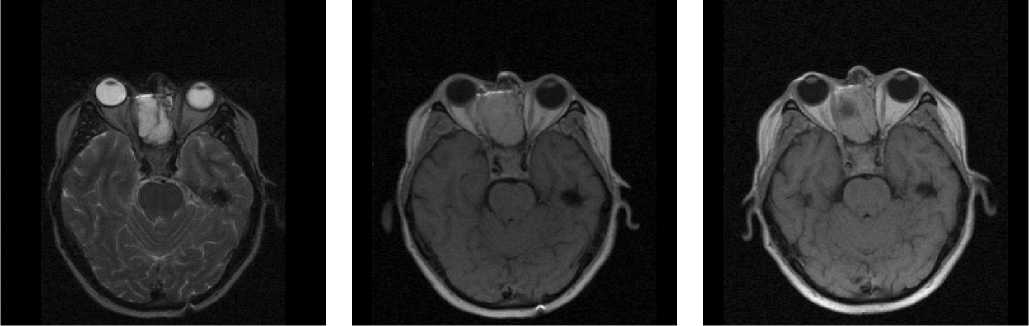
Рис. 4. Случай парамагнитного контрастирования фиброэпителиальной опухоли решетчатого лабиринта с распространением на твердую мозговую оболочку передней черепной ямки. Рис. 4а, г (крайний столбец справа) – Т1-взвешенные изображения до введения контрастных препаратов, в сагиттальной и фронтальной плоскостях, соответственно. Рис. 4ж – аксиальное изображение новообразования в Т2-взв. режиме.
Рис. 4б, д, з – Т1- взвешенные изображения в сагиттальной, фронтальной и аксиальной плоскостях после введения гадопентетата. Рис. 4в, е, и – Т1- взвешенные изображения в сагиттальной, фронтальной и аксиальной плоскостях после введения мангапентетата. Исследование с мангапентетатом проводилось спустя 10 дней после исследования с гадопентетатом. Обращает на себя внимание видимый на МР-томограммах с контрастированием мангапентетатом небольшой дефект ткани новообразования за счет проведенной в этом промежутке частичной резекции опухоли (биопсии)
ОБСУЖДЕНИЕ
Парамагнитное контрастирование для МР-томог-рафии доказало свою высокую клиническую значимость уже вскоре после практической реализации МРТ как метода в клинике [5, 6, 7]. С конца 80-х годов ХХ века соединения гадолиния с ДТПА и сходными с ДТПА хелатами вошли уже и в широкую клиническую практику в виде таких известных препаратов, как магневист (Schering-Bayer AG), омнискан (Nycomed), 20
вьюгам (Mallinckrodt Inc.) и других. В последнее время все большее количество контрастных МР-то-мографических исследований приходится на долю кардиологических и ангиологических применений методик МРТ.
Гадолиний был выбран в качестве основного иона-парамагнетика для производства контрастных препаратов для МР-томографии с самого начала использования парамагнитного контрастирования в клинике в первую очередь благодаря тому, что показатели релаксивности
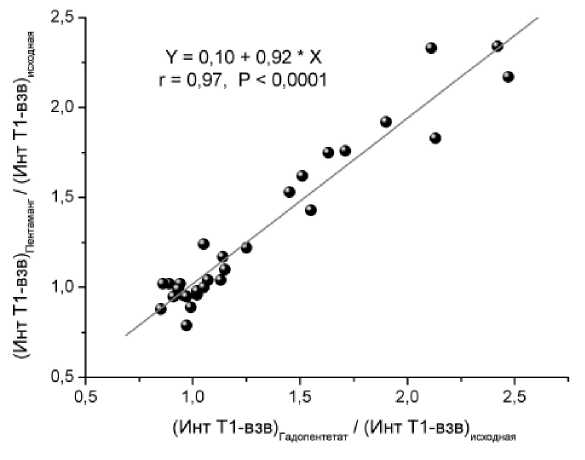
Рис. 5. Корреляция индекса усиления Т1-взвешенного изображения МРТ:
ИУ=(Интенсивность_Т1-взв.МРТКонтраст)/(Интенсивность_Т1-взв. МРТ Исходная ) , полученного У одних и при исследовании с использованием использовании мангапентетата (Mn-ДТПА, Пентаманга) и стандартного препарата сравнения – гадопентетата (Gd-ДТПА, Магневиста) в обобщенной группе пациентов с глиальными и менингиальными новообразованиями
гадолиния при экспериментах in vitro несколько превосходят таковые для марганца, железа, диспрозия, лантана и других парамагнетиков [6]. Препараты гадолиния показали свою неизменно высокую эффективность в качестве контрастных средств для МРТ в большом количестве клинических исследований [7, 8, 9, 10]. Однако для контрастных препаратов на основе гадолиния остаются нерешенными две важные практические проблемы – высокая дороговизна этих соединений и потенциальная токсичность гадолиния в свободном состоянии, что исключает создание препаратов с даже минимальным высвобождением этого иона в итоге метаболических изменений препарата в организме.
В последнее десятилетие наряду с гадолинием, безусловно занимающим пока монопольное положение на рынке парамагнитных препаратов, появился ряд препаратов на основе других пармагнитных ионов, в первую очередь марганца (II). Препараты марганца безопасно используются пока для МРТ-визуализации печени и поджелудочной железы – дипиридоксальдифосфат марганца [12], а также для контрастирования просвета желудочно-кишечного тракта – хлорид марганца [13,14]. Марганец также оказался пригодным для визуализации миокардиальной перфузии, поскольку в свободном виде интенсивно поглощается из плазмы клетками миокарда [15, 16]. Другим аспектом применения марганца для функциональной визуализации явилось его использование для представления функциональной активации головного мозга [17]. Однако исследований, визуализирующих возможности марганца в комплексе с гидрофильными молекулам, в частности с такими, как полиацетатные хелаты, парадоксальным образом не проводилось. Поэтому представляется естественным и необходимым оценить практическую пригодность марганца как контрастного препарата для внутривенного контрастирования в первую очередь в комплексе с ДТПА – наиболее широко используемым препаратом – хелатором ионов. ДТПА используется в клинике как в виде комплексов с Gd для контрастирования в МРТ, так и в виде натриевой соли – в качестве детоксиканта, тетацина, при отравлениях тяжелыми металлами. Тем не менее до последнего времени таких сообщений сделано не было.
Ранее в доклинических исследованиях визуализирующих и токсикологических свойств комплексов марганца нам удалось показать, что как Mn-ДТПА , так и Mn-ЭДТА [18] являются высокоэффективными нетоксичными препаратами парамагнетиками, относящимися по ГОСТ 12.1.007 – 76 к 4-му классу (малоопасные вещества) [19]. В настоящем исследовании мы пытались провести прямое сравнение мангапентетата с гадопентетатом, препаратом – «золотым стандартом» конт растирования в МРТ [20], у пациентов с опухолевой патологией.
При сравнении визуальной картины опухолевых новообразований, полученной с помощью парамагнитного усиления с мангапентетатом и гадопентетатом, она оказалась практически идентичной, хотя при использовании мангапентетата она выглядит чуть “мягче”. При визуальном выделении границ патологических новообразваний тем не менее значимых различий в их размерах мы не нашли. При этом в настоящем исследовании мы не использовали автоматизированных алгоритмов обработки и выделения границ. Однако в целом по выборке обследованных пациентов ни в одном случае не было такого положения, чтобы какая то анатомическая особенность, выявленная с использованием гадопентетатата, осталась бы невизуализи-рованной с помощью мангапентетата. В двух случаях низкодифференцированной глиомы и мультиформной глиобластомы (рис. 2) протяженность опухолевого включения парамагнетика при контрастировании ман-гапентетатом оказалась чуть больше. Интенсивность накопления контрастного препарата в обеих случаях, судя по показателю индекса усиления, была связана практически линейно, но мангапентетат при этом был чуть менее ярким (на 6-7%). На оценку анатомической протяженности опухолей это не повлияло. Таким образом, визуализационные возможности комплексов ДТПА оказываются (для случая таких комплексов, как мангапентетат и гадопентетат) практически равными.
Единственным верифицированным недостатком 0,5М раствора мангапентетата оказался распространенный почти у половины обследованных эффект “ощущения тепла”. Однако никакими другими реальными неприятностями – головокружением, рвотными эффектами и другими нарушениями со стороны ЖКТ, и тем более изменениями в картине периферической крови (таблица), ЭКГ и артериального давления применение мангапентетата не сопровождалось.
Это представляется естественным, поскольку комплекс ДТПА с марганцем отличается даже большей, чем комплекс Gd-ДТПА стойкостью при близких к нейтральным величинах pH [5]. Биофизические параметры мангапентетата, как и показатели его токсикологических исследований у животных, также однозначно относят его к малоопасным веществам [18, 19]. С этим как раз согласуется полное отсутствие клинически значимых побочных действий мангапентетата у пациентов и в нашем случае, соответствуя традиции для парамагнитных контрастных препаратов [2].
Говорить о возможности замены препаратов гадолиния соединениями марганца с ацетатными комплексами или хотя бы рыночной конкуренции на сегодня пока рано. Однако высокие визуализирующие возможности мангапентетата позволят использовать его более широко в качестве парамагнитного зонда, связанного с физиологически активными соединениями или метаболитами [21, 22] и улучшить возможности функциональной контрастированной МР-томографической диагностики в неврологии [23].
Тем не менее, уже теперь можно обоснованно полагать, что мангапентетат (Mn-ДТПА, Пентаманг) в клиническом исследовании является парамагнитным контрастным препаратом, не вызвавшим ни в одном случае каких-либо побочных эффектов и доказавшим значительную, не уступающую соединениям Gd, контрастирующую способность при МР-томографии в Т1-взвешенном режиме.
Список литературы Разработка и доклиническое исследование парамагнитных контрастных препаратов на основе органических комплексов марганца (II) для магнитно-резонансной томографии
- Синицын В.Е., Корниенко В.Н., Никитин В.Г. и др. Применение Омнискана (гадодиамида) в магнитно-резонансных исследованиях центральной нервной системы//Вест.рентгенол. радиол. -1995. -№ 4. -С. 5-11.
- Сергеев П.В., Свиридов Н.К., Шимановский Н.Л. Контрастные средства. М.: Медицина, 1993.
- Скальный А В. Химические элементы в физиологии и экологии человека. М. Мир. 2004.
- Исследование системы крови в клинической практике/Под ред. Г.И. Козинца и В.А. Макарова. М.: Триада, 1997.
- Hamm B., Wolf K.J. Contrast material for computed tomography and magnetic resonance imaging of the gastrointestinal tract.//Curr Opin Radiol. -1991. -Vol. 3. -№ 3. -Р. 474-482.
- Caravan P., Ellison J.J., McMurry T.J., Lauffer R.B. Gadolinium(III) Chelates as MRI Contrast Agents: Structure, Dynamics, and Applications//Chem. Rev.-1999.-Vol. 99. -P. 2293-2352.
- Беленков Ю.Н., Терновой С.К, Синицын В.Е. Магнитно-резонансная томография сердца и сосудов. М.: Видар, 1997. С. 111-117.
- Тотолян Н.А.,Трофимова Т.Н., Скоромец А.А., Тютин Л.А., Поздняков А.В., Тычкова И.К. Возможности методов магнитно-резонансной визуализации в диагностике рассеянного склероза.//Журнал неврологии и психиатрии им. С.С.Корсакова.-2002.-№1.-С. 32-41.
- Kim RJ, Wu E, Rafael A, et al. The use of contrast-enhanced magnetic resonance imaging to identify reversible myocardial dysfunction..//N.Engl.J.Med.-2000.-Vol. 343: -P. 1445-1453.
- Ding G., Jiang Q., Li L., et al. Detection of BBB disruption and hemorrhage by Gd-DTPA enhanced MRI after embolic stroke in rat//Brain Res. 2006. -Vol. 1114.-№ 1.-Р.195 -203
- Tanimoto A., Kuribayashi S. Hepatocute-targeted MRcontrast agents: contrast-enhanced detection of liver cancer in diffusely damaged liver.//Magn.Res.Med.Sci.-2005.-Vol. 4.-№ 2.-Р.53-60.
- Bellin M.F., Webb J.A., Van Der Molen A.J. e.a. Safety of MR liver specific contrast media.//Eur.Radiol. -2005. -Vol.15.-№.8.-Р. 1607-1614.
- Pautler R.G. Biological applications of manganese-enhanced magnetic resonance imaging.//Methods Mol.Med. -2006.-Vol.124. -Р. 365-386
- Sahani D.V., Kalva S.P., Fishman A.J. e.a. Detection of liver metastases from adenocarcinoma of the colon and pancreas: comparison of mangafodipir trisodium-enhanced liver MRI and whole-body FDG PET.//Am.J.Roentgenol.-2005.-Vol.185.-№.1.-Р. 239-246.
- Wendland M.F. Applications of manganese-enhanced magnetic resonance imaging (MEMRI) to imaging of the heart.//NMR Biomed. -2004.-Vol. 17.-№. 8. -Р. 581-594
- Усов В.Ю., Бородин О.Ю., Белянин М.Л. и др. Перфузионная МР -томография миокарда с MnCl2 в эксперименте//Мед Визуализация. -2005.-№4.-С. 128 -134.
- Henning E.C., Meng X., Fisher M., Sotak C.H. Visualization of cortical spreading depression using manganese-enhanced magnetic resonance imaging.//Magn.Reson.Med.-2005. -Vol. 53. -№ 4.-Р. 851-857.
- Усов В.Ю., Белянин М.Л., Бородин О.Ю. и др. Доклинические испытания Mn-этилендиаминтетраацетата в качестве парамагнитного контрастного препарата для МР-томографии//Мед визуализация. -2006. -№6.-С. 134 -144.
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М., 2000. С. 18-24.
- Арзуманова Н.В., Стуков Л.А., Тютин Л.А. Динамическая контрастная магнитно-резонансная томография в диагностике заболеваний молочных желез//Медицинская визуализация. -1999.-№ 2. -С. 2-6.
- Nunn A. D.; Linder K., Tweedle M. Can receptors be imaged with MRI agents?//Quart.J.Nuc.Med. -1997. -Vol. 41. -№ 2.-Р. 155 -162.
- Muller R.N., Vander Elst L., Laurent S., Spin transition molecular materials: intelligent contrast agents for magnetic resonance imaging//J.Am.Chem.Soc.-2003.-Vol. 125. -№ 27.-Р.8405-8407
- Aoki I., Naruse S., Tanaka C. Manganese-enhanced magnetic resonance imaging (MEMRI) of brain activity and applications to early detection of brain ischemia.//NMR Biomed.-2004.-Vol. 17.-№ 8. -Р. 569-580.


