Разработка магнитоуправляемой системы для доставки химиопрепаратов на основе наноразмерных частиц железа
Автор: Галанов А.И., Юрмазова Т.А., Савельев Г.Г., Булдаков М.А., Рудык Ю.В., Литвяков Н.В., Нечаев К.А., Тузиков С.А., Чердынцева Н.В., Яворовский Н.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Экспериментальные исследования
Статья в выпуске: 3 (27), 2008 года.
Бесплатный доступ
В работе исследованы физико-химические свойства магнитоуправляемых наночастиц (НЧ), полученных на основе композиционных ферромагнитных нанопорошков электроискровым диспергированием железа в жидких диэлектрических растворителях и растворах. Показана наиболее высокая эффективность адсорбции (по механизму хемосорбции) доксорубицина (ДР) на образце НЧ, полученных электроразрядом в гексане. Такие частицы способны образовывать в процессе инкубации прочно сцепленные с поверхностью опухолевых клеток агломераты, что свидетельствует как о троп-ности НЧ к мембране опухолевых клеток, так и о доставке ДР непосредственно к клеткам опухоли. Показано выраженное цитолитическое действие ДР, адсорбированного на полученных в гексане НЧ, на опухолевые клетки карциномы Эрлиха. Полученные данные свидетельствуют о перспективности дальнейших исследований по разработке магнитоуправляемых систем доставки химиопрепаратов на основе наноразмерных частиц железа и изучению их противоопухолевой активности in vitro и in vivo.
Наночастицы, цитостатики
Короткий адрес: https://sciup.org/14054863
IDR: 14054863 | УДК: 616-018
Текст научной статьи Разработка магнитоуправляемой системы для доставки химиопрепаратов на основе наноразмерных частиц железа
Актуальным объектом современных исследований в различных областях науки, техники и медицины являются наночастицы [6, 11, 15]. Наночастицы (НЧ) – это относительно новые и малоисследованные объекты, которые имеют характерные размеры от единиц до сотен нанометров, то есть всего в 10 … 100 раз больше атомов, так что в них значительная доля атомов, обычно более 1 %, находится на поверхности. Так как поверхностные атомы и молекулы имеют повышенную реакционную способность, то они присоединяют к себе атомы среды. В результате частицы имеют сложное строение, практически всегда – ядро и оболочку, часто – внешние функциональные группы. Поэтому свойства НЧ (электронные, оптические, магнитные, физико-химические) могут существенно отличаться от свойств соответствующих компактных материалов. Адсорбированные на поверхности НЧ молекулы могут делать их более инертными по отношению к окружающей среде. Кроме того, они могут способствовать образованию устойчивых коллоидных растворов. Модифицируя поверхность НЧ оболочкой с активными функциональными группами, можно присоединять такие НЧ к различным биологическим объектам. Это, в частности, можно использовать для приготовления магнитоуправляемых лекарственных форм, работающих по принципу: лекарство – орган-мишень [6, 10, 11, 21, 24], что позволяет создать оптимальную концентрацию лекарства в зоне реализации лечебного эффекта и существенно снизить системную токсичность как за счет уменьшения общей дозы, так и за счёт более продолжительного удержания в очаге поражения [17].
Для эффективного использования магнитных частиц в медицинских целях требуется определенный комплекс свойств: достаточная удельная намагниченность, низкая коэрцитивная сила, высокая дисперсность, коррозионная устойчивость, бактерицидность. Во избежание риска эмболизации мелких сосудов и капилляров размеры частиц порошка в растворе, вводимом в кровяное русло, не должны превышать 1 мкм [10, 16].
К настоящему времени предложен ряд магнитоуправляемых систем на основе магнетита [3, 5, 9, 13, 20, 22], который не проявляет токсических свойств [8]. Также достоверно установлено, что мелкодисперсный магнетит исчезает из кровяного русла через 1–6 ч после внутривенного или внутриартериального введения и перераспределяется по другим органам и тканям. Отмечено, что частицы магнетита через 10–12 дней после введения полностью выводятся из организма [8].
Работы по созданию магнитоуправляемых лекарственных препаратов проводятся в настоящее время в трех направлениях [4]:
-
1) НЧ магнитного носителя и лекарственное вещество инкапсулированы в различные «оболочки», в качестве которых могут быть использованы липосомы [1, 2, 7, 8, 26 ]. К недостаткам этого метода можно отнести трудоемкость получения липосомных форм лекарственных препаратов, ограничения по срокам хранения, высокую себестоимость;
-
2) полимерная оболочка (декстран, декстрин и др.) формируется на поверхности магнетита, на которой далее фиксируется лекарственное
вещество [5, 13]. Метод обладает рядом достоинств, прежде всего связанных с относительной простотой реализации. Но в то же время обычно мала прочность закрепления лекарства на поверхности носителя, что делает возможным его удаление в кровотоке до достижения органа-мишени;
-
3) «прямая посадка» (адсорбция, капиллярная конденсация и т.д.) лекарственного вещества на поверхность магнитного носителя [4, 12, 19]. Это направление обладает рядом преимуществ, связанных, прежде всего, с простотой и быстротой получения, возможностью приготовления магнитоуправляемого препарата непосредственно на месте применения. В последних работах [19] показано, что прочность закрепления препаратов на композиционном носителе цеолит + Fe3O4 достаточно высокая, десорбция лекарств имеет значительные величины в физиологической среде только при 10–24 ч десорбции.
Материал и методы
В связи с тем что третье направление недостаточно разработано как в теоретическом, так и в практическом отношении, была выполнена совместная работа на базе НИИ высоких напряжений Томского политехнического университета и НИИ онкологии ТНЦ СО РАМН по получению и исследованию физико-химических свойств на-норазмерных магнитоуправляемых носителей, изучению сорбции на них доксорубицина (ДР) и исследованию противоопухолевой активности полученной лекарственной формы НЧ+ДР в системе in vitro. Выбор ДР обусловлен тем, что этот препарат часто используется в различных схемах химиотерапии при лечении опухолей различных локализаций [4, 27]. В качестве магнитного носителя, кроме магнетита, в составе композиционных НЧ было решено использовать и железо, которое обладает лучшими магнитными свойствами.
В данной работе магнитные порошки получали диспергированием железных стружек при обработке их импульсными электрическими разрядами (ИЭР), при этом средой диспергирования служила дистиллированная вода (образец 1), раствор фосфорной кислоты (образец 2), этиловый спирт (образец 3) и гексан (образец 4). Продуктом электроэрозии являлась суспензия,

Рис. 1. Электронная микрофотография и дифрактограмма образца 4 (полученного в гексане)
состоящая из дисперсионной среды и композиционных твердых частиц. Частицы выделялись из суспензии центрифугированием при 6000 об/мин и сушились при 200 ° С. Полученные порошки были подробно обследованы методами химического анализа, электронной микроскопии (ЭМ) и электронографии (ЭГ), рентгенофазовым анализом (РФА), инфракрасной спектроскопии (ИКС), определена удельная поверхность методом БЭТ и магнитная восприимчивость.
Результаты и обсуждение
Анализ фазового состава свидетельствует о многофазности порошков. Для всех образцов характерно наличие фазы металлического железа, для образцов 1–3 – различные фазы оксидов и оксогидроксидов железа, в образце 4 – фазы карбидов железа (табл. 1). Первичные частицы композиционного материала имеют размеры от 5 до 100 нм, при этом они сильно агломерированы (рис. 1). Первичные частицы образуют внутри агрегатов систему нанопор с диаметром 5–20 нм, размеры агрегатов достигают 2 мкм. В целом электронография образцов подтвердила первичные результаты по химическому анализу и РФА, но, кроме того, были обнаружены незначительные количества фазы оксида трехвалентного железа и графита для образца 4.
Полученные порошки по своим магнитным свойствам близки к типичным ферромагнетикам. Высокая величина удельной намагниченности и низкая коэрцитивная сила позволяют
Таблица 1
|
Метод получения образца |
Фазовый состав, % |
Удельная поверхность, м2/г |
Средний размер частиц, нм |
Магнитный момент при Н=5 kOe, (emu/g) |
Количество ДР, адсорбированного из раствора с Снач = 27,5 мг/л |
|
ИЭР в Н2О (образец 1) |
a -Fe -16,9 Fe3O4- 66,7 FeOOH-16,4 |
50,7 |
80 |
62,5 |
8,1 мг/г |
|
ИЭР в растворе Н3РО4 (образец 2) |
a -Fe - 42,21 Fe3O4- 41,24 FeOOH - 16,54 |
38,6 |
120 |
51,2 |
20,7 мг/г |
|
ИЭР в 90 %-ном этаноле (образец 3) |
a -Fe - 29,35 Fe3O4- 58,08 FeOOH - 12,57 |
19,5 |
150 |
88,3 |
16,9 мг/г |
|
ИЭР в С6Н14 (образец 4) |
a -Fe - 33,12, FeC - 9,6, Fe4N (кубический) - 2,96, Fe3C (орторомбический) - 54,32 |
55,2 |
85 |
45,5 |
25,0 мг/г 45 мг/г |
Физико-химические свойства нанопорошков
сделать вывод о возможности использования полученных НЧ в качестве магнитоуправляемых систем даже при небольших напряженностях внешнего магнитного поля.
Сорбцию ДР проводили в статическом режиме. При сравнительном исследовании адсорбционной способности нанопорошков, полученных в различных средах (табл. 1), установлено, что ДР наиболее эффективно сорбируется на порошках, полученных в гексане (образец 4). Для этого образца определена максимальная сорбционная емкость: при равновесной концентрации ДР 40 мг/мл она составила 45 мг/г.
Для изучения формы взаимодействия доксорубицина с поверхностью образца были проведены дополнительные исследования по ИК-спектроскопии. ИК-спектр образца с адсорбированным ДР значительно отличается как от спектра исходного образца нанопорошка, так и от спектра ДР (рис. 2). Это свидетельствует в пользу хемосорбции ДР за счёт донорноакцепторных взаимодействий и не соответствует случаю слабой физической адсорбции.
Следующим этапом работы было изучение противоопухолевой активности образцов на базе лаборатории иммунологии ГУ «НИИ онкологии ТНЦ СО РАМН». Сначала оценили действие на пролиферацию модельных опухолевых клеток в системе in vitro образцов 1–4 и выбрали образец, который обладал наиболее выраженным антипро-лиферативным эффектом. В дальнейшем изучали действие на пролиферацию опухолевых клеток этого образца с адсорбированным ДР, а также определяли жизнеспособность опухолевых клеток после 24-часовой совместной инкубации.
В работе использовались опухолевые клетки карциномы Эрлиха, поддерживаемые в асцитной форме на мышах линии C57Bl/6j. Клетки были получены от 5 разных мышей. Для использования в эксперименте опухолевые клетки извлекались из брюшной полости на 3-и сут после трансплантации (в экспонециальной фазе роста) и ресуспедировались в концентрации 1,25 x 10 6 клеток/мл в полной культуральной среде (ПКС) – RPMI-1640 с 10 % обогащением эмбриональной телячьей сывороткой, 5 мМ глутамина, 40 мкг/мл гентамицина и 40 мкг/мл 5 в -меркаптоэтанола. Пролиферативную активность опухолевых клеток оценивали по
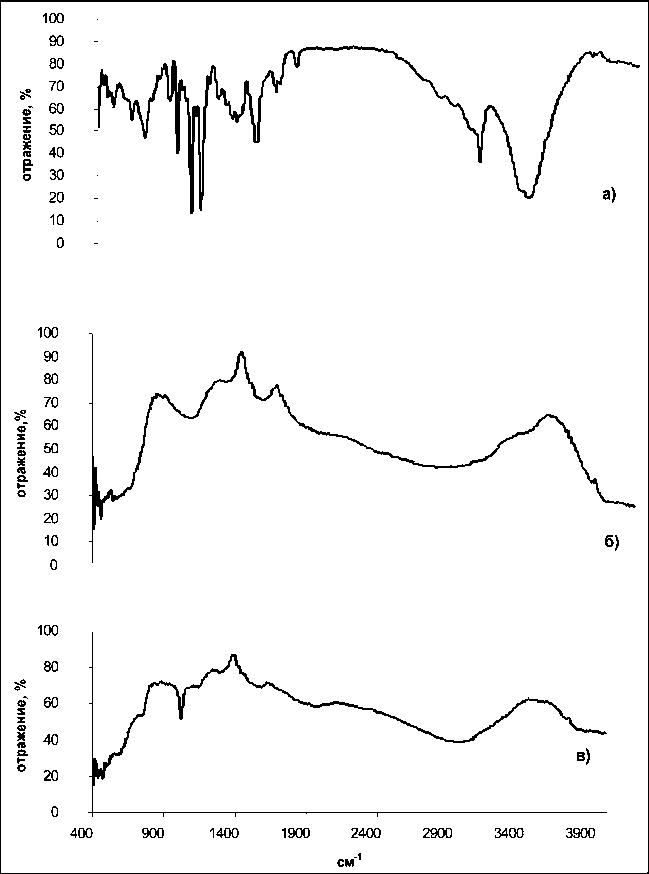
Рис. 2. ИК-спектр собственно доксорубицина (а), образца 4 (б) и образца 4 с адсорбированным доксорубицином (в)
уровню включения Н3-тимидина в ДНК опухолевых клеток. Клетки инкубировались 24 ч при 370С в атмосфере с 5 % СО2 в 96 луночных планшетах по 0,2 мл на лунку, Н3-тимидин добавляли по 1 мкКи/лунку перед инкубацией. После инкубации радиоактивность измеряли с помощью сцинтилляционного β-счетчика MicroBeta Trilux (Perkin Elmer). В качестве результата использовали среднее по 10 лункам значение числа импульсов в минуту (cpm – count per minute) или индекс ингибиции пролиферации (ИИП)= ((контроль(cpm)-опыт(cpm))/ контроль(cpm))×100 % [18, 25, 28].
В первом эксперименте были сформированы следующие группы: группа контроля (опухолевые клетки, культивируемые в ПКС, без добавления НЧ); группы с добавлением НЧ (образцы 1–4) в концентрациях 0,25 мг/мл, 0,5 мг/мл и 1 мг/мл. В следующем эксперименте, кроме группы контроля и групп с добавлением НЧ (образец, который обладал наиболее выраженным
Таблица 2
Ингибиция пролиферации опухолевых клеток карциномы Эрлиха после 24-часовой инкубации с наночастицами (образцы 1–4)
Результаты первого эксперимента представлены в табл. 2. При всех концентрациях образца 1 отмечается стимуляция пролиферации опухолевых клеток карциномы Эрлиха (ИИП имеет отрицательное значение). Образец 3 проявил небольшую антипролиферативную активность только в самой высокой концентрации 1 мг/мл, ИИП составил 18 %. Образец 2 при низкой концентрации (0,25 мг/мл) в культуральной среде на оказывал значимого действия на пролиферацию клеток карциномы Эрлиха, с увеличением концентрации дозозависимо проявлялся противоопухолевый эффект (табл. 2). Только образец 4 – ИЭР в С6Н14 оказывал анти-пролиферативное действие на опухолевые клетки карциномы Эрлиха при всех исследуемых концентрациях, причем в концентрации 1 мг/ мл его антипролиферативная активность достигла 70 %. Таким образом, образец 4 проявил наибольшую противоопухолевую активность и был выбран для адсорбции доксорубицина и дальнейших экспериментов.
В культуре клеток, где был добавлен раствор комплекса ДР+НЧ (образец 4), было отмечено СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2008. №3 (27)
самое значительное в исследуемых группах снижение пролиферативной активности опухолевых клеток, например пролиферативная активность в культуре клеток с добавлением 1 мг/мл комплекса была более чем в 4 раза ниже, чем при введении раствора ДР с самой высокой концентрацией (табл. 3). Во всех наблюдениях был отмечен дозозависимый эффект.
Для анализа характера взаимодействия НЧ (образец 4) и ДР, при использовании их в комплексе, мы применили формулу, предложенную в работе [23]. По этой формуле был вычислен ожидаемый эффект совместного действия препаратов. Ожидаемый эффект от комплекса НЧ и ДР оказался ниже их реального эффекта. Это свидетельствует о синергичном характере взаимодействия комплекса НЧ и ДР в реализации антипролиферативного действия на клетки карциномы Эрлиха.
Оценку жизнеспособности клеток проводили с помощью красителя трипанового синего. Для этого клетки после 24-часовой инкубации отмывали один раз с помощью фосфатного буфера и добавляли 0,3 % раствор трипанового синего. Подсчет клеток проводили через 5 мин после добавления красителя. Подсчитывали общее количество клеток, а также количество живых (неокрашенных) и мертвых (окрашенных) клеток. В качестве результата использовали среднее по 5 лункам количество клеток (млн/мл) от 5 разных животных.
Таблица 3
Уровень пролиферации опухолевых клеток карциномы Эрлиха после 24-часовой инкубации с наночастицами (образец 4) и доксорубицином
|
Конечная концентрация в культуре клеток, мг/мл |
Группа |
Пролиферация опухолевых клеток, cpm |
||
|
Mean |
± SD |
± SEM |
||
|
Контроль |
29548 |
6667 |
1308 |
|
|
0,25 |
НЧ |
22001 |
4643 |
910 |
|
0,5 |
НЧ |
21167 |
5916 |
1160 |
|
1 |
НЧ |
8943 |
5508 |
1080 |
|
10 |
ДР |
14332 |
5966 |
1170 |
|
20 |
ДР |
10573 |
4828 |
947 |
|
40 |
ДР |
4373 |
2130 |
418 |
|
0,25 |
НЧ+ДР |
3963* |
3581 |
716 |
|
0,5 |
НЧ+ДР |
2178* |
2249 |
441 |
|
1 |
НЧ+ДР |
970* |
1127 |
225 |
Примечание: все значения статистически значимо отличаются от контроля; * – различия статистически значимы по сравнению с группой НЧ и группой ДР в соответствующих концентрациях; НЧ+ДР – группа с добавлением адсорбированного на НЧ доксорубицина, указана конечная концентрация НЧ, ДР адсорбирован в концентрации 40 мкг на 1 мг НЧ.
Таблица 4
Жизнеспособность опухолевых клеток карциномы Эрлиха после 24-часовой инкубации с наночастицами (образец 4) и доксорубицином
|
Конечная концентрация в культуре клеток, мг/мл |
Группа |
Количество мертвых опухолевых клеток, млн |
Количество живых опухолевых клеток, млн |
||||
|
Mean |
± SD |
± SEM |
Mean |
± SD |
± SEM |
||
|
Контроль |
1,09 |
0,24 |
0,14 |
5,13 |
1,13 |
0,65 |
|
|
0,25 |
НЧ |
1,81 |
0,57 |
0,33 |
2,38 |
0,90 |
0,52 |
|
0,5 |
НЧ |
0,57 |
0,23 |
0,13 |
4,19 |
0,69 |
0,40 |
|
1 |
НЧ |
1,40 |
0,26 |
0,15 |
2,57 |
0,80 |
0,46 |
|
10 |
ДР |
0,68 |
0,30 |
0,17 |
1,58 |
0,34 |
0,20 |
|
20 |
ДР |
0,19 |
0,13 |
0,08 |
2,41 |
0,65 |
0,38 |
|
40 |
ДР |
0,57 |
0,20 |
0,11 |
3,58 |
0,51 |
0,29 |
|
0,25 |
НЧ+ДР |
2,38* |
0,30 |
0,17 |
0,42* |
0,24 |
0,14 |
|
0,5 |
НЧ+ДР |
3,32* |
0,17 |
0,10 |
1,25* |
0,30 |
0,17 |
|
1 |
НЧ+ДР |
2,15* |
0,41 |
0,24 |
0,19* |
0,07 |
0,04 |
Примечание: все значения статистически значимо отличаются от контроля; * – различия статистически значимы по сравнению с группой НЧ и группой ДР в соответствующих концентрациях; НЧ+ДР – группа с добавлением адсорбированного на НЧ доксорубицина, указана конечная концентрация НЧ, ДР адсорбирован в концентрации 40 мкг на 1 мг НЧ.
Практически во всех группах культур клеток, где были введены растворы с НЧ (образец 4) или ДР, отмечено преобладание количества живых клеток над мертвыми, хотя количество живых клеток было достоверно меньше, чем в контроле. В культурах клеток, где был введен раствор комплекса ДР с НЧ, отмечено значительное преобладание количества мертвых клеток над жи- выми, независимо от концентрации раствора, и это статистически значимо отличалось от групп НЧ или ДР (табл. 4). Самое низкое содержание живых опухолевых клеток наблюдалось после введения раствора комплекса ДР с НЧ (образец 4) в концентрации 1 мг/мл, при этом количество живых клеток было значительно меньше количества мертвых клеток. Можно признать,
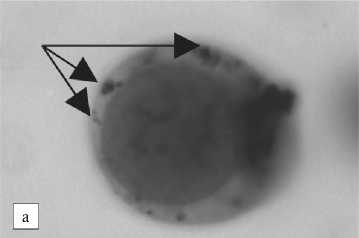
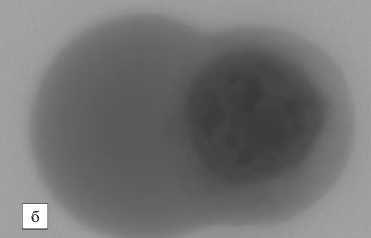
Рис. 3. а – агломераты комплекса наночастиц (образец 4) с доксорубицином на поверхности опухолевых клеток карциномы Эрлиха; б – контрольные клетки карциномы Эрлиха
что под воздействием ДР, адсорбированного на НЧ (образец 4), опухолевые клетки карциномы Эрлиха в значительной степени погибают по механизму некроза или цитолизиса, поскольку трипановый синий способен проникать и окрашивать только клетки с поврежденной мембраной. Под действием ДР останавливалась клеточная пролиферация, но опухолевые клетки не погибали, т.е. ДР оказывал цитостатический эффект.
Была показана способность НЧ (образец 4) и комплекса ДР с НЧ (образец 4) в процессе инкубации образовывать видимые агломераты на поверхности опухолевых клеток карциномы Эрлиха (рис. 3). Эти агломераты были достаточно прочно сцеплены с поверхностью опухолевых клеток и не смывались с неё в процессе интенсивного пипетирования клеток в фосфатном буфере. Таким образом, получено свидетельство тропности НЧ (образец 4) к мембране опухолевых клеток, это может также служить косвенным свидетельством доставки ДР непосредственно к клеткам опухоли. Полученные результаты свидетельствуют о сильном влиянии не только способа, но и конкретных условий получения НЧ на их состав и физико-химические свойства, а через них – и на биологическое действие. Действительно, обнаружено как усиление (для образцов 1 и 3), так и подавление пролиферативной активности – для образца 2 и 4.
Выводы
-
1. Для приготовления магнитоуправляемых лекарственных форм, работающих по принципу: лекарство – орган-мишень, предложено использовать композиционные ферромагнитные
-
2. Установлено, что наибольшая адсорбция доксорубицина имеет место на образце, полученном электроразрядом в гексане – до 45 мг/г. Показано, что взаимодействие в системе доксорубицин + магнитная наночастица имеет характер хемосорбции.
-
3. Опытами in vitro показано, что наночастицы, полученные электроразрядом в фосфорной кислоте и гексане, обладают собственным анти-пролиферативным действием на опухолевые клетки карциномы Эрлиха. Образцы, полученные в воде и спирте, наоборот, стимулируют пролиферативную активность клеток. Для образца, полученного в гексане, с адсорбированным на наночастицах доксорубицином обнаружен синергичный характер взаимодействия в реализации антипролиферативного действия на клетки карциномы Эрлиха, причем характер этого действия – цитолитический, а не цитостатический, как у доксорубицина.
-
4. Показана способность наночастиц, полученных в гексане (как с адсорбированным на нём доксорубицином, так и без него), образовывать в процессе инкубации прочно сцепленные с поверхностью опухолевых клеток агломераты.
нанопорошки, получаемые электроискровым диспергированием железа в жидких диэлектрических растворителях и растворах. Определены физико-химические свойства полученных порошков.
Полученные данные говорят о перспективности дальнейшей работы по разработке магнитоуправляемых систем доставки химиопрепаратов на основе наноразмерных частиц железа и изучению их противоопухолевой активности in vitro и in vivo.


