Разработка методики определения хлорамфеникола в мясных продуктах
Автор: Уланова Т.С., Карнажицкая Т.Д., Пшеничникова Е.О., Нахиева Э.А.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Экспериментальные модели и инструментальные исследования
Статья в выпуске: 4 (4), 2013 года.
Бесплатный доступ
Представлены результаты исследований по разработке методики определения хлорамфеникола в мясной продукции с использованием жидкостной хроматографии в сочетании с масс-селективным детектированием (ЖХ/МС). В ходе проведенных исследований отработаны оптимальные условия проведения анализа хлорамфеникола на жидкостном хроматографе Agilent серии 1200 в сочетании с масс-спектрометрическим детектором с тройным квадруполем LC/MS 6460 Agilent Technologies. Изучены условия эффективного извлечения хлорамфеникола из образцов мяса. В качестве оптимального варианта выбран метод жидкостной экстракции этилацетатом с последующей очисткой экстракта гексаном. Степень извлечения антибиотика из матрицы достигает 70–100 % в зависимости от содержания хлорамфеникола в мясопродуктах. Выполнены исследования по установлению метрологических характеристик разработанной методики, в ходе которых определены значения следующих показателей: точность – не превышает 26 %, воспроизводимость – не более 10 %, повторяемость – не более 5 %. Анализ образцов мясной продукции с помощью разработанной методики выявил присутствие антибиотика в 17,6 % проб.
Хлорамфеникол, ветеринарный лекарственный препарат, остатки ветеринарных лекарственных препаратов, мясные продукты, метод жх/мс
Короткий адрес: https://sciup.org/14237848
IDR: 14237848 | УДК: 613.2/3
Текст научной статьи Разработка методики определения хлорамфеникола в мясных продуктах
Хлорамфеникол (левомицетин) является антибиотиком широкого спектра действия. В ветеринарной медицине хлорамфеникол используют для лечения и профилактики возникновения у сельскохозяйственных животных инфекций, вызванных анаэробными бактериями или устойчивых к другим противомикробным средствам. Хлорамфеникол хорошо всасывается при пероральном и парентеральном поступлении, медленно выводится из организма животных и сравнительно долго сохраняет свою активность при хранении продуктов [13]. Для лечения человека хлорамфеникол используют с большой осторожностью. При исследовании токсичных свойств препарата выявлены ге- нотоксичность хлорамфеникола и его метаболитов, эмбриотоксичность, канцерогенный риск для человека и отсутствие корреляции в системе «доза–реакция» в случаях апластической анемии, вызванной лечением хлорамфениколом [8, 10, 11].
При употреблении продуктов животного происхождения, содержащих остатки ветеринарных лекарственных препаратов, в организме человека вырабатывается резистентность к антибиотикам, могут развиваться дисбактериоз, аллергические реакции, снижается иммунитет. При постоянном употреблении пищи с остатками ветеринарных лекарственных препаратов повышается нагрузка на системы и органы, от-
ветственные за выведение чужеродных соединений из организма (печень, почки) [2].
В странах ЕЭС в отношении ряда ветеринарных лекарственных препаратов, в том числе хлорамфеникола, действует запрет на их содержание в пищевых продуктах. Так, в регламенте стран европейского экономического союза (ЕЭС) № 2377/90 от 1990 г. представлены вещества, содержание которых недопустимо в продуктах в сыром и готовом виде, в их числе присутствует хлорамфеникол. В документе Комиссии Codex Alimentarius, утвержденном в июле 2012 г. на 35-й сессии Комиссии, перечислены запрещенные ветеринарные лекарственные препараты, для которых не может быть установлено никакое допустимое остаточное содержание в продуктах, так как остатки в любом количестве создают риск здоровью человека. В данном перечне присутствует хлорамфеникол [7]. В Российском законодательстве действует технический регламент Таможенного союза, в соответствии с которым не допускается присутствие хлорамфеникола в продуктах убоя, предназначенных для производства мясной продукции (примечание: < 0,0003 мг/кг) [6].
Действующие методические указания МУК 4.1.1912-04 устанавливают порядок определения хлорамфеникола в продуктах животного происхождения двумя методами – жидкостной хроматографией, обеспечивающей селективность определения, но имеющей низкую чувствительность – 0,01 мг/кг (арбитражный метод), и иммуноферментным анализом с высокой чувствительностью определения – 0,000012 мг/кг, но недостаточной специфичностью и воспроизводимостью результатов [4]. В соответствии с ГОСТ Р ИСО 13493-2005 «Метод определения содержания хлорамфеникола (левомицетина) с помощью жидкостной хроматографии» минимально определяемая концентрация хлорамфеникола в мясе составляет 0,0065 мг/кг.
В целях обеспечения контроля безопасности продуктов питания необходимо совершенствовать существующие и разрабатывать новые более высокочувствительные и селективные методики анализа. В настоящее время максимальную чувствительность и наиболее точную идентификацию сложных органических соединений в продуктах питания и других биологических образцах обеспечивают современные инструментальные методы газовой и жидкостной хроматографии в сочетании с масс-спектрометрией (ГХ/МС и ЖХ/МС) [1, 5, 13].
Цель исследования – разработка методики определения хлорамфеникола в мясной продукции с использованием жидкостной хроматографии в сочетании с масс-селек-тивным детектированием (ЖХ/МС).
Материалы и методы. Исследования проведены в лаборатории методов жидкостной хроматографии ФБУН «ФНЦ медикопрофилактических технологий управления рисками здоровью населения» на жидкостном хроматографе Agilent серии 1200 с масс-спектрометрическим детектором с тройным квадруполем LC/MS 6460 Agilent Technolo-giesи с ионизацией электростатическим распылением (ESI). В качестве стандартного образца использовали хлорамфеникол чистотой ≥98 % (пр-во SIGMA-ALDRICH).
Разработка методики определения хлорамфеникола в продуктах питания включала следующие этапы:
-
– оптимизация условий масс-спектрометрического анализа;
-
– извлечение хлорамфеникола из образца и очистка извлеченной пробы;
-
– количественное определение и качественное подтверждение наличия остатков хлорамфеникола в пробе.
Оптимизацию параметров масс-спектрометрического детектора для качественного определения хлорамфеникола проводили в автоматическом режиме при использовании программы «Optimizer». По литературным данным в условиях ионизации распылением в электрическом поле (ESI) регистрируются отрицательно заряженные частицы хлорамфеникола, в связи с этим исследования проведены в режиме отрицательной ионизации.
При отработке оптимальных условий хроматографического разделения стандартного образца хлорамфеникола с компонентами матрицы предварительно определили оптимальную длину волны диодно-матричного детектора.
Изучение разделения хлорамфеникола с компонентами матрицы проводили на колонках для обращено-фазной хроматографии: Poroshel 120 EC-C18 длиной 50 мм и внутренним диаметром 3,0 мм, размер частиц 2,7 мкм; Eclipse XDB-C18 длиной 150 мм и внутренним диаметром 2,1 мм, размер частиц 5 мкм; Bonus RP длиной 50 мм и внутренним диаметром 4,6 мм, размер частиц 1,8 мкм.
Для выявления мешающего влияния матричных компонентов анализировали образцы мясного фарша с добавлением и без добавления хлорамфеникола в оптимальном режиме элюирования на колонке Bonus RP.
Следующий этап разработки методики анализа хлорамфеникола в мясных продуктах включал отработку способа подготовки проб к анализу. Подготовка пробы влияет на все последующие стадии анализа антибиотика и, следовательно, является критически важным для абсолютной идентификации, подтверждения и количественного определения аналита. Масс-спектрометрия позволяет использовать более простые универсальные методы очистки. Вместе с тем эффективная очистка матрицы является необходимой мерой, так как компоненты, присутствующие в матрице, могут повлиять на производительность масс-спектрометра, в частности, посредством снижения сигнала детектора [14].
Для выбора оптимального способа подготовки проб мясных продуктов к анализу методом ЖХ/МС проведены экспериментальные исследования по определению эффективности извлечения хлорамфеникола из матрицы с использованием подходов, рекомендуемых в научной и методической литературе, – жидкостной и твердофазной экстракции.
Исследования по определению степени экстракции хлорамфеникола из образцов мяса осуществляли методом «введено– найдено». В образец мясного фарша навеской 10 г вносили известное количество хлорамфеникола, задавая определенную концентрацию антибиотика в мясе (мг/кг). Степень экстракции считали как отношение извлеченного количества к общему (начальному) количеству хлорамфеникола в образце по формуле
„ A - 100 R =------ ,
N где R – степень экстракции хлорамфеникола, %; А – извлеченное количество вещества, мкг; N – общее (начальное) количество вещества, мкг.
Образцы анализировали в оптимальных условиях работы жидкостного хроматографа и масс-спектрометрического детектора.
Техника выполнения процедуры жидкостной экстракции анализируемого вещества из биологической матрицы включала гомогенизацию образца, извлечение аналита из образца подходящим органическим растворителем, разделение фаз, удаление белков, липидов и других соединений из экстракта. По литературным данным для извлечения хлорамфеникола из продуктов питания методом жидкостной экстракции использовались органические растворители: этилацетат, ацетонитрил, смесь этилацетата с ацетонитрилом, смесь хлороформа и ацетона, смесь ацетонитрила и ацетатного буфера (рН 5,0). Среди перечисленных растворителей наибольшее применение в практике анализа хлорамфеникола нашел этилацетат.
Исследования по определению эффективности извлечения хлорамфеникола из мяса этилацетатом проводили по схеме: в образец мясного фарша массой 10 г вносили хлорамфеникол в количестве 0,192 мкг и экстрагировали дважды 20 см3 этилацетата в течение 10 мин; объединенный экстракт высушивали в токе воздуха при температуре 45 °С до образования маслянистого остатка. Образец очищали от белков и жира, добавляя в пробу метанол (для осаждения белков), соль хлорид натрия и 20 см3 гексана (для удаления жиров). После перемешивания и центрифугирования гексановый слой отбрасывали и повторно очищали. Оставшийся раствор дважды экстрагировали этилацетатом. Высушенный экстракт пере-растворяли в смеси метанол:вода и анализи- ровали аликвоту на приборе. Приведенная процедура подготовки проб обеспечивает получение надежных и высокочувствительных результатов анализа хлорамфеникола. Эффективность экстракции данным способом составила 70–99,9 %.
Согласно действующим методическим указаниям МУК 4.1.1912-04 извлечение хлорамфеникола проводится этилацетатом в присутствии буферного раствора. Этилацетатный экстракт очищается от примесей петролейным эфиром и анализируется методом ВЭЖХ.
Изучена возможность применения в качестве пробоподготовки для анализа хлорамфеникола метода QuEChERS, технически представляющего метод дисперсионной твердофазной экстракции, успешно применяющегося в аналитической химии для извлечения пестицидов, антибиотиков и других загрязняющих веществ из продуктов питания растительного и животного происхождения. Пробоподготовка основана на экстракции контаминантов ацетонитрилом из гомогенизированной пробы в присутствии солей, в основном MgSO 4 и NaCl, в условиях оптимального значения рН среды, задаваемого с помощью буферных растворов, и очистке экстракта насыпными полимерными сорбентами. В ходе исследований изучены два варианта пробоподготовки по методу QuEChERS.
Для количественного определения хлорамфеникола использовали метод внешнего стандарта – устанавливали зависимость интенсивности сигнала детектора от концентрации анализируемого соединения в мясе и рассчитывали градуировочный коэффициент.
Важной особенностью анализа химических соединений в биологических субстратах, к которым относятся пищевые продукты, является влияние многокомпонентной матрицы на конечный результат. Для получения достоверных результатов анализа необходимо учитывать мешающее влияние компонентов матрицы, степень извлечения анализируемого вещества, а также погрешность всех этапов подготовки образца к анализу [1, 3]. В связи с этим при построении градуировочной зависимости пробы с содержанием стандартного образца хлорамфеникола в диапазоне концентраций 0,00005–0,02 мг/кг подвергались обработке аналогично исследуемым пробам – экстракцией этилацетатом с последующей очисткой гексаном. Подготовленные пробы анализировали в оптимальных условиях ЖХ/МС анализа.
Градуировочный коэффициент рассчитывали по формуле
n
∑ C i/ S i
K= i=1 , n где Ci – массовая концентрация хлорамфеникола в градуировочном растворе, мг/кг; Si – среднее значение трех измерений площади пика хлорамфеникола i-й концентрации, усл. ед; n – количество градуировочных растворов.
Для расчета метрологических показателей методики (точности, правильности, повторяемости, внутрилабораторной прецизионности) применяли методы математической статистики.
Метрологические показатели методики определения хлорамфеникола в мясных продуктах устанавливали в соответствии с рекомендациями по межгосударственной стандартизации РМГ 61-2010 «Показатели точности, правильности, прецизионности методик количественного химического анализа. Методы оценки» и ГОСТ Р ИСО 5725-1÷6-2002 «Точность (правильность и прецизионность) методов и результатов измерений». Для получения экспериментальных данных готовили серию стандартных образцов хлорамфеникола в мясном фарше (мг/кг) с концентрациями вблизи нижнего, среднего и верхнего значений диапазона измеряемых концентраций
Результаты и их обсуждение. При сканировании дочерних отрицательных ионов в режиме грубой настройки зарегистрированы родительский ион с отношением массы к заряду (m/z) 321 и 4 дочерних иона с соотношением m/z 152, 257, 151,2 и 121. Максимальный отклик детектора получен для до-
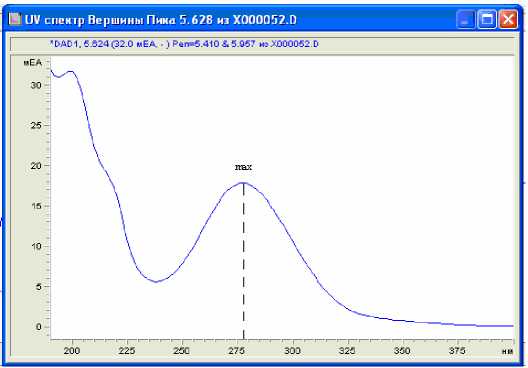
Рис. 1. Спектр поглощения хлорамфеникола в 50%-ном водном растворе метанола, λ max = 278 нм
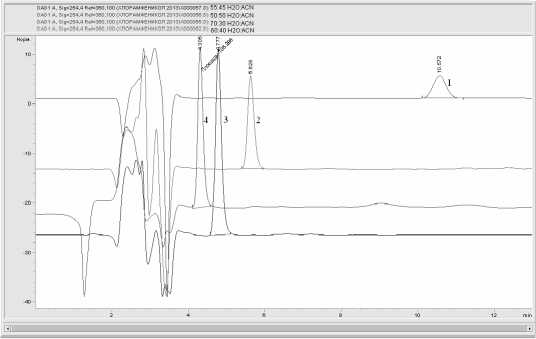
Рис. 2. Хроматограммы стандартного раствора хлорамфеникола, полученные на колонке Bonus RP при соотношении воды и ацетонитрила 70:30 (1), 60:40 (2), 55:45 (3), 50:50 (4)
черних ионов с m/z 152 и 257. На основании полученных результатов в качестве основного иона выбран фрагмент с m/z=152, подтверждающего иона – фрагмент с m/z=257. В режиме тонкой настройки детектора уточнено образование дочерних ионов с соотношением m/z 152,1 и 257,1. При этом значение оптимального напряжения фрагментатора составило 126 V, значения энергии ячейки соударения для дочерних ионов (СЕ) 12 и 4 V. Полученные значения согласуются с приведенными в литературе данными [9, 12].
На основании спектральной характеристики поглощения хлорамфеникола в ультрафиолетовой области света в диапазоне длин волн 190-400 нм в качестве оптимальной для селективного детектирования хлорамфеникола выбрана длина волны 278 нм (рис. 1).
Установлены времена удерживания и интенсивность сигнала хлорамфеникола для каждой колонки в различных режимах элюирования, варьирующихся по соотношению растворителей (вода/ацетонитрил) в подвижной фазе при скорости элюирования 0,2 см3/мин и температуре колонки 25 °С. В ходе исследований установлено, что на колонке Poroshel 120 EC-C18 при соотношениях ацетонитрила и воды 80:20, 75:25, 70:30 и 60:40 анализируемое вещество практически не удерживается, время выхода менее 1 минуты. На колонке Eclipse XDB-C18 оптимальный режим элюирования достигается при соотношении ацетонитрила и воды 55:45, время выхода хлорамфеникола 3,08 мин. На колонке Bonus RP оптимальное элюирование стандартного раствора хлорамфеникола с учетом времени выхода, высоты и симметрии пика протекает при соотношении воды и ацетонитрила 60:40 (рис. 2).
В дальнейших исследованиях использовали колонку Bonus RP. Оптимальные условия элюирования на колонке Bonus RP длиной 50 мм и внутренним диаметром 4,6 мм с размером частиц 1,8 мкм: элюент – смесь воды и ацетонитрила в соотношении 60:40, скорость элюирования 0,2 см3/мин, температура колонки 25 °С. При данных условиях время выхода хлорамфеникола составляет 6,1±0,3 мин. Установлено, что в выбранном режиме элюирования компоненты матрицы полностью разделяются с хлорамфениколом (рис. 3).
Проведенные нами экспериментальные исследования показали, что степень экстракции хлорамфеникола из образцов мяса этилацетатом с очисткой петролейным эфиром составляет 56,4 %.
В первом варианте пробоподготовки по методу QuEChERS экстракция хлорамфеникола этилацетатом проводилась в нейтральной среде, степень извлечения составила 33,2 %. Во втором варианте экстракция протекала в кислой среде (рН=3), степень извлечения хлорамфеникола этилацетатом составила 41,0 %. Результаты изучения
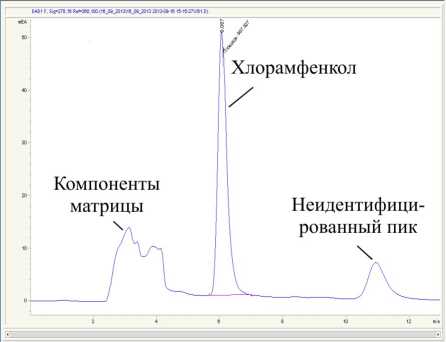
а
Рис. 3. Хроматограммы мясного образца с добавкой ( а ) и без добавки ( б ) стандартного раствора хлорамфеникола, полученные на колонке Bonus RP в оптимальном режиме элюирования
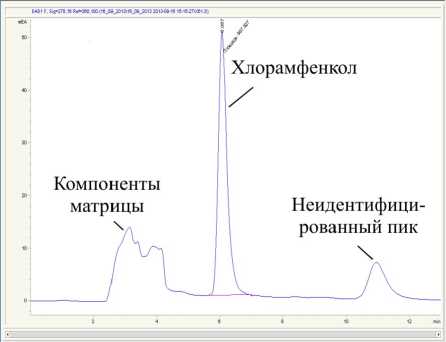
б
степени экстракции хлорамфеникола различными способами пробоподготовки представлены в табл. 1.
При сравнении различных способов пробоподготовки установлено, что максимальная степень экстракции антибиотика из образцов мясного фарша достигается с использованием в качестве растворителя-экстрагента этилацетата с последующей очисткой экстракта гексаном (см. табл. 1). При этом степень экстракции увеличивается от 70 до 99,9 % в зависимости от уменьшения концентрации хлорамфеникола в образце в диапазоне изучаемых концентраций (от 0,00005 до 0,02 мг/кг).
Результаты исследований по определе- нию метрологических характеристик представлены в табл. 2.
Таблица 1
Эффективность извлечения хлорамфеникола из мясной матрицы различными способами пробоподготовки
|
№ п/п |
Способ пробоподготовки |
Степень экстракции, % |
|
|
с учетом матричного эффекта |
без учета матричного эффекта |
||
|
1 |
Жидкостная экстракция этилацетатом и очистка экстракта гексаном |
70–99,9 |
101,3 |
|
2 |
Экстракция по методу QuEChERS в нейтральной среде |
33,2 |
91,0 |
|
3 |
Экстракция по методу QuEChERS в кислой среде (рН = 3) |
41,0 |
77,5 |
|
4 |
Экстракция этилацетатом и очистка экстракта петролейным эфиром |
56,4 |
70,5 |
Таблица 2
Значения показателей точности, повторяемости, воспроизводимости
|
Точка диапазона измерений хлорамфеникола, мг/кг |
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости), σ r , % |
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости) σ R , % |
Показатель точности (границы относительной погрешности при вероятности р = 0,95), ±δ, % |
|
0,000086 |
4,49 |
9,95 |
25,55 |
|
0,0019 |
2,84 |
4,41 |
10,98 |
|
0,018 |
1,22 |
1,81 |
4,64 |
На основании результатов, представленных в табл. 2, можно заключить, что максимальная погрешность измерения хлорамфеникола в мясных продуктах не превышает 26 % в диапазоне измерений от 0,00005 до 0,02 мг/кг включительно.
В ходе апробации методики определения хлорамфеникола в мясных продуктах ( n =17) антибиотик обнаружен в 17,6 % всех проанализированных проб в диапазоне концентраций от 0,00005 до 0,0019 мг/кг (максимальное содержание 0,0019 мг/кг).
Выводы:
– разработана высокочувствительная и селективная методика хромато-масс-спектрометрического определения хлорамфеникола (левомицетина) в мясных продуктах питания с нижним пределом определения 0,00005 мг/кг, позволяющая контролировать остаточное содержание антибиотика в мясной продукции в соответствии с требованиями технического регламента Таможенного союза «О безопасности мяса и мясной продукции» [6];
– анализ остаточных количеств хлорамфеникола в образцах мясной продукции (говядина, свинина, птица, n = 17) посредством данной методики показал присутствие хлорамфеникола в 17,6 % проб;
– методика может быть рекомендована к применению в лабораториях, осуществляющих контроль качества и безопасности продовольственного сырья и пищевых продуктов.
Список литературы Разработка методики определения хлорамфеникола в мясных продуктах
- Другов Ю.С., Родин А.А. Анализ загрязненных биосред и пищевых продуктов: практическое руководство. -М.: БИНОМ, Лаборатория знаний, 2010. -294 с.
- Егоров Н.С. Основы учения об антибиотиках: учебник для студентов биологических специальностей университетов. -4-е изд. -М.: Высшая школа, 1986. -448 с.
- Онищенко Г.Г., Зайцева Н.В., Уланова Т.С. Контроль содержания химических соединений и элементов в биологических средах: руководство. -Пермь: Книжный формат, 2011. -520 с.
- МУК 4.1.1912-04. Определение остаточных количеств левомицетина (хлорамфеникола, хлормицетина) в продуктах животного происхождения методом высокоэффективной жидкостной хроматографии и иммуноферментного анализа: методические указания. -М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2004. -26 с.
- Панин А.Н., Комаров А.А. Проблемы аналитического контроля безопасности кормов и продукции животноводства//Журнал Российского химического общества им. Д.И. Менделеева. -2005. -Т. XLIX, № 3. -С. 71-82.
- Технический регламент Таможенного союза «О безопасности мяса и мясной продукции» ТР ТС 034/2013/утвержден решением Совета Евразийской экономической комиссии № 68 9 октября 2013 г. -URL: http://socialvet.ru/blog/vetrinarni_meri_tsouz/3270.html (дата обращения: 10.09.2013).
- Codex Alimentarius Commission Maximum Residue Limits for Veterinary Drugs in Foods Updated as at the 35th Session of the Codex Alimentarius Commission (July 2012) CAC/MRL 2-2012. -URL: http://www.codexalimentarius.org/input/download/standards/45/MRL2_e.pdf (дата обращения: 10.09.2013).
- European Committee for Veterinary Medicinal Products. Chloramphenicol summary report. 1994. -European Agency for the Evaluation of Medicinal Products. -URL: http://www.emea.eu.int/pdfs/vet/mrls/chloramphenicol.pdf (дата обращения: 18.05.2004).
- Heidi R., James S., Hurlbut J. LC/MS/MS Analysis of Chloramphenicol in Crab Meat/U.S. Food and Drug Administration, Pacific Regional Lab Northwest, 22201 23rd Drive SE, Bothell, WA 98021//Laboratory Information Bulletin. -2003, April. -Vol. 19, № 4. -URL: http://www.fda.gov/Food/FoodScienceResearch/LaboratoryMethods/ucm113380.htm (дата обращения: 21.08.2013).
- IARC Monographs on the evaluation of carcinogenic risk of chemicals to humans//Chloramphenicol. -Lyon: IARCPress, 1990. -Vol. 50. -P. 169-193.
- Interaction of chloramphenicol and metabolites with colony stimulating factors: possible role in chloramphenicol-induced bone marrow injury/J.J. Jimenez, J.G. Jimenez, D. Daghistani and A.A. Yunis//Am. J. Med. Sci. -1990. -Vol. 300. -P. 350-353.
- Neuhaus В., Hurlbut J., Hammack W. LC/MS/MS Analysis of Chloramphenicol in Shrimp//Laboratory Information Bulletin. -2002. -№ 4290.
- Plumb D.C. Veterinary Drug Handbook. -Ames: Iowa State Press, 2002. -4th Ed. -P. 166-169.
- Wang J., Macneil J.D., Kay J.F. Chemical analysis of antibiotic residues in food. -Wiley, 2012. -353 p.


