Разработка микробиологического метода снижения вредоносности фузариоза на сое
Автор: Маслиенко Л.В., Курилова Д.А.
Рубрика: Защита и иммунитет
Статья в выпуске: 2 (151-152), 2012 года.
Бесплатный доступ
Представлены результаты ступенчатого скрининга коллекционных штаммов лаборатории биометода ВНИИМК к патогенному изоляту гриба Fusarium sporotrichiella Bilai var. poae (Pk.) Wr. emend Bilai. В результате отобраны два наиболее эффективные штаммы антагонистов Xk-1 Chaetomium olivaceum Cook et Ellis и 14-3 Pseudomonas chlororaphis. Установлена высокая биологическая эффективность лабораторных образцов микробиопрепаратов на фоне искусственного заражения возбудителем фузариоза и положительное влияние на культуру сои. Изучены физиологические признаки перспективного бактериального штамма-продуцента 14-3 Pseudomonas chlororaphis. Установлена совместимость перспективных штаммов Xk-1 Ch. olivaceum и 14-3 P. chlororaphis с рекомендованными к применению на сое фунгицидами с целью возможного совместного применения в интегрированной системе защиты.
Фузариоз, соя, антагонисты, грибы, бактерии, микробиопрепараты, скрининг, штаммы, ростостимуляция, антибиотическая активность, периодическое культивировоние
Короткий адрес: https://sciup.org/142151083
IDR: 142151083 | УДК: 632.937:633.853.52
Текст научной статьи Разработка микробиологического метода снижения вредоносности фузариоза на сое
Введение. Соя поражается грибными, бактериальными и вирусными болезнями. В нашей стране особой вредоносностью отличаются болезни всходов и увядания растений, одним из возбудителей которых является Fusarium spp. [1; 2; 3]. На посевах сои фузариоз встречается повсеместно. Согласно литературным данным использование живых культур микроорганизмов в борьбе с фузариозными заболеваниями растений является наиболее интересным подходом. Этот метод микробиозащиты не только менее опасен с точки зрения защиты окружающей среды, но и более обоснован с позиции эволюционного осмысления соотношения паразитических и сапрофитных свойств фузариев. Поскольку грибы рода Fusarium являются почвообитающими факультативными паразитами, способными длительное время вести сапрофитное существование, то интродукция антагонистов должна создавать дополнительное давление в сторону элиминирования агрессивных рас [4; 5].
Стратегия биологического метода защиты растений от болезней не ставит задачу полного уничтожения вредных организмов, а ориентируется на регулирование популяции патогена на уровне ниже экономического порога вредоносности [6]. Грамотное и своевременное применение микробиологических средств защиты растений на фоне высокой агротехники может значительно улучшить фитосанитарную обстановку посевов и значительно увеличить урожай, поскольку микробиологические средства защиты растений оказывают положительное влияние на растения и других членов агроценозов.
Целью данной работы являлась разработка эффективного и экологически допустимого микробиологического метода снижения вредоносности фузариоза на сое.
Материалы и методы. Объектом исследований служили: штаммы грибов и бактерий-антагонистов возбудителей болезней масличных культур, тест-культура возбудителя фузариоза сои, лабораторные образцы микробиопрепаратов. Грибы и бактерии, проявляющие антагонизм в отношении патогенных фузариозных грибов, были взяты из коллекции микроорганизмов лаборатории биометода ВНИИМК. В качестве тест-объекта для испытания антагонистической активности штаммов грибов и бактерий был выбран наиболее патогенный и агрессивный для сои изолят гриба Fusarium sporotrichiella Bilai var. poae (Pk.) Wr. emend Bilai, выделенный из корневой системы сои.
Определение антагонистической активности грибных и бактериальных штаммов проводили методом двойных (встречных) культур [7; 8] на картофель-но-сахарозном агаре (КСА) или среде Кинга В, при двух температурных режимах: 25 и 10 оС. Изучали характер взаимоотношений антагониста и патогена: наличие или отсутствие стерильных зон, их размер, изменение цвета, плотности, толщины и направления роста мицелия патогена. Все активные штаммы грибов при совместном культивировании с возбудителем фузариоза изучали по пяти типам взаимоотношений [9]. Взаимоотношения бактерий с возбудителем фуза-риоза изучали по образованию стерильных зон антибиотического действия или обладающих высоким показателем подвижности [10].
Определение фитотоксичности штаммов проводили методом обработки семян сои опытными партиями микробиопрепаратов и методом погружения подрезанной корневой системы здоровых 7-дневных проростков сои в суспензию штаммов антагонистов. Для изучения ростостимулирующего влияния перспективных штаммов на проростки сои, семена обрабатывали опытными партиями микробиопрепаратов и помещали на проращивание в рулоны из фильтровальной бумаги (в течение 7 дней при температуре 25 оС). Параметрами для последующего анализа служили длина и масса корня и побега.
Защитный эффект жидких культур (ЖК) и водных суспензий (ВС) штаммов антагонистов прорастающего семени и подбор оптимальных норм их применения определяли на фоне искусственного заражения семян сои F. sporotrichiella var. poae в лабораторных условиях во влажной камере методом агаровых блоков [11]. Контроль – чистые семена без нанесения инфекции и с нанесением инфекции. Опыт проводился при 25 оС. Активные штаммы антагонистов наращивали на подобранных средах. Перед обработкой семян определяли титр микробиопрепаратов. Титр ЖК и ВС во всех опытах определяли методом Коха [12].
Биологическую эффективность биопрепарата определяли по формуле [13]:
1 О О x (а - b ) C = , где C – биологическая эффективность;
a – количество больных растений в контроле;
b – количество больных растений в варианте.
Для определения колонизирующей активности и защитного эффекта штаммов антагонистов корней проростков сои использовали методические рекомендации по оценке и отбору растений подсолнечника на устойчивость к фузариозной корневой гнили [14]. Оценку степени поражения проростков возбудителем фу-зариоза производили согласно разработанной нами 6-балльной шкале.
Для создания искусственного фона заражения почвы фузариозом в лабораторных условиях на основе общепринятых методик [15; 16] нами были испытаны различные способы и нормы внесения инфекционного начала фитопатогена [17]. Учеты производили на 7 и 10-й день после посева.
Изучение физиологических особенностей перспективного штамма антагониста 14-3 Pseudomonas sp. проводили на жидкой питательной среде Кинга В. Культивирование микроорганизма осуществляли глубинным способом на качалке со скоростью вращения 195 об./мин, в колбах Эрленмейера (750 мл) при объеме среды 150 мл. Оптимальные параметры физиологических признаков определяли по количеству колониеобразующих единиц (КОЕ) в 1,0 мл жидкой культуры (титр). Повторность в каждом опыте – 3-кратная. Для определения оптимальной температуры культивирования, штамм бактерии выращивали при температурах 20, 25, 30 и 35 °С. Для определения оптимальной кислотности среды, pH устанавливали в пределах 3, 5, 6, 7, 8, и 10, добавляя лимонную кислоту или щелочь (4Н раствор NaOH). Устанавливали оптимальные источники углеродного и азотного питания. Источниками углеродного питания служили глюкоза, сахароза, глицерин и меласса. Источниками азотного питания служили азотнокислый натрий, пептон, дрожжевой и кукурузный экстракты. При подборе оптимальных питательных сред для выращивания перспективного штамма бактерии испытывали ряд сложных питательных сред: мясо-пептонный бульон (МПБ), Кинга В, Чапека для бактерий, пептонодрожжевая, в состав которых вхо- дят минеральные соли, сахара, микроэлементы, кукурузный и дрожжевой экстракты.
Для изучения динамики периодического роста, глубинное культивирование штамма бактерии осуществляли при оптимальных условиях в течение 4 суток, с предварительным внесением посевной (маточной) культуры (2 % от объема питательной среды). Для выращивания культуры использовали питательную среду Кинга В. Пробы для анализа брали через 8, 16, 24, 36, 48 и 72 часа после начала культивирования.
Антибиотическую активность определяли методом диффузии в агар [8].
Определение совместимости штаммов-продуцентов микробиопрепаратов с перспективными пестицидами проводили, используя модифицированный метод диффузии в агар, разработанный для определения антибиотической активности микроорганизмов [18; 19].
Результаты и обсуждения. На первом этапе скрининга тестировали 20 грибных штаммов из коллекции перспективных штаммов антагонистов фитопатогенов масличных культур лаборатории биометода ВНИИМК, представленных родами Trichoderma , Penicillium , Chaetomium , Trichothecium , Sordaria , Talaromyces и классом Basidiomycetes ; и 26 бактериальных штаммов, представленных родами Bacillus и Pseudomonas .
В результате первичного скрининга штаммов грибов и бактерий антагонистов к возбудителю фузариоза сои F. sporo-trichiella var. poae при двух температурных режимах 25 и 10 ºС наибольшую эффективность показали 12 штаммов антагонистов, среди которых 5 штаммов грибов: Tk-1 Trichoderma koningii , T-4 Trichoderma sp ., Sm-1 Sordaria macro-spora, A-1 Basidiomycetes , Хk-1 Chaetomi-um olivaceum , и 7 штаммов бактерий: 12-2 Pseudomonas sp . , 14-3 Pseudomonas sp. , Sgrc-1 P. fluorescens , Far 8 Bacillus sp ., 111 Bacillus sp ., Б-5 B. liche-niformis , Б-12 B. licheniformis [20].
Следующим этапом скрининга стало исследование возможного токсического воздействия активных штаммов антагонистов на культуру сои. Анализ данных показал, что тестируемые штаммы не оказывают негативного влияния на всхожесть семян и не вызывают увядания проростков. Более того, отмечено повышение всхожести семян по сравнению с контролем на 9,0–20,0 % [21].
Изучение ростостимулирующего влияния перспективных штаммов антагонистов на проростки сои показало, что наиболее сильное влияние штаммы оказывали на длину и массу корня. Максимальное увеличение длины корня (на 22,0–25,2 %) наблюдалось у штаммов грибов Xk-1 Ch. olivaceum , Tk-1 T. konin-gii. Максимальное увеличение массы корня (на 13,3–20,0 %) наблюдалось в вариантах с грибом Xk-1 Ch. olivaceum и бактериями 12-2 и 14-3 Pseudomonas sp . Влияние штаммов антагонистов на длину и массу стебля также отмечено, но в меньшей степени (2,6–11,5; 8,5–9,8 % соответственно) [21].
Определение защитного эффекта перспективных штаммов антагонистов прорастающего семени сои от фузариоза, а также отработку оптимальных норм расхода опытных образцов биопрепаратов проводили во влажной камере, используя метод агаровых блоков. Для бактериальных штаммов испытывались нормы от 0,5 до 3,0 л/т, для грибных штаммов от 2,0 до 4,0 л/т. Оптимальными были признаны: для бактериальных штаммов рода Pseudomonas 12-2 и Sgrc-1 – 1,0 л/т, для 14-3 – 2,0 л/т; для грибных штаммов Хk-1 Ch. oli-vaceum и Pv-3 P. verrucosum – 3,0 л/т; для Sm-1 S. macrospora, Tk-1 Tr. koningii и А-1 Basidiomycetes – 4,0 л/т. Максимальная биологическая эффективность на фоне поражения фузариозом в контроле 58,6 % установлена у штаммов: 12-2 Pseudomonas sp . (65,9 %), Хk-1 Ch. olivaceum (59,0 %), 14-3 Pseudomonas sp . (52,2 %), Tk-1 T. koningii (49,8 %), Sm-1 S. macrospora и Sgrc-1 Pseudomonas sp . (47,6 %).
Изучение колонизирующей активности, а одновременно и защитного эффекта, показало, что на жестком (100 %) фоне заражения F. sporotrichiella var. poae максимальную эффективность проявили штаммы: 14-3 Pseudomonas sp., Pv-3 P. verru- cosum, Б-5 B. licheniformis, Sgrc-1 P. fluo-rescens, 12-2 Pseudomonas sp., Sm-1 S. macrospora и Xk-1 Ch. olivaceum. В этих вариантах от 40,0 до 100 % проростков оказались жизнеспособными, тогда как в контрольном варианте жизнеспособных проростков не обнаружено.
Максимальная биологическая эффективность на фоне искусственного заражения семян сои фузариозом в почве отмечена у штаммов Xk-1 Ch. olivaceum (33,9 %), Tk-1 T. koningii (27,2 %) и 14-3 Pseudomonas sp . (20,3 %), при поражении в контроле 79,7 % [17].
Принимая во внимание положение о том, что успешный биоагент должен обладать комплексом положительных свойств на растение [22; 23], мы объединили весь спектр данных, полученных по скринингу активных штаммов антагонистов (рис. 1).
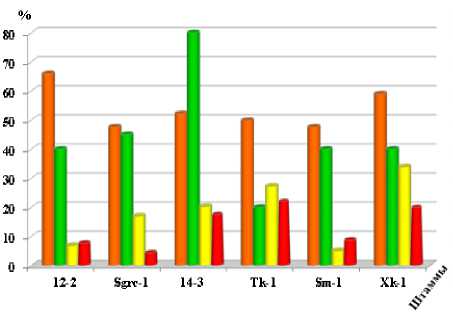
Рисунок 1 – Защитный эффект и колонизирующая активность на фоне искусственного заражения Fusarium sporotrichi-ella var. poae , а также ростостимулирующее действие микробиопрепаратов на основе перспективных штаммов антагонистов при обработке семян сои: – защитный эффект во влажной камере;
■ – колонизирующая активность во влажной камере;
– защитный эффект в почве;
■ – ростостимулирующее действие перспективных штаммов антагони- стов на проростки сои.
В результате анализа полученных экспериментальных данных в качестве продуцентов микробиопрепаратов для защиты растений сои от фузариоза были отобраны штаммы Xk-1 Chaetomium olivaceum Cook et Ellis и 14-3 Pseudomonas sp. Данные штаммы не только обеспечивали эффективную защиту семян и проростков сои на жестком фоне искусственного заражения возбудителем фуза-риоза, но и активно колонизировали корень, одновременно оказывая ростостимулирующее действие на культуру сои.
Согласно видовой идентификации штамма 14-3 Pseudomonas sp., проведённой в Центре «Биоинженерия» (г. Москва), изолят 14-3 является штаммом вида Pseudomonas chlororaphis.
Так как гриб Ch. olivaceum является продуцентом микробиопрепарата Хетомин, разработанного ранее в лаборатории биометода , основная часть дальнейших исследований проводилась по изучению бактериального штамма 14-3 P. chlororaphis.
Существенное значение для роста микроорганизмов имеет такой фактор внешней среды, как температура (табл. 1).
Таблица 1
Влияние температуры на рост штамма бактерии-антагониста 14-3 P. chlorora-phis в процессе периодического культивирования
|
Штамм |
Титр ЖК, КОЕ/мл |
||||
|
маточная культура |
температура, °С |
||||
|
20 |
25 |
30 |
35 |
||
|
14-3 P. chloro-raphis |
6,2х1010 |
1,4х109 |
2,9х1012 |
5,7х1012 |
2,3х1010 |
Максимальный титр клеток отмечен при 25 и 30 °С (2,9–5,7 × 1012). Следовательно, данный температурный диапазон является оптимальным для роста штамма 14-3 P. chlororaphis.
Одним из важных факторов, определяющих нормальный рост бактерий, является реакция рН среды. При изменении ее в неблагоприятную сторону микроорганизм перестает расти даже в тех случаях, если все остальные условия окружающей среды будут оптимальными [25].
Максимальный титр штамма 14-3 отмечался при рН среды 5,0 (5,3 × 1014), достаточно высокий при рН 6,0–10,0 (от 3,2 × 1012 до 2,1 × 1013) (табл. 2). Лимитирующим оказалось значение реакции среды 3,0, при котором выживали лишь единичные клетки. Следовательно, для штамма 14-3 P. chlororaphis оптимальным является достаточно широкий диапазон реакции среды – 5,0–10,0.
Таблица 2
Влияние реакции рН среды на рост штамма бактерии-антагониста 14-3 P. chlororaphis в процессе периодического культивирования
|
Штамм |
Титр ЖК, КОЕ/мл |
||||||
|
маточная культура |
рН |
||||||
|
3,0 |
5,0 |
6,0 |
7,0 |
8,0 |
10,0 |
||
|
14-3 P. chlorora-phis |
4,7 × 1014 |
8,0 × 103 |
5,3 × 1014 |
2,1 ×1013 |
6,0 × 1012 |
8,4 ×1012 |
3,2 ×1012 |
Для определения оптимальных источников углеродного и азотного питания штамм 14-3 P. chlororaphis выращивали при температуре 25,0 °С и рН среды 5,0. Максимальный титр штамма-продуцента отмечен в вариантах с добавлением глюкозы, глицерина и сахарозы (2,8–8,3 ×
1012 КОЕ/мл). Также хорошее развитие культура бактерии получила в варианте с мелассой (2,1 × 1010 КОЕ/мл) (табл. 3).
Таблица 3
Влияние источников углерода на рост штамма бактерии-антагониста 14-3 P. chlororaphis в процессе периодического культивирования
|
Штамм |
Титр ЖК, КОЕ/мл |
||||
|
маточная культура |
источник углерода |
||||
|
глицерин |
глюкоза |
сахароза |
меласса |
||
|
14-3 P. chloro-raphis |
4,9×1014 |
4,0×1014 |
2,8×1014 |
8,3×1014 |
2,1×1012 |
При испытании источников азота установлено, что добавление кукурузного экстракта в среду приводит к полной гибели клеток. На питательной среде с добавлением азотнокислого натрия отмечен низкий титр штамма (3,5 × 103 КОЕ/мл). Тогда как высокий титр штамма 14-3 наблюдался при использовании пептона и дрожжевого экстракта (2,1–4,4 × 1012 КОЕ/мл) (табл. 4).
Таблица 4
Влияние источников азота на рост штамма бактерии-антагониста 14-3 P. chlororaphis в процессе периодического культивирования
|
Штамм |
Титр ЖК, КОЕ/мл |
||||
|
маточная культура |
источник азота |
||||
|
пептон |
дрожже -вой экс тракт |
азотнокислый натрий |
кукурузный экстракт |
||
|
14-3 P. chloro-raphis |
2,9×1014 |
2,1×1014 |
4,4×1014 |
3,5×105 |
0 |
Определение оптимальных питательных сред для культивирования штамма 14-3 P. chlororaphis проводили на сложных синтетических и органосинтетических средах (табл. 5).
Таблица 5
Влияние питательных сред на рост штамма бактерии-антагониста 14-3 P. chlororaphis в процессе периодического культивирования
|
Штамм |
Титр ЖК, КОЕ/мл |
||||
|
маточная культура |
с |
еда |
|||
|
Кинга В |
Чапека для бактерий |
пептоно-дрожжевая |
мясо-пептонный бульон |
||
|
14-3 P. chloro-raphis |
3,2×1014 |
3,5×1012 |
2,2×1010 |
4,8×1012 |
2,9×107 |
Максимальный титр отмечен при культивировании бактериального штамма на пептон-дрожжевой и среде Кинга В (3,5– 4,8 × 1012 КОЕ/мл). Также хорошее развитие культура получила на среде Чапека для бактерий (2,2 × 1010 КОЕ/мл). На МПБ был получен низкий титр (2,9 × 107 КОЕ/мл). При этом, принимая во внимание титр маточной культуры (3,2 × 1014 КОЕ/мл) и посевной объем (3,0 мл на 150 мл стерильной питательной среды), можно сделать вывод о том, что бактерии не размножались, а находились в состоянии покоя, сохраняя жизнеспособность.
Изучение кинетики роста штамма 14-3 P. chlororaphis показало, что лучшими сроками культивирования данной бактерии являются 36–48 часов. Образцы жидкой культуры биопрепарата в этот период характеризовались высоким титром (1,6– 1,7 × 1013 КОЕ/мл) (табл. 6).
Таблица 6
Рост штамма бактерии-антагониста 14-3 P. chlororaphis в процессе периодического культивирования
|
Время культивирования, час |
Титр жидкой культуры штамма, КОЕ/мл |
|
8 |
3,0 × 10 6 |
|
16 |
4,2 × 10 9 |
|
24 |
7,8 × 10 12 |
|
36 |
1,6 × 10 13 |
|
48 |
1,7 × 10 13 |
|
72 |
1,8 × 10 12 |
|
96 |
4,3 × 10 10 |
Антибиотическую активность штамма-продуцента определяли в зависимости от срока периодического культивирования методом диффузии в агар. Установлено, что максимальная антибиотическая активность штамма 14-3 P. chlororaphis к возбудителю фузариоза сои, которая оказывала стойкое сдерживающее действие на патоген, наблюдалась через 72–96 часов культивирования (табл. 7).
Таблица 7
Антибиотическая активность штамма бактерии-антагониста 14-3 P. chlororaphis к возбудителю фузариоза F. sporotrichiella var. poae при периодическом культивировании
|
Вариант |
Срок культи-вирования штамма, час |
Срок выращивания Fusarium sporotrichiella var. poae , сут. |
|||||||
|
рост мицелия патогена, балл |
|||||||||
|
2 |
3 |
4 |
5 |
6 |
7 |
10 |
15 |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Контроль 14-3 P. chlor-oraphis |
8 |
2 2 |
5 6 |
6 6 |
6 6 |
6 6 |
6 6 |
6 6 |
6 6 |
|
Контроль 14-3 P. chlo- roraphis |
16 |
2 2 |
5 6 |
6 6 |
6 6 |
6 6 |
6 6 |
6 6 |
6 6 |
|
Контроль 14-3 P. chloro-raphis |
24 |
2 2 |
6 6 |
6 6 |
6 6 |
6 6 |
6 6 |
6 6 |
6 6 |
|
Контроль 14-3 P. chloro-raphis |
36 |
2 3 |
6 6 |
6 6 |
6 6 |
6 6 |
6 6 |
6 6 |
6 6 |
Продолжение таблицы 7
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Контроль 14-3 P. chloro- |
48 |
2 |
5 |
6 |
6 |
6 |
6 |
6 |
6 |
|
raphis |
2 |
6 |
6 |
6 |
6 |
6 |
6 |
6 |
|
|
Контроль 14-3 P. chloro- |
72 |
3 |
6 |
6 |
6 |
6 |
6 |
6 |
6 |
|
raphis |
2 |
4 |
5 |
5 |
5 |
5 |
5 |
5 |
|
|
Контроль 14-3 P. chloro- |
96 |
3 |
6 |
6 |
6 |
6 |
6 |
6 |
6 |
|
raphis |
2 |
4 |
4 |
5 |
5 |
5 |
5 |
5 |
Примечание: 2 балла – рост мицелия патогена на 15,0–25,0 % площади питательной среды; 3 балла – рост мицелия патогена на 30,0–40,0 % площади питательной среды; 4 балла – рост мицелия патогена на 45,0–60,0 % площади питательной среды; 5 баллов – рост мицелия патогена на 65,0–80,0 % площади питательной среды; 6 баллов – рост мицелия патогена на 85,0–100,0 % площади питательной среды.
Таким образом, для штамма 14-3 P. chlororaphis установлены оптимальные условия (t – 25–30 оС, рН – 5–10) и сроки культивирования (с учетом синтеза максимальной концентрации антибиотических веществ) – 72 часа.
Для установления возможности совместного применения грибного штамма Xk-1 Ch. olivaceum и бактериального штамма 14-3 P. chlororaphis определяли их совместимость методом встречных культур (рис. 2).
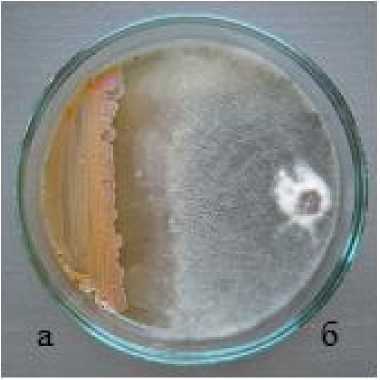
Рисунок 2 – Совместимость перспективных штаммов-продуцентов микробиопрепаратов на 10 сутки инкубации:
а – штамм 14-3 P. chlororaphis ;
б – штамм Xk-1 Ch. olivaceum.
На 7-е сутки инкубации наблюдалась явная антагонистическая активность штамма 14-3 P. chlororaphis по отношению к штамму Хk-1 Ch. olivaceum , которая выражалась в образовании антибиотической зоны (14 мм), тогда как в чистой культуре гриб занял всю площадь питательной среды чашки Петри. На 10-е сутки совместного культивирования расстояние между штаммами сократилось до 8 мм, однако вблизи зоны мицелий штамма Xk-1 был тонкий, паутинистый, плодовые тела отсутствовали. На 14-е сутки инкубации изменений не произошло. Таким образом, нами установлено, что штаммы Xk-1 и 14-3 несовместимы между собой, что исключает их совместное применение.
Следующим этапом исследований стало определение совместимости разработанных лабораторных образцов микробиопрепаратов и химических фунгицидов, разрешённых к применению на сое, с целью определения возможности их совместного применения в интегрированной системе защиты сои от комплекса болезней. Установлено, что штамм 14-3 P. chlororaphis совместим со всеми фунгицидами, рекомендуемыми в настоящее время для обработки семян сои: ТМТД, ВСК (тирам, 400 г/л), Максим, КС (флу-диоксонил, 25 г/л), Фундазол, СП, (бено-мил, 500 г/кг). Это делает возможным его применение в сложных композиционных составах для обработки семян сои. Грибной штамм Xk-1 Ch. olivaceum оказался совместим только с ТМТД, ВСК (тирам, 400 г/л), который оказывал на него незначительное ингибирующее действие. Такие препараты, как Максим, КС (флу-диоксонил, 25 г/л) и Фундазол, СП, (беномил, 500 г/кг) существенно задерживали рост гриба, что исключает их совместное применение [26].
Выводы. По итогам ступенчатого скрининга отобраны перспективные штаммы-продуценты микробиопрепаратов: Хк-1 Ch. olivaceum и 14-3 P. chloro-raphis, обеспечивающие эффективную защиту семян и проростков сои на жёстком фоне искусственного заражения фу-зариозом во влажной камере и в почве, активно колонизирующие корень, одновременно оказывающие стимулирующее влияние на культуру сои.
Для штамма 14-3 P. chlororaphis установлены оптимальные условия (температура 25,0–30,0 оС, рН 5–10) и сроки культивирования (с учетом синтеза максимальной концентрации антибиотических веществ) – 72 часа, элементы питания (источники углерода – глюкоза, глицерин, сахароза и меласса; источники азота – пептон и дрожжевой экстракт), питательные среды (пептон-дрожжевая и Кинга В).
При изучении совместимости лабораторных образцов микробиопрепаратов и химических фунгицидов была определена возможность их совместного применения в интегрированной системе защиты сои от комплекса болезней (14-3 P. chloro-raphis – с ТМТД, ВСК, Максим, КС, Фундазол, СП; Хк-1 Chaetomium olivaceum – с ТМТД, ВСК). Совместное же применение штаммов Xk-1 и 14-3 не представляется возможным.
Работа выполнена при финансовой поддержке гранта РФФИ № 09-08-00726-а и программы У.М.Н.И.К., государственный контракт №14046.


