Разработка микрофлюидной тест-системы на основе флюоресцентных микросфер для обнаружения иммуноглобулинов класса G к Sars-Cov-2
Автор: Шакуров Руслан Ильдарович, Шанский Ярослав Дмитриевич, Прусаков Кирилл Александрович, Сизова Светлана Викторовна, Дудик Степан Павлович, Плотникова Людмила Валерьевна, Манувера Валентин Александрович, Клинов Дмитрий Владимирович, Лазарев Василий Николаевич, Беспятых Юлия Андреевна, Басманов Дмитрий Викторович
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.14, 2023 года.
Бесплатный доступ
Обоснование. С 2019 года весь мир охватила пандемия новой коронавирусной инфекции COVID-19, которая продолжается по сей день. За эти годы возбудитель SARS-CoV-2 претерпел ряд мутационных изменений в геноме, что повлекло распространение различных генетических вариантов вируса. Между тем для диагностики этиологического агента, установления стадии заболевания и оценки иммунитета используются методы, неспецифичные в отношении различных вариантов SARS-CoV-2 и требующие значительных временных затрат. Таким образом, актуальным направлением является разработка новых методов диагностики COVID-19, а также внедрение данных разработок в практику. Широкие возможности в этом направлении открывают системы на основе химически модифицированных флюоресцентных микросфер с возможностью мультиплексного анализа целевых белковых молекул. Цель исследования - разработка микрофлюидной тест-системы на основе флюоресцентных микросфер для специфического обнаружения иммуноглобулинов класса G (IgG) к SARS-CoV-2. Методы. Формирование охарактеризованной коллекции образцов сыворотки крови человека с использованием иммуноферментного анализа и коммерчески доступных наборов реагентов. Обнаружение IgG к SARS-CoV-2 в сыворотке крови человека, содержащей известный уровень антител, разработанным иммунофлюоресцентным методом с использованием микросфер, на поверхности которых химическим путем был иммобилизован RBD-фрагмент S-белка вируса SARS-CoV-2, вариант Каппа. Результаты. Согласно данным иммуноферментного анализа, уровень IgG в сыворотке крови добровольцев в группе, перенесших коронавирусную инфекцию, в 9-300 раз превышал таковой в группе условно здоровых добровольцев, не болевших COVID-19. Получены конъюгаты флюоресцентных микросфер с RBD-фрагментом S-белка, способные специфически связывать IgG из сыворотки крови. Образование иммунных комплексов подтверждено данными флюоресцентной микроскопии: интенсивность флюоресценции вторичных антител в иммунных комплексах при их образовании на поверхности флюоресцентных микросфер прямо пропорциональна содержанию IgG (r=0,963). Тест-система обладает хорошей прогностической значимостью (AUC 70,3%). Заключение. Разработана тест-система на основе флюоресцентных микросфер, содержащих иммобилизованный RBD-фрагмент S-белка SARS-CoV-2, для иммунофлюоресцентного выявления IgG в сыворотке крови человека. При апробации системы на образцах сыворотки крови добровольцев с различным уровнем IgG к SARS-CoV-2 показана ее прогностическая ценность, что позволяет позиционировать представленную тест-систему как метод оценки содержания иммуноглобулинов к SARS-CoV-2 в сыворотке крови человека с перспективой внедрения в клиническую практику. Представленная тест-система может быть использована также для интеграции в различные микрофлюидные системы и создания чипов и приборов «прикроватной диагностики».
Диагностика covid-19, иммуноферментный анализ, персонализированная медицина
Короткий адрес: https://sciup.org/143179884
IDR: 143179884 | DOI: 10.17816/clinpract278280
Текст научной статьи Разработка микрофлюидной тест-системы на основе флюоресцентных микросфер для обнаружения иммуноглобулинов класса G к Sars-Cov-2
Submitted 23.02.2023 Revised 01.03.2023 Published 31.03.2023
ОБОСНОВАНИЕ
В настоящее время в мире продолжается пандемия новой коронавирусной инфекции COVID-19, вызываемой представителем рода бетакоронави-русов SARS-CoV-2. На данный момент идентифицировано 14 вариантов SARS-CoV-2, возникших в результате замены нуклеотидов в вирусной РНК, из которых 5 вариантов являются эпидемиологически значимыми [1]. Иммунный ответ на попадание вируса SARS-CoV-2 в организм человека включает выработку специфичных иммуноглобулинов (антител) различного типа. Иммуноглобулины класса G

кт ГА
(IgG) являются в наибольшей мере ответственными за формирование стойкого иммунитета. Данный тип антител вырабатывается к структурному белку нуклеокапсида (N-белок), гликопротеину шипиков (S-белок) и его RBD-фрагменту, который отвечает за связывание вирусной частицы с клеткой-мишенью. Определение уровня IgG используется для оценки эффективности иммунного ответа на перенесенную и текущую инфекцию, а также для выявления поствакцинального иммунитета и отбора доноров с наилучшими показателями содержания защитных антител. Более поздние варианты SARS-CoV-2 обладают повышенной трансмиссив-ностью и вирулентностью, а также пониженной чувствительностью к механизмам иммунитета [2]. В частности, такие варианты могут ускользать от поствакцинальных антител, что обусловливает необходимость их своевременного обнаружения и оценки уровня иммунитета к ним.
Существует ряд диагностических методов, основанных на определении содержания IgG в биологических жидкостях человека. В клинической практике основным на сегодняшний день является неконкурентный иммуноферментный анализ (ИФА). Хотя золотым стандартом в диагностике COVID-19 остается непосредственно обнаружение РНК вируса в организме человека методом полимеразной цепной реакции [3], ИФА получил широкое распространение как для выявления антител, так и антигена вируса. К преимуществам ИФА относится высокая скорость проведения исследования, что особенно важно для своевременной постановки диагноза [4]. Однако коммерческие наборы ИФА обычно неспецифичны в отношении различных вариантов коронавируса. В связи с этим актуальным является создание высокочувствительной и специфичной мультиплексной тест-системы, направленной на обнаружение IgG в сыворотке крови человека.
В период пандемии COVID-19, когда резко возросла нагрузка на лечебно-профилактические учреждения и серьезно сократились временные и материальные ресурсы, особенно очевидной стала важность не только точности анализа, но и скорости его получения. Одним из решений данной проблемы стали разработка и внедрение в клиническую практику методов диагностики непосредственно у постели пациента, так называемой прикроватной диагностики (point-of-care) [5]. Коммерчески доступные флюоресцентные микросферы, модифицированные различными химическими группами, представляют собой удобную и гибкую платформу для разработки мультиплексных тест-систем для «прикроватной диагностики» [6].
Цель исследования : разработать микрофлю-идную тест-систему на основе флюоресцентных микросфер с целью специфического обнаружения IgG к SARS-CoV-2 с перспективой мультиплексирования для разных генетических вариантов вируса.
МЕТОДЫ
Критерии соответствия
Критерии включения в первую группу исследования: условно здоровые добровольцы обоего пола в возрасте от 18 лет и старше, без жалоб на состояние здоровья, без перенесенной новой коронавирусной инфекции (на основании анамнеза и оценки уровня IgG и IgM к SARS-CoV-2) и гиперчувствительности к компонентам вакцины в анамнезе.
Критерии включения во вторую группу исследования: добровольцы обоего пола в возрасте от 18 лет и старше, перенесшие новую коронавирусную инфекцию и имеющие подтвержденный высокий уровень IgG к SARS-CoV-2.
Критерии невключения: гиперчувствительность к компонентам вакцины в анамнезе.
Условия проведения
Исследование проводили в ФГБУ ФНКЦ ФХМ им. академика Ю.М. Лопухина ФМБА России (Одинцово, Московская область).
Описание медицинского вмешательства
Формирование коллекции образцов сыворотки крови
Для формирования коллекции образцов сыворотки крови у добровольцев ( n =27) отбирали кровь в объеме 5 мл в пробирки с гелем и активатором свертывания (Zhejiang Gongdong Medical Technology, Китай). Пробирки центрифугировали при 2000 об./мин в течение 20 мин (центрифуга LMC-3000, Biosan, Латвия). Далее отбирали сыворотку и аликвотировали в пластиковых микроцен-трифужных пробирках (Eppendorf, Германия) по ~1,0 мл, при необходимости хранили при -40°С.
Иммуноферментный анализ IgG
Уровень содержания IgG и IgM в образцах коллекции сыворотки крови человека определяли методом непрямого неконкурентного иммуно-ферментного анализа. Исследование проводили на анализаторе Lazurite (Dynex Technologies Inc., США) с использованием наборов реагентов для иммуноферментного выявления IgG и IgM к SARS-CoV-2 — «SARS-CoV-2-IgG-ИФА-БЕСТ», «SARS-CoV-2-IgМ-ИФА-БЕСТ» (Вектор-Бест, Россия). По результатам измерений рассчитывали коэффициент позитивности (КП):
КП = ODобр / ( ( OD1К– + OD2К–) / 2 + 0,2 )
где ODобр — оптическая плотность образца сыворотки; К– — отрицательный контрольный образец из набора. Значения КП интерпретировали следующим образом: КП >1,1 — результат положительный (присутствуют IgG); 0,8≤ КП <1,1 — результат пограничный; КП <0,8 — результат отрицательный (отсутствуют IgG).
Микросферы
В исследовании использовали парамагнитные полилактидные микросферы Magplex-C 056 (Luminex, США) диаметром 6,5±0,2 мкм с поверхностными карбоксильными группами. Активацию карбоксильных групп на поверхности микросфер проводили при помощи 1-этил-3-(3-диметилами-нопропил)-карбодиимида (EDС, Sigma Aldrich, Германия) в MES-буфере (BioRad, США) в присутствии N-гидроксисульфосукцинимида (NHS, Abcam, США). Для конъюгации с активированными микросферами использовали RBD-фрагмент синтетического
S-белка вируса SARS-CoV-2 (вариант B.1.617.1 Каппа) в концентрации 0,1 мг/мл.
Микрофлюидный чип
Микрофлюидный чип был изготовлен из полиметилметакрилата методом лазерной абляции [7]. Чип представлял собой многослойную конструкцию из слоев полиметилметакрилата и акрилового адгезива, изготовленную методом лазерной абляции (GCC Spirit GLS, США). Чип имеет каналы и переходные отверстия и содержит реакционную лунку объемом 200 мкл с микрофильтрующей мембраной из SiO2 Advantec GC5025MM (Cole-Parmer, США) с напылением хрома, на которой удерживаются микросферы (рис. 1).
Флюоресцентная микроскопия
Для детекции флюоресцентных сигналов от микросфер, расположенных на микрофильтрующей мембране в микрофлюидном чипе, использовался автоматизированный эпифлюоресцентный микроскоп собственной разработки и сборки. Микроскоп собран на основе оптических компонент: объектив Nikon N10X-PF (Nikon Instruments Inc., Япония), тубусная линза ThorLabs TTL200 (Thorlabs Inc., США), цифровая КМОП-камера Basler acA2040-90um (Basler AG, Германия), набор спектральных фильтров (SemRock, США). Особенность данного микроскопа состоит в возможности автоматизированного получения серий микроизображений из
Отверстие для подключения вакуума
Резервуар отработанных жидкостей
Реакционная лунка с микрофильтрующей мембраной
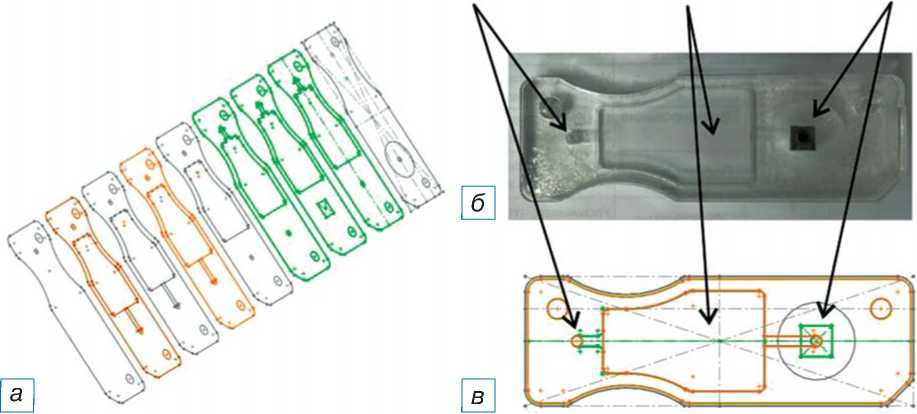
Рис. 1. Многослойный микрофлюидный чип: послойная модель ( а ), фото ( б ) и схематическая модель ( в ).
Fig. 1. A multilayered microfluidic chip: a layer-by-layer model ( а ), a photo image ( б ), and а schematic model ( в ).

разных фокусных плоскостей в нескольких спектральных каналах. Необходимость сканирования по фокусу обусловлена развитым рельефом микрофильтрующей мембраны, на которой расположены микросферы. С помощью данной экспериментальной установки анализировались флюоресцентные сигналы в трех спектральных каналах. Первый канал с длиной волны возбуждения λ ex_1=520 нм и длиной волны эмиссии λ em_1=578 нм предназначен для детекции флюоресцентного свечения от конъюгатов вторичных антител anti-IgG с флюорофором фикоэритрин (PE). Данные конъюгаты являются завершающим слоем иммунного комплекса антиген– антитело–вторичное антитело с флюорофором, образуемого на поверхности микросфер, и, таким образом, интенсивность флюоресцентного сигнала от них отображает количество (концентрацию) искомых антител в пробе. Второй и третий флюоресцентные каналы предназначены для детекции паспортных флюорофоров, входящих в состав микросфер. Длина волны возбуждения этих флюорофоров составляет λ ex_2&3=623 нм, а длины волн эмиссии — λ em_2=661 нм и λ em_3=710 нм. Получаемые в данных спектральных каналах микрофотографии использовали для точного определения положения и размера каждой микросферы на изображении.
Апробация методики на образцах сыворотки крови человека
Для построения калибровочного графика были взяты образцы стандартных растворов сывороток-калибраторов — растворов антител IgG из указанного ранее коммерческого набора «Вектор-Бест». Калибраторы разводили фосфатным солевым буферным раствором (рН 7,4; BioRad, США). Конечные концентрации составили 0,0; 0,5; 1,0; 6,25; 12,5; 25,0 и 50,0 BAU/мл.
Для валидации методики использованы образцы коллекции сыворотки крови добровольцев ( n =13 и n =14 для групп с низким и высоким значением КП соответственно).
Предварительно активировали карбоксильные группы на поверхности микросфер добавлением раствора EDC (16,67 мг/мл) и раствора NHS (10,0 мг/мл) в MES-буфере, полученную смесь инкубировали при комнатной температуре и постоянном перемешивании (ротор-шейкер Multi Bio RS-24, Biosan, Латвия) в течение 30 мин.
К активированным микросферам добавляли 0,2 мл фосфатного буферного раствора. Супернатант, содержащий продукты активации, удаляли, при этом микросферы удерживали при помощи магнитного держателя. Активированные микросферы ресуспендировали в 0,1 мл фосфатного буфера в микроцентрифужных пробирках (Eppendorf, Германия); в пробирки добавляли 0,1 мл раствора RBD-фрагмента S-белка; конечная концентрация белка в реакционной смеси составляла 0,1 мг/мл. Пробирки помещали на мешалку и инкубировали при встряхивании в течение 1 ч при комнатной температуре в темноте. Для блокировки непрореагировавших карбоксильных групп по истечении времени инкубации из пробирок удаляли супернатант, при этом микросферы, конъюгированные с RBD-фрагментом S-белка, удерживали при помощи магнитного держателя, и добавляли 0,1 мл раствора бычьего сывороточного альбумина (BSA, Sigma Aldrich, США) в концентрации 0,1 мг/мл.
Пробирки помещали на мешалку и инкубировали при встряхивании в течение 1 ч при комнатной температуре в темноте, после этого конъюгаты микросфер и RBD-фрагмента S-белка удерживали на магнитном держателе, удаляли супернатант и к полученным конъюгатам добавляли 0,1 мл подготовленного раствора калибранта или опытной сыворотки крови человека, предварительно разведенной фосфатным буферным раствором (в соотношении 1:10). Пробирки снова помещали на мешалку и инкубировали при встряхивании в течение 45 мин при комнатной температуре в темноте, микросферы удерживали на магнитном держателе, удаляли супернатант и к микросферам добавляли вторичные антитела anti-IgG с флюоресцентной меткой фикоэритрин (Invitrogen, США) в разведении 1:100. Повторяли инкубацию при встряхивании в течение 45 мин при комнатной температуре в темноте. Микросферы удерживали на магнитном держателе, супернатант удаляли, к микросферам добавляли 0,2 мл фосфатного буферного раствора, ресуспендировали в 0,2 мл буфера для хранения (Bioplex, BioRad, США) и хранили при 4°С.
Пробу суспензии микросфер объемом 50 мкл наносили на мембрану микрофлюидного чипа. Жидкость удаляли под мембраной с помощью лабораторного вакуумного насоса (Vacuubrand MD 4C NT, Германия). Чип помещали на предметный столик флюоресцентного микроскопа и анализировали полученные максимумы флюоресценции.
Статистический анализ
Статистический анализ проводили с использованием пакета программ Statistica 10.0 (Statsoft Inc.,
2011, CA, США). Для оценки нормальности распределения данных использовали тест Шапиро–Уилка. Так как распределение данных, вошедших в анализ, было отличным от нормального, то их представляли в виде медианы (Q2) и интерквартильного размаха (Q1–Q3). Для сравнения двух несвязанных выборок применяли тест Манна–Уитни. Определение прогностической эффективности проводили при помощи ROC-анализа. Результаты считали значимыми при p <0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Объектом исследования были добровольцы, разделенные на две группы.
Первая группа ( n =13) — условно здоровые добровольцы обоего пола в возрасте от 18 лет и старше, без жалоб на состояние здоровья, без перенесенной новой коронавирусной инфекции (на основании анамнеза и оценки уровня IgG и IgM к SARS-CoV-2) и гиперчувствительности к компонентам вакцины в анамнезе.
Вторая группа ( n =14) — добровольцы обоего пола в возрасте от 18 лет и старше, перенесшие новую коронавирусную инфекцию и имеющие подтвержденный высокий уровень IgG к SARS-CoV-2.
Формирование коллекции образцов
В условиях пандемии сложным этапом является подбор доноров образцов крови, не содержащих антитела к циркулирующему инфекционному агенту SARS-CoV-2. В связи с этим образцы сыворотки крови потенциально здоровых добровольцев первой группы ( n =13) тестировали на содержание IgG, а также IgM. Анализ на наличие IgM необходим для исключения из контрольной группы пациентов на начальной стадии заболевания. Согласно полученным данным, все 13 образцов коллекции не содержали антител (IgM, IgG) к SARS-CoV-2. В то же время все образцы коллекции второй группы ( n =14) содержали IgG. Коэффициент позитивности IgG в группе перенесших коронавирусную инфекцию в 9–300 раз превышал таковой в группе условно здоровых добровольцев ( p <0,001). Измеренные методом ИФА концентрации IgG приведены на рис. 2.
Схема проведения анализа
Для проведения исследований нами была разработана следующая схема анализа.
-
1. В отдельных пробирках (1.1) активация карбоксильных групп флюоресцентных микросфер и отмывка от остаточных продуктов активации;
-
2. Нанесение образца микросфер с комплексами антиген–антитело–вторичное антитело с меткой на мембрану микрофлюидного чипа.
-
3. Помещение чипа в систему флюоресцентной визуализации.
-
4. Анализ флюоресценции с помощью программного обеспечения.
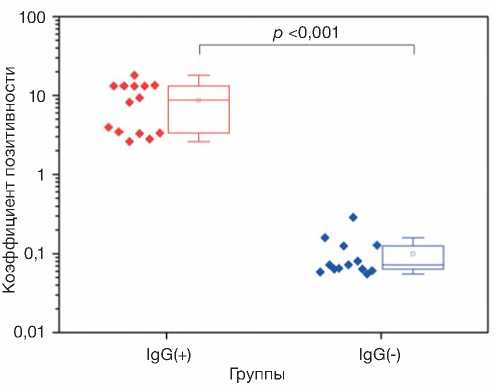
Рис. 2. Сравнение коэффициента позитивности для IgG в образцах сыворотки крови в исследуемых группах.
Примечание. Точки — исходные данные, ящичная диаграмма — медиана, Q1–Q3 и интервал без выбросов.
Fig. 2. Comparison of IgG CoP in the serum samples by groups.
Note: The points are raw data. Box plots: line — the median; box borders — the 25% and 75% quartiles; whiskers — the non-outlier range.
(1.2) блокировка сайтов неспецифического связывания антител на поверхности микросфер добавлением раствора BSA; (1.3) ковалентное связывание RBD-фрагмента S-белка с активированными карбоксильными группами на поверхности микросфер и отмывка от непрореагировавших компонентов; (1.4) связывание IgG из опытных образцов путем инкубации в них микросфер с комплексами антиген–антитело; (1.5) добавление вторичных антител anti-IgG с флюоресцентной меткой (фикоэритрин) для визуализации иммунного комплекса.
В текущем исполнении этапы 1.1–1.5 проводятся в индивидуальных пробирках и ручном режиме. Однако использование микрофлюидных технологий и микрофлюидных чипов класса «лаборатория-на-чипе», уже предлагаемых авторами данного исследования ранее [7], в дальнейшем могут позволить реализовать полную автоматизацию процесса большого спектра анализов на выявление антител или белковых маркеров в биологической пробе пациента.

кт ГА
Флюоресцентная микроскопия
Образование иммунных комплексов между RBD-фрагментом S-белка и IgG сыворотки крови на поверхности микросфер было подтверждено данными флюоресцентной микроскопии (рис. 3).

Рис. 3. Изображение реакционной мембраны микро-флюидного чипа с проявленными флюоресцентными микросферами; в выноске — фрагмент мембраны с дополнительным увеличением ( х 4). Изображение получено в паспортном канале микросфер.
Fig. 3. The reaction membrane of a microfluidic chip with detected fluorescent microspheres on the membrane (a fragment of the membrane is magnified, х 4). The image was obtained in the ‘passport’ channel of microspheres.
Группы
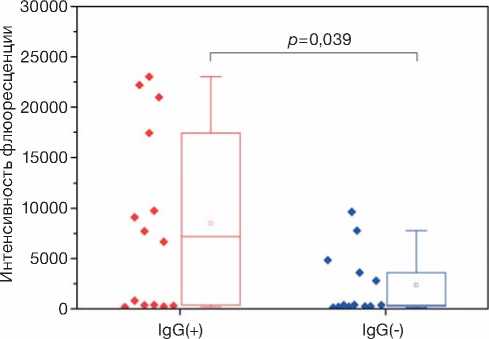
Рис. 4. Сравнение интенсивности флюоресценции вторичных антител anti-IgG в составе иммунных комплексов при образовании последних на поверхности микросфер в группах с низкими (IgG-) и высокими (IgG+) значениями коэффициента позитивности IgG.
Примечание. Точки — исходные данные, ящичная диаграмма — медиана, Q1–Q3 и интервал без выбросов.
Fig. 4. Comparison of the fluorescence intensity of secondary anti-IgG antibodies in the immune complexes formed on the microspheres’ surface in the groups with low (IgG(-)) and high (IgG(+)) IgG CoP values.
Note: The points are raw data. Box plots: line — the median; box borders — the 25% and 75% quartiles; whiskers — the non-outlier range.
На основании построенного по результатам флюоресцентной микроскопии калибровочного графика показана прямая линейная зависимость между концентрацией IgG в анализируемом образце и интенсивностью светимости микросфер, инкубированных с данным образцом (R2 0,963). Линейность сохранялась в диапазоне концентраций IgG от 0,5 до 50,0 BAU/мл.
Результаты апробации методикина образцах сыворотки крови человека
При оценке интенсивности флюоресценции вторичных антител anti-IgG в составе иммунных комплексов при образовании последних на поверхности микросфер было выявлено, что уровень светимости микросфер прямо пропорционален значениям КП IgG. Интенсивность данной флюоресценции в группе с высокими значениями КП IgG (медиана 7187,0, минимум-максимум 188,5–23019,0) была статистически значимо выше, чем в группе с низким КП (медиана интенсивности свечения 371,3, минимум-максимум 129,7–9632,1) ( p =0,039); рис. 4.
Оценка диагностической значимости
Для оценки диагностических характеристик разрабатываемой тест-системы в сравнении со стандартным референтным методом ИФА проведен ROC-анализ. Согласно результатам анализа, тест-система обладает хорошей прогностической ценностью: площадь под кривой (AUC) 70,3%; точка отсечения: интенсивность флюоресценции 5754,0; чувствительность 0,571; специфичность 0,846 (рис. 5).
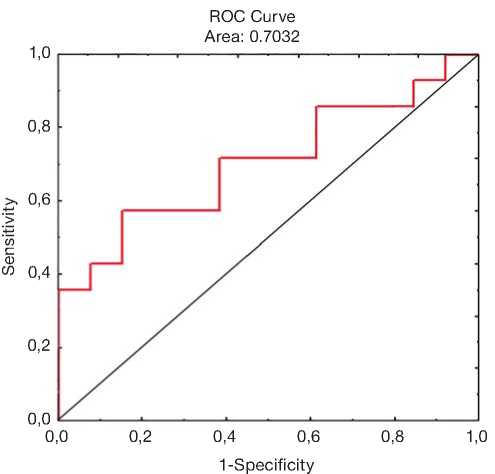
Рис. 5. ROC-кривая для тест-системы.
Fig. 5. A ROC curve for the test system.
ОБСУЖДЕНИЕ
В настоящее время в мире растет интерес к созданию «лабораторий-на-чипе» (lab-on-a-chip), которые позволяют одновременно определять несколько биохимических или иммунологических показателей с использованием минимального количества анализируемого образца и максимальным уровнем автоматизации процесса проведения анализа [7]. В случае COVID-19 имеется потенциальная возможность объединить высокую скорость ИФА с большим количеством определяемых данным методом биомаркеров [8, 9]. В частности, подобные решения были предложены для нуклео-капсидного белка [10], IgM и IgG [11], общих антител к SARS-CoV-2 [12]. В то же время ИФА обладает рядом ограничений и недостатков. Например, наличие градиента определяемых концентраций аналита в разных по положению лунках планшета может привести к занижению или завышению истинной концентрации аналита в зависимости от конструкции тест-системы. При использовании наиболее распространенных планшетных тест-систем невозможно определить несколько аналитов в одном образце единовременно.
Использование флюоресцентно меченых микросфер в сочетании с микрофлюидным чипом позволит преодолеть данные ограничения. Как было отмечено ранее, уровень IgG к SARS-CoV-2 используется для оценки напряженности постинфекционного и поствакцинального иммунитета. Взаимодействие вируса SARS-CoV-2 с мембраной клетки-хозяина обусловлено наличием S-белка, в частности его RBD-фрагмента, мутации в котором привели к появлению британского и индийского вариантов SARS-CoV-2 [13], устойчивых к антителам против варианта Омикрон [14, 15]. В связи с этим для разработки диагностических COVID-19-тест-сис-тем представляют интерес IgG, вырабатываемые именно к RBD-фрагменту S-белка. В предложенной нами тест-системе успешно реализована флюоресцентная детекция специфического иммунного взаимодействия антител в биологических образцах с ковалентно связанным на поверхности микросфер RBD-фрагментом S-белка варианта B.1.617.2 Каппа вируса SARS-CoV-2. Данный вариант вируса, впервые обнаруженный в Индии в декабре 2020 года, ассоциирован с подъемом заболеваемости COVID-19 в 2021 году. Для апробации описываемой тест-системы использован белок именно данного штамма как наиболее актуальный на момент проведения исследования. В то же время одна из основных идей создания подобной тест-системы — это переход к мультиплексному тестированию.
Таким образом, в дальнейшем предполагается размещение различных вариантов антигенов SARS-CoV-2 на собственном типе микросфер. Разные типы микросфер в данной логике имеют собственные спектральные «паспорта», по которым и происходит их идентификация. Использование в диагностической тест-системе различных вариантов антигенов позволит установить, каким именно штаммом вируса был инфицирован пациент, а также спрогнозировать тип и характер формирования иммунитета. Таким образом, возможно создание полноценной диагностической «лабора-тории-на-чипе».
Ограничения исследования
Представленная тест-система для измерения уровня IgG к SARS-CoV-2 в сыворотке крови человека требует валидации на большей выборке для предоставления заключения о возможности использования в клинико-лабораторной диагностике COVID-19, что планируется выполнить в дальнейших исследованиях. Параметры уровня IgG могут варьировать в зависимости от ряда факторов, таких как наличие в анамнезе недавней или отдаленной инфекции COVID-19, вакцинации и т.д. В задачи данной работы не входило изучение вклада данных факторов.
ЗАКЛЮЧЕНИЕ
В ходе данного исследования была разработана микрофлюидная тест-система на основе флюоресцентных микросфер, содержащих иммобилизованный RBD-фрагмент S-белка SARS-CoV-2, для имму-нофлюоресцентного обнаружения IgG в сыворотке крови человека. При калибровке системы выявлена прямая зависимость между концентрацией IgG в стандартных растворах известной концентрации и флюоресцентным сигналом. Система апробирована на образцах сыворотки крови добровольцев, содержащих различный уровень IgG к SARS-CoV-2, показана ее прогностическая ценность. На данном этапе продемонстрирована сопоставимость данной тест-системы с классическим методом ИФА. В то же время возможность мультиплексирования системы делает ее намного перспективнее ИФА.
Полученные в ходе данной работы результаты позволяют позиционировать флюоресцентную тест-систему на чипе как количественный метод оценки содержания IgG к SARS-CoV-2.
▼ж^жтжтж LVAVAVAV ГАТАТ
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ / ADDITIONAL INFORMATION
Вклад авторов. Р.И. Шакуров — разработка концепции, разработка химических протоколов конъюгирования; Я.Д. Шанский — получение данных для анализа, анализ полученных данных, написание текста рукописи, обзор публикаций по теме исследования; К.А. Прусаков , С.В. Сизова , Л.В. Плотникова — получение экспериментальных данных, анализ полученных данных; С.П. Дудик — написание текста рукописи, обзор публикаций по теме исследования; В.Н. Лазарев , В.А. Манувера — получение RBD-фрагмента синтетического S-белка вируса SARS-CoV-2; Д.В. Клинов — концепция методики мультиплексной детекции на флюоресцентных микросферах; Ю.А. Беспятых , Д.В. Басманов — концепция исследования, написание текста рукописи. Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Author contribution. R.I. Shakurov — concept development, development of chemical conjugation protocols; Ya.D. Shansky — data acquisition and analysis, literature review, manuscript writing; K.A. Prusakov , S.V. Sizova , L.V. Plotnikova — data acquisition and analysis; S.P. Dudik — literature review, manuscript writing; V.N. Lazarev , V.A. Manuvera — the synthesis of RBD of S-protein SARS-CoV-2; D.V. Klinov — concept of multiplex detection technique using fluorescent microspheres; D.V. Basmanov , J.A. Bespyatykh — study concept, manuscript writing. The authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
Источник финансирования. Научное исследование проведено при поддержке гранта Президента Российской Федерации (грант № МК-2988.2022.3).
Funding source. This work was supported by the grant of the President of Russian Federation (grant № МК-2988.2022.3).
Список литературы Разработка микрофлюидной тест-системы на основе флюоресцентных микросфер для обнаружения иммуноглобулинов класса G к Sars-Cov-2
- World Health Organization. Tracking SARS-CoV-2 variants [cited 2023 February, 20]. Режим доступа: https://www.who.int/en/activities/tracking-SARS-CoV-2-variants/. Дата обращения: 20.02.2023.
- Баклаушев В.П., Юсубалиева Г.М., Бычинин М.В., и др. Рациональная стратегия поддержания противовирусного иммунитета к новым вариантам SARS-CoV-2 // Клиническая практика. 2022. Т. 13, № 3. С. 43–55. [Baklaushev VP, Yusubalieva GM, Bychinin MV, et al. A rational strategy for the maintenance of antiviral immunity to new SARS-CoV-2 strains. Journal of Clinical Practice. 2022;13(3):43–55. (In Russ).] doi: 10.17816/clinpract111120
- Fernandes RS, de Oliveira Silva J, Gomes KB, et al. Recent advances in point of care testing for COVID-19 detection. Biomed Pharmacother 2022;153:113538. doi: 10.1016/J.BIOPHA.2022.113538
- Filchakova O, Dossym D, Ilyas A, et al. Review of COVID-19 testing and diagnostic methods. Talanta 2022;244:123409. doi: 10.1016/J.TALANTA.2022.123409
- Farmer S, Razin V, Peagler AF, et al. Don’t forget about human factors: Lessons learned from COVID-19 point-ofcare testing. Cell Reports Methods 2022;2:100222. doi: 10.1016/J.CRMETH.2022.100222
- Zhong Z, Wang J, He S, et al. An encodable multiplex microsphere-phase amplification sensing platform detects SARS-CoV-2 mutations. Biosens Bioelectron. 2022;203:114032.
- Патент РФ № RU 200301 U1/2020.10.15. Прусаков К.А., Басманов Д.В., Алдаров К.Г., и др. Микрофлюидный чип для проведения многопараметрического иммуноанализа. [Patent RUS № RU 200301 U1/2020.10.15. Prusakov KA, Basmanov DV, Aldarov KG, et al. Microfluidic chip for multiparametric immunoassay. (In Russ).] Режим доступа: https://yandex.ru/patents/doc/RU200301U1_20201015. Дата обращения: 20.02.2023.
- Yuan H, Chen P, Wan C, et al. Merging microfluidics with luminescence immunoassays for urgent point-of-care diagnostics of COVID-19. TrAC Trends Anal Chem 2022; 157:116814. doi: 10.1016/J.TRAC.2022.116814
- Sheridan C. Fast, portable tests come online to curb coronavirus pandemic. Nat Biotechnol 2020;38:515–518. doi: 10.1038/D41587-020-00010-2
- Drain PK, Ampajwala M, Chappel C, et al. A rapid, highsensitivity SARS-CoV-2 nucleocapsid immunoassay to aid diagnosis of acute COVID-19 at the point of care: A clinical performance study. Infect Dis Ther. 2021;10:753–761. doi: 10.1007/S40121-021-00413-X/FIGURES/2
- Chen R, Ren C, Liu M, et al. Early detection of SARSCoV-2 seroconversion in humans with aggregationinduced near-infrared emission nanoparticle-labeled lateral flow immunoassay. ACS Nano. 2021;15:8996–9004. doi: 10.1021/ACSNANO.1C01932
- Zhou Y, Chen Y, Liu W, et al. Development of a rapid and sensitive quantum dot nanobead-based double-antigen sandwich lateral flow immunoassay and its clinical performance for the detection of SARS-CoV-2 total antibodies. Sensors Actuators B Chem 2021;343:130139. doi: 10.1016/J.SNB.2021.130139
- Hajazadeh F, Khanizadeh S, Khodadadi H, et al. SARS-COV-2 RBD (Receptor binding domain) mutations and variants (A sectional-analytical study). Microb Pathog 2022;168:105595. doi: 10.1016/J.MICPATH.2022.105595
- Heggestad JT, Kinnamon DS, Olson LB, et al. Multiplexed, quantitative serological profiling of COVID-19 from blood by a point-of-care test. Sci Adv 2021;7:4901–4926. doi: 10.1126/SCIADV.ABG4901/SUPPL_FILE/ABG4901_SOURCE_DATA.XLSX
- Gan HH, Zinno J, Piano F, Gunsalus KC. Omicron spike protein has a positive electrostatic surface that promotes ACE2 recognition and antibody escape. Front Virol 2022;2:43. doi: 10.3389/FVIRO.2022.894531


