Разработка мультиплексной панели микросателлитов для генетической паспортизации сибирского осетра (Acipenser baerii)
Автор: Бардуков Н.В., Никипелова А.К., Белоус А.А., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетика и геномика
Статья в выпуске: 6 т.58, 2023 года.
Бесплатный доступ
Сибирский осетр ( Acipenser baerii Brandt, 1869) - один из наиболее значимых видов рыб аквакультуры в России. Благодаря высокому спросу на ценную товарную продукцию, разведение сибирского осетра - перспективное направление в развитии отрасли. Однако селекционно-племенную работу с этим видом существенно осложняет наличие тетраплоидного генома, что в совокупности с необходимостью смешивания икры и спермы от нескольких производителей при получении потомства препятствует введению в практику хорошо зарекомендовавших себя молекулярно-генетических методов, таких как микросателлитный анализ. В настоящей работе впервые дана характеристика известным микросателлитным локусам у сибирского осетра с точки зрения возможности эффективного учета доз их аллелей в тетраплоидном геноме. Обнаружено семь локусов, соответствующих этому критерию. Целью нашей работы стало создание панели микросателлитных маркеров, адаптированной для использования в селекции сибирского осетра ленской популяции. Исследования проводили в 2023 году. В качестве биологического материала использовали срезы плавниковой ткани сибирского осетра ленской популяции, взятые от рыб экспериментального стада, содержащегося в установке замкнутого водоснабжения ФИЦ животноводства - ВИЖ им. академика Л.К. Эрнста. Экспериментальное стадо содержало две группы: I - рыбы, полученные на Можайском производственно-экспериментальном рыбоводном заводе (д. Горетово, Можайский городской округ, Московская обл.; n = 42), II - рыбы, полученные от ООО РТФ «Диана» (рабочий пос. Кадуй, Кадуйский р-н, Вологодская обл.; n = 47). ДНК выделяли помощью набора ДНК-Экстран-2 (НПК «Синтол», Россия) согласно протоколу фирмы-производителя. Качественную оценку ДНК осуществляли методом электрофореза в агарозном геле (1,2 % агарозы). ПЦР выполняли на амплификаторе Thermal Cycler SimpliAmp («Thermo Fisher Scientific, Inc», США). Электрофоретическое разделение продуктов амплификации проводили в системе капиллярного электрофореза Нанофор 05 (НПК «Синтол», Россия). Размеры аллелей определяли с помощью программного обеспечения GeneMаrker (Version 3.0.1). Для каждого локуса определяли дозу каждого аллеля. Для тестирования использовали 27 микросателлитных маркеров: Ls 19, Aox 45, Aox 9, Ls 68, Agu 38, Ag 49a, Agu 37, Agu 41, Agu 15, Agu 51, Agu 59, Agu 34, Agu 36, Agu 46, Agu 56, Agu 54, AoxD 161, AfuG 63, AfuG 51, AfuG 112, An 20, Aru 13, Aru 18, Afu 68 b, Spl 163, AfuG41, Ls 39, ранее известных для осетровых видов рыб. Из них для включения в мультиплексные панели было отобрано семь (Agu 38, An 20, Aru 18, Ls 19, Ag 49a, Agu 37, Agu 41). На основании полиморфизма семи микросателлитных локусов для двух исследуемых групп особей сибирского осетра был выполнен расчет классических популяционно-генетических показателей: среднего числа аллелей на локус (Na = 6,86), числа эффективных аллелей (Ne = 3,61), наблюдаемой (Ho = 0,839) и ожидаемой (He = 0,6535) гетерозиготности. Выявлено отсутствие инбридинга в исследуемых группах (FIS = -0,340 и -0,173), а также наличие значительной генетической дифференциации между ними: значение генетической дистанции M. Nei составило 0,1340, индекс Fst = 0,0796. Группы сформировали два четких, практически не пересекающихся кластера на PCA-плоте, несмотря на то, что предки особей сибирского осетра у обеих групп имели изначально родственное происхождение. Был оценен вклад дозы аллеля тетраплоидного локуса в эффективность микросателлитного анализа: в среднем информативность каждого локуса повышалась на 32 %. Сопоставление результатов генетического анализа с имеющимися данными литературы позволяет предположить, что в аквакультуральных стадах сибирского осетра ленской популяции происходят процессы, связанные с изменением частот аллелей микросателлитных локусов, которые постепенно усиливают их генетическую дифференциацию. В результате работы была подтверждена высокая эффективность созданных панелей микросателлитных маркеров и их потенциальная пригодность для использования в генетической паспортизации - каждая особь сибирского осетра имела собственный генетический профиль. Распределение аллелей семи микросателлитных локусов указывало на формирование уникальной генетической структуры в стадах сибирского осетра в каждом из двух рыбоводных предприятий, которые были источниками рыбопосадочного материала.
Микросателлиты, тетраплоиды, сибирский осетр, осетроводство, нуль-аллели
Короткий адрес: https://sciup.org/142240677
IDR: 142240677 | УДК: 639.212:575.174.4 | DOI: 10.15389/agrobiology.2023.6.1057rus
Текст научной статьи Разработка мультиплексной панели микросателлитов для генетической паспортизации сибирского осетра (Acipenser baerii)
Сибирский осетр ( Acipenser baerii Brandt, 1869) — один из наиболее значимых видов рыб, выращиваемых в условиях товарной аквакультуры. Основные преимущества сибирского осетра — быстрое накопление массы и высокая выживаемость в промышленных условиях разведения (1, 2). К важным факторам успешного разведения этого вида относится способность производить высококачественную икру. Благодаря экономической значимости и высокому спросу на продукцию сибирского осетра его разведение имеет значительный потенциал для развития аквакультуры (3).
В дикой природе сибирский осетр находится в статусе исчезающего вида вследствие загрязнения окружающей среды, бесконтрольного вылова, деградации естественной среды обитания. Вид занесен в Красную книгу Международного союза охраны природы и природных ресурсов МСОП (4). Кроме того, сибирский осетр включен в приложения 1 и 2 Конвенции о международной торговле видами дикой фауны и флоры, находящимися под угрозой исчезновения (Convention on International Trade in Endangered species of wild fauna and flora, CITES) (5). Неудовлетворительное состояние диких популяций обязывает сохранять биоразнообразие в стадах сибирского осетра на рыбоводных заводах и грамотно использовать генетический потенциал аквакультуральных популяций (6).
Современные методы племенной работы опираются на данные, получаемые с помощью молекулярной генетики. Это позволяет существенно ускорить и упростить работу по повышению продуктивности у сельскохозяйственных видов животных и растений (7-9). Однако в осетроводстве внедрение этих технологий в повседневную селекционную практику замедлилось. На сегодняшний день молекулярно-генетические маркеры (в первую очередь, микросателлиты и митохондриальная ДНК) применяются для контроля видовой принадлежности с целью дальнейшего использования молоди для восполнения природных популяций (10). Сложности разработки молекулярно-генетических панелей для индивидуальной идентификации сибирского осетра связаны с тем, что вид имеет тетраплоидный геном (11), при этом определенные локусы могут проявлять диплоидный или даже гек-саплоидный характер (12, 13).
Применению молекулярно-генетических методов непосредственно в селекции сибирского осетра также препятствует продолжительное время созревания этого вида и сложившаяся на рыбоводных заводах система разведения, предполагающая смешивание половых продуктов от нескольких рыб-производителей. Это существенно снижает отход, повышает процент оплодотворенной икры, но и препятствует точному соотнесению родителей и их потомков, что необходимо при проведении селекционной работы. Массовое внедрение на осетровых заводах индивидуального мечения рыб-производителей с использованием электронных чипов создает благоприятные предпосылки для применения молекулярно-генетических методов в племенной работе.
В настоящей работе впервые дана характеристика известным мик-росателлитным локусам у сибирского осетра с точки зрения возможности эффективного учета доз их аллелей в тетраплоидном геноме. Обнаружено семь локусов, соответствующих этому критерию.
Целью нашей работы стало создание панели микросателлитных маркеров, адаптированной для использования в селекции сибирского осетра ленской популяции.
Методика. Исследования проводили в 2023 году. В качестве биологического материала использовали срезы плавниковой ткани сибирского осетра ленской популяции, взятые от рыб экспериментального стада, со- держащегося в установке замкнутого водоснабжения Федерального исследовательского центра животноводства — ВИЖ им. академика Л.К. Эрнста. Экспериментальное стадо было представлено двумя группами: I — рыбы, полученные на Можайском производственно-экспериментальном рыбоводном заводе (д. Горетово, Можайский городской округ, Московская обл.; n = 42), II — рыбы, полученные от ООО РТФ «Диана» (рабочий пос. Кадуй, Кадуйский р-н, Вологодская обл.; n = 47).
ДНК выделяли помощью набора ДНК-Экстран-2 (НПК «Синтол», Россия) согласно протоколу фирмы-производителя. Качественную оценку ДНК осуществляли методом электрофореза в агарозном геле (1,2 % агарозы). ПЦР проводили в конечном объеме 15 мкл. В пробирки вносили по 14 мкл реакционной смеси, состоящей из 1,5 мкл 10½ Turbo-буфера (ЗАО «Евроген», Россия), 1,5 мкл 2 мМ раствора dNTPs, 0,3 мкл 10 мМ смеси праймеров, 1 ед. Smart Таq-полимеразы (ЗАО «Диалат Лтд.», Россия), добавляли ~ 50-100 нг исследуемой геномной ДНК, доводили до конечного объема деионизированной водой. Реакции выполняли на амплификаторе Thermal Cycler SimpliAmp («Thermo Fisher Scientific, Inc», США) в следующем режиме: 10 мин при 94 ° С (первичная денатурация); 30 с при 95 ° С (денатурация), 40 с при 58 ° С (отжиг праймеров на ДНК-матрице), 35 с при 72 ° С (элонгацию цепей) (38 циклов); 5 мин при 72 ° С (финальная элонгация). Электрофоретическое разделение продуктов амплификации проводили в системе капиллярного электрофореза Нанофор 05 (НПК «Синтол», Россия). Размеры аллелей определяли с помощью программного обеспечения GeneMаrker (Version 3.0.1). Для каждого локуса определяли дозу каждого аллеля (14).
Апробацию собранных панелей проводили на I и II группах экспериментального стада сибирского осетра. Для каждой из групп рассчитывали классические популяционно-генетические показатели: ожидаемую (H e ) и наблюдаемую (H o ) гетерозиготность, среднее число аллелей на локус (Na), среднее число эффективных аллелей (Ne), коэффициент инбридинга (F IS ), генетические дистанции по методу M. Nei (15), индекс F st (16, 17). Для обработки данных микросателлитного анализа использовали R-пакет Polysat (Version 1.7) (18), STRUCTURE (Version 2.3.4) (19), SPA Ge Di1-5d (20). PCA (Principal Coordinate Analysis)-плот был построен на основе вычисления генетических дистанций по методу R. Bruvo с соавт. (21).
Результаты. Поскольку необходимо было создать мультиплексные микросателлитные панели с единообразным характером плоидности локусов, а также отсутствием нулевых аллелей, отбор микросателлитных маркеров имел достаточно жесткие условия. Локус не должен был иметь более четырех аллелей у одного образца, не должен иметь нулевых аллелей, должен обладать стабильной амплификацией в ПЦР при условии мультиплексирования и полиморфизмом, доза каждого аллеля должна визуально хорошо определяться.
Для создания панели микросателлитных маркеров, предназначенной для индивидуальной идентификации и контроля достоверности происхождения сибирского осетра, мы протестировали 27 микросателлитных локусов: Ls 19, Aox 45, Aox 9, Ls 68 (22, 23), Agu 38, Ag 49a, Agu 37, Agu 41, Agu 15, Agu 51, Agu 59, Agu 34, Agu 36, Agu 46, Agu 56, Agu 54 (24), AoxD 161, AfuG 63, AfuG 51, AfuG 112, An 20, Aru 13, Aru 18, Afu 68 b, Spl 163, AfuG41, Ls 39 (25, 26). В ряде локусов (AoxD 161, AfuG 41, Agu 59) было идентифицировано более 4 аллелей (рис. 1), и такие локусы исключили из дальнейшего анализа.
Как известно, наличие нулевых аллелей приводит к искажению статистических расчетов, завышая гомозиготность (27, 28). Виды с полиплоидными геномами имеют повышенный риск образования нулевых аллелей (29). Полиплоидизация может быть вызвана слиянием геномов, полиморфных по сайту отжига праймеров. Кроме того, считается, что сам процесс полиплоидизации сопровождается повышенной активности транспозонов и потерей участков ДНК из-за геномных перестроек (30), что также может разрушать сайты связывания праймеров (31). В связи с этим определение дозы аллелей было критическим требованием при отборе локусов. Определение дозы каждого аллеля (рис. 2) позволило выявить локусы, предположительно имеющие нулевые аллели (AfuG 51, Aru 13, Agu 15).
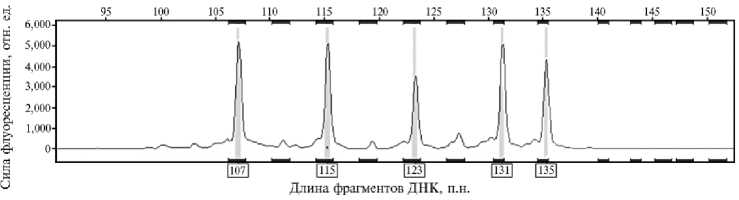
Рис. 1. Пример генетического профиля у особей одомашненной формы сибирского осетра ( Acipenser baerii Brandt, 1869) ленской популяции по локусу AoxD 161 с пятью выявленными аллелями (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год) .
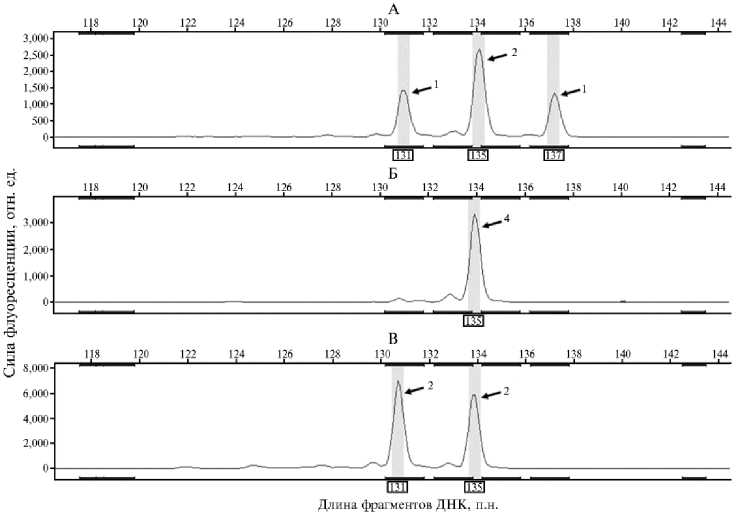
Рис. 2. Определение дозы каждого аллеля микросателлитного локуса Ls 19 у особей одомашненной формы сибирского осетра ( Acipenser baerii Brandt, 1869) ленской популяции: А — особь с соотношением аллелей 1/2/1, Б — особь с соотношением аллелей 4/0, В — особь с соотношением аллелей 2/2. Стрелками указаны пики, соответствующие аллелям, цифрами обозначены дозы аллелей — число хромосом в тетраплоидном геноме, несущих данный аллель (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год).
Так, для микросателлитного локуса AfuG 51 было выявлено три аллеля с примерно одинаковым количеством полученного ПЦР-продукта (рис. 3). Поскольку геном сибирского осетра тетраплоидный, то четвертый аллель, скорее всего, должен быть нулевым, но мы наблюдали присутствие четвертого пика со слабым сигналом, который, вероятно, и был четвертым аллелем с измененным сайтом отжига праймера.
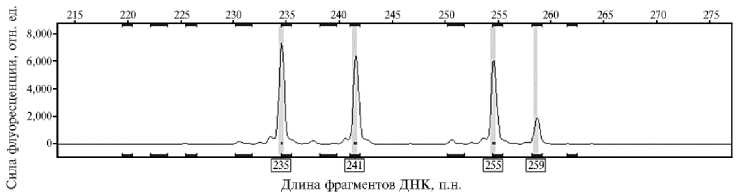
Рис. 3. Определение нуль-аллеля на примере локуса AfuG 51 у особей одомашненной формы сибирского осетра ( Acipenser baerii Brandt, 1869) ленской популяции: 235, 241, 255 — три аллеля с примерно одинаковой эффективностью синтеза в ПЦР, 259 — четвертый пик с низким значением флуоресценции, вероятно, соответствует аллелю с измененным сайтом отжига праймера (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год).
На небольшой выборке образцов ДНК сибирского осетра ( n = 16) было проведено предварительное тестирование возможности мультиплексирования микросателлитных локусов, а также явного отклонения от тетрапло-идного наследования. При этом подбор локусов для мультиплексной ПЦР также содержал требование сохранить возможность учета дозы аллелей при мультиплексировании ПЦР. В результате из 27 микросателлитных маркеров отобрали 7 позиций: Agu 38, An 20, Aru 18, Ls 19, Ag 49a, Agu 37, Agu 41 (табл. 1, рис. 4), которые были скомпонованы в две мультиплексные панели (панель 1: Agu 38, An 20, Aru 18; панель 2: Ls 19, Ag 49a, Agu 37, Agu 41).
-
1. Характеристика микросателлитных локусов, отобранных для тестирования особей одомашненной формы сибирского осетра ( Acipenser baeri i Brandt, 1869) ленской популяции (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год)
Локус
Метка
Диапазон аллелей по данным литературы, п.н. (22-26)
Диапазон аллелей по результатам исследования, п.н.
Последовательность праймеров
Панель 1
Agu 38
6-FAM
108-114
90-112
F: ACTGGGGTTGAAGGACAGTG
R: TCCGTCTCATGTCCAAGGGTA
An 20
6-FAM
151-207
143-185
F: AATAACAATCATTACATGAGGCT
R: TGGTCAGTTGTTTTTTTATTGAT
Aru 18
R6G
138-154
137-145
Панель 2
F: CCTGGAACACGTCCAGTTTT
R: TGGGTGAATGTTTTGGTGTG
Ls 19
6-FAM
118-145
119-137
F: CATCTTAGCCGTCTGGGTAC
R: CAGGTCCCTAATACAATGGC
Agu 37
R6G
128-136
124-128
F: ACATGGTAGCAAAATCCCAA
R: CAGCAAGCTTAGATGCATGG
Agu 41
ROX
178-218
177-229
F: AAGACAAACAGTGGCCCAAC
R: CAATGGCAGGTGCTACTGAA
Ag49a
6-FAM
198-219
192-218
F: TGTTATCTGCTCTGATATTGATTCG
R: CGTTTTAAAGTTTGAACGGCA
-
2. Частота аллелей 7 микросателлитных локусов у особей одомашненной формы сибирского осетра ( Acipenser baerii Brandt, 1869) ленской популяции (расчет в программе SPAGeDi1-5d) (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год)
Локус Группа
Na
Ne
H e
1 H o
Fis
PIC
Все ( M ±SEM) I + II
6,86±1,506
3,61±0,731
0,6535±0,07441
0,839±0,0976 - 0,191±0,0778
I
4,43±0,519
2,90±0,476
0,5770±0,10235
0,816±0,1413 - 0,340±0,1106
II
6,14±1,300
3,63±0,657
0,6744±0,05663
0,860±0,0653 - 0,173±0,0590
Agu 38 I + II
6
3,45
0,7102
0,989
- 0,366
0,639
I
5
3,13
0,6809
1,000
- 0,460
0,609
II
5
3,32
0,6993
0,979
- 0,359
0,608
An 20 I + II
13
6,17
0,8379
0,989
- 0,167
0,813
Результаты апробации собранных панелей в двух группах особей экспериментального стада сибирского осетра представлены в таблице 2.
Продолжение таблицы 2
|
I |
6 |
3,98 |
0,7486 |
1,000 |
- 0,335 |
0,688 |
|
|
II |
12 |
6,11 |
0,8365 |
0,979 |
- 0,156 |
0,803 |
|
|
Aru 18 |
I + II |
4 |
1,45 |
0,3122 |
0,337 |
0,231 |
0,396 |
|
I |
3 |
1,05 |
0,0471 |
0,048 |
0,330 |
0,301 |
|
|
II |
4 |
1,98 |
0,4943 |
0,596 |
0,091 |
0,447 |
|
|
Ls 19 |
I + II |
5 |
2,47 |
0,5953 |
0,854 |
- 0,158 |
0,526 |
|
I |
3 |
2,01 |
0,5028 |
0,857 |
- 0,397 |
0,429 |
|
|
II |
5 |
2,67 |
0,6258 |
0,851 |
- 0,172 |
0,526 |
|
|
Ag 49a |
I + II |
6 |
3,56 |
0,7193 |
0,966 |
- 0,291 |
0,653 |
|
I |
4 |
3,05 |
0,6723 |
0,976 |
- 0,411 |
0,591 |
|
|
II |
5 |
3,98 |
0,7491 |
0,957 |
- 0,233 |
0,687 |
|
|
Agu 37 |
I + II |
4 |
2,33 |
0,5703 |
0,753 |
- 0,078 |
0,502 |
|
I |
4 |
2,56 |
0,6090 |
0,833 |
- 0,184 |
0,519 |
|
|
II |
3 |
2,01 |
0,5036 |
0,681 |
- 0,028 |
0,449 |
|
|
Agu 41 |
I + II |
10 |
5,86 |
0,8295 |
0,989 |
- 0,180 |
0,793 |
|
I |
6 |
4,51 |
0,7781 |
1,000 |
- 0,282 |
0,724 |
|
|
II |
9 |
5,33 |
0,8123 |
0,979 |
- 0,185 |
0,767 |
Примечани е. I группа — рыбы, полученные на Можайском производственно-экспериментальном рыбоводном заводе (д. Горетово, Можайский городской округ, Московская обл.; n = 42), II группа — рыбы, полученные от ООО РТФ «Диана» (рабочий пос. Кадуй, Кадуйский р-н, Вологодская обл.; n = 47). H o — наблюдаемая гетерозиготность, He — ожидаемая гетерозиготность, Na — среднее число аллелей на локус, Ne — среднее число эффективных аллелей на локус, F is — коэффициент инбридинга, PIC — индекс полиморфного информационного содержания локуса.

Рис. 4. Пример мультиплексирования локусов с сохранением эффекта дозы аллелей для особей одомашненной формы сибирского осетра ( Acipenser baerii Brandt, 1869) ленской популяции: А — панель ¹ 1 (локусы Agu 38, An 20; канал FAM), Б — панель ¹ 2 (локусы Ls 19, Ag 49a; канал FAM). Стрелками указаны пики, соответствующие аллелям, цифрами обозначены дозы аллелей (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год).
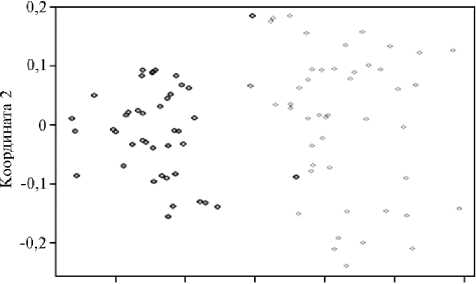
В сумме из 7 микросателлитных локусов наиболее эффективными оказались An 20 и Agu 41, что можно заметить по значениям индекса полиморфного информационного содержания локуса (PIC). Несмотря на то, что исследуемая выборка состояла из объектов аквакультуры, происходящих от дикого сибирского осетра ленской популяции, мы увидели четкую генетическую дифференциацию между исследуемыми группами экспериментального стада. Значение индекса фиксации Fst оказалось равным 0,0796, то есть 7,96 % изменчивости было обусловлено внутрипопуляционными различиями, а 92,04 % — межпопуляционными. Значение генетической дистанции, рассчитанное по M. Nei на основании частот аллелей 7 микросателлитных локусов, составило 0,1340. Генетическая дифференциация групп сибирского осетра хорошо выявлялась при формировании генетических кластеров в программе STRUCTURE (рис. 5), а также по результатам PCA-анализа (рис. 6).
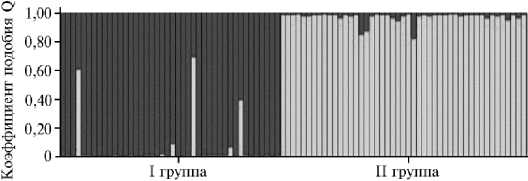
Рис. 5. Результаты кластерного анализа особей одомашненной формы сибирского осетра ( Acipenser baerii Brandt, 1869) ленской популяции, выполненного на основании частот аллелей 7 микроса-теллитных локусов в программе STRUCTURE для числа кластеров К = 2: I группа — рыбы, полученные на Можайском производственно-экспериментальном рыбоводном заводе (д. Го-ретово, Можайский городской округ, Московская обл.), II группа — рыбы, полученные от ООО РТФ «Диана» (рабочий пос. Кадуй, Кадуйский р-н, Вологодская обл.) (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год).
•0.2 -0,1 0 0.1 0,2 0,3
Координата 1
Рис. 6. Локализация особей сибирского осетра в пространстве двух измерений на основании генотипирования по 7 микросателлитным маркерам. I группа (черный цвет) — рыбы, полученные на Можайском производственно-экспериментальном рыбоводном заводе (д. Горетово, Можайский городской округ, Московская обл.), II группа (серый цвет) — рыбы, полученные от ООО РТФ «Диана» (рабочий пос. Кадуй, Кадуйский р-н, Вологодская обл.). PCA (Principal Coordinate Analysis)-плот построен на основе вычисления генетических дистанций по методу R. Bruvo с соавт. (21) (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год).
Рассматривая полученные значения популяционно-генетических показателей, можно утверждать, что анализируемые группы сибирского осетра ленской популяции не являются инбредными. Учитывая относительно более низкие значения Na, Ne, H o и H e , можно сделать вывод о меньшем генетическом разнообразии I группы, полученной на Можайском производственно-экспериментальном рыбоводном заводе. Этот эффект мог быть следствием ориентации завода на выпуск молоди осетровых для восполнения природных популяций и более жестких требований к происхождению производителей.
Поскольку для каждого микросателлитного локуса мы учитывали эффект дозы аллеля, то сравнили разрешающую способность микросател-литного анализа при игнорировании данных по этому эффекту и при его учете. При учете эффекта дозы аллеля в среднем по каждому локусу получили увеличение числа генотипов на 31,75 % (табл. 3).
3. Число генотипов сибирского осетра ( Acipenser baerii Brandt, 1869) ленской популяции с учетом и без учета эффекта дозы аллеля (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год)
|
Способ учета уникальных генотипов |
Локус |
|||||
|
Agu 38 |
1 An 20 1 |
Aru 18 1 |
Ls 19 1 Ag 49a |
Agu 37 \ Agu 41 1 |
∑ |
|
|
Без дозы аллеля |
11 |
34 |
5 |
11 21 |
5 39 |
126 |
|
С учетом дозы |
19 |
48 |
6 |
14 27 |
6 46 |
166 |
К сожалению, следует признать, что современное программное обеспечение для вычисления популяционно-генетических показателей плохо адаптировано для работы с данными по дозе аллеля микросателлитного локуса. Так, для конвертации файла данных с результатами генотипирования под форматы программ STRUCTURE и SPAGeDi мы использовали R-пакет Polysat, специально разработанный для анализа полиплоидных генотипов. При этом данные по дозе аллеля удалялись. Снижение качества анализа, однако, не приводило к критичным ошибкам при расчете популяционной статистики. В то же время при соотнесении генетических профилей родителей и потомков это может оказать существенное воздействие и привести к необходимости включения в анализ большего числа микросателлитных маркеров. Такая ситуация будет особенно заметна для стад, где среди производителей есть большая доля сибсов и полусибсов.
Микросателлитный полиморфизм дикой ленской популяции сибирского осетра исследован достаточно подробно (10, 14). Многие авторы изучали особенности генетической структуры аквакультуральных стад этого вида, однако среди подобных работ можно выделить исследование А.Е. Бар-минцевой с соавт. (32), в котором проведена сравнительная характеристика полиморфизма стад сибирского осетра ленской популяции из девяти хозяйств по пяти микросателлитным локусам. Как и в нашем исследовании, авторы выделили два четких генетических кластера, но характер их формирования имел существенные различия. Авторы отмечают необычный эффект — на принадлежность конкретной особи к кластеру определяющее значение оказывал год ее рождения. Независимо от принадлежности к хозяйству, особи генераций 1990-1996 годов образовывали единый кластер с дикими представителями ленской популяции, аквакультурный кластер формировался из особей, начиная с 2001 года рождения. В нашем исследовании этот эффект не повторился, мы получили четкую генетическую дифференциацию особей 2022 года рождения исключительно в зависимости от их происхождения. Сибирский осетр ленской популяции доместицирован в недавнем прошлом (1993 год) (33). В работе А.Е. Барминцевой с соавт. (32) тестирование проведено на выборках, представители которых относились к генерациям 1990-2008 годов. Если брать в расчет довольно значительный по отношению ко времени доместикации временной промежуток (2008-2022 годы), то вполне вероятным объяснением может оказаться постепенное накопление различий частот аллелей в современных маточных стадах сибирского осетра ленской популяции в разных хозяйствах в связи с проводимой селекционной работой. Также на выявление генетической дифференциации могло оказать влияние увеличение числа применяемых микро-сателлитных маркеров. Однако эти предположения нуждаются в проверке на других выборках.
Таким образом, использование разработанной нами мультилокусной панели из их семи микросателлитных локусов даже без учета данных по дозе каждого аллеля позволяет получать для каждой особи сибирского осетра уникальный, свойственный только для нее генотип. Это делает возможным создание индивидуальных генетических паспортов. Четкая дифференциация генетической структуры экспериментальных групп сибирского осетра, происходящих из двух разных предприятий, отражает влияние проводимой в хозяйствах селекционно-племенной работы. Наличие таких генетически дифференцированных стад может в дальнейшем быть полезно при формировании новых пород и линий. Перед выпуском молоди сибирского осетра в естественные популяции целесообразно проводить сравнение генетических профилей диких и выпускаемых рыб с целью контроля и сохранения особенностей генетической структуры нативных популяций. Разработка программного обеспечения, специально предназначенного для работы с данными, включающими дозу аллелей полиплоидных локусов, представляется весьма актуальной задачей. Создание такого инструмента позволит существенно улучшить разрешающую способность генетического анализа при работе с видами, обладающими полиплоидными геномами.
Выражаем благодарность ООО РТФ «Диана», Союзу осетроводов и лично А.В. Михайлову за предоставление рыбопосадочного материала сибирского осетра. За помощь в выполнении эксперимента благодарим главного рыбовода А.П. Глебова.
Список литературы Разработка мультиплексной панели микросателлитов для генетической паспортизации сибирского осетра (Acipenser baerii)
- Ashouri G .., Mahboobi Soofiani N., Hoseinifar S. H.H., Torfi Mozanzadeh M., Mani A., Khosravi A., Carnevali O. Compensatory growth, plasma hormones and metabolites in juvenile Siberian sturgeon ( Acipenser baerii , Brandt 1869) subjected to fasting and re feeding. Aquaculture Nutrition, 20 19 , 26 ( 400 409 (doi: 10.1111/anu.13002).
- Bronzi P., Rosenth а l H. Present and future sturgeon and c а vi а r production and m а rketing: а glob аl mаrket overview. Journal of Applied Ichthyology , 2014, 30 ( 6): 1536 1546 (doi: 10.1111/jai.12628).
- Bronzi P .., Chebanov M .., Michaels J T .., Wei Q .., Rosenthal H .., Gessner J. Sturgeon meat and caviar production: global update 2017. Journal of Applied Ichthyology 2019, 35 ( 257 266 (doi: 10.1111/jai.13870).
- Ruban G., Mugue N. Acipenser baerii The IUCN Red List of Threatened Species , 2022: e.T244A156718817 (doi: 10.2305/IUCN.UK.2022 1.RLTS.T244A156718817.en).
- Gisbert E. Williot P. Advances in the larval rearing of Siberian sturgeon. Journal of Fish Biology , 2002, 60 ( 5): 1071 1092 (doi : 10.1111/j.1095 8649.2002. tb01705.x).
- Красильникова А.А., Тихомиров А. М. Получение жизнеспособной молоди русского осетра Acipenser gueldenstaedtii ) при использовании криоконсервированной спермы и оценка веденческих реакций у криопотомства. Сельскохозяйственная биология , 2018, 53(4): 762 768 (doi: 10.15389/agrobiology.2018.4. 762rus
- Селионова М.И., Трухачев В.И., Айбазо в A M.M. M., Столповский Ю.А., Зиновьева Н. Генетические маркеры в козоводстве (обзор). Сельскохозяйственная биология , 2021, 56 6 1031 1048 ( doi : 10.15389/agrobiology.
- Абдельманова А. С., Форнара М.С., Бардуков Н. В.В., Сермя гин А.А., Доцев А.В., Зиновьева Н.А. Полногеномное исследование ассоциаций SNP с высотой в холке в популяциях локальных и трансграничных пород крупного рогатого скота в России. Сельскохозяйственная биология , 2021, 56(6): 1111 1122 (doi: 10.15389/agrobiology.2021.6.1111rus).
- Zhang W .., Zhao J .., He J .., Kang L .., Wang X .., Zhang F .., Hao C .., Ma X .., Chen D. Functional gene assessment of bread wheat: breeding implications in Ningxia Province. BMC Plant Biology, 2021, 21(1): 103 (do i: 10.1186/s12870 021 02870 5).
- Barmintseva A. E., Mugue N.S. Natural genetic polymorphism and phylogeography of Siberian sturgeon Acipenser baerii Brandt, 1869. Russian Journal of Genetics 2017, 53: 358 368 ( doi: 10.1134/S1022795417030024
- Shivaramu S .., Lebeda I .., Vuong D T .., Rodina M .., Gela D .., Flaj Flajšhans M. Ploidy l evels and itness r elated t raits in p urebreds and h ybrids o riginating from Sterlet ( Acipenser ruthenus ) and nusual p loidy l evels of Siberian s turgeon ( A. baerii ). Genes , 2020, 11( 1164 (doi: 10.3390/genes11101164).
- Havelka M .., Bytyutskyy D .., Symonov Symonová R .., R Ráb P .., Flaj Flajšhans M. The second highest chromosome count among vertebrates is observed in cultured sturgeon and is associated with genome plasticity. Genetics Selection Evolution 2016, 48: 12 (doi: 10.1186/s12711 016 0194 0).
- Ludwig A., Belfiore N., Pitra C., Svirsky V., Jenneckens I. Genome d uplication e vents and f unctional r eduction of p loidy l evel s in s turgeon (Acipenser, Huso and Scaphirhynchus). Genetics , 2001, 158 ( 1203 1215 ( doi: 10.1093/genetics/158.3.1203).
- Барминцева А.Е. Филогеография и внутривидовой генетический полиморфизм сибирского осетра Acipenser baerii Brandt , 1869 в природе и аквакультуре. Канд . дис . М 2018.
- Nei M. Estimation of average heterozygosity and genetic distance for small number of individuals. Genetics 1978, 89 ( 3): 583 590 (doi: 10.1093/genetics/89.3.583).
- Nielsen R., Tarpy D.R .., Kern H. Estimating effective paternity number in social insects and the effective number of alleles in a population. Molecular Ecology , 2003, 12 ( 11): 3157 3164 (doi: 10.1046/j.1365 294X.2003.01994. x).
- Weir B.S., Cockerham C. C. Estimating F statistics for the analysis of population structure. Evolution , 1984, 38 ( 6): 1358 1370 doi : 2307/2408641).
- Clark L V Jasieniuk M. polysat: an R package for polyploid microsatellite analysis. Molecular Ecology Resources 2011, 11(3): 562 566 ( doi : 10.1111/j.1755 0998.2011. 02985.x).
- Hubisz M J .., Falush D .., Stephens M .., Pritchard J K. Inferring weak population structure with the assistance of sample group information. Molecular Ecology Resources , 2009, 9( 1322 1332 (doi : 10.1111/j.1755 0998.2009.02591. x).
- Hardy O., Vekemans X. SPAGeDI: A versatile computer program to analyse spatial genetic structure at the individual or population levels. Molecular Ecology Notes, 2002, 2(4): 618-620 (doi: 10.1046/j.1471-8286.2002.00305.x).
- Bruvo R., Michiels N.K., D'souza T.G., Schulenburg H. A simple method for the calculation of microsatellite genotype distances irrespective of ploidy level. Molecular Ecology , 2004, 13(7): 2101 2106 (doi: 10.1111/j.1365 294X.2004.02209.x).
- Georgescu S., Canareica O., Dudu A., Costache M. Analysis of the m icrosatellite v ariation in thec ommon h ybrid b etween Russian s turgeon ( Acipenser g ueldenstaedtii Brandt and Ratzeburg, 1833) and S iberian s turgeon ( Acipenser b aerii Brandt, 1869) from a quaculture. Transylvanian Review of Systematical and Ecological Research , 2013, 15 ( 117 124 ( doi: 10.2478/trser 2013 0024).
- Georgescu S., Sergiu E., Canareica O., Popa G., Dudu A., Costache M. Characterization of five m icrosatellites in the Siberian s turgeon Acipenser b aerii from a quaculture. Journal of Animal Science and Biotechnology , 2013, 46: 95 98.
- Kohlmann K., Kersten P., Ge Geßner J., Eroglu, O., Firidin S., Ciorpac M., Suciu R. Validation of 12 species specific, tetrasomic microsatellite loci from the Russian sturgeon, Acipenser guelden-staedtii , for genetic broodstock management. Aquaculture International , 2018, 26: 1365 1376 (10.1007/s10499 018 0290 y).
- Smith C. T., Nel son R. J., Pollard S. S., Rubidge E., McKay S., Rodzen J., May B., Koop B. Population genetic analysis of white sturgeon ( Acipenser transmontanus ) in the Fraser River. Journal of Applied Ichthyology, 2002, 18 (4 6)6): 307 312 ( 10.1046/j.1439 0426.2002.00418.x).
- Fopp Bayat D. Microsatellite DNA v ariation in the Siberian s turgeon, Acipenser b aeri Actinopterygii , Acipenseriformes , Acipenseridae ), cultured in a Polish f ish f arm. Acta Ichthyologica et Piscatoria , 2010, 40 ( 1): 21 25 doi: 10.3750/AIP2010.40.1.03).
- Zhao N., Ai W., Shao Z., Zhu B., Brosse S., Chang J. Microsatellites assessment of Chinese sturgeon ( Acipenser sinensis Gray) genet ic variability. Journal of Applied Ichthyology , 2005 , 21 ( 1): 7 13 (doi 10.1111/j.1439 0426.2004.00630.x
- Cui X., Li C., Qin S., Huang Z., Gan B., Jiang Z., Huang X., Yang X., Li Q., Xiang X. Chen J., Zhao Y., Rong J. High throughput sequencing based microsatellite genotyping for polyploids to resolve allele dosage uncertainty and improve analyses of genetic diversity, structure and differ-entiation: A case study of the hexaploidy Camellia oleifera . Molecular Ecology Resources , 2022, 22 ( 199 211 ( doi : 10.1111/1755 0998.13469).
- Dakin E.E .., Avise J.C. Microsatellite null alleles in parentage analysis. Heredit y 2004, 93: 504 509 (doi: 10.1038/sj.hdy.6800545).
- Parisod C .., Salmon A .., Zerjal T., Tenaillon M., Grandbastien M., A Aïnouche M. Rapid structural andepigenetic reorganization near transpo sable elements inhybrid and allopolyploid genomes in Spartina . New Phytologist , 2009, 184 ( 1003 1015 (doi 1 0.1111/j.1469 8137.2009.03029. x).
- Dufresne F., Stift M., Vergilino R., Mable B. K. Recent progress and challenges in population genetics of polyploid organisms: an overview of current state of the art molecular and statistical tools. Molecular Ecology , 2013, 23(1): 40 69 (doi: 10.1111/mec.12581).
- Барминцева А.Е., Мюге Н.С. Генетический полиморфизм сибирского осетра Acipenser baerii Brandt, 186 9 в аквакультуре. Генетика, 2018, 54: 216 223 (doi: 10.7868/S0016675818020030
- Государственный реестр селекционных достижений, допущенных к использованию. Т. 2. Породы животных . М., 2016.


