Разработка ПЦР в режиме реального времени для выявления полевых изолятов вируса заразного узелкового дерматита в пробах от крупного рогатого скота
Автор: Пестова Я.Е., Артюхова Е.Е., Кострова Е.Е., Шумилова И.Н., Кононов А.В., Спрыгин А.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Вирусология
Статья в выпуске: 2 т.53, 2018 года.
Бесплатный доступ
Заразный узелковый дерматит (нодулярный дерматит, НД, бугорчатка, nodular dermatitis, lumpy skin disease, LSD) представляет серьезную угрозу скотоводству, в связи с чем необходимы надежные экспресс-методы для лабораторной диагностики заболевания на фоне применения живых гомологичных вакцин. Ранее предложенные и рекомендованные World Organization for Animal Health (Международное эпизоотическое бюро, Париж, OIE - МЭБ) методы выявляют также ДНК вирусов оспы овец и оспы коз. В классической ПЦР существует риск контаминации продуктами амплификации в связи с необходимостью электрофоретической детекции. C.E. Lamien с соавт. (2011) разработали метод детекции вируса заразного узелкового дерматита, вируса оспы коз и вируса оспы овец амплификацией фрагментов ДНК с последующим анализом их кривых плавления с высоким разрешением. Однако высокая зависимость метода от качества и концентрации ДНК в исследуемой пробе не позволяет использовать его в рутинной диагностике. Нами представлены результаты разработки, применения и оптимизации метода ПЦР в режиме реального времени (ПЦР-РВ) для выявления ДНК полевых изолятов вируса LSD в образцах биоматериала от крупного рогатого скота. Специфичность метода оценили с использованием ДНК гомологичных и гетерологичных вирусов, депонированных в коллекции микроорганизмов ФГБУ ВНИИЗЖ. Разработанный метод продемонстрировал высокую специфичность в отношении полевых изолятов вируса заразного узелкового дерматита. Ложноположительных результатов с аттенуированным вакцинным штаммом и родственными каприпоксвирусами не выявлены. Чувствительность метода, которую оценивали, используя 10-кратные разведения ДНК референтного штамма ВНД КРС/Дагестан/2015 (диагностический), составила 0,21 lg ТЦД50/мл. Показана эффективность амплификации 98,6 % с вариабельностью стандартного отклонения (±SD) при тестировании пяти 10-кратных разведений в 3-кратной повторности от 0,11 до 0,33. Валидацию метода проводили с образцами от экспериментально зараженных животных. Быков заражали подкожно, отбирали пробы цельной крови и носовых смывов. Дополнительно образцы анализировали методом классической ПЦР по D.C. Ireland и Y.S. Binepal (1998) (данные не приведены). При тестировании предложенная нами тест-система ПЦР-РВ для выявления ДНК полевых изолятов вируса заразного узелкового дерматита показала высокую специфичность и чувствительность и может быть рекомендован для анализа полевых образцов в профильных ветеринарных лабораториях.
Заразный узелковый дерматит, диагностика, пцр-рв, геном, вирус
Короткий адрес: https://sciup.org/142214142
IDR: 142214142 | УДК: 636.2:619:57.083.2:577.2 | DOI: 10.15389/agrobiology.2018.2.422rus
Текст научной статьи Разработка ПЦР в режиме реального времени для выявления полевых изолятов вируса заразного узелкового дерматита в пробах от крупного рогатого скота
Каприпоксвирусы из рода Capripoxvirus (вирус заразного узелкового дерматита крупного рогатого скота, вирус оспы овец и вирус оспы коз) — возбудители трансграничных зоонозных болезней крупного и мелкого рогатого скота, которые представляют серьезную угрозу скотоводству, нанося существенные экономические потери хозяйствам и экономике стран (1, 2). За последние несколько лет в связи с расширением торговых отношений и, возможно, вследствие действия природных факторов каприпоксвирусы стали массово распространяться в северном направлении, включая страны ближнего Востока, Европы, Турцию и Россию (3-7). Наиболее опасным в настоящее время считается вирус нодулярного дерматита крупного рогатого скота (lumpy skin disease virus, LSDV), массовое распространение которого в 2015-2016 годах на юге Европы, Балканском полуострове и в Российской Федерации обострило необходимость в высокочувствительных методах, позволяющих проводить мониторинг и однозначно диагностировать это заболевание в кратчайшие сроки для своевременного и адекват- ного применения профилактических и защитных мероприятий.
У LSDV (род Capripoxvirus , сем. Poxviridae ) геном представлен двуцепочечной ДНК (8). Вирус может передаваться механически через укусы насекомых или через контаминированный корм, воду, а также через сперму при оплодотворении (1, 8-11). Недавно показана роль клещей в распространении этого вируса (12, 13).
LSD — трансграничная вирусная болезнь крупного рогатого скота, сопровождающаяся лихорадкой, снижением живой массы, поражением лимфатической системы, отеком внутренних органов, формированием узлов (нодул, бугорков) в коже и внутренних органах (14). В настоящее время болезнь включена в список World Organization for Animal Health (Международное эпизоотическое бюро, Париж, OIE — МЭБ) (15). В соответствии с этим заболевание крупного рогатого скота заразным узелковым дерматитом подлежит обязательной нотификации. Согласно приказу ¹ 62 Минсельхоза РФ от 09 марта 2011 года, заразный узелковый дерматит крупного рогатого скота внесен в «Перечень заразных и иных болезней животных», но отсутствует в «Перечне заразных, в том числе особо опасных болезней, по которым устанавливаются ограничения (карантин)», утвержденном приказом Минсельхоза РФ ¹ 476 от 19 декабря 2011 года.
Ранее LSD крупного рогатого скота регистрировался в странах африканского континента, проявляя сезонный характер (16). Однако беспрецедентное распространение возбудителя этого заболевания на юге России в 2015-2016 годах (5, 17) требует применения высокочувствительных методов диагностики. Согласно рекомендациям МЭБ (15), детекция генома LSDV осуществляется с помощью ПЦР. Применяются как классическая ПЦР (18), так и ПЦР в режиме реального времени (19). Однако предложенные и рекомендованные МЭБ методы выявляют также ДНК вирусов оспы овец и оспы коз. Более того, при работе с классической ПЦР существует риск контаминации продуктами амплификации в связи с необходимостью электрофоретической детекции. C.E. Lamien с соавт. (20) разработали метод детекции LSDV, вируса оспы коз и вируса оспы овец амплификацией фрагментов ДНК с последующим анализом их кривых плавления с высоким разрешением. Однако высокая зависимость метода от качества и концентрации ДНК в исследуемой пробе не позволяет использовать его в рутинной диагностике. Кроме того, применение живых вакцин против LSD на основе штамма Neethling требует разработки подходов для выявления и дифференциации генома полевых изолятов.
Нами предложен быстрый, надежный, чувствительный и специфичный метод ПЦР в режиме реального времени, который позволяет выявлять ДНК полевых изолятов LSDV в образцах тканей и органов от экспериментально и естественно зараженных животных.
Целью исследования была разработка и валидация метода ПЦР в режиме реального времени для выявления ДНК LSDV в биоматериале.
Методика . Суммарную ДНК выделяли из 100 мкл суспензии анализируемых образцов, используя набор РИБО-сорб (ФГУН ЦНИИЭ Роспотребнадзора, г. Москва) согласно инструкции изготовителя.
С помощью программного обеспечения Primer3 Engine Software (доступно на разрабатывали праймеры и зонды. Синтез праймеров и зондов выполнен фирмой «Beagle Biotechnology» (г. Санкт-Петербург). Для детекции вируса использовали праймеры f2 TAGAAAATGGATGTACCACAAATACAG и r33 TTGTTA-CAACTCAAATCGTTAGGTG, а также зонд Taqman ACCACCTAATGA-TAGTGTTTATGATTTAC, который на 5′-конце был помечен флуорес- центным красителем карбоксифлуоресцеином (6FAM), а на 3'-конце — гасителем флуоресценции BHQ-1.
Для проведения реакции использовали набор реактивов GoTaq Flexi DNA Polymerase, 5½ Colorless GoTaq PCR Buffer, MgCl2 («Promega Corp.», США) и 100 mM dNTP Set («Invitrogen», США). Конечный объем реакционной смеси составил 25 мкл, который включал 5 мкл 10½ ПЦР-буфера, 3 мкл 25 мМ MgCl2, 0,5 мкл 10 нмоль dNTP, по 12,5 пмоль прямого и обратного праймеров, а также 7,5 пмоль зонда. ПЦР в режиме реального времени (ПЦР-РВ, qPCR) осуществляли с помощью прибора Rotor Gene («Qiagen N.V.», Германия). ПЦР-протокол: активация в течение 10 мин при 95 ° С; 40 циклов — 15 с при 95 ° С, 1 мин при 60 ° С.
Полученные данные интерпретировали на основании наличия или отсутствия пересечения кривой флуоресценции с пороговой линией, что соответствует наличию или отсутствию значения порогового цикла Ct в соответствующей графе в таблице результатов реакции, выведенной при машинном анализе. Результат считали достоверным при условии прохождения положительного (Ct < 30) и отрицательного (Ct не определен) кон-тролей амплификации. Образец учитывали как положительный (наличие ДНК LSDV), если значение Ct не превышало 35, как отрицательный — если для него значение Ct отсутствовало или было больше 37.
Cпецифичность праймеров проверяли с помощью онлайн-ресурса BLAST и тестированием с генетическим материалом гомологичных и гетерологичных вирусов. Эксперименты по оценке специфичности были поставлены индивидуально с ДНК каждого вируса и при одновременном присутствии в реакционной смеси ДНК нескольких вирусов.
Аналитическую чувствительность ПЦР-РВ определяли при тестировании 10-кратных разведений (до 10 - 5) геномной ДНК диагностического штамма ВНД/Дагестан/2015 с исходным титром 5,21 lg ТЦД50/мл. Для статистической верификации провели 3 повторных эксперимента с 10-кратными разведениями геномной ДНК для оценки линейности результатов.
При экспериментальном заражении использовали 6 быков в возрасте 1,5 лет. Животных инфицировали, вводя внутривенно полевой вирус ВНД КРС/Дагестан/2015 с титром 5,21 lg ТЦД50/мл (2 мл) согласно общепринятым рекомендациям. Одно животное (контроль) заражению не подвергали. Для детекции генома LSDV на 4-е и 14-е сут после заражения отбирали пробы крови, которую стабилизировали EDTA, и назальные смывы. Для подтверждения результатов ПЦР-РВ после окончания эксперимента животных подвергали убою и отбирали пробы биоматериала, из которых выделяли вирус, используя перевиваемую культуру клеток тестикул ягненка (коллекция культур клеток ФГБУ ВНИИЗЖ) согласно описанию (21).
Линейную регрессию строили с помощью программы Statistica 10 («StatSoft, Inc.», США). При оценке воспроизводимости результатов рассчитывали стандартные отклонения (±SD) и коэффициент детерминации r2.
Результаты . Праймеры и зонд для тест-системы были разработаны для амплификации и детекции фрагмента гена EEV (extracellular enveloped virions, ORF126) LSDV, кодирующего один из белков экстрацеллюлярного оболочечного вириона, в котором у других представителей семейства Capripoxviridae и вакцинных штаммов типа Neethling есть делеция 27 п.н., отсутствующая у полевых изолятов (22, 23).
Специфичность. Для тестирования и оптимизации разработанного метода использовали ДНК референтных штаммов гетерологичных вирусов (депонированы в коллекции микроорганизмов ФГБУ ВНИИЗЖ), а 424
также ДНК изолятов LSDV, выделенных в разных регионах России в 20152016 годах (табл. 1). Было показано, что разработанный метод ПЦР-РВ не давал ложноположительных результатов и специфично выявлял ДНК полевых изолятов LSDV как отдельно, так и в присутствии ДНК гетерологичных вирусов (вирусы оспы овец и коз), а также ДНК вакцинного штамма.
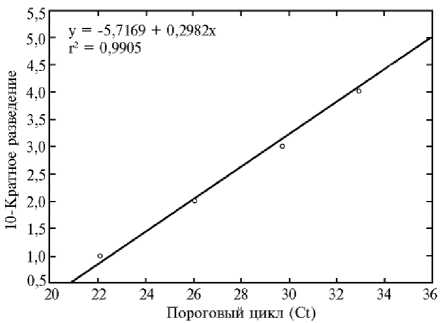
Чувствительность ПЦР-РВ. При оценке с использованием диагностического штамма ВНД/Дагестан/2015 с титром 5,21 lg ТЦД50/мл предел чувствительности предложенного метода составил 0,21 lg ТЦД50/мл. Для оценки эффективности амплификации в повторных экспериментах получены значения Сt, которые использовали для вычисления эффективности. На основании средних значений Сt была получена линейная регрессия со значением эффективности амплификации (Е) 98,6 % (рис.).
1. Тестирование специфичности разработанного метода выявления полевых изолятов вируса LSDV (lumpy skin disease virus) с помощью ПЦР в реальном времени (ПЦР-РВ)
|
Источник ДНК |
Происхождение/коллекция |
ПЦР-РВ |
|
ВНД КРС/Дагестан/2015 (диагностический штамм) |
Россия/ФГБУ ВНИИЗЖ |
+ |
|
ВНД КРС Э-95 |
Африка/ФГБУ ВНИИЗЖ |
+ |
|
Аттенуированный вакцинный штамм |
ЮАР VRI Onderstepoort/ ФГБУ ВНИИЗЖ |
- |
|
Вирус оспы овец, штамм Афганский |
Афганистан/ФГБУ ВНИИЗЖ |
- |
|
Вирус оспы овец, штамм ВНИИЗЖ |
Россия/ФГБУ ВНИИЗЖ |
- |
|
Вирус оспы овец, полевой изолят |
Россия (Ярославская обл.)/– |
- |
|
Вирус оспы коз, штамм Приморский 2003 |
Россия/ФГБУ ВНИИЗЖ |
- |
|
Вирус оспы коз, штамм ВНИИЗЖ 2003 |
Россия/ФГБУ ВНИИЗЖ |
- |
|
Вирус чумы мелких жвачных, штамм ВНИИЗЖ |
Россия/ФГБУ ВНИИЗЖ |
- |
|
Вирус везикулярного стоматита, штамм ВНИИЗЖ |
Россия/ФГБУ ВНИИЗЖ |
- |
|
Вируса эктимы овец, полевой изолят |
Россия/– |
- |
|
Вирус оспы коров, штамм ВНИИЗЖ |
Россия/ФГБУ ВНИИЗЖ |
- |
|
П р и м е ч а н и е. ФГБУ ВНИИЗЖ — Федеральный центр охраны здоровья животных; прочерки означают, что образец в коллекции не депонирован. |
||
Линейность результатов тестирования 10-кратных разведений ДНК диагностического штамма вируса LSDV (lumpy skin disease virus) ВНД КРС/Да-гестан 2015 предложенным методом ПЦР в реальном времени. Линейная регрессия построена с помощью программы Statistica 10 («StatSoft, Inc.», США).
Воспроизводимость определяли с помощью величины стандартного отклонения (±SD) для каждой серии разведений, используя полученные значения Сt. Стандартное отклонение SD для пяти 10-кратных разведений варьировало от 0,11 до 0,33. При этом коэффициент детерминации r2 составил 0,990.
Тестирование метода ПЦР-РВ при экспериментальном заражении животных. До инокуляции вирусом, на 4-е и 14-е сут после заражения от всех животных получали смывы стерильным, предварительно увлажненным ватным аппликатором, а также отбирали кровь для анализа. Результаты тестирования показали (табл. 2), что все животные до инокуляции были отрицательны. На 4-е сут после заражения положительными в ПЦР-РВ были пробы крови от быков ¹¹ 1, 2 и 3, тогда как в смывах геном LSDV был обнаружен у быков ¹¹ 2, 5 и 6. На 14-е сут ге- ном LSDV в крови выявлялся у всех быков, кроме животного ¹ 3, в смывах — у всех животных, за исключением быков ¹ 1 и ¹ 3. Все пробы от контрольного животного были отрицательны в ПЦР-РВ. В культуре клеток вирус выделили от животных ¹¹ 2, 3 и 4.
2. Выявление генома вируса LSDV нодулярного дерматита (lumpy skin disease virus) у экспериментально зараженных быков с помощью разработанного метода ПЦР в реальном времени (ПЦР-РВ) и выделение вируса в культуре клеток тестикул ягненка
|
¹ животного |
ПЦР-РВ (значения Ct) |
Выделение вируса в культуре клеток |
||||
|
до заражения |
4-е сут |
14-е сут |
||||
|
кровь |
назальный смыв |
кровь |
назальный смыв |
|||
|
1 |
0/ - |
25,01 |
нв |
24,07 |
нв |
- |
|
2 |
0/ - |
26,11 |
29,87 |
26,30 |
29,00 |
+ |
|
3 |
0/ - |
29,50 |
0 |
нв |
нв |
+ |
|
4 |
0/ - |
нв |
нв |
29,09 |
29,40 |
+ |
|
5 |
0/ - |
нв |
29,21 |
21.00 |
25,54 |
- |
|
6 |
0/ - |
нв |
29,44 |
19,30 |
29,22 |
- |
|
Контроль |
0/ - |
нв |
нв |
нв |
нв |
- |
П р и м еч а ни е. «-»/«+» — отсутствие/наличие вируса при выделении в культуре клеток, нв — геном не выявлен.
Мы также сравнили результаты разработанного метода ПЦР-РВ и классического, который рекомендован МЭБ (15). Было установлено, что классический метод не выявлял ДНК вируса, если значение Сt было больше 26,4 (данные не представлены).
Главной целью исследований была разработка ПЦР в режиме реального времени для практического применения метода при выявлении ДНК полевых изолятов LSDV в биологическом материале в условиях широкого использованием живых гомологичных вакцин против заразного узелкового дерматита крупного рогатого скота. Разработанные праймеры и зонд проверяли на специфичность с помощью BLAST и экспериментально с ДНК всех представителей каприпоксвирусов разного происхождения, депонированных в коллекции штаммов ФГБУ ВНИИЗЖ (см. табл. 1), а также родственных вирусов оспы овец и оспы коз во всех случаях был получен отрицательный результат, что указывает на высокую аналитическую специфичность разработанной тест-системы. Важно отметить, что тест-система выявляла только ДНК полевых изолятов LSDV, тогда как с вакцинным вирусом и другими родственными каприпоксви-русами результаты были отрицательными (см. табл. 1).
Анализ российских и зарубежных публикаций показывает, что ПЦР-РВ для выявления генома полевых изолятов LSDV, описываемый в нашем исследовании, представляет интерес в качестве диагностического инструмента для рутинной диагностики. Отметим, что сообщения по этой тематике на русском языке сравнительно немногочисленны, а по диагностическим тест-системам — практически отсутствуют. Публикации по валидации соответствующих коммерческих тест-систем, известных на российском рынке, в отечественной научной литературе также не представлены. Поэтому целесообразно провести исследование всех коммерческих аналогов, присутствующих на российском рынке, для их объективного сравнения.
На настоящий момент нам известна единственная российская публикация (22) по детекции и дифференциации каприпоксвирусов методом классической ПЦР. Описанная авторами этой работы мультиплексная ПЦР имеет ряд достоинств, однако ПЦР-РВ позволяет предотвратить риск перекрестной контаминации при выявлении генома LSDV, снижая вероятность ложноположительных результатов и сокращая продолжительность 426
анализа, так как не требует изучения продуктов амплификации в агарозном геле. Кроме того, метод ПЦР-РВ более чувствительный и позволяет проводить количественный анализ. Оценка числа копий вирусных частиц при экспериментальном заражении не входила в задачу представленной работы, но рассматривается нами как предмет дальнейших исследований биологических свойств LSDV.
В доступной отечественной литературе мы также не обнаружили данных об экспериментальном заражении восприимчивых животных вирусом LSDV. Это первое подобное исследование, хотя полученные нами результаты недостаточны для статистически достоверных выводов из-за небольшого числа исследуемых животных.
Предложенный метод ПЦР-РВ показал более высокую чувствительность по сравнению с классическим методом (18), который не выявлял ДНК вируса при значениях порогового цикла более 26,4. Несмотря на это, выделение вируса дало три положительных результата, из них два — у животных, отрицательных при тестировании в классической ПЦР (18). Интересно, что вирус к концу эксперимента начал регистрироваться в носовых истечениях (24, 25), при этом значения Сt при выявлении генома LSDV для образцов крови и носовых смывов практически не различались, тогда как M. Sevik с соавт. (24) сообщили, что значения Ct для проб носовых смывов были меньше, чем для проб крови. Возможно, причиной заключается в том, что в нашей работе быков заражали экспериментально, тогда как в работе M. Sevik с соавт. (24) животные инфицировались естественным путем.
Предложенная тест-система ПЦР-РВ уже успешно валидирована на полевых образцах от крупного рогатого скота во время вспышек LSD в 2015-2016 годах, чему будет посвящено следующее сообщение авторов.
Таким образом, нами разработан быстрый, надежный, чувствительный и специфичный метод ПЦР в режиме реального времени для выявления генетического материала полевых изолятов LSDV (lumpy skin disease virus) в пробах от крупного рогатого скота. Этот метод можно рекомендовать для применения в профильных лабораториях, проводящих диагностические исследования на вирус нодулярного дерматита.
Список литературы Разработка ПЦР в режиме реального времени для выявления полевых изолятов вируса заразного узелкового дерматита в пробах от крупного рогатого скота
- Tuppurainen E.S., Venter E.H., Shisler J.L., Gari G., Mekonnen G.A., Juleff N., Lyons N.A., De Clercq K., Upton C., Bowden T.R., Babiuk S., Babiuk L.A. Capripoxvirus diseases: current status and opportunities for control. Transbound. Emerg. Dis., 2017, 64: 729-745 ( ) DOI: 10.1111/tbed.12444
- Beard P.M. Lumpy skin disease: a direct threat to Europe. Vet. Rec., 2016, 28: 557-558 ( ) DOI: 10.1136/vr.i2800
- Şevik M., Doğan M. Epidemiological and molecular studies on lumpy skin disease outbreaks in Turkey during 2014-2015. Transbound. Emerg. Dis., 2016, 64(4): 1268-1279 ( ) DOI: 10.1111/tbed.12501
- Abutarbush S.M., Ababneh M.M., Al Zoubi I.G., Al Sheyab O.M., Al Zoubi M.G., Alekish M.O., Al Gharabat R.J. Lumpy skin disease in Jordan: disease emergence, clinical signs, complications and preliminary-associated economic losses. Transbound. Emerg. Dis., 2015, 62(5): 549-554 ( ) DOI: 10.1111/tbed.12177
- Мищенко А. В., Караулов А. К. Мищенко В. А. Нодулярный дерматит крупного рогатого скота. Ветеринария, 2016, 4: 3-6.
- Tasioudi K.E., Antoniou S.E., Iliadou P., Sachpatzidis A., Plevraki E., Agianniotaki E.I., Fouki C., Mangana-Vougiouka O., Chondrokouki E., Dile C. Emergence of lumpy skin disease in Greece, 2015. Transbound. Emerg. Dis., 2016, 63(3): 260-265 ( ) DOI: 10.1111/tbed.12497
- Mercier A., Arsevska E., Bournez L., Bronner A., Calavas D., Cauchard J., Falala S., Caufour P., Tisseuil C., Lefrançois T., Lancelot R. Spread rate of lumpy skin disease in the Balkans, 2015-2016. Transbound. Emerg. Dis., 2018, 65(1): 240-243 ( ) DOI: 10.1111/tbed.12624
- Tulman E.R., Afonso C.L., Lu Z., Zsak L., Kutish G.F., Rock D.L. Genome of lumpy skin disease virus. J. Virol., 2001, 75(15): 7122-7130 ( ) DOI: 10.1128/JVI.75.15.7122-7130.2001
- Chihota C.M., Rennie L.F., Kitching R.P., Mellor P.S. Mechanical transmission of lumpy skin disease virus by Aedes aegypti (Diptera: Culicidae). Epidemiol. Infect., 2001, 126: 317-321 ( ) DOI: 10.1017/S0950268801005179
- Irons P.C., Tuppurainen E.S., Venter E.H. Excretion of lumpy skin disease virus in bull semen. Theriogenology, 2005, 63: 1290-1297 ( ) DOI: 10.1016/j.theriogenology.2004.06.013
- Annandale C.H., Holm D.E., Ebersohn K., Venter E. H. Seminal transmission of lumpy skin disease virus in heifers. Transbound. Emerg. Dis., 2013, 61: 443-448 ( ) DOI: 10.1111/tbed.12045
- Tuppurainen E.S., Lubinga J.C., Stoltsz W.H., Troskie M., Carpenter S.T., Coetzer J.A., Venter E.H., Oura C.A. Evidence of vertical transmission of lumpy skin disease virus in Rhipicephalus decoloratus ticks. Ticks Tick Borne Dis., 2013, 4: 329-333 ( ) DOI: 10.1016/j.ttbdis.2013.01.006
- Lubinga J.C., Tuppurainen E.S., Mahlare R., Coetzer J.A., Stoltsz W.H., Venter E.H. Evidence of transstadial and mechanical transmission of lumpy skin disease virus by Amblyomma hebraeum ticks. Transbound. Emerg. Dis., 2013, 62: 174-182 ( ) DOI: 10.1111/tbed.12102
- Макаров B.В., Грубый В.А., Груздев К.Н., Сухарев О.И. Список МЭБ и трансграничные инфекции животных: монография. М., 2012: 76-79.
- Beard P., Lubisi B.A. Manual of diagnostic tests and vaccines for terrestrial animals 2017. Chapter 2.4.13. Lumpy skin disease. Режим доступа: http://www.oie.int/fileadmin/Home/eng/Health_stand-ards/tahm/2.04.13_LSD.pdf. Дата обращения: 21.12.2017.
- Abera Z., Degefu H., Gari G., Ayana Z. Review on epidemiology and economic importance of lumpy skin disease. International Journal of Basic and Applied Virology, 2015, 4(1): 8-21 ( ) DOI: 10.5829/idosi.ijbav.2015.4.1.9117
- Мищенко А.В., Мищенко В.А., Кононов А.В., Шевкопляс В.Н., Джаилиди Г.А., Дресвянникова С.Г., Черных О.Ю. Проблема нодулярного дерматита крупного рогатого скота. Ветеринария Кубани, 2015, 5: 3-6.
- Ireland D.C., Binepal Y.S. Improved detection of capripoxvirus in biopsy samples by PCR. J. Virol. Methods, 1998, 74: 1-7 ( ) DOI: 10.1016/S0166-0934(98)00035-4
- Bowden T.R., Babiuk S.L., Parkyn G.R., Copps J.S., Boyle D.B. Capripoxvirus tissue tropism and shedding: a quantitative study in experimentally infected sheep and goats. Virology, 2008, 371(2): 380-393 ( ) DOI: 10.1016/j.virol.2007.10.002
- Lamien C.E., Lelenta M., Goger W., Silber R., Tuppurainen E., Matijevic M., Luckins A.G., Diallo A. Real time PCR method for simultaneous detection, quantitation and differentiation of capripoxviruses. J. Virol. Methods, 2011, 171: 134-140 ( ) DOI: 10.1016/j.jviromet.2010.10.014
- Кононова С.В., Шумилова И.Н., Бьядовская О.П. Методические рекомендации по выделению вируса нодулярного дерматита крупного рогатого скота в культуре клеток: методический материал. М., 2017: 5-17.
- Орлова Е.С., Щербаков А.В., Диев В.И., Захаров В.М. Видовая и штаммовая дифференциация каприпоксвирусов методом полимеразной цепной реакции. Молекулярная биология, 2006, 40(1): 158-164.
- Menasherow S., Rubinstein-Giuni M., Kovtunenko A., Eyngor Y., Fridgut O., Rotenberg D., Khinich Y., Stram Y. Development of an assay to differentiate between virulent and vaccine strains of lumpy skin disease virus (LSDV). J. Virol. Methods, 2014, 199: 95-101 ( ) DOI: 10.1016/j.jviromet.2013.12.013
- Şevik M., Avci O., Doğan M., İnce Ö.B. Serum biochemistry of lumpy skin disease virus-infected cattle. Biomed. Res. Int., 2016, 2016: 6257984 ( ) DOI: 10.1155/2016/6257984
- Balinsky C.A., Delhon G., Smoliga G., Prarat M., French R.A., Geary S.J., Rock D.L., Rodriguez L.L. Rapid preclinical detection of sheep pox virus by a real-time PCR assay. J. Clin. Microbiol., 2008, 46: 438-442 ( ) DOI: 10.1128/JCM.01953-07


