Разработка пробиотического консорциума для людей с онкологическими заболеваниями
Автор: Веснина А.Д., Просеков А.Ю., Козлова О.В., Курбанова М.Г., Козленко Е.А., Голубцова Ю.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 1 (87), 2021 года.
Бесплатный доступ
По данным Всемирной организации здравоохранения онкологические заболевания являются распространенной причиной смертности населения, в результате чего актуальна разработка мероприятий, направленных на профилактику канцерогенеза. Данное исследование посвящено получению пробиотического консорциума, состоящего из бактерий, выделенных из желудочно-кишечного тракта здорового человека, с дальнейшей перспективой его применения в противораковой терапии в виде биологически активной добавки (БАД) в специализированных продуктах питания. Объектом исследования являлись бактерии, выделенные из фекалий здорового человека, и консорциумы на их основе. Идентификация бактерий и исследование антимикробной, антиоксидантной активности, противоопухолевых свойств, устойчивости к антибиотикам, кислой среде и желчи бактерий и консорциумов на их основе проводилось по общепринятым методикам. Результатами исследования является формирование консорциумов из выделенных и идентифицированных бактерий: №1 - B. bifidum, B. breve, L. plantarum, L. acidophilus, №2 - B. bifidum, B. breve, L. plantarum, L. fermentum, №3 - B. breve, L. fermentum, S. salivarius, №4 - B. breve, L. fermentum, S. thermophiles, проявляющих пробиотические свойства. Антимикробную активность к наибольшему количеству тест-культур проявлял консорциум №2; умеренную устойчивость к наибольшему числу антибиотиков - №1 и №2; наибольшую антиоксидантную активность - №1, наиболее выраженными противораковыми свойствами по отношению к HepG2, ЛБР2, MDA-MB-231, U87 и Panc-1 - №4, а к MCF-7 - №3; наибольшую устойчивость к средам с низкой кислотностью и желчью - №2. По результатам исследования видно, что выделенные штаммы, как и консорциумы на их основе, обладали антимикробной, антиоксидантной активностью, проявляли противоопухолевое действие, устойчивость к действию антибиотиков, желчи и кислой среды, благодаря чему, их можно использовать в качестве пробиотических средств в виде БАД и специализированных молочнокислых продуктов для профилактики канцерогенеза.
Пробиотические свойства, канцерогенез, микробиота кишечника, идентификация микроорганизмов, молочнокислые бактерии, противораковые свойства
Короткий адрес: https://sciup.org/140257325
IDR: 140257325 | УДК: 579.86:615.276:615.277.3 | DOI: 10.20914/2310-1202-2021-1-219-232
Текст научной статьи Разработка пробиотического консорциума для людей с онкологическими заболеваниями
Микрофлора желудочно-кишечного тракта (ЖКТ) влияет на здоровое состояние организма, регулируя его метаболическую, защитную, координирующую и эпигенетическую функции [1]. Она участвует в развитии канцерогенеза – существует взаимосвязь между канцерогенезом, его лечением и микробиотой, которая прослеживается в следующих аспектах [2]:
-
1. Наличие и развитие опухоли негативно сказывается на функционирование микробиоты, через токсины, вырабатываемые раковыми клетками [3], приводящими к дисбактериозу.
-
2. У онкобольных после лечения иммунная система ослаблена, происходит накопление метаболитов раковых клеток, наблюдается прирост патогенных бактерий в организме, что вызывает дисбактериоз, еще больше нарушающий функционирование иммунной системы [4].
-
3. Нарушение нормальной работы микрофлоры, из-за негативных факторов окружающей среды, приводит к развитию дисбактериоза, вследствие которого уменьшается разнообразие микробиоты, иммунная система кишечника подвергается атаке патогенных, условно-патогенных бактерий, способствующих развитию воспалений, ряда патологических процессов: снижению общего иммунитета, изменению гомеостаза, возникновению воспаления и канцерогенеза [5, 6].
Для нормализации работы микрофлоры ЖКТ необходим прием пробиотических препаратов [1]. Пробиотики – это живые непатогенные микроорганизмы, употребление которых способствует поддержанию нормальной работоспособности микрофлоры кишечника и всего организма в целом [7].
В основном к пробиотикам относят молочнокислые бактерии рода Lactobacillus, Bifidobacterium, Lactococus, Streptococcus, Enterococcus и микроорганизмы, не относящиеся к молочнокислым бактериям, рода Bacillus, Saccharomyces , и Escherichia coli . Для того, чтобы микроорганизмы можно было отнести к пробиотикам, они должны соответствовать ряду критериев, представленных в работе P. Markowiak [8]:
─ критерию безопасности, то есть иметь человеческое или животное происхождение, быть идентифицированными, обладать устойчивостью к действию антибиотиков и т. п.;
─ критерию технологической полезности, то есть накапливать большое количество биомассы, сохранять жизнеспособность и функциональность при хранении (при замораживании и сублимационном высушивании) и т. п.
В рамках данной работы, микроорганизмы должны обладать противораковой и антиоксидантной активностью. Роль пробиотиков в онкологии представлена на рисунке 1 [2, 4].
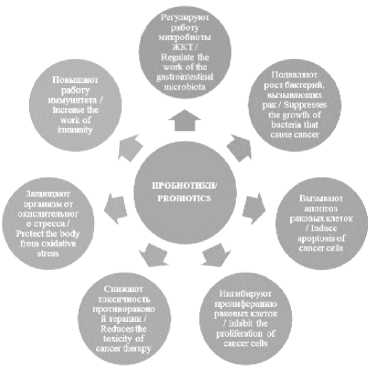
Рисунок 1. Пробиотики и профилактика рака
Figure 1. Probiotics and cancer prevention
Цель работы – создание пробиотического консорциума, состоящего из бактерии, выделенные из ЖКТ здорового человека, использование которого в качестве компонента функциональных, специализированных продуктов питания или в качестве БАД к диетическим рекомендациям станет частью противоопухолевой терапии.
Материалы и методы
Работа осуществлялась на базе Лаборатории биотестирования природных нутрицевтиков НИУ ФГБОУ ВО «Кемеровский государственный университет» (Россия). Объектом исследования являлись штаммы бактерий, выделенные из ЖКТ здорового человека, и разработанные на их основе консорциумы.
Для выделения молочнокислых бактерий из ЖКТ использовали фекалии здорового человека, из которых готовили суспензию и серию разведений. Разведения рассаживали на питательные среды: Рогоза (HiMedia Laboratories, Индия), Лактобакагар (ФБУН ГНЦ ПМБ, Россия), MRS (ФБУН ГНЦ ПМБ, Россия), Бифидум (ФБУН ГНЦ ПМБ, Россия), Блаурокка (ФБУН ГНЦ ПМБ, Россия), М17 (HiMedia Laboratories, Индия), Bifidobacterium Agar (HiMedia Laboratories, Индия) [9, 10]. Культивирование осуществляли в анаэробных условиях в СО2-инкубаторе
ИЛМ-170–01-«Ламинар-С» (LAMSYSTEMS, Россия) при температуре 37 ºC в течение 24–48 часов.
Предварительная идентификация выделенных колоний молочнокислых бактерий (колонии заранее пересаживали на агаризованную среду MRS [11]) осуществлялась с помощью определения культуральных и морфологических свойств штаммов, при использовании микроскопа Микмед-5 (ЛОМО, Россия), набора окраски по Граму (Лаб-Биомед, Россия), общепринятых стандартов (ГОСТ 10444.11–89 [12, 13] и Определителя Берджи (Берге) [14]. Принадлежность штаммов к виду определяли с помощью микробиологического анализатора VITEK 2 Compact (BioMerieux, Франция).
Антимикробную активность определяли методом диффузии в лунках агара, методика прописана в исследовании A. Davoodabadi и его коллег [15]. Использовали следующие тест-культуры: Escherichia coli B-6954, Bacillus fastidiosus B-5651, Pseudomonas fluorescens B-3502, Pseudomonas aeruginosa ATCC 9027, Leuconostoc mesenteroides B-8404, Candida albicans ATCC 885–653, Staphylococcus aureus ATCC 25923), предоставленные ФГБУ «Кемеровская МВЛ», Россия. При зоне ингибирования диаметром менее 11 мм штамм не проявлял активность, при зоне в 11–16 мм штамм проявлял слабую активность, а при зоне в 17–22 мм – среднюю активность, зона более 23 мм – высокую активность [16].
Антибиотикорезестентность определяли с помощью диско-диффузионного метода, описанного в работе Y. Yang и его коллег [17]. В методе использовали диски, пропитанные бензилпенициллином (10 мкг), стрептомицином (10 мкг), тетрациклином (30 мкг), ампициллином (10 мкг), канамицином (30 мкг), xлopaмфe-никoлом (30 мкг), гентамицином (10 мкг) (HiMedia Laboratories, Индия). При зоне ингибирования диаметром менее 15 мм штамм являлся устойчивым, при зоне в 16–20 мм штамм обладал умеренной устойчивостью, а при зоне более 21 мм штамм проявлял чувствительность по отношению к антибиотику [18].
Антиоксидантную активность определяли с помощью анализа по спектрофотометрическому определению DPPH, описанному в работе Pyrzynska K. и Pȩkal A [19]. Методика определения представлена в работе Н.С. Карамовой и Р.Э. Хабибуллина [20, 21].
Противоопухолевые свойства анализировали in vitro с помощью раковых клеток: HepG2, ЛБР2, MDA-MB-231, MCF-7, U87, Panc-1 (Cancer Center Karolinska, Швеция), методика анализа представлена в работе Бабич О.О. [22].
Устойчивость к неблагоприятным условиям ЖКТ, а именно кислотостойкость и устойчивость к желчи были определены по методикам, описанным в работе A. Sharma и ее коллег [23].
Определение биосовместимости реализовывали по капельной методике, описанной в работе Волковой Г.С. и ее коллег [24].
Для того, чтобы получить максимальное накопление биомассы при культивировании консорциумов, подбирали оптимальные питательные среды. Рассматривали прирост биомассы путем культивирования на среде Рогоза, MRS, Лактобакагаре при 37°С в течение 24 ч, измерение количества клеток проводили каждые 2 ч. Количественный учет выросших микроорганизмов проводили, используя метод разведений, представленный в работе А.И. Нетрусова и его коллег [25].
Для консорциумов изучение антимикробной активности, антибиотикорезистентности, антиоксидантной активности, противоопухолевых свойств и устойчивости к кислой среде и желчи проводили по вышеописанным методикам.
Хранение пробиотических консорциумов осуществлялось путем высушивания с помощью сублимационной сушилки «ИНЕЙ-6» (ИБП-РАН, Россия). Методика описана в работе В.А. Не-счисляева и И.В. Фадеева [26].
Результаты
1.1 Идентификация колоний, выделенных из биоматериала
Результаты определения культуральных и морфологических свойств (таблица 1), выросших в анаэробных условиях колоний, выделенных из биоматериала здорового человека свидетельствовали о том, что колонии № 1 и № 2 относились к роду Bifidobacterium, так как имели характерные культуральные и морфологические признаки, присущие данному роду и росли на среде Блаурокка и Бифидум-среде. Колонии № 3, № 4, № 5 относились к роду Lactobacillus и росли на селективных средах (Рогоза, Лактобакагар, Bifidobacterium Agar). Колонии № 6, № 7, № 8 относились к роду
Streptococcus и росли на селективной среде М17.
Результаты видовой идентификации выделенных колоний анализатором VITEK 2 Compact свидетельствовали о том, что колония:
№ 1 – Bifidobacterium bifidum ,
№ 2 – Bifidobacterium breve ,
№ 3 – Lactobacillus plantarum ,
№ 4 – Lactobacillus acidophilus ,
№ 5 – Lactobacillus fermentum ,
№ 6 – Streptococcus salivarius ,
№ 7 – Streptococcus agalactiae ,
№ 8 – Streptococcus thermophilus.
Таблица 1.
Культуральные и морфологические свойства колоний бактерий, выросших на среде MRS
Table 1.
Cultural and morphological properties of bacterial colonies grown on MRS medium
|
Признаки | Signs |
Колонии | Colonies |
|||
|
№ 1 1 |
№ 2 1 |
№ 3 |
№ 4 |
|
|
Культуральные признаки | Cultural traits |
||||
|
Форма колонии | Colony form |
круглая | round 1 |
точка с хвостиком | tail point |
круглая | round |
|
|
Размер колонии | Colony size |
мелкие | small |
|||
|
Цвет колонии | Colony color |
белый | white |
|||
|
Рельеф колонии | Colony relief |
плоский | flat 1 |
куполообразный | dome-shaped |
выпуклый | convex |
|
|
Блеск колонии | Colony glitter |
блестящая | shiny |
|||
|
Прозрачность колонии Colony transparency |
непрозрачная | opaque |
|||
|
Характер краев колонии Edges of the colony |
ровные | flat |
шероховатые | rough |
волнистые wavy |
ровные flat |
|
Морфологические признаки | Morphological signs |
||||
|
Форма | Form |
палочки V-образной формы V-shaped sticks |
палочки Y-образной формы Y-shaped sticks |
длинные палочки ong sticks |
|
|
Подвижность | Mobility |
неподвижные | motionless |
|||
|
Споры | spore |
отсутствуют | absent |
|||
|
Окраска по Граму | Gram stain |
Грам+ | Gram + |
|||
Результаты литературного обзора, проведенного авторами, показали, что штамм Streptococcus agalactiae являлся патогенном, стимулирующим развитие ряда инфекционных заболеваний (менингита, пневмонии и т. п.) [27, 28], следовательно, штамм Streptococcus agalactiae в качестве пробиотика использоваться не может, вследствие исключен из дальнейшего исследования.
-
1.2 Результаты проверки пробиотических
свойств выделенных штаммов
-
1.2.1 Исследование антимикробной активности
выделенных штаммов
Полученные в ходе анализа результаты показали (таблица 2), что все исследуемые микроорганизмы, выделенные из ЖКТ человека, проявляли высокую антимикробную активность по отношению к используемым в опыте тест-культурам. К штамму Escherichia coli B-6954 наибольшую активность проявлял Bifidobacterium bifidum, к Bacillus fastidiosus B-5651 – Lactobacillus plantarum, к штамму Pseudomonas fluorescens B-3502 – Lactobacillus fermentum, к штамму Pseudomonas aeruginosa ATCC 9027 – Streptococcus thermophilus, к штамму Leuconostoc mesenteroides B-8404 – Streptococcus thermophiles, к штамму Candida albicans ATCC 885–653 и Staphylococcus aureus ATCC 25923 – Streptococcus salivarius.Исследо-вание устойчивости выделенных штаммов к действию антибиотиков.
Таблица 2.
Антимикробная активность выделенных чистых культур из ЖКТ человека
Table 2.
Antimicrobial activity of isolated pure cultures from the human gastrointestinal tract
|
Тест-культуры Test cultures |
,g и > |
1 £ и 5 4 |
I 3 |
1 £ 4 |
|||
|
Диаметр зон подавления роста тест-культур, мм Diameter of zones of suppression of growth of test cultures, mm |
|||||||
|
Escherichia coli B-6954 |
37,0±1,0 |
28,4±1,5 |
27,3±1,3 |
26,7±1,1 |
29,0±1,9 |
34,0±1,6 |
33,9±1,4 |
|
Bacillus fastidiosus B-5651 |
29,1±1,3 |
29,8±1,9 |
34,1±1,6 |
32,0±1,3 |
31,8±1,6 |
27,7±1,6 |
27,7±1,5 |
|
Pseudomonas fluorescens B-3502 |
33,0±1,5 |
34,2±1,1 |
32,8±1,5 |
31,7±1,2 |
33,4±1,5 |
29,6±1,4 |
25,3±1,3 |
|
Pseudomonas aeruginosa ATCC 9027 |
29,3±1,2 |
35,8±1,2 |
28,6±1,2 |
27,2±1,4 |
29,6±1,3 |
35,6±1,6 |
36,4±1,5 |
|
Leuconostoc mesenteroides B-8404 |
31,2±1,3 |
27,1±1,9 |
27,6±1,3 |
28,7±1,6 |
30,1±1,2 |
33,2±1,7 |
35,7±1,8 |
|
Candida albicans ATCC 885–653 |
33,5±1,6 |
30,0±1,6 |
29,0±1,4 |
30,0±1,8 |
35,2±1,5 |
36,4±1,5 |
34,2±1,7 |
|
Staphylococcus aureus ATCC 25923 |
37,2±1,2 |
32,2±1,8 |
33,9±1,7 |
31,8±1,5 |
30,6±1,2 |
37,9±1,1 |
32,2±1,6 |
Полученные в ходе исследования результаты (таблица 3) свидетельствовали о том, что выделенные из ЖКТ штаммы имели различную устойчивость к действию антибиотиков. Так, штаммы Bifidobacterium breve и Lactobacillus plantarum обладали устойчивостью к действию бензилпенициллина, Lactobacillus plantarum, Lactobacillus acidophilus, Lactobacillus fermentum – к действию стрептомицина. Штаммами с умеренной устойчивостью относились: Streptococcus salivarius – к действию бензилпенициллина; Lactobacillus plantarum, Lactobacillus acidophilus, Lactobacillus fermentum – к действию тетрациклина и гентамицина; Lactobacillus plantarum, Lactobacillus acidophilus – к действию канами-цина; Lactobacillus fermentum – к действию хлopaмфeникoла.
Таблица 3.
Антибиотикорезистентность выделенных чистых культур из ЖКТ
Table 3.
Antibiotic resistance of isolated pure cultures from the gastrointestinal tract
|
Антибиотик Antibiotic |
,g 1 -fe |
1 £ u 5 "§ к <1 |
I 3 |
1 £ <1 |
11 co "S |
||
|
Диаметр зон ингибирования роста, мм | Diameter of growth inhibition zones, mm |
|||||||
|
Бензилпенициллин Benzylpenicillin |
36,4±1,2 |
3,3±0,5 |
14,3±0,9 |
29,2±1,5 |
33,1±1,5 |
18,7±0,8 |
34,6±1,3 |
|
Стрептомицин Streptomycin |
33,3±1,7 |
28,1±1,3 |
7,5±0,5 |
7,7±0,6 |
10,8±1,0 |
35,1±1,9 |
33,1±1,5 |
|
Тетрациклин Tetracycline |
27,5±1,3 |
32,1±1,3 |
18,3±1,8 |
19,2±1,1 |
20,2±1,3 |
23,1±1,2 |
34,3±1,7 |
|
Ампициллин Ampicillin |
28,3 ±1,1 |
32,3±1,2 |
32,0±1,2 |
35,3±1,8 |
29,8±1,6 |
24,2±1,6 |
37,3±1,4 |
|
Канамицин Kanamycin |
25,1±1,9 |
27,9±1,8 |
15,2±1,6 |
15,2±0,7 |
23,9±1,6 |
31,1±152 |
32,3±1,9 |
|
Xлopaмфeникoл Chloropamfenikol |
22,8±1,3 |
29,1±1,2 |
31,2±1,9 |
36,1±1,2 |
19,9±1,8 |
27,3±1,6 |
30,9±1,9 |
|
Гентамицин Gentamicin |
35,5±1,6 |
33,4±1,6 |
19,2±1,1 |
18,3±1,8 |
17,9±1,9 |
32,4±1,6 |
30,1±1,2 |
-
1.2.2 Исследование антиоксидантной активности выделенных штаммов
Результаты исследования антиоксидантной активности свидетельствовали о том, что все исследуемые микроорганизмы проявляли способность нейтрализовать свободные радикалы
(таблица 4). Антиоксидантная активность зависела от фазы роста штаммов, так восстановление реагента DPPH более интенсивно при 2 ч культивирования, чем при 7 ч и 25 ч, то есть с увеличением продолжительности роста – снижалась антиоксидантная активность.
Таблица 4.
Оптическая плотность исследуемых супернатантов, полученных при культивировании штаммов
Table 4.
Optical density of the studied supernatants obtained by cultivating the strains
|
Образцы | Samples |
Оптическая плотность (при длине волны 517 нм) Optical density (at a wavelength of 517 nm) |
|||
|
2 ч | 2 h |
4 ч | 4 h |
7 ч | 7 h |
25 ч | 25 h |
|
|
DPPH |
1,78±0,09 |
1,78±0,09 |
1,78±0,09 |
1,78±0,09 |
|
Bifidobacterium bifidum |
1,05±0,06 |
1,07±0,06 |
1,10±0,07 |
1,13±0,08 |
|
Bifidobacterium breve |
1,05±0,07 |
1,08±0,06 |
1,11±0,07 |
1,13±0,08 |
|
Lactobacillus plantarum |
1,07±0,07 |
1,09±0,09 |
1,13±0,08 |
1,17±0,09 |
|
Lactobacillus acidophilus |
1,08±0,08 |
1,09±0,08 |
1,11±0,07 |
1,17±0,09 |
|
Lactobacillus fermentum |
1,09±0,07 |
1,08±0,06 |
1,14±0,09 |
1,18±0,07 |
|
Streptococcus salivarius |
1,10±0,06 |
1,12±0,07 |
1,16±0,08 |
1,19±0,05 |
|
Streptococcus thermophilus |
1,10±0,05 |
1,14±0,07 |
1,18±0,08 |
1,21±0,09 |
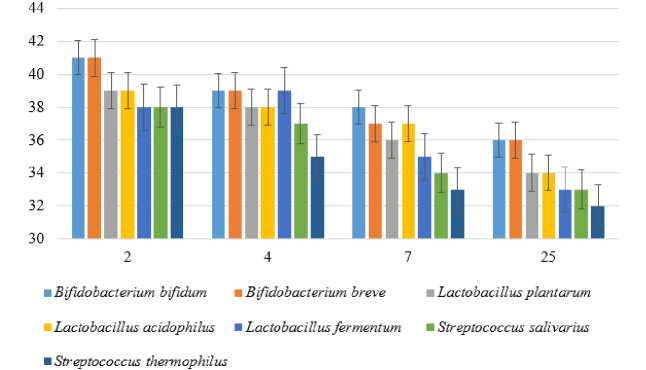
Рисунок 2. Антиоксидантная активность супернатанта штаммов, выделенных из ЖКТ человека
Figure 2. Antioxidant activity of the supernatant of strains isolated from the human gastrointestinal tract
-
1.2.3 Исследования противоопухолевых свойств штаммов, выделенных из ЖКТ
к различным типам раковых клеток. Наибольшей активностью обладали штаммы Bifidobacterium breve, Lactobacillus plantarum и Lactobacillus acidophilus .
Результаты исследования показали (таблица 5), что все исследуемые штаммы проявляли противоопухолевое действие по отношению
Таблица 5.
Противоопухолевое действие исследуемых штаммов различной концентрации на жизнеспособность ряда раковых клеток
Antitumor effect of the studied strains of various concentrations on a number of cancer cells
Table 5.
|
Концентрация микроорганизмов, КОЕ/мл | Concentration microorganisms, CFU/ml |
Клеточная линия | Cell line |
|||||
|
HepG2 |
ЛБР2 |
MDA-MB-231 |
MCF-7 |
U87 |
Panc-1 |
|
|
Количество жизнеспособных клеток, % | The number of viable cells, % |
||||||
|
Bifidobacterium bifidum |
||||||
|
105 |
98,3±0,9 |
87,2±1,6 |
79,1±1,1 |
92,2±1,2 |
90,3±1,5 |
80,3±1,3 |
|
107 |
58,1±0,8 |
43,5±1,7 |
39,2±1,3 |
50,3±1,8 |
52,8±1,6 |
38,9±1,1 |
|
Bifidobacterium breve |
||||||
|
105 |
63,2±0,5 |
63,9±0,9 |
55,2±0,2 |
65,2±0,4 |
71,2±1,1 |
58,2±1,6 |
|
107 |
32,6±0,7 |
33,2±0,2 |
29,1±0,5 |
34,2±0,6 |
39,2±1,2 |
30,2±1,1 |
|
Lactobacillus plantarum |
||||||
|
105 |
56,2±0,9 |
52,1±0,7 |
60,9±1,5 |
61,1±0,8 |
58,3±0,7 |
65,1±1,2 |
|
107 |
31,3±0,5 |
26,5±1,2 |
32,1±1,9 |
28,4±0,8 |
28,8±1,1 |
32,1±0,6 |
|
Lactobacillus acidophilus |
||||||
|
105 |
60,9±0,8 |
76,1±0,9 |
71,2±0,9 |
74,1±1,0 |
61,1±0,7 |
59,1±0,4 |
|
107 |
16,1±0,3 |
33,2±0,4 |
19,1±0,5 |
22,0±0,9 |
19,9±1,1 |
23,2±0,5 |
|
Lactobacillus fermentum |
||||||
|
105 |
87,1±1,2 |
99,1±1,2 |
68,2±0,8 |
78,1±1,2 |
87,2±1,6 |
91,9±1,4 |
|
107 |
36,3±0,6 |
50,9±0,9 |
33,4±1,1 |
35,4±0,9 |
45,3±0,7 |
49,3±0,5 |
|
Streptococcus salivarius |
||||||
|
105 |
81,1±1,3 |
92,9±1,4 |
75,2±1,1 |
83,9±1,0 |
77,2±1,3 |
73,2±1,2 |
|
107 |
42,1±0,7 |
50,1±0,8 |
38,5±0,5 |
45,0±0,2 |
36,1±0,4 |
40,0±0,2 |
|
Streptococcus thermophilus |
||||||
|
105 |
87,9±0,9 |
90,3±0,2 |
95,5±0,3 |
93,1±1,2 |
65,9±1,5 |
79,2±0,8 |
|
107 |
45,5±0,2 |
47,9±1,3 |
57,0±0,2 |
65,2±0,9 |
48,2±1,2 |
43,5±0,5 |
-
1.2.4 Исследования устойчивости выделенных штаммов к неблагоприятным условиям ЖКТ
Результаты исследования (таблица 6) свидетельствовали о том, что штаммы исследуемых культур не теряли свою жизнеспособность при воздействии сред с низкими значениями рН и желчи различной концентрации в течение 2 ч.
Таблица 6.
Устойчивость исследуемых штаммов к различным значениям рН желчи различной концентрации
Table 6.
Resistance of the studied strains to different pH values of bile of different concentrations
-
1.3 Результаты разработки консорциумов и
- изучения их пробиотических свойств
-
1.3.1 Анализ биосовместимости исследуемых
штаммов
Результаты исследования показали (таблица 7), что анализируемые микроорганизмы проявляли необходимые свойства для того, чтобы их можно было использовать в качестве пробиотиков. К тому же, наличие биосовместимости различных штаммов позволяло создавать на их основе пробиотические консорциумы, использование которых актуально для профилактики возникновения канцерогенеза.
Table 7.
|
Образцы | Samples |
Выживаемость клеток (%) при различном рН | Cell survival (%) at different pH |
|||||||||||
|
30 мин | 30 mins |
60 мин | 60 mins |
90 мин | 90 mins |
120 мин | 120 mins |
|||||||||
|
рН2 |
рН3 |
рН4 |
рН2 |
рН3 |
рН4 |
рН2 |
рН3 |
рН4 |
рН2 |
рН3 |
рН4 |
|
|
Bifidobacterium bifidum |
60,2 |
72,3 |
83,2 |
52,3 |
65,4 |
75,3 |
48,8 |
62,1 |
70,8 |
43,2 |
59,3 |
62,4 |
|
±0,2 |
±0,1 |
±0,5 |
±0,4 |
±0,3 |
±0,5 |
±0,3 |
±0,6 |
±0,2 |
4±30,,27 |
±0,7 |
±620,,49 |
|
|
Bifidobacterium breve |
71,2 ±0,8 |
86,4 ±0,3 |
98,2 ±0,2 |
65,0 ±0,9 |
81,6 ±0,2 |
90,9 ±0,4 |
60,8 ±0,1 |
74,9 ±0,3 |
85,8 ±0,3 |
55,1 ±1,1 |
64,9 ±0,2 |
79,8 ±0,5 |
|
Lactobacillus plantarum |
72,0 |
85,3 |
96,1 |
66,3 |
79,5 |
89,9 |
64,3 |
75,9 |
85,1 |
60,3 |
73,9 |
80,8 |
|
±0,2 |
±0,7 |
±0,3 |
±0,2 |
±0,6 |
±0,1 |
±640,,36 |
±0,1 |
±850,,16 |
±0,8 |
±0,3 |
±0,6 |
|
|
Lactobacillus acidophilus |
73,1 ±1,2 |
87,6 ±0,3 |
97,1 ±0,9 |
70,3 ±0,8 |
82,1 ±0,3 |
94,1 ±0,9 |
67,2 ±0,1 |
79,3 ±0,5 |
89,3 ±0,4 |
60,1 ±1,1 |
74,1 ±0,9 |
81,3 ±1,2 |
|
Lactobacillus fermentum |
70,2 |
80,4 |
92,2 |
65,3 |
69,1 |
75,9 |
89,9 |
63,9 |
85,8 |
55,1 |
64,9 |
79,8 |
|
±0,8 |
±0,5 |
±920,,22 |
±0,5 |
±0,8 |
±0,4 |
±0,2 |
±0,9 |
±0,3 |
±1,1 |
±0,2 |
±0,5 |
|
|
Streptococcus salivarius |
70,2 ±0,5 |
81,1 ±0,2 |
91,2 ±0,5 |
64,9 ±0,5 |
79,2 ±0,6 |
85,9 ±0,2 |
60,2 ±0,9 |
70,1 ±0,6 |
80,1 ±0,2 |
59,3 ±0,5 |
66,7 ±0,6 |
75,9 ±0,2 |
|
Streptococcus thermophilus |
75,1 |
88,2 |
93,9 |
72,1 |
85,3 |
89,9 |
68,1 |
70,9 |
82,4 |
65,3 |
70,1 |
75,9 |
|
±1,6 |
±0,8 |
±0,2 |
±0,2 |
±0,6 |
±0,2 |
±0,6 |
±0,1 |
±0,9 |
±0,9 |
±0,5 |
±1,3 |
|
|
Выживаемость клеток (%) при различной концентрации желчи | Cell survival (%) in the assimilation of bile |
||||||||||||
|
Образцы | Samples |
0,3% |
0,5% |
1,0% |
0,3% |
0,5% |
1,0% |
0,3% |
0,5% |
1,0% |
0,3% |
0,5% |
1,0% |
|
Bifidobacterium bifidum |
70,2 |
80,3 |
93,2 |
68,1 |
78,6 |
90,1 |
65,6 |
72,1 |
84,9 |
61,2 |
68,9 |
70,1 |
|
±0,3 |
±0,2 |
±0,5 |
±680,,16 |
±0,4 |
±0,1 |
±0,2 |
±0,3 |
±840,,96 |
±0,6 |
±0,1 |
±0,1 |
|
|
Bifidobacterium breve |
70,6 ±0,1 |
82,1 ±0,3 |
91,9 ±0,2 |
68,9 ±0,2 |
79,2 ±0,6 |
89,5 ±0,6 |
64,9 ±0,3 |
75,6 ±0,4 |
85,7 ±0,4 |
60,1 ±0,1 |
71,1 ±0,2 |
80,9 ±0,3 |
|
Lactobacillus plantarum |
73,4 |
87,1 |
97,2 |
70,1 |
84,1 |
95,3 |
67,9 |
80,2 |
90,5 |
63,2 |
78,3 |
86,9 |
|
±0,6 |
±0,2 |
±0,1 |
±0,3 |
±840,,12 |
±0,2 |
±0,1 |
±800,,26 |
±0,3 |
±0,1 |
±0,1 |
±0,1 |
|
|
Lactobacillus acidophilus |
70,6 ±0,6 |
85,2 ±0,1 |
93,1 ±0,2 |
68,9 ±0,1 |
80,1 ±0,1 |
90,2 ±0,1 |
62,1 ±0,3 |
78,1 ±0,1 |
89,1 ±0,3 |
60,1 ±0,1 |
74,3 ±0,2 |
84,9 ±1,0 |
|
Lactobacillus fermentum |
73,5 |
85,9 |
98,1 |
71,0 |
83,5 |
94,9 |
69,1 |
80,4 |
90,1 |
66,0 |
77,9 |
87,2 |
|
±0,2 |
±0,1 |
±1,1 |
±0,1 |
±0,1 |
±0,1 |
±0,2 |
±0,2 |
±0,1 |
±0,6 |
±0,2 |
±0,5 |
|
|
Streptococcus salivarius |
70,0 ±0,2 |
80,0 ±0,6 |
90,6 ±0,4 |
65,9 ±0,2 |
75,6 ±0,4 |
87,1 ±0,3 |
62,6 ±0,2 |
70,1 ±0,1 |
82,1 ±0,1 |
60,1 ±0,1 |
67,2 ±0,1 |
77,2 ±0,1 |
|
Streptococcus thermophilus |
70,6 |
82,6 |
93,0 |
69,1 |
80,1 |
89,9 |
65,9 |
68,1 |
78,9 |
63,4 |
67,1 |
74,9 |
|
±0,2 |
±0,2 |
±0,6 |
±0,5 |
±0,1 |
±0,9 |
±0,1 |
±0,1 |
±0,9 |
±0,5 |
±0,2 |
±0,2 |
|
|
Bifidobacterium bifidum |
70,2 |
80,3 |
93,2 |
68,1 |
78,6 |
90,1 |
65,6 |
72,1 |
84,9 |
61,2 |
68,9 |
70,1 |
|
±0,3 |
±0,2 |
±0,5 |
±680,,16 |
±0,4 |
±0,1 |
±0,2 |
±0,3 |
±840,,96 |
±0,6 |
±0,1 |
±0,1 |
|
Таблица 7.
Биосовместимость исследуемых штаммов, выделенных из ЖКТ человека
Biocompatibility of the studied strains isolated from the human gastrointestinal tract
|
Штамм | Strain |
О |
s 5 Ч О |
o' |
a g o' |
3 1 "q |
-5 |
|
|
B. bifidum |
+ |
+ |
+ |
+ |
± |
± |
|
|
B. breve |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
L. plantarum |
+ |
+ |
+ |
+ |
± |
± |
|
|
L.acidophilus |
+ |
+ |
+ |
± |
- |
- |
|
|
L. fermentum |
+ |
+ |
+ |
± |
+ |
+ |
|
|
S. salivarius |
± |
+ |
± |
- |
+ |
+ |
|
|
S. thermophilus |
± |
+ |
± |
- |
+ |
+ |
|
|
«+» – биосовместимы, «–» – бионесовместимы, «±» – слабый антагонизм, «-+» – сильный антагонизм | «+» – biocompatible, «-» – bio-incompatible, «±» – weak antagonism, «±» – strong antagonism |
|||||||
-
1.3.2 Разработка консорциума из выделенных штаммов
На основании данных о биосовместимости были выбраны консорциумы следующего состава:
-
• № 1: Bifidobacterium bifidum +
Bifidobacterium breve + Lactobacillus plantarum + Lactobacillus acidophilus (1:1:1:1);
-
• № 2: Bifidobacterium bifidum +
Bifidobacterium breve + Lactobacillus plantarum + Lactobacillus fermentum (1:1:1:1);
-
• № 3: Bifidobacterium breve + Lactobacillus
fermentum + Streptococcus salivarius (1:1:1);
-
• № 4: Bifidobacterium breve + Lactobacillus fermentum + Streptococcus thermophiles (1:1:1).
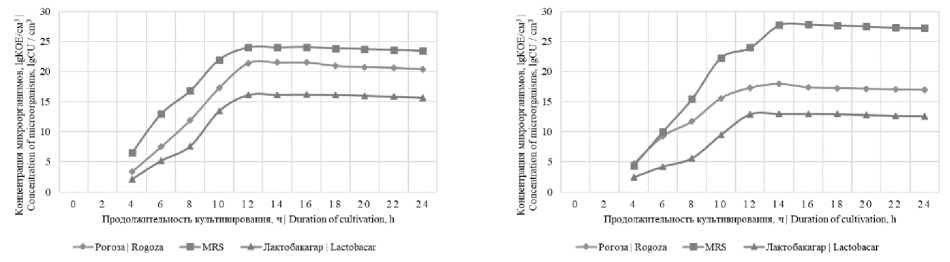
Осуществлялся подбор питательной среды для максимального накопления биомассы и дальнейшего хранения консорциумов путем исследования прироста биомасс ( рисунок 2). Результаты свидетельствовали о том, что наибольший прирост клеточной биомассы консорциумов № 1 и № 2 наблюдался на питательной среде Рогоза, а № 3 и № 4 на среде MRS, в результате данные среды целесообразно использовать и для дальнейшего хранения смеси штаммов.
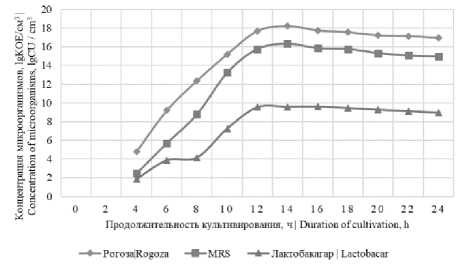
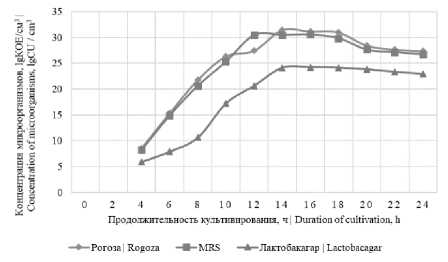
(a) (b)
(c)
(d)
Рисунок 2. Прирост биомассы консорциумов при культивировании на различных питательных средах: (a) культивирование консорциума № 1; (b) культивирование консорциума № 2; (c) культивирование консорциума № 3; (d) культивирование консорциума № 4
Figure 2. Increase in the biomass of consortia when cultivated on various nutrient media: (a) cultivation of consortium № 1; (b) cultivation of consortium № 2; (c) cultivation of consortium № 3; (d) cultivation of consortium № 4
Для того чтобы оценить пригодность выбранных консорциумов в качестве пробиотиков необходимо определить наличие антимикробной активности, устойчивости к действию антибиотиков, антиоксидантной активности, противоопухолевых свойств и устойчивости к действию желчи и кислот.
-
1.3.3 Определение пробиотических свойств консорциумов
-
1.3.3.1 Антимикробная активность консорциумов
Результаты исследования показали (таблица 8), что все исследуемые консорциумы проявляли высокую антимикробную активность по отношению к патогенным и условнопатогенным тест-культурам. Так, наибольшую активность к штаммам Escherichia coli B-6954, Pseudomonas aeruginosa ATCC 9027, Candida albicans ATCC 885–653 проявлял консорциум № 2, к штаммам Bacillus fastidiosus B-5651 и Leuconostoc mesenteroides B-8404 консорциум № 1, к штамму Pseudomonas fluorescens B-3502 консорциум № 3, к штамму Staphylococcus aureus ATCC 25923 консорциум № 4.
Таблица 8.
Антимикробная активность консорциумов
Table 8.
Antimicrobial activity of consortia
|
Тест-культуры Test cultures |
№ 1 |
№ 2 |
№ 3 |
№ 4 |
|
Диаметр зон подавления роста тест-культур, мм Diameter of zones of suppression of growth of test cultures, mm |
||||
|
Escherichia coli B-6954 |
38,2 ±1,2 |
38,7 ±1,9 |
24,4 ±1,1 |
26,8 ±1,3 |
|
Bacillus fastidiosus B-5651 |
33,1 ±1,3 |
32,5 ±1,2 |
30,1 ±1,1 |
31,4 ±1,2 |
|
Pseudomonas fluorescens B-3502 |
30,6 ±1,1 |
30,1 ±1,4 |
33,8 ±1,1 |
32,9 ±1,6 |
|
Pseudomonas aeruginosa ATCC 9027 |
28,1 ±1,3 |
32,4 ±1,1 |
27,5 ±1,4 |
27,9 ±1,3 |
|
Leuconostoc mesenteroides B-8404 |
35,3 ±1,2 |
34,8 ±1,1 |
35,2 ±1,8 |
30,7 ±1,2 |
|
Candida albicans ATCC 885–653 |
31,4 ±1,4 |
32,0 ±1,1 |
28,7 ±1,1 |
30,0 ±1,5 |
|
Staphylococcus aureus ATCC 25923 |
34,5 ±1,2 |
31,2 ±1,6 |
35,1 ±1,1 |
37,1 ±1,3 |
-
1.3.3.2 Антибиотикорезестентность консорциумов
Результаты анализа свидетельствовали о том (таблица 9), что консорциумы имели различную устойчивость к действию антибиотиков. Консорциум № 1 и № 2 чувствительны к действию ампициллина, но умерено устойчивы к действию всех других антибиотиков. Консорциум № 3 обладал умеренной устойчивостью к действию бензилпенициллина и тетрациклина, а консорциум № 4 только умеренную устойчивость к действию тетрациклина.
Таблица 9.
Антибиотикорезистентность консорциумов
Table 9.
Antibiotic resistance of consortia
|
Антибиотик Antibiotic |
№ 1 |
№ 2 |
№ 3 |
№ 4 |
|
Диаметр зон ингибирования роста, мм | Diameter of growth inhibition zones, mm |
||||
|
Бензилпенициллин Benzylpenicillin |
18,9 ±1,8 |
19,3 ±1,6 |
20,8 ±1,7 |
23,2 ±1,5 |
|
Стрептомицин Streptomycin |
20,8 ±1,1 |
20,1 ±1,7 |
27,1 ±0,5 |
25,7 ±0,7 |
|
Тетрациклин Tetracycline |
20,4 ±1,9 |
20,3 ±1,5 |
20,9 ±0,8 |
20,9 ±0,1 |
|
Ампициллин Ampicillin |
32,1 ±1,4 |
32,1 ±1,1 |
32,0 ±1,4 |
33,3 ±1,2 |
|
Канамицин Kanamycin |
20,9 ±0,1 |
20,3 ±1,5 |
24,1 ±1,8 |
27,1 ±1,1 |
|
Xлopaмфeникoл Chloropamfenikol |
20,8 ±1,4 |
20,9 ±0,2 |
21,2 ±1,6 |
22,3 ±1,4 |
|
Гентамицин Gentamicin |
20,1 ±1,7 |
20,0 ±1,4 |
21,1 ±0,9 |
23,1 ±1,1 |
-
1.3.3.3 Антиоксидантная активность консорциумов
Результаты свидетельствовали о том (таблица 10, рисунок 3), что все исследуемые консорциумы обладали антиоксидантной активностью.
Таблица 10.
Оптическая плотность исследуемых супернатантов Table 10.
Optical density of the studied supernatants
|
Образцы| Samples |
Оптическая плотность (при длине волны 517 нм) | Optical density (at a wavelength of 517 nm) |
|||
|
2 ч| 2 h |
4 ч| 4 h |
7 ч| 7 h |
25 ч| 25 h |
|
|
DPPH |
1,78± 0,09 |
1,78± 0,09 |
1,78± 0,09 |
1,78± 0,09 |
|
№ 1 |
1,13± 0,09 |
1,26± 0,10 |
1,40± 0,10 |
1,57± 0,29 |
|
№ 2 |
1,12 ±0,08 |
1,25± 0,08 |
1,38± 0,53 |
1,54± 0,21 |
|
№ 3 |
1,23± 0,12 |
1,31± 0,192 |
1,52± 0,39 |
1,72± 0,21 |
|
№ 4 |
1,25± 0,10 |
1,33± 0,12 |
1,55± 0,42 |
1,73± 0,19 |
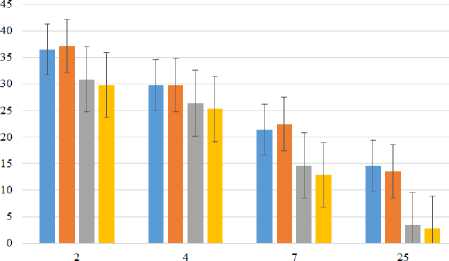
■ №1 "№2 "№3 №4
Рисунок 3. Антиоксидантная активность супернатанта консорциумов
Figure 3. Antioxidant activity of consortium supernatant
Результаты также показали, что с увеличением продолжительности роста – снижалась антиоксидантная активность. Наибольшей антиоксидантной активностью обладал консорциум № 1. 1.3.3.4 Противоопухолевые свойства консорциумов
По результатам исследования видно (таблица 11), что все исследуемые консорциумы проявляли противоопухолевое действие по отношению к раковым клеткам (HepG2, ЛБР2, MDA-MB-231, MCF-7, U87, Panc-1). Наибольшей активностью обладал консорциум № 4.
-
1.3.3.5 Устойчивость консорциумов к кислотам и желчи
Результаты свидетельствовали о том (таблица 12), что исследуемые консорциумы не теряли свою жизнеспособность при низких значениях рН и при воздействии желчи различной концентрации в течение 2 ч. Наибольшую устойчивость за рассматриваемый промежуток времени проявлял консорциум № 2
Таблица 11.
Противоопухолевое действие исследуемых консорциумов различной концентрации на жизнеспособность ряда раковых клеток
Table 11.
Antitumor effect of the studied consortia of various concentrations on a number of cancer cells
|
Концентрация микроорганизмов, КОЕ/мл | Concentration microorganisms, CFU/ml |
Клеточная линия |
| Cell line |
||||
|
HepG2 |
ЛБР2 |
MDA-MB-231 |
MCF-7 |
U87 |
Panc-1 |
|
|
Количество жизнеспособных клеток, % | The number of viable cells, % |
||||||
|
№ 1 |
||||||
|
10 5 |
64,3±1,4 |
79,4±1,8 |
73,5±1,7 |
77,2±2,1 |
63,4±1,4 |
61,4±1,8 |
|
10 7 |
16,5±1,0 |
34,7±1,5 |
19,4±1,1 |
22,3±1,6 |
20,8±1,2 |
25,3±1,3 |
|
№ 2 |
||||||
|
10 5 |
89,3±1,4 |
85,2±1,5 |
75,3±2,2 |
80,1±2,4 |
91,5±1,7 |
96,2±1,6 |
|
10 7 |
35,9±2,7 |
54,6±1,7 |
34,1±1,5 |
36,2±1,6 |
49,2±0,9 |
51,2±2,1 |
|
№ 3 |
||||||
|
10 5 |
64,5±1,1 |
85,4±1,1 |
70,2±1,2 |
71,3±2,3 |
60,1±1,5 |
62,5±1,2 |
|
10 7 |
14,3±1,7 |
37,2±1,6 |
25,2±2,1 |
21,5±1,7 |
21,3±1,4 |
23,2±1,1 |
|
№ 4 |
||||||
|
10 5 |
60,5±2,4 |
69,9±2,8 |
70,4±1,8 |
74,4±2,7 |
62,1±1,1 |
59,9±1,8 |
|
10 7 |
12,5±2,6 |
27,5±1,9 |
15,9±1,7 |
25,7±1,1 |
20,1±1,3 |
23,1±0,9 |
Таблица 12.
Устойчивость исследуемых консорциумов к рН и желчи Table 12.
Resistance of the studied consortia to pH and bile
|
Образцы Samples |
Выживаемость клеток (%) при различном рН | Cell survival (%) at different pH |
||||||||||||
|
30 мин | 30 mins |
60 мин |
30 мин | 30 mins |
120 мин | 120 mins |
||||||||||
|
рН2 |
рН3 |
рН4 |
рН2 |
рН3 |
рН4 |
рН2 |
рН3 |
рН4 |
рН2 |
рН3 |
рН4 |
||
|
№ 1 |
72,8 ±1,2 |
86,7 ±0,2 |
95,1 ±0,7 |
67,8 ±0,6 |
82,2 ±0,3 |
88,6 ±0,9 |
64,5 ±0,3 |
73,6 ±0,5 |
80,9 ±0,2 |
62,7 ±0,5 |
72,4 ±0,4 |
76,9 ±1,6 |
|
|
№ 2 |
68,2 ±0,8 |
82,1 ±0,1 |
92,8 ±0,2 |
62,5 ±0,5 |
76,4 ±0,3 |
85,2± 0,5 |
58,8 ±0,1 |
72,5 ±0,2 |
82,2 ±0,5 |
52,9 ±0,1 |
66,4 ±0,5 |
74,4 ±0,4 |
|
|
№ 3 |
70,6 ±0,2 |
79,3 ±0,5 |
95,6 ±0,2 |
64,1 ±0,7 |
75,5 ±0,2 |
83,4 ±0,3 |
75,8 ±0,3 |
74,9 ±0,1 |
83,4 ±0,3 |
65,1 ±0,1 |
64,9 ±0,3 |
73,2 ±0,9 |
|
|
№ 4 |
72,2 ±1,1 |
85,1 ±0,3 |
94,6 ±0,9 |
67,4 ±0,8 |
78,7 ±0,1 |
85,6 ±0,8 |
72,3 ±0,2 |
65,9 ±0,9 |
84,6 ±0,2 |
58,5 ±0,3 |
66,7 ±0,7 |
72,1 ±1,1 |
|
|
Выживаемость клеток (%) при различной концентрации |
желчи | Cell survival |
(%) in the assimilation of bile |
|||||||||||
|
Образцы Samples |
0,3% |
0,5% |
1,0% |
0,3% |
0,5% |
1,0% |
0,3% |
0,5% |
1,0% |
0,3% |
0,5% |
1,0% |
|
|
№ 1 |
70,4 ±0,1 |
81,4 ±0,5 |
94,3 ±0,4 |
69,2 ±0,1 |
78,9 ±0,2 |
93,2 ±0,4 |
66,1 ±0,3 |
75,1 ±0,8 |
89,1 ±0,1 |
61,3 ±0,4 |
71,0 ±0,9 |
83,1 ±0,9 |
|
|
№ 2 |
74,7 ±0,6 |
86,7 ±0,2 |
98,1 ±1,1 |
73,2 ±0,7 |
83,6 ±0,5 |
94,2 ±0,6 |
69,9 ±0,4 |
79,9 ±0,1 |
90,2 ±0,2 |
66,2 ±0,3 |
75,3 ±0,1 |
86,9 ±0,4 |
|
|
№ 3 |
72,8 ±0,3 |
83,2 ±0,4 |
94,2 ±0,4 |
69,3 ±0,5 |
80,1 ±0,1 |
90,8 ±0,6 |
65,4 ±0,5 |
77,1 ±0,6 |
87,3 ±0,1 |
62,5 ±0,5 |
71,2 ±0,4 |
82,3 ±0,5 |
|
|
№ 4 |
72,2 ±0,1 |
86,3 ±0,2 |
95,1 ±0,3 |
69,1 ±0,3 |
81,3 ±0,5 |
91,3 ±0,1 |
66,7 ±0,4 |
78,2 ±0,3 |
89,4 ±0,2 |
63,1 ±0,4 |
72,3 ±0,6 |
85,1 ±0,3 |
|
|
№ 1 |
70,4 ±0,1 |
81,4 ±0,5 |
94,3 ±0,4 |
69,2 ±0,1 |
78,9 ±0,2 |
93,2 ±0,4 |
66,1 ±0,3 |
75,1 ±0,8 |
89,1 ±0,1 |
61,3 ±0,4 |
71,0 ±0,9 |
83,1 ±0,9 |
|
|
Хранение консорциумов осуществлялось с помощью сублимационного высушивания по методике, описанной в материалах и методах. Обсуждение В ходе данной работы составлены консорциумы из штаммов, выделенных из ЖКТ здорового человека. Выделенные микроорганизмы были идентифицированы как Bifidobacterium bifidum, |
Bifidobacterium breve, Lactobacillus plantarum, Lactobacillus acidophilus, Lactobacillus fermentum, Streptococcus salivarius, Streptococcus thermophilus . Данные штаммы, как и консорциумы на их основе, обладали антимикробной, антиоксидантной активностью, проявляли противоопухолевое действие, устойчивость к действию антибиотиков и негативным условиям ЖКТ (к желчи и кислой среде). |
||||||||||||
По результатам литературного обзора установлено, что в основном учеными разрабатываются пробиотические консорциумы, в состав которых входят штаммы рода Lactobacillus [15, 16]. Авторами данной работы разработаны консорциумы, помимо Lactobacillus , включающие в себя штаммы рода Bifidobacterium и Streptococcus : №1 – B. bifidum , B. breve, L. plantarum, L. acidophilus , №2 – B. bifidum, B. breve, L. plantarum, L. fermen-tum , №3 – B. breve, L. fermentum, S. salivarius , №4 – B. breve, L. fermentum, S. thermophiles. Такие консорциумы проявляли более активные пробиотические свойства. Антимикробную активность к наибольшему количеству патогенных и условно-патогенных тест-культур проявлял консорциум № 2. Умеренную устойчивость к наибольшему числу антибиотиков проявляли консорциумы № 1 и № 2. Наибольшей антиоксидантной активностью обладал консорциум № 1. Наиболее выраженными противораковыми свойствами в концентрации 10 7 по отношению к клеткам HepG2, ЛБР2, MDA-MB-231, U87 и Panc-1 обладал консорциум № 4, а к MCF-7 – № 3. Наибольшую устойчивость к средам с низкой кислотностью и желчи проявлял консорциум № 2. Благодаря наличию таких свойств штаммы и консорциумы на их основе можно использовать в качестве пробиотиков для профилактики онкологических заболеваний.
Недостатком данной работы является отсутствие исследований качественного и количественного состава микробных метаболитов, а также клинических испытаний для подтверждения эффективности разработанных пробиотиков. Авторы данной работы планируют в дальнейшем устранить обозначенные ограничения, а также разработать рецептуру и технологическую схему функционального продукта питания на основе разработанных консорциумов.
Заключение
По данным ВОЗ онкологические заболевания занимают лидирующие позиции по смертности населения, в результате чего актуальна разработка профилактических мероприятий, антиканцерогенной направленности [29]. Систематическое употребление пробиотических средств, в виде биологически активных добавок и / или пробиотических, синбиотических продуктов питания – может является важной составляющей противораковой терапии, так как пробиотики участвуют в нормализации работы микрофлоры ЖКТ, функционирование которой напрямую влияет на состояние здоровья человека, на возникновение воспалительных, канцерогенных и прочих процессов.
В данной работе представлен алгоритм разработки индивидуального пробиотического консорциума, который включал в себя выделение и идентификацию микроорганизмов ЖКТ, проверку их пробиотических свойств, подбор соотношений штаммов консорциумов, проверку их активности. Данный алгоритм может в дальнейшем использоваться в качестве начального этапа для создания индивидуальных молочнокислых продуктов питания, имеющих противораковые свойства.
Список литературы Разработка пробиотического консорциума для людей с онкологическими заболеваниями
- Корниенко Е.А. Микробиота кишечника как ключевой фактор формирования иммунитета и толерантности. Возможности пробиотиков//Медицинский совет. 2020. № 10. С. 92-100. doi: 10.21518/2079-701Х-2020-10-92-100
- Badgeley A., Anwar H., Modi K., Murphy P., Lakshmikuttyamma A. Effect of probiotics and gut microbiota on anticancer drugs: Mechanistic perspectives // Reviews on Cancer. 2021. V. 1875. № 1. doi: 10.1016/j.bbcan.2020.188494
- Morkunas E., Skieceviciene J., Kupcinskas J. The impact of modulating the gastrointestinal microbiota in cancer patients //Best Practice & Research Clinical Gastroenterology. 2020. V. 48-49. P. 101700. doi: 10.1016/j.bpg.2020.101700
- Gori S., Inno A., Belluomini L., Bocus P. et al. Gut microbiota and cancer: How gut microbiota modulates activity, efficacy and toxicity of antitumoral therapy // Critical Reviews in Oncology/Hematology. 2019. V. 143. P. 139-147. doi: 10.1016/j.critrevonc.2019.09.003
- Малихова О.А., Карасев И.А., Давыдкина Т.С., Верещак В.В. и др. Кишечный микробиом и колоректальный рак. Обзор литературы // Поволжский онкологический вестник. 2019. Т. 10. № 4 (41). С. 45-51.
- Мулендеев С.В., Соловьёв И.А., Шостка К.Г., Арутюнян К.В. и др. Роль дисбиоза кишечника в этиологии и профиликтике колоректального рака // Профилактическая и клиническая медицина. 2017. № 4 (65). С. 55-60.
- Mego M., Holec V., Drgona L., Hainova K. et al . Probiotic bacteria in cancer patients un-dergoing chemotherapy and radiation therapy // Complementary Therapies in Medicine. 2013. V. 21. I. 6. P. 712-723. doi: 10.1016/j.ctim.2013.08.018
- Markowiak P., Slizewska K. Effects of Probiotics, Prebiotics, and Synbiotics on Human Health // Nutrients. 2017. № 9 (9). P. 1021. doi: 10.3390/nu9091021
- Домотенко Л.В., Шепелин А.П. Бифидум-среда для выделения и культивирования бифидобактерий // Инфекция и иммунитет. 2014. № 4(3). С. 279-283. doi: 10.15789/2220-7619-2014-3-279-283
- Домотенко Л.В., Шепелин А.П., Детушев К.В. Сравнительные испытания лактобакагара и MRS агара // Курский научно-практический вестник человек и его здоровье. 2014. № 4. С. 5-10.
- de Man J.C., Rogosa M., Sharpe M.E. A medium for the cultivation of lactobacilli // J Appl Bacteriol. 1960. № 23. P. 130-135.
- ГОСТ 10444.11-89 Продукты пищевые. Методы определения молочнокислых микроорганизмов. Продукты пищевые, консервы. Методы микробиологического анализа. М.: Стандартинформ, 2010.
- ГОСТ Р 56139-2014 Продукты пищевые специализированные и функциональные. Методы определения и подсчета пробиотических микроорганизмов (с Изменением № 1). М.: Стандартинформ, 2015. URL: http://docs.cntd.ru/document/1200115455
- Bergey's manual of systematic bacteriology. Second edition. Volume three. The Firmicutes - Springer Science+Business Media. 2009. P. 1422.
- Davoodabadi A., Dallal M.M., Foroushani A.R., Douraghi M. Harati F.A. Antibacterial activity of Lactobacillus spp. isolated from the feces of healthy infants against enteropathogenic bacteria // Anaerobe. 2015. № 34. Р. 53-58. doi: 10.1016/j.anaerobe.2015.04.014.
- Jomehzadeh N., Javaherizadeh H., Amin M., Saki M. et al. Isolation and identification of potential probiotic Lactobacillus species from feces of infants in southwest Iran // International Journal of Infectious Diseases. 2020. V. 96. P. 524530. doi: 10.1016/j.ijid.2020.05.034
- Yang Y., Babich O., Sukhikh S, Zimina M. et al. Antibiotic activity and resistance of lactic acid bacteria and other antagonistic bacteriocin-producing microorganisms // Foods and Raw Materials. 2020. V. 8. № 2. P. 377-384. doi: 10.21603/2308-4057-2020-2-377-384
- Hashemi S.M., Shahidi F., Mortazavi S.A., Milani E. et al. Potentially probiotic Lactobacillus strains from traditional Kurdish cheese //Probiotics Antimicrob Proteins. 2014. № 6. P. 22-31. doi: 10.1007/sl2602-014-9155-5
- Pyrzynska K., Pfkal A. Application of free radical diphenylpicrylhydrazyl (DPPH) to estimate the antioxidant capacity of food samples (Review) //Anal. Methods. 2013. № 5. P. 4288^1295. doi: 10.1039/C3AY40367J
- Карамовой Н.С., Хабибуллина Р.Э. Антирадикальные свойства Lactobacillus acidophilus n.v. Ep. 317/402 in vitro // Вестник Казанского технологического университета. 2013. № 23. С. 127-129. URL: https://www.elib-rary.ru/item.asp? id=20916564
- Мальцева Е.М., Егорова Н.О., Егорова И.Н., Мухамадияров Р.А. Антиоксидантная и антирадикальная активность in vitro экстрактов травы Sanguisorba officinalis L., собранной в различные фазы развития // МвК. 2017. Т. 16. № 2. С. 32-37.
- Бабич О.О., Асякина Л.К., Шишин М.В. Методика определения цитотоксических свойств микроорганизмов, выделенных из желудочно-кишечного тракта человека // Современная наука: тенденции развития. 2016. № 13. С. 146-150.
- Sharma A., Lavania M., Singh R., Lal B. Identification and probiotic potential of lactic acid bacteria from camel milk// Saudi Journal of Biological Sciences. 2020. doi: 10.1016/j.sjbs.2020.11.062
- Волкова Г.С., Куксова Е.В., Серба Е.М. Изучение биологических межштаммовых взаимодействий и ростовых свойств производственных штаммов молочнокислых бактерий // Актуальные вопросы молочной промышленности, межотраслевые технологии и системы управления качеством. 2020. Т. 1. № 1(1). С. 104-109.
- Нетрусов, А.И., Котова, И.Б. Микробиология. М.: ИЦ «Академия», 2012. 384 с.
- Пат. № 2200566, RU, A61K 35/74. Способ получения лактобактерина. Несчисляев В.А., Фадеева И.В. № 2001121098/14; Заявл. 26.07.2001; Опубл. 20.03.2003, Бюл" № 8.
- Paveenkittiporn W., Ungcharoen R., Kerdsin A. Streptococcus agalactiae infections and clinical relevance in adults, Thailand // Diagnostic Microbiology and Infectious Disease. 2020. V. 97. № 1. Р. 115005. doi: 10.1016/ j. diagmicrobio .2020.115005
- Fujita H., Nakamura I., Tsukimori A., Sato A. et al. Severe infective endocarditis in a healthy adult due to Streptococcus agalactiae // International Journal of Infectious Diseases. 2015. V. 38. P. 43-45. doi: 10.1016/j.ijid.2015.07.009


