Разработка специализированных функциональных продуктов питания человека на основе коктейля бактериофагов
Автор: Бурова Н.С.
Журнал: Биология в сельском хозяйстве @biology-in-agriculture
Рубрика: Современные аспекты производства продуктов питания
Статья в выпуске: 3 т.8, 2015 года.
Бесплатный доступ
Разработанный на основе научных исследований коктейль, состоящий из двух энтерококковых бактериофагов EF - 2, EF - 8, одного escherichia phage EC - 3, одного листериального фага LM - 7, параметров, необходимых для использования в качестве компонентов продуктов (высокая литическая активность, фиксированная диапазон политической активности), соответствует отдельной монофагии. Антагонистический эффект взаимодействия фагов отсутствует.
Короткий адрес: https://sciup.org/14770304
IDR: 14770304 | УДК: 579.678
Текст научной статьи Разработка специализированных функциональных продуктов питания человека на основе коктейля бактериофагов
Одна из категорий функциональных продуктов – это продукты для питания специального оздоровительного использования ( Food for Specific Health Use – FOSHU). Продукты, относимые к категории FOSHU, представляют собой продукты для питания с добавлением высокоэффективных ингредиентов, которые должны обеспечивать иммуномодулирующую поддержку организму, оказывать противовоспалительное действие, обладать бифидогенной и протеобиотической активностями.
В качестве активного начала в состав разрабатываемого специализированного продукта входят специфические бактериофаги (программа в рамках решения Ученого Совета Роспотребнадзора от 21 июня 2011 года).
Наличие специфических бактериофагов в составе продукта оздоровительного питания позволяет решить ряд задач:
-
- бактериофаги специализированного продукта, лизируя бактериальные инфекционные агенты желудочно-кишечного тракта, не подавляя рост пробиотических штаммов бифидобактерий, лактобацилл, E.coli и нормальной микрофлоры человека, позволят снизить нагрузку на иммунную систему человека, связанную с указанными органами;
-
- включение в программу медицинской реабилитации фагового коктейля позволит снизить количество пациентов с дисбактериозом кишечника второй и третьей степени, либо добиться полной нормализации показателей микробиоценоза за счёт элиминации патогенных микроорганизмов;
-
- при профилактическом режиме использования продукта на основе коктейля бактериофагов происходит 100% санация патогенных микроорганизмов, вызывающих воспалительные процессы и
- Designed on the basis of scientific studies cocktail consisting of two enterococcal bacteriophages EF - 2, EF - 8, one escherichia phage EC - 3, one listeria phage LM -7, the parameters necessary for use as components of products (high lytic activity, fixed range of political activity), corresponds to a separate monophagy. The antagonistic effect of the interaction of phages is lacking.
Цель
Разработка специализированного продукта для функционального питания человека на основе выделенных и изученных специфических бактериофагов. Задачи
-
1. Выделить, изучить биологические свойства и отобрать изоляты бактериофагов для создания специализированного продукта на основе коктейля бактериофагов.
-
2. Изучить бактериофаги по показателям химической и микробиологической безопасности.
-
3. Разработать состав фагового коктейля и соотношение компонентов специализированного продукта.
Материалы исследований
Питательные среды: мясопептонный бульон, мясопептонный агар (ГНЦ прикладной микробиологии, г. Оболенск).
Лабораторная посуда и оборудование: термостат ТС-80М-2, автоклав ГК-100-3, шкаф сушильностерилизационный ШСС-80п УХЛ 42, холодильник бытовой, дистиллятор, термометр ртутный, мерные цилиндры, флаконы, чашки Петри, пробирки, пипетки мерные, колбы, штативы, спиртовки.
Штаммы бактерий: объектами исследования являлись референс-штаммы бактерий видов Enterococcus faecalis , Escherichia coli , Listeria monocytogenes из музея кафедры микробиологии, вирусологии, эпизоотологии и ВСЭ Ульяновской ГСХА им. П.А. Столыпина.
Штаммы бактериофагов : объектами исследования являлись 2 изолята бактериофагов бактерий вида E . faecalis , 1 изолят бактериофага бактерий вида E . coli, 1 изолят бактериофага бактерий вида
L.monocytogenes , выделенные нами из объектов внешней среды.
Методы исследований
Выделение и изучение биологических свойств бактериофагов проводили по методам, предложенным Д.А. Васильевым, С.Н. Золотухиным [ 1 ], Э. Каттер, А. Сулаквелидзе [3] , Е.Н. Ковалевой [2, 4, 5] , m.r.j. c lokie , a.m. k ropinski [6] .
Последовательность исследований и обсуждение их результатов
Выделение, изучение биологических свойств и селекция бактериофагов
Первым этапом наших исследований стало выделение бактериофагов бактерий видов E . faecalis , E . coli, L.monocytogenes из объектов внешней среды. Всего исследована 31 проба объектов внешней среды.
Исследуемый материал объёмом 10 мл засевали в колбу с мясопептонным бульоном в объёме 50 мл, внося при этом по 1 мл 18-часовых бульонных культур изучаемых бактерий. Посевы инкубировали при температуре 37°С в течение 18-24 часов. После инкубации из колбы брали 10 мл жидкости и помешали в стерильную пробирку.
Затем, с целью инактивации посторонней микрофлоры, материал обрабатывали хлороформом (1:10) и центрифугировали в течение 30 мин при 700 g. Полученный надосадок исследовали методом агаровых слоев на присутствие бактериофага, гомологичного энтерококкам / эшерихиям / листериям.
Для этого мясопептонный 1,5% агар разливали в чашки Петри в количестве 25-30 мл (первый слой). После застывания среды чашки ставили на 1,5-2,0 часа для подсыхания. В пробирку с 2,5 мл 0,7% расплавленного и остуженного до температуры 45°С агара вносили 1 мл исследуемого фильтрата и 0,2 мл 18-часовой бульонной культуры референс-штамма бактерий изучаемых видов. Содержимое пробирок быстро перемешивали, чтобы не произошло застывания агара, и выливали в ту же чашку вторым слоем. После того, как агар принимал плотную консистенцию, посевы ставили в термостат при 37°С.
Контролем служила индикаторная культура референс-штамма изучаемых бактерий, засеянная методом агаровых слоев с 1 мл стерильного мясопептонного бульона.
Учёт результатов проводили через 12-18 часов инкубирования при температуре 37°С. Присутствие бактериофага определяли по наличию прозрачных пятен, хорошо видимых на матовом фоне глубинного роста бактерий (см. рис. 1, 2).

Рис. 1. Негативные колонии выделенного бактериофага (метод агаровых слоев)
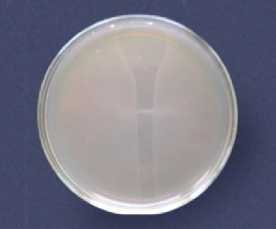
Рис. 2. Зона лизиса на фоне роста бактериальной культуры (spot-тест)
В случае положительного результата негативные колонии или участок лизиса пересевали с помощью бактериологической петли в мясопептонный бульон с индикаторной культурой. Для этого в две пробирки с 4,5 мл мясопептонного бульона добавляли стерильной пипеткой 0,2 мл 18-часовой бульонной индикаторной культуры, в одну из которых пересевали негативную колонию, вторая пробирка служила контролем.
Посевы инкубировали при температуре 37°С в течение 4-6 часов или 11-12 часов при комнатной температуре. Определяющим моментом являлось просветление бульона в опытной пробирке и выраженного помутнения среды в контроле (см. рис. 3, 4).

Рис. 3. Опытные пробирки до инкубирования

Рис. 4. Опытные пробирки после 6 часов инкубирования при температуре 37°С
После этого с целью инактивации микрофлоры содержимое опытной пробирки обрабатывали хлороформом (1:10) в течение 30 мин. Полученный фаголизат использовали для проведения пассирования фага.
Повышение литической активности фагов проводили пассивированием на индикаторных культурах с периодическим пересевом типичных для данного изолята негативных колоний.
По этой методике выделенные клоны фага пассировали 7-10 раз до получения популяции фагов с однородными негативными колониями.
В результате проведенных исследований выделено 2 изолята бактериофагов бактерий вида E . faecalis , 1 изолят бактериофага бактерий вида E . coli, 1 изолят бактериофага бактерий вида L. monocytogenes .
Исследование бактериофагов по показателям химической и микробиологической безопасности
Из полученного объема фаголизатов отбирали пробу каждого фага по 5 мл для определения чистоты физических свойств, титра фага по отношению к эталонной культуре.
Для определения внешнего вида, цвета, наличия хлопьев, пленок, механических примесей каждый флакон с фагом просматривали визуально в проходящем свете. Индикаторные фаги не содержали посторонних примесей, фаголизаты были про- зрачными, светло-желтого цвета.
Для проверки на контаминацию каждый фаг в количестве 0,2 мл высевали в пробирки с 5 мл и во флаконы с 50 мл мясопептонного бульона, со средой Китта-Тароцци, Сабуро. Посевы проводили в 2 пробирки и 2 флакона с каждой средой из каждого образца. Пробирки с засеянной средой Сабуро культивировались при 20-24°С. Посевы на других средах культивировали при температуре 37°С. Через двое суток из жидких сред материал пересевали на мясопептонный агар, в мясопептонный бульон, среду Китта-Тароцци, по две пробирки и во флаконы с мясопептонным бульоном, со средой Китта-Тароцци. Первичные посевы выдерживали в термостате 10 суток, а вторичные – 8 суток. На питательных средах с посевами рост бактериальной и грибной микрофлоры отсутствовал.
Литическую активность изучаемых бактериофагов определяли методами Аппельмана (метод серийных разведений в жидких питательных средах) и Грациа (метод агаровых слоев на плотных питательных средах).
Литическая активность фагов составляла от 10-8 до 10-10по методу Аппельмана и от 4 х 108 до 2 х 1010 по методу Грациа (см. табл. 1).
Все изоляты бактериофагов обладали литической активностью, достаточной для использования их в качестве биологических препаратов.
Таблица 1 – Литическая активность изучаемых бактериофагов
|
Бактериофаги |
Литическая активность |
|
|
по методу Аппельмана (степень разведения) |
по методу Грациа (количество корпускул в 1 мл) |
|
|
EF – 2 |
10-9 |
7 х 109 |
|
EF – 8 |
10-9 |
3 х 109 |
|
EC – 3 |
10-10 |
2 х 1010 |
|
LM – 7 |
10-8 |
4 х 108 |
Разработка фагового коктейля и соотношения компонентов специализированного продукта.
Для конструирования биопрепарата предложена схема совместного применения изученных фагов. Необходимым условием использования смеси фагов является отсутствие антагонистического эффекта при их взаимодействии.
При исследовании литической активности бактериофагов и их смеси в равном объёме по методам Ап-пельмана и Грациа выявили активность смеси четырех бактериофагов (соотношение 1:1) на уровне не ниже активности исходных монофагов – 3х108 (см. табл. 2).
Таблица 2 – Литическая активность изучаемых бактериофагов и их смеси
|
Бактериофаги |
Литическая активность |
|
|
по методу Аппельмана (степень разведения) |
по методу Грациа (количество корпускул в 1 мл) |
|
|
EF – 2 |
10-9 |
8 х 109 |
|
EF – 8 |
10-9 |
3 х 109 |
|
EC – 3 |
10-10 |
1 х 1010 |
|
LM – 7 |
10-8 |
3 х 108 |
|
Смесь фагов (1:1) |
10-8 |
3 х 108 |
Таким образом, установлено, что сконструированный нами коктейль, состоящий их двух энтерокок-ковых бактериофагов EF – 2, EF – 8, одного эшерихи-озного EC – 3, одного листериозного LM – 7, по параметрам, необходимым для использования в каче- стве составных частей специализированного продукта (высокая литическая активность, фиксированный диапазон литической активности) соответствует отдельным монофагам. Антагонистический эффект при взаимодействии фагов отсутствует.
Список литературы Разработка специализированных функциональных продуктов питания человека на основе коктейля бактериофагов
- Бактериофаги микроорганизмов значимых для животных, растений и человека. Научное издание/Д.А. Васильев ; под. ред. Васильева Д.А., Золотухина С.Н. -Ульяновск, НИИЦМиБ, 2013. -316 с.
- Выделение и характеристика бактериофагов Listeria monocytogenes/Е.Н. Ковалева //Материалы Международной научно-практической конференции «Бактериофаги: теоретические и практические аспекты применения в медицине, ветеринарии и пищевой промышленности». -Ульяновск: УГСХА им. П.А. Столыпина, 2013, т. II. -С. 130 -133.
- Каттер, Э. Бактериофаги: биология и практическое применение/Э. Каттер, А. Сулаквелидзе; пер. с англ.: коллектив пер.; науч. ред. рус. изд. А.В. Летаров. -Москва: Научный мир, 2012. -636 с.
- Ковалева, Е.Н. Биопрепарат энтерококковых бактериофагов/Е.Н. Ковалева//Материалы международной научно-практической конференции молодых ученых «Роль молодых ученых в развитии АПК». -М., 2011. -С. 165 -169.
- Ковалева, Е.Н. Разработка биопрепарата на основе энтерококковых фагов для детекции Enterococcus faecalis/Е.Н. Ковалева, Д.А. Васильев, С.Н. Золотухин//Материалы Международной научно-практической конференции «Бактериофаги: теоретические и практические аспекты применения в медицине, ветеринарии и пищевой промышленности». -Ульяновск: УГСХА им. П.А. Столыпина, 2013, т. II. -С. 133 -136.
- Clokie, M.R.J. Bacteriophages: methods and protocols, volume 1: isolation, characterization, and interactions/M.R.J. Clokie, A.M. Kropinski, 2009, Humana Press, 301 p.


