Разработка способа индикации и идентификации Vibrio parahaemolyticus с помощью real-time ПЦР
Автор: Полеева Марина Владимировна, Чемисова Ольга Сергеевна, Трухачев Алексей Леонидович
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2019 года.
Бесплатный доступ
Бактерии Vibrio parahaemolyticus могут быть причиной возникновения острого кишечного заболевания у людей, протекающего по типу пищевой токсикоинфекции. Успех лечебно-профилактических и санитарно-противоэпидемических мероприятий, направленных на предотвращение распространения «галофилезов», во многом зависит от своевременной точной идентификации штаммов вибрионов, выделяемых от больных, из морепродуктов и при мониторинге объектов окружающей среды. Представлена разработка способа идентификации штаммов вида V. parahaemolyticus методом ПЦР в режиме «реального времени» (Real-Time PCR), который включает выделение хромосомной ДНК из исследуемого материала, постановку ПЦР со сконструированными нами праймерами, специфичными к участку гена коллагеназы vppC, и зондом, позволяющим детектировать амплифицированный фрагмент и проводить учет полученных результатов в режиме реального времени. Показана возможность индикации и идентификации микроорганизмов вида V. parahaemolyticus при исследовании проб биологического материала (рыба, морепродукты) на основе метода Real-Time PCR.
Праймеры, металлопротеаза (коллагеназа)
Короткий адрес: https://sciup.org/147227079
IDR: 147227079 | УДК: 579.843:57.083.18:576.3:616-078 | DOI: 10.17072/1994-9952-2019-2-175-181
Текст научной статьи Разработка способа индикации и идентификации Vibrio parahaemolyticus с помощью real-time ПЦР
Vibrio parahaemolyticus – грамотрицательная галофильная бактерия, встречающаяся в природе в морских и эстуарных водах и часто изолируемая из различных морепродуктов – устриц, креветок, крабов, лобстеров, омаров, раков, рыбы (треска, сардина, скумбрия, камбала), осьминогов, гребешков и замороженных морепродуктов во многих странах мира [Spanggaard et al., 2000; Hara-Kudo et al., 2001; Deepanjali et al., 2005]. Этот возбудитель вызывает заболевание по типу острого гастроэнтерита, характеризующегося тошнотой, рвотой, спаз- мами в животе, диареей [Chakraborty, Nair, Shinoda, 1997; Daniels et al., 2000]. Выявлена взаимосвязь обсемененности вибриофлорой воды и рыбы с заболеваемостью людей. Заражение людей происходит при употреблении в пищу некачественно приготовленных продуктов моря. Так, установлено, что последние годы в Астраханской обл. острые кишечные инфекции, обусловленные вибрионами, составляют около 14% всех диарей. В районах промысла дельты р. Волги различные вибрионы были выделены из судака, осетра, белуги, стерляди. Заболевания, вызываемые парагемоли-тическими вибрионами и связанные с употребле-
нием в пищу морепродуктов, регистрируются на побережье Черного и Азовского морей [Домниц-кий, 2016]. В 2012 г. была зарегистрирована вспышка пищевой токсикоинфекции, вызванной V. parahaemolyticus в Хасанском р-не Приморского края.
Успех лечебно-профилактических и санитарноэпидемиологических мероприятий, направленных на предотвращение распространения «галофиле-зов», во многом зависит от своевременной точной идентификации штаммов вибрионов, выделяемых от больных, из морепродуктов, а также при мониторинге объектов окружающей среды.
В настоящее время существует большое количество микробиологических методов детекции, основанных на культивировании, выделении чистых культур и биохимической идентификации этих вибрионов [Лабораторная …, 2004]. Сложность идентификации и дифференциации парагемолити-ческих от других близкородственных видов вибрионов традиционными методами обусловлена их большим фенотипическим сходством, вариабельностью признаков и, как следствие, небольшой относительной диагностической ценностью отдельных таксономических тестов.
Молекулярно-генетические методы находят широкое применение, как для идентификации культивируемых микроорганизмов, так и для детекции специфических групп бактерий. Для быстрой идентификации V. parahaemolyticus успешно применяется метод MALDI-ToF масс-спектрометрии; однако, не все лаборатории оснащены необходимым оборудованием [Чемисова и др., 2013; Полеева, Чемисова, 2018].
Методы диагностики бактериальных инфекций на основе видоспецифичной полимеразной цепной реакции (ПЦР-диагностика) показали свое преимущество перед классическими микробиологическими методами [Белькова, Дзюба, Суханова, 2009] и могут стать основой молекулярногенетического мониторинга ассоциированной микрофлоры водных организмов. Они требуют меньшего времени и эффективны в детекции конкретных патогенов на всех стадиях заболевания. ПЦР-диагностика позволяет корректно идентифицировать микроорганизмы, культивирование и определение которых по классическим биохимическим тестам затруднительно. Эти методы активно используются в странах с развитой аквакультурой, постоянно совершенствуются и развиваются [Buller, 2004; Белькова и др., 2010].
В последние годы широкое распространение получил метод идентификации микроорганизмов с помощью полимеразной цепной реакции с детекцией продуктов амплификации в режиме реального времени (Real-Time PCR), преимуществами которого являются объединение этапов амплифика- ции и детекции, что упрощает процедуру анализа, снижает риск контаминации, позволяет проводить количественный учет результатов, обеспечивает высокую специфичность и чувствительность анализа [Ребриков и др., 2009].
Ранее зарубежными авторами, были выявлены видоспецифичные для V. parahaemolyticus участки ДНК и разработаны методы идентификации с помощью ПЦР с электрофоретическим способом учета результатов [Di Pinto, Ciccarese, Tantillo, 2005; Luan et al., 2007; Reham, Amani, 2012; Li et al., 2016]. Однако учет результатов реакции с помощью электрофореза требует дополнительного времени, организации отдельной рабочей зоны в связи с повышенным риском контаминации. Эти обстоятельства усложняют использование метода ПЦР с учетом результатов с помощью электрофореза в геле. Метод Real-Time ПЦР лишен этих недостатков. На сегодняшний день в Российской Федерации отсутствуют зарегистрированные олигонукле-отидные праймеры и зонды для видовой идентификации вида V. parahaemolyticus , а существующие зарубежные тест-системы являются дорогостоящими для широкого применения в лабораторной практике.
Цель данной работы – разработка способа индикации и идентификации микроорганизмов вида V. parahaemolyticus при исследовании проб биологического материала (рыба, морепродукты) на основе метода полимеразной цепной реакции с детекцией продуктов амплификации в режиме реального времени (Real-Time PCR).
Материалы и методы исследования
В работе были использованы штаммы V. parahaemolyticus (100 штаммов) из коллекции Музея живых культур ФКУЗ Ростовского-на-Дону противочумного института Роспотребнадзора, а также коллекционные штаммы других видов рода Vibrio – V. alginolyticus (25 штаммов), V. fluvialis (10 штаммов), V. hollisae (5 штаммов), V. vulnificus (10 штаммов), V. harvey (5 штаммов), V. mimicus (5 штаммов), V. furnisii (5 штаммов) и V. fortis (2 штамма).
Для анализа нуклеотидной последовательности ДНК V. parahaemolyticus была использована база данных GeneBank. Для поиска уникальных последовательностей специфического гена были использованы ресурсы GeneBank-on-line Blast. Для конструирования праймеров и зонда было применено программное обеспечение PrimerM (ФКУЗ Ростов-ский-на-Дону противочумный институт Роспотребнадзора) и BLAST NCBI.
Синтез сконструированных нами праймеров и зонда был осуществлен компанией «Синтол» (г. Москва). Для проведения амплификации использована коммерческая стандартизированная реак- ционная смесь для проведения ПЦР в режиме «реального времени» компании «Синтол» (г. Москва). Амплификацию и флуоресцентную детекцию проводили на автоматическом детектирующем термоциклере «ДТ-Lite» (ДНК-технология, Россия), в режиме «реального времени».
Подготовка материала для исследования
-
1. Штаммы микроорганизмов. Суточные агаровые культуры суспендировали в дистиллированной воде до 1×109 микробных клеток в 1 мл (м. кл./мл) и обеззараживали прогреванием при 100ºС в течение 30 мин., согласно МУ 1.3.2569-09 [МУ 1.3.2569-09, 2010]. Затем дебрис осаждали центрифугированием при 10 тыс. об/мин в течение 5 мин. и использовали супернатанты в качестве ДНК-матриц при ПЦР.
-
2. Образцы тканей рыбы (судака), искусственно контаминированной бактериями V. parahaemoly-ticus . В исследование брали кусочки кожи с чешуей и мышцами. Навеску массой 1 г измельчали и тщательно растирали в стерильной ступке с 2–3 г стерильного кварцевого песка. Добавляли 10 мл забуференного физиологического раствора, тщательно перемешивали. Затем к гомогенату добавляли 0.1мл микробной взвеси V. parahaemolyticus , содержащей 109–103 м. кл./мл согласно стандарту мутности ГИСК им. Тарасевича. Тщательно перемешивали и давали отстояться приготовленной смеси 20 мин. при комнатной температуре. Затем через стерильный тампон отбирали пробу (надосадочную жидкость) объемом 0.5 мл и использовали в качестве ДНК-матриц при ПЦР.
-
3. При использовании бактериальных взвесей с концентрацией 104–101 м. кл./мл проводили дополнительное обогащение в 1%-ной пептонной воде с 2%-ным NaCl в течение 8 ч. Контроль количества клеток проводили бактериологическим высевом на плотную питательную среду с последующим подсчетом колоний. ПЦР ставили через 2, 4,
-
6, 8 ч. выращивания в среде обогащения.
Выделение ДНК проводили с помощью комплекта реагентов для экстракции ДНК из клинического материала «АмплиПрайм ДНК-сорб-В», согласно прилагаемой инструкции. В качестве контроля реакции использовали бактериальные взвеси в концентрации 109–103 м. кл./мл согласно стандарту мутности ГИСК им. Тарасевича.
Приготовление реакционной смеси для ПЦР . Реакцию проводили в 25 мкл смеси, содержащей: буферный раствор для ПЦР в реальном времени; 0.25 мМ каждого из дезоксинуклеозидтрифосфатов; 1 ед. Taq-полимеразы с функцией «горячего старта»; 2.5 мМ хлористого магния; 50 пкМ каждого праймера; 50 пкМ зонда и 20 нг хромосомной ДНК одного из исследуемых образцов.
Амплификация . Постановку реакции амплификации в автоматическом детектирующем ам-плификаторе ДТ-Lite (ДНК-технология, Россия), в котором были заданы следующие условия: первичной денатурации и активация Taq-полимеразы (94°С, 15 мин.), 35 циклов, включающих этапы 94°С, 30 с.; 55°С, 30 с. (детекция) и 72°С, 30 с.
Детекция флуоресценции производится автоматически в ходе проведения ПЦР с помощью детектирующего амплификатора. При наличии в исследуемой пробе ДНК гена металлопротеазы (коллагеназы) вида V. parahaemolyticus с помощью используемой пары специфических праймеров гибридизируется зонд, так как является комплементарным ему (фрагменту), а последующее разрушение зонда Taq-полимеразой приводит к началу флуоресцентного свечения флуорофора ROX с длиной волны 605 нм, которое регистрируется прибором. Учет детекции флуоресцентного свечения по соответствующей длине волны в амплифи-каторе отражается на мониторе компьютера, связанного с прибором, в виде графиков, на которых представлены кривые и численные значения, отражающие уровни флуоресцентного свечения определенной длинны волны, соответствующие каждой пробе, взятой для исследования.
Результаты и их обсуждение
С помощью программного обеспечения PrimerM (ФКУЗ Ростовский-на-Дону противочумный институт Роспотребнадзора) и BLAST NCBI был проанализирован участок гена металлопротеа-зы (коллагеназы), в результате чего определен специфический фрагмент гена, который был использован в качестве мишени для конструирования специфического зонда, комплементарного соответствующей последовательности ДНК. Зонд имел следующую структуру: vppCProbaA (ROX-CG-TTC-ACA-ACC-ACC-AAC-AGC-AAC-GAC-TTG-BHQ2). Зонд комплементарен специфическим продуктам ПЦР, гибридизуясь с ними и впоследствии разрушаясь под воздействием ДНК-полимеразы во время ферментативной реакации, что приводит к началу флуоресцентного свечения флуорофора, связанного с зондом. Данный специфический зонд vppCProbaA содержит в своем составе флуоресцентную метку ROX, гаситель флуоресценции BHQ2.
Для амплификации в ПЦР фрагмента ДНК, содержащего мишень для зонда и в соответствии с нуклеотидной последовательностью зонда, были сконструированы и синтезированы специфичные для вида V. parahaemolyticus праймеры:
– праймер vppCFor (CGG-CAA-GCG-TGG-TTT-GTG-AC);
– праймер vppCRev (CGT-TGA-TGC-AAC-TTG-CAC-CTT-G).
Был получен патент на изобретение «Способ идентификации штаммов вида Vibrio parahaemolyticus методом ПЦР в режиме реального времени № 2644232 от 8 февр.2018 г.
При апробации предложенного способа на коллекционных штаммах V. parahaemolyticus с точно установленной видовой принадлежностью и штаммах видов V. alginolyticus , V. fluvialis , V. hollisae , V. vulnificus , V. harvey , V. mimicus , V. furnisii и V. fortis , разработанные праймеры и зонд показали 100%-ную специфичность по отношению к штаммам V. parahaemolyticus (таблица).
Результаты идентификации клинических штаммов V. parahaemolyticus методом Real-Time ПЦР
|
Вид микроорганизма |
Число ис-следованных штаммов |
Результаты ПЦР |
|
|
число положи-тельных проб |
число от-рица-тельных проб |
||
|
V. parahaemolyticus |
100 |
100 |
0 |
|
V. alginolyticus |
25 |
0 |
25 |
|
V. fluvialis |
10 |
0 |
10 |
|
V. hollisae |
5 |
0 |
5 |
|
V. vulnificus |
10 |
0 |
10 |
|
V. harvey |
5 |
0 |
5 |
|
V. mimicus |
5 |
0 |
5 |
|
V. furnisii |
5 |
0 |
5 |
|
V. fortis |
2 |
0 |
2 |
Флуоресцентный сигнал с длиной волны 605 нм, характерной для флуорофора Rox, детектировался в ПЦР выше порогового значения тогда, когда пробы содержали ДНК парагемолитических вибрионов, и не детектировался в случае содержания в пробах ДНК других представителей рода Vibrio (таблица). При исследовании чистых культур бактериальных суспензий положительный результат нами наблюдался при концентрации клеток 109–105 м. кл./мл. При этом наблюдалась зависимость количества клеток и номера цикла (начала реакции): 15-й цикл при 109 м. кл./мл и 29-й при 105 м. кл./мл. (рисунок).
Таким образом, в результате проведенной нами работы были сконструированы специфичные праймеры и зонд к ДНК гена металлопротеазы (коллагеназы) V. parahaemolyticus . Были подобраны оптимальные условия проведения полимеразной цепной реакции с выбранной парой праймеров и флуоресцентным зондом в режиме «реального времени». Использование предполагаемого способа выявления специфического участка ДНК гена металлопротеазы (коллагеназы) V. parahae-molyticus с помощью ПЦР в режиме «реального времени» позволит быстро, точно и эффективно проводить идентификацию представителей вида V.
parahaemolyticus и дифференцировать их от близкородственных видов.
Следующим этапом нашей работы было определение возможности использования сконструированных нами праймеров для индикации штаммов V. parahaemolyticus в биологическом материале. Для этого использовали пробы рыбы, искусственно контаминированные бактериями V. parahae-molyticus. В результате наблюдали наличие флуоресценции по каналу ROX в пробах, содержащих (с учетом разведений) 107–105 м. кл./мл. При этом реакция начиналась позже, чем при постановке ее с чистой культурой микроорганизмов: 107 – 27-й цикл, 105 – 31-й цикл (рисунок).
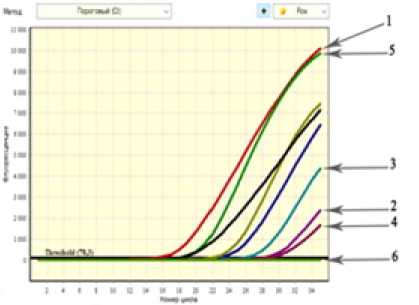
Зависимость флуоресценции канала ROX и номера цикла от состава пробы:
-
1 – концентрация клеток чистой культуры V. para-haemolyticus 109 м. кл./мл; 2 – концентрация клеток чистой культуры V. parahaemolyticus 105 м. кл./мл; 3 – концентрация клеток V. parahaemolyticus в контаминированной пробе рыбы, 107 м. кл./мл; 4 – концентрация клеток V. parahaemolyticus в контаминированной пробе рыбы, 105 м. кл./мл; 5 – положительный контроль; 6 – отрицательный контроль
Проведенные нами исследования показали возможность использования полученных праймеров, специфичных последовательности генов металло-протеазы (коллагеназы) – vppC V. parahae-molyticus, для индикации парагемолитических вибрионов в зараженных пробах рыбы. Чувствительность реакции составила 105 м. кл. в 1 г зараженного продукта.
При изучении возможности использования среды обогащения (1%-ная пептонная вода с 2%-ным NaCl) для накопления культуры в пробах, содержащих V. parahaemolyticus в количестве 101–104 м. кл./мл было показано, что после «подращивания» проб, изначально содержащих 104 м. кл./мл, в течение 4 ч. в среде обогащения количество колоний на плотной агаровой среде составило 105 м. кл./мл; пробы, изначально содержащие 101 м. кл./мл, достигли концентрации 105 м. кл./мл через 8 ч. выращивания в среде обогащения. После проведения ПЦР в режиме «реального времени» через 8 ч. выращивания наблюдали наличие флуоресценции по каналу ROX в пробах, изначально содержащих 101 м. кл./мл.
Использование метода Real-Тime ПЦР с предложенными нами праймерами, позволяет существенно повысить достоверность ПЦР-анализа, исключив возможность контаминации; сократить трудозатраты и время анализа, задействовав в аналитическом процессе минимум сотрудников; проводить ПЦР-анализ в одном помещении, что играет существенную роль для лабораторий, занимающихся исследованиями объектов рыбного промысла.
Выводы
Набор полученных нами олигонуклеотидов, включающий прямые, обратные праймеры и флуоресцентно-меченый зонд, сконструированные на основе фрагментов гена металлопротеазы (коллагеназы), специфичного V. parahaemolyticus , позволяет методом ПЦР с гибридизационно-флуоресцентным учетом результатов в режиме реального времени выявлять ДНК возбудителей V. pa-rahaemolyticus в исследуемом материале.
Применение разработанного набора реагентов для идентификации штаммов вида V. parahaemo-lyticus методом полимеразной цепной реакции в режиме реального времени (Real-Time PCR) при исследовании проб биологического материала и объектов окружающей среды позволяет обнаружить и дифференцировать ДНК возбудителей V. parahaemolyticus с аналитической чувствительностью от 1×105 м. к./мл и аналитической специфичностью – 100%.
Предварительное обогащение проб в 1%-ной пептонной воде с 2%-ным NaCl в течение 8 ч. позволяет выявлять бактерии V. parahaemolyticus при исходной концентрации их в пробе 101 м. кл./мл методом Real-Time PCR.
Список литературы Разработка способа индикации и идентификации Vibrio parahaemolyticus с помощью real-time ПЦР
- Белькова Н.Л., Дзюба Е.В., Суханова Е.В. Молекулярно-генетическая идентификация кишечной микрофлоры и протистов байкальских рыб // Аннотированный список фауны оз. Байкал и его водосборного бассейна. Новосибирск: Наука, 2009. С. 957-980.
- Белькова Н.Л. и др. Молекулярно-генетический мониторинг ассоциированной микрофлоры лососевидных рыб: разнообразие и физиологический статус // Известия Самарского научного центра РАН. 2010. Т. 12, № 1(4). С. 1108-1114.
- Домницкий И.Ю. Ихтиопатология: краткий курс лекций. Саратов, 2016. 120 с.
- Лабораторная диагностика заболеваний, вызываемых парагемолитическими и другими патогенными для человека вибрионами: МУК 4.2.1793-03. М.: Федеральный центр госсанэпиднадзора Минздрава России, 2004. 26 с.
- Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности: МУ 1.3.2569-09. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010. 51 c.
- Полеева М.В., Чемисова О.С. Использование масс-спектрометрического анализа для детекции бактериальных токсинов // ЖМЭИ. 2018. № 1. С. 93-101.
- Ребриков Д.В. и др. ПЦР в реальном времени. М: Бином. Лаборатория знаний, 2019. 223 с.
- Способ идентификации штаммов вида Vibrio paraharmolyticus методом ПЦР в режиме реального времени: пат. № 2016146441 Рос. Федерации, 2016. № 2644232; заявл. 08.02.2018. Бюл. № 4 / Чемисова О.С., Трухачев А.Л., Рыковская О.А., Полеева М.В.
- Чемисова О.С. и др. Масс-спектрометрический анализ как метод идентификации и внутривидовой дифференциации Vibrio parahaemolyticus // Холера и патогенные для человека вибрионы: материалы проблемной комиссии. Ростов-н/Д, 2013. Вып. 26. С. 153-157.
- Buller N.B. Bacteria from fish and other aquatic animals: a practical identification manual. Oxfordshire: CABI publishing, 2004. 361 p.
- Chakraborty S., Nair G.B., Shinoda S. Pathogenic vibrios in the natural aquatic environment // Rev. Environ. Health. 1997. Vol. 12 (2). P. 63-80.
- Daniels N.A.et al. Emergence of a new Vibrio parahaemolyticus serotype in raw oysters: A prevention quandary // J. Am. Med. Assoc. 2000. Vol. 284 (12). P. 1541-1545.
- Deepanjali A. et al. Seasonal variation in abundance of total and pathogenic Vibrio parahaemolyticus bacteria in oysteralong the southwest coast of India // Appl. Environ. Microbiol. 2005. Vol. 71 (7). P. 3575-3580.
- Di Pinto A., Ciccarese G., Tantillo G. A collagenase-targeted multiplex PCR assay for identification of Vibrio alginolyticus, Vibrio cholerae, and Vibrio parahaemolyticus // J. of Food Protection. 2005. Vol. 68, № 1. P. 150-153.
- Hara-Kudo Y. et al. Improved method for detection of Vibrio parahaemolyticus in seafood // Appl. Environ Microbiol. 2001. Vol. 67 (12). P. 5819-5823.
- Li R. et al. A Novel PCR-Based Approach for Accurate Identification of Vibrio parahaemolyticus // Front Microbiol. 2016. Vol. 7. P. 44.
- Luan X.-Y. et al. Comparison of different primers for rapid detection of Vibrio parahaemolyticus using the polymerase chain reaction // Lett. Appl. Microbiol. 2007. Vol. 44 (3). P. 242-247.
- Reham A.A., Amani M.S. Specific Detection of Pathogenic Vibrio species in shellfish by using multiplex polymerase chain reaction // J. Global Veterinaria. 2012. Vol. 8, № 5. P. 525-531.
- Spanggaard B. et al. The microflora of rainbow trout intestine: a comparison of traditional and molecular identification // Aquaculture. 2000. Vol. 182. P. 1-15.


