Разработка технологии получения хитозана из панцирьсодержащего сырья
Автор: Солдатова С.Ю.
Журнал: Вестник Нижневартовского государственного университета @vestnik-nvsu
Рубрика: Химия и химические технологии
Статья в выпуске: 1, 2015 года.
Бесплатный доступ
Цель работы - получение хитозана из различных видов сырья: панцирь рака, панцирь креветки, целиковый рачок гаммаруса. Для этого были поставлены задачи отработки щадящей технологии выделения хитина из первичного сырья и его сушки, наиболее полного деацетилирования хитина и получения хитозана, определения физико-химических свойств образцов хитозана. На основании эксперимента был рассчитан выход готового продукта по сырью (около 11% для панцирей раков и креветок, 4% для гаммаруса) и по хитину (79%, 78% и 62% соответственно). Вискозиметрическим методом установлена молекулярная масса образцов хитозана, которая составила от 72444 Да для хитозана из панциря раков, 63200 - из панцирей креветок и 57300 - из гаммаруса. Полученные результаты согласуются с литературными данными. Можно констатировать, что выбранные условия получения хитозана из сырья позволяют выделить образцы с достаточно высокой молекулярной массой. Следует отметить, что молекулярная масса получаемого хитозана зависит не только от вида сырья, способа выделения хитина и метода его деацетилирования, но также от условий хранения и срока сбора сырья...
Биологически активные добавки, хитин, хитозан, ик-спектрометрия, потенциометрическое титрование
Короткий адрес: https://sciup.org/14116866
IDR: 14116866 | УДК: 612.396.172
Текст научной статьи Разработка технологии получения хитозана из панцирьсодержащего сырья
Здоровье нации стало на сегодняшний день одной из приоритетных государственных задач, над решением которой активно работает индустрия здорового питания. К новым поколениям пищевых продуктов относятся функциональные пищевые продукты, которые снижают риск развития многих заболеваний, связанных с питанием, за счет наличия в их составе физиологически важных веществ, и способствуют сохранению здоровья и долголетия человека.
Один из путей создания функциональных пищевых продуктов — использование в рецептуре традиционных продуктов питания природных биологически активных ингредиентов, выделенных из растительного и животного сырья и продуктов его переработки.
С этой точки зрения перспективен хитозан — деацетилированное производное хитина, определяющего структуру панциря ракообразных, кутикулы насекомых и клеточные стенки грибов. Хитин и хитозан представляют собой смесь олигосахаридов с различной степенью полимеризации.
Хитозан обладает очень широким спектром биологического действия. В качестве биологически активной добавки к пище он способствует снижению уровня холестерина и сахара в крови, нормализует артериальное давление, обладает противоопухолевым и бактериостатическим действием по отношению к патогенным микроорганизмам, улучшает работу кишечника, стимулирует иммунную активность и рост би-фидофлоры. В настоящее время хитозан используется в медицине в качестве ранозаживляющего средства, в косметологии — в очищающих средствах, в пищевой промышленности — как загуститель и структурообразова-тель, в сельском хозяйстве, в технических отраслях — для улучшения качества бумаги, создания нетканых материалов, упаковки для пищевых продуктов и т.д [8].
По своей химической природе хитин является поли-Х-ацетил-В-глюкозо-2-амином, мономерные единицы — N-ацетилглюкозамин, связанные Ь-(1,4)-гликозидными связями.
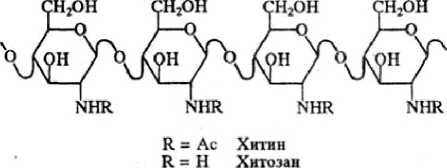
Рис. 1. Структурная формула хитина и хитозана
Получение хитозана из исходного хитина производится в две стадии: выделение хитина из сырья и его деацетилирование. Хитин в составе растительных и животных оболочек присутствует не в чистом виде, а в виде комплексов: хитин-глюкановый комплекс — в клеточной стенке грибов, хитин-меланиновый — в кутикуле насекомых, хитин-белковый — в панцире ракообразных. Для выделения хитина в чистом виде необходимо разрушить эти комплексы. Наиболее доступен для гидролиза хитин-белковый комплекс панциря ракообразных, к тому же в России в достатке имеется этот вид сырья за счет промысла крабов на Дальнем Востоке, поэтому панцири ракообразных, в частности криля и крабов, являются наиболее доступным видом сырья для получения хитина.
Цель данной работы — получение хитозана из различных панцирьсодержащих отходов (панцирь рака, панцирь креветки, рачок гаммарус) и сравнение его химических свойств. Работа состояла из нескольких этапов.
-
1. Выделение хитина из различных сырьевых источников.
-
2. Деацетилирование хитина и получение хитозана.
-
3. Подтверждение аутентичности полученного хитозана путем сравнения с эталонным продуктом.
-
4. Изучение физико-химических свойств хитозана из различного сырья.
Выделение хитина.
Выделение хитина из всех видов сырья (панцирь рака, панцирь креветки, рачок гаммарус) проводили по одной методике, включающей в себя стадии депротеинизации и деминерализации [3; 7].
Депротеинизацию проводят раствором гидроксида натрия для удаления белков панциря. Процесс депротеинизации протекает при повышенных температурах 70—90°С и концентрации раствора гидроксида натрия 0,5—1 М в течение 90—150 мин.
Начальное содержание белка может находиться в пределах 25—50% в зависимости от вида сырья, по окончании процесса депротеинизации остаточное количество белка составляет менее 1%. При необходимости получения более чистого хитина процесс депротеинизации может проводиться несколько раз [2].
В своем исследовании мы измельчали сырье до размера частиц 3—5 мм (размер частиц оп ределяли по остатку на сите). Депротеинизацию проводили 1Н раствором гидроксида натрия, соотношение сырья и раствора NaOH — 1:13. Процесс вели при постоянном перемешивании, температуре 80±3°С в течение 120 минут.
В ходе процесса происходило небольшое вспенивание реакционной массы, обусловленное поверхностно-активным свойством белков, наблюдалось первичное обесцвечивание частиц панциря.
Депротеинизированные частицы панциря откидывали на сито и промывали водой, подкисленной соляной кислотой (pH ~ 5), а затем дистиллированной водой до нейтрального значения pH промывных вод.
В процессе деминерализации удаляются соли кальция, фосфаты и карбонаты, обуславливающие прочность покровов (например, панцирь краба), таким образом, цель процесса деминерализации — удаление минеральных солей, таких как карбонат кальция, из депротеинизированного панциря. Деминерализацию проводят растворами соляной кислоты (концентрация 0,5—1,5 М) при температуре не выше 40°С во избежание гидролиза гликозидных связей хитина.
Под действием соляной кислоты нерастворимые в воде соединения кальция переходят в растворимые и могут быть удалены вместе с фильтратом.
Химическое уравнение процесса деминерализации можно представить в следующем виде:
СаСОз + 2НС1 = СаС12 + Н2О + СОД
Начальное содержание минеральных веществ составляет от 15% до 50% в зависимости от вида используемого сырья, по окончании процесса деминерализации остаточное количество минеральных веществ должно быть от 3% до 0,2% [2].
В наших экспериментах мы проводили деминерализацию 1Н раствором соляной кислоты при температуре 22±1°С в течение 120 минут и постоянном перемешивании. В ходе реакции происходило выделение углекислого газа, что приводило к вспениванию реакционной массы. Добавление небольших количеств н-бутанола позволяло избежать сильного пенообразования.
Полученный в результате деминерализации хитин откидывали на сито, промывали водой, подщелоченной NaOH (pH ~ 8) и дистиллированной водой до нейтрального значения pH промывных вод. Полученный хитин был белого цвета и не нуждался в обесцвечивании.
Перед деацетилированием полученный хитин необходимо высушить. Отработку температурного режима сушки мы вели на примере хитина из панциря рака. Высушивание проводили до постоянной массы в вакуум-сушильном шкафу при температуре 30±2°С и при 80±2°С.
В первом случае были получены белые чешуйки хитина в виде хлопьевидного порошка, вторая партия хитина, высушенная при более высокой температуре, имела коричнево-желтый цвет. Опыт показал, что более высокая темпера тура сушки вызывает частичное ороговение и деструкцию хитина с образованием окрашенных продуктов. Такой хитин плохо ацетилируется, полученный из него хитозан обладает меньшей растворимостью. Таким образом, оптимальная температура для сушки хитина 30±2°С. Проведенные исследования позволили определить процентный выход хитина из различных источников сырья. Результаты представлены в таблице 1.
Таблица 1
Процентный выход хитина из различного панцирьсодержащего сырья
|
Тип сырья |
Выход от массы исходного сырья, % |
|
Панцирь рака |
16,6 |
|
Панцирь креветки |
13,6 |
|
Рачок гаммарус |
5,4 |
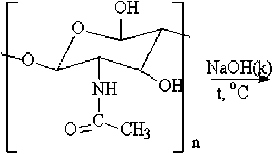
Рис. 2. Деацетилирование хитина
Получение хитозана. Хитозан является самым распространенным производным хитина. Хитозан получают деацетилированием хитина.
Для проведения процесса деацетилирования хитин каждого вида сырья заливали 50%-ным раствором NaOH и нагревали до температуры 120±5°С в течение 90 минут при постоянном перемешивании. Реакционная смесь темнела, что было вызвано разложением остаточного белка в сильно щелочной среде.
Более длительное деацетилирование мы сочли нецелесообразным, так как наиболее ак тивно процесс протекает в первые 90 минут, а дальнейшая обработка щелочью вызывает гидролиз и деструкцию хитозана [3; 4].
По окончании процесса деацетилирования жидкость фильтруют, полученный хитозан промывают водой, подкисленной соляной кислотой до рН~5 и далее дистиллированной водой до получения промывных вод с нейтральным значением pH. Сушка хитозана проводится аналогично сушке хитина.
На основании полученных данных можно рассчитать процентный выход хитозана (табл. 2).
Таблица 2
Процентный выход хитозана из панцирьсодержащего сырья
|
Вид хитина |
Выход хитозана по хитину, % |
Выход хитозана по сырью, % |
|
Из панциря рака |
79 |
11,5 |
|
Из панциря креветки |
78 |
10,7 |
|
Из рачков гаммаруса |
62,3 |
3,37 |
Как видно из полученных данных, рачки гам-марус в качестве сырьевого источника для получения хитозана менее перспективны, чем раки и креветки. Полученные результаты хорошо согласуются с литературными источниками [3; 7].
Изучение физико-химических свойств хитозана из разных видов сырья. Важнейшими характеристиками хитозана, определяющими возможность его дальнейшего использования в качестве БАД, полимерной пленки, адсорбента и т.д., являются растворимость, молекулярная масса и степень деацетилирования. Однако сначала мы должны были подтвердить соответствие полученных нами образцов эталонному хитозану, полученному промышленным способом. Для этого мы сравнивали ИК-спектры наших образцов и эталонного образца (метод ИК-спек-троскопии).
ИК-спектроскопия — аналитический метод, широко применяемый в химии для установле ния строения органических соединений. Каждое органическое соединение имеет свой собственный строго индивидуальный спектр, следовательно, ИК-спектроскопия позволяет достоверно определить чистоту и состав вещества. ИК-спектроскопия позволяет проводить как качественный (по характеристическим частотам поглощения), так и количественный (по интенсивности поглощения) анализ [1].
Инфракрасная спектроскопия образцов хитозана. ИК-спектры снимали на ИК-Фурье-спектрометре Perkin Elmer, в диапазоне от 450 до 4000 см"1. Для определения хитозан прессовали в таблетки с КВг. Результаты обрабатывали в программе IR-Spectrum. Эталонный спектр хитозана брали из библиотеки программы IR-Spectrum. Результаты представлены на рисунке 3 в виде спектрограммы (на примере хитозана из панциря рака).
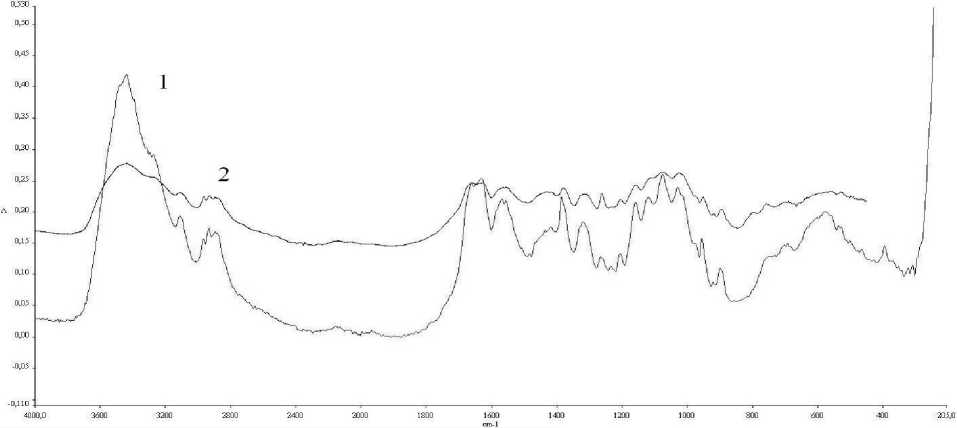
Рис. 3. Сравнение спектров полученного хитозана и эталонного образца: 1 — ИК-спектр опытного образца; 2 — ИК-спектр эталона
Как видим, различия спектров в полученных образцах хитозана заключаются лишь в интенсивности полос поглощения 3437 см"1 и 1659 см"1. Эти различные интенсивности поглощения полос можно объяснить неодинаковой степенью деацетилирования сравниваемых образцов. Кроме того, используемый для прессования КВг гигроскопичен и при длительном хранении может поглощать какое-то количество воды, в результате чего интенсивность линии поглощения воды в ИК-спектрах увеличивается.
На рисунке 4 представлен ИК-спектр хитозана из панциря рака с указанием основных частот поглощения.
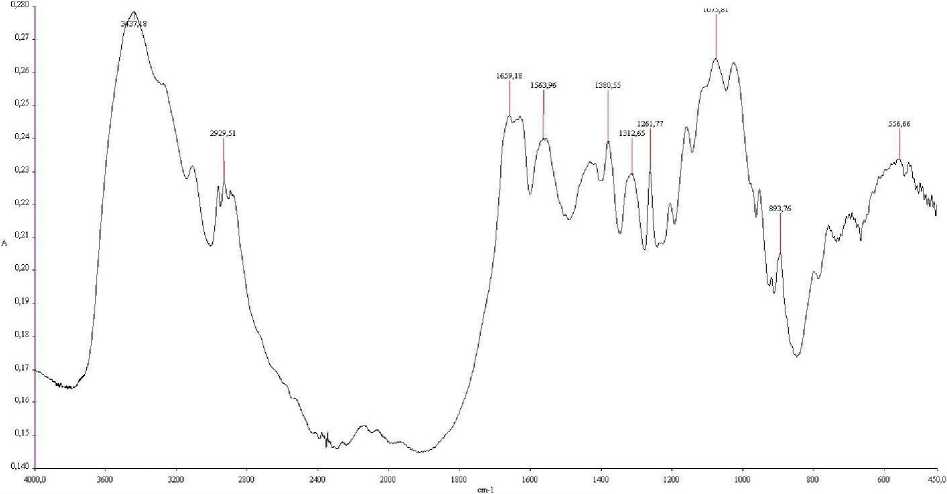
Рис. 4. ИК-спектр полученного образца хитозана
Проводя качественный анализ по ИК-спек-тру образца хитозана, рассмотрим основные характеристические частоты поглощения.
Согласно литературным данным [5], полосы в районе области 3447 и 1655см"1 могут быть интерпретировны как колебания аминогруппы. Следует отметить, что область в районе 3440 см"1 перекрывается с колебаниями свободного гидроксила.
Колебания в районе 1660—1619 см"1 попадают в зону антисимметричных деформационных колебаний NH3+. Колебание в области 893 см"1 является деформационным колебанием Ci-H в Р-сахарах.
Таким образом, анализируя характеристические частоты и сравнивая спектры образцов, можно подтвердить идентичность исследуемых химических соединений.
Для качественного анализа образцов и определения их физико-химических свойств мы проанализировали такие показатели, как раствори мость образцов хитозана в 2% уксусной кислоте, их молекулярная масса, степень деацетилирования.
Растворимость. Определение растворимости хитозана в уксусной кислоте — важный показатель качества. Хитин в отличие от хитозана не растворим в уксусной кислоте, следовательно, проверка растворимости и определение массы нерастворимой фракции хитозана показывает эффективность процесса деацетилирования [1]. Растворимость хитозана в уксусной кислоте обусловлена наличием в хитозане первичных аминогрупп, способных ионизироваться (про-тонироваться) в кислой среде.
Образцы хитозана растворяли в 2% растворе уксусной кислоты при постоянном перемешивании. Через 10 минут раствор фильтровали и определяли массу нерастворенного хитозана по остатку на фильтре после высушивания до постоянной массы. Результаты опыта представлены в табл. 3.
Таблица 3
Содержание нерастворимых фракций в опытных образцах хитозана
|
Вид хитозана |
Доля нерастворимой фракции, % |
|
Из панциря раков |
5 |
|
Из панциря креветок |
4 |
|
Из гаммаруса |
2 |
Судя по представленным данным, наименьшее количество нерастворимых частиц содержится в хитозане из гаммаруса.
Определение молекулярной массы хитозана. Молекулярную массу образцов хитозана определяли визкозиметрическим методом. Этот метод является наиболее простым и доступным для определения молекулярной массы полимеров в широкой области значений молекулярных масс [6]. В качестве растворителя использовали 2% раствор уксусной кислоты, измерение вязкости проводили с растворами хитозана концентрацией 0,2; 0,5; 1,0; 1,5%. Полученные результаты представлены в табл. 4.
Таблица 4
Молекулярная масса хитозана
|
Вид хитозана |
Характеристическая вязкость, см’/г |
Молекулярная масса, Дальтон |
|
Из панциря раков |
3,09 |
72444 |
|
Из панциря креветок |
2,68 |
63200 |
|
Из гаммаруса |
2,43 |
57340 |
Из полученных данных видно, что молекулярные массы образцов отличаются между собой незначительно. Следует отметить, что молекулярная масса получаемого хитозана зависит не только от вида сырья, способа выделения хитина и метода его деацетилирования, но также от условий хранения и срока сбора сырья [1; 7].
Определение степени деацетилирования хитозана. Метод основан на потенциометрическом титровании хлористого водорода, связанного с аминогруппами молекул хитозана [4].
Потенциометрическое титрование растворов хитозана проводили раствором гидроксида натрия (0.1 Н) при помощи ионометра И-160 МП с шагом 0,1 см3. Количество щелочи, необходимое для титрования связанной с аминогруппами кислоты, определяли из графика зависимости электропроводности раствора от объема щелочи. Титрование проводили в трех повторностях, за окончательный результат брали среднее арифметическое значение. Полученные результаты представлены в табл. 5.
Таблица/
Степень деацетилирования образцов хитозана
|
Вид хитозана |
Степень деацетилирования, % |
|
Хитозан из панциря раков |
79,5 |
|
Хитозан из панциря креветок |
88,4 |
|
Хитозан из рачков гаммарус |
95,0 |
Степень деацетилирования напрямую связана со способностью хитозана растворяться в кислой среде. Чем выше степень деацетилирования, тем больше свободных аминогрупп, способных к ионизации, следовательно, тем лучше растворимость хитозана. Полученные данные по степени деацетилирования коррелируют с данными по растворимости [6].
Таким образом, в работе был получен хитозан из трех видов сырья со степенью чистоты и физико-химическими характеристиками, позволяющими использовать его не только для технических нужд, но и в качестве биологически активной добавки к пище.
Список литературы Разработка технологии получения хитозана из панцирьсодержащего сырья
- Абдуллин В.Ф., Шиповская А.Б. и др. Физико-химические свойства хитозана из разных источников сырья // Химические волокна. 2008. № 1.
- Безродных Е.А., Тихонов В.Е., Lopez Llorca L.V. Выделение хитина из отходов морепродуктов и получение из него хитозана//Рыбпром. 2010. № 2.
- Комплексная технология хитина и хитозана из панциря ракообразных. М., 2006.
- Кучина Ю.А., Долгопятова Н.В., Новиков В.Ю. и др. Инструментальные методы определения степени деацетилирования хитина//Вестн. МГТУ. 2012. Т. 15. № 1.
- Наканиси К. Инфракрасные спектры и строение органических соединений. Практич. руководство. М., 1965.
- Федосеева Е.Н., Смирнова Л.А., Федосеев В.Б. Вязкостные свойства растворов хитозана и его реакционная способность//Химия. Вестн. Нижегород. ун-та. 2008. № 4.
- Хитин и хитозан. Получение, свойства и применение/Под ред. К.Г.Скрябина, Г.А.Вихоревой, В.П.Варламова. М., 2002.
- Zivanovic S., Shuang Chi, Draughon A. Antimicrobial activity of chitosan films enriched with essential oils//Journal of food science. 2005. Vol. 70. № 5.


