Разработка тест-систем ПЦР в режиме реального времени для выявления ДНК Mycoplasma bovis и Mycoplasma bovigenitalium
Автор: Абед Алхуссен М., Кротова А.О., Федорова О.Е., Захаров В.М., Жбанова Т.В., Бьядовская О.П., Спрыгин А.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная микробиология
Статья в выпуске: 6 т.59, 2024 года.
Бесплатный доступ
В настоящее время возбудители микоплазмоза крупного рогатого скота (КРС), вызванного Mycoplasma bovis и M. bovigenitalium , распространены в животноводческих хозяйствах во всем мире, в том числе и в Российской Федерации. Микоплазмозы КРС характеризуются поражением верхних дыхательных путей, серозно-катаральным воспалением легких, артритами, ринитами, пневмониями у молодняка, абортами у беременных животных, вульвовагинитами, маститами и рождением мертвого или нежизнеспособного плода. Экономический ущерб складывается из падежа, вынужденного убоя, недополучения живой массы и потомства, затрат на лечение, профилактику. Разработка методов выявления указанных возбудителей имеет большое значение для контроля микоплазменной инфекции. В настоящем сообщении предлагается тест-система для выявления геномов M . bovis и M . bovigenitalium с помощью полимеразной цепной реакции в режиме реального времени (с подтвержденной эффективностью, специфичностью и высокой аналитической чувствительностью), разработка которой была целью нашего исследования. Мы провели анализ геномных последовательностей M . bovis и M . bovigenitalium из базы данных GenBank (NCBI) и выбрали локус fusA для M . bovis и межгенное пространство генов 16S-23S рРНК для M . bovigenitalium . Определены оптимальные концентрации компонентов реакционной смеси: хлорида магния - 5,5 мМ для M. bovis и 6,0 мМ для M. bovigenitalium , дезоксинуклеозидтрифосфатов - 300 мкМ для M. bovis и 200 мкМ для M. bovigenitalium , праймеров - 0,4 мкМ для M. bovis и 0,3 мкМ для M. bovigenitalium , флуоресцентных зондов - 0,05 мкМ для M. bovis и 0,15 мкМ для M. bovigenitalium , а также подобран следующий температурно-временной режим реакции для M. bovis и M. bovigenitalium : 10 мин при 95 °С (прогрев реакционной смеси), далее 40 циклов ПЦР, состоящих из денатурации ДНК в течение 10 с при 95 °С, отжига праймеров и элонгации кДНК в течение 60 с при 60 °С. Установлены высокая аналитическая специфичность предложенных тест-систем: предел обнаружения ДНК микоплазм составил 25-50 КОЕ/мл при эффективности амплификации 90,94 и 91,85 % соответственно для M . bovis и M . bovigenitalium . При применении разработанных нами методик для тестирования 1342 проб биоматериала от КРС с клиническими признаками репродуктивной и/или респираторной патологии, проанализированных ранее с использованием других методических подходов, показано полное совпадение результатов. Таким образом, на основе полимеразной цепной реакции в режиме реального времени нами разработаны специфичные, высокочувствительные и воспроизводимые тест-системы для выявления ДНК M . bovis и M . bovigenitalium при рутинной диагностике микоплазмоза крупного рогатого скота.
Полимеразная цепная реакция в режиме реального времени, чувствительность, специфичность, эффективность амплификации
Короткий адрес: https://sciup.org/142244132
IDR: 142244132 | УДК: 619:579.62:577.21 | DOI: 10.15389/agrobiology.2024.6.1237rus
Текст научной статьи Разработка тест-систем ПЦР в режиме реального времени для выявления ДНК Mycoplasma bovis и Mycoplasma bovigenitalium
Представители рода Mycoplasma широко распространены во всем мире и способны вызывать у крупного рогатого скота (КРС) мастит, пневмонию, септицемию и нарушения репродуктивной функции (1, 2). Mycoplasma bovis — наиболее распространенный наряду с возбудителем контагиозной плевропневмонии КРС (Mmm SC) и один из этиологических агентов, выявляемых в ассоциации с другими патогенами и вызывающих комплекс респираторных заболеваний КРС (BRDC, bovine respiratory disease complex) с высоким заболеваемостью и смертностью (3, 4). Кроме того, M. bovis — один из основных патогенов, вызывающих множество заболеваний: воспаление дыхательных путей, пневмонию, отит, артриты, кератоконъюнктивиты, эндометрит, маститы, что приводит к значительным экономическим и производственным потерям в мясном и молочном животноводстве, особенно в развивающихся странах (5-7). Mycoplasma bo-vigenitalium связана с репродуктивными нарушениями и маститом у КРС.
Экономический ущерб при поражении данным видом микоплазм связан с бесплодием и снижением репродуктивной способности животных (8-11).
Для выделения микоплазм культуральным методом используют множество жидких, полужидких и плотных питательных сред (12, 13). Однако биологические особенности возбудителей микоплазмоза КРС существенно затрудняют эту процедуру (2).
Недавно было показано, что коммерчески доступные тест-системы для диагностики инфекции, вызванной M . bovis , методом иммунофер-ментного анализа (ИФА) различаются по характеристикам (14), и хотя подобные подходы могут помочь в идентификации этих инфекций, они не позволяют получить изоляты, которые можно дополнительно охарактеризовать по таким признакам, как, например, устойчивость к противомик-робным препаратам (15).
Для борьбы с микоплазмозом КРС используются антибиотики, но проблема резистентности к противомикробным препаратам вызывает озабоченность и еще больше ограничивает и без того короткий список эффективных лекарственных средств, используемых при заболеваниях, вызванных микоплазмами (16, 17).
На сегодняшний день в доступной литературе представлена информация о различных модификациях полимеразной цепной реакции (ПЦР), позволяющих выявлять ДНК M . bovis и M . bovigenitalium в пробах биологического материала (18, 19). Многие исследователи указывали на эффективность идентификации и выявления M . bovis и M . bovigenitalium с использованием ПЦР и ПЦР в реальном времени (ПЦР-РВ) (20-24). Также для выделения и идентификации M . bovis у КРС использовались бактериологический и молекулярно-генетический методы (25).
В современных условиях оперативность диагностики может быть достигнута за счет применения ПЦР-РВ, что обеспечивает быструю и точную идентификацию генома микоплазм в пробах биологического материла (26). Наличие инструментов молекулярной идентификации геномов M . bovis и M. bovigenitalium позволяет контролировать не только эпизоотическую ситуацию в отечественных хозяйствах, но и проводить контроль как при импорте генетического материала от племенных быков, так и перед его использованием в производственных целях (2, 14, 27).
В нескольких исследованиях, проведенных с использованием ПЦР-РВ, сообщалось об эффективной и достоверной диагностике мастита, вызванного M. bovis . В Индии S. Behera и соавт. (28) применили метод ПЦР-РВ с красителем SYBR green для выявления M. bovis в молоке и легочной ткани, основываясь на идентификации гена uvrC (28). Недавно C.A.M. Becker и соавт. (29), используя ген polC , выявили M. bovis в 51 % положительных проб в 251 носовом мазке от телят на западе Франции. Этот же ген был использован в ПЦР-РВ, которая выявила 58 % образцов с M. bovis в 351 бронхоальвеолярной лаважной жидкости с телячьих ферм в Алжире (30). K. Chauhan и соавт. (31) разработали мультиплексную ПЦР-РВ для одновременного выявления M. bovis , Acholeplasma laidlawii и нескольких видов Mycoplasma — M . californicum , M . bovigenitalium , M. cana-dense , M . arginini и M . alkalescens . Этот набор, разработанный с учетом гена 16S рРНК Mycoplasma , гена rpoB M. bovis и межгенного транскрибируемого спейсера (ITS) 16S-23S рРНК A. laidlawii , позволил обнаруживать и дифференцировать M. bovis от других распространенных видов Mycoplasma spp. и непатогенного A. laidlawii в пробах молока, собранных на молочных фермах Калифорнии в США (31).
В результате исследования 1186 проб биоматериала, полученных из различных регионов Российской Федерации в период с 2015 по 2018 год, геном M. bovis был обнаружен в 10,1 % проб, а геном M. bovigenitalium выявлен в 8,6 % проб (4), кроме того, при исследовании 410 образцов спермы из российских и зарубежных племенных центров ДНК M. bovis обнаружена в 1,2 %, M. bovigenitalium — в 43,4 % образцов (27). Несмотря на то, что имеются данные, свидетельствующие о значительной распространенности M. bovis и M. bovigenitalium среди животных в России, однако комплексная и систематическая лабораторная диагностика микоплазмозов КРС, вызванных этими патогенами, на территории Российской Федерации, к сожалению, не проводится, что осложняет борьбу с заболеванием. Следовательно, необходимы коммерчески доступные российские диагностические тест-систем для выявления ДНК M. bovis и M. bovigenitalium на основе ПЦР-РВ.
В настоящем сообщении мы представили результаты разработки специфичных, высокочувствительных и воспроизводимых тест-систем для выявления ДНК M . bovis и M . bovigenitalium при рутинной диагностике микоплазмоза крупного рогатого скота. Системы валидированы с применением коллекции актуальных штаммов микоплазм КРС и позволяют оперативно и эффективно проводить исследования распространенности указанных микоплазм среди КРС.
Нашей целью была разработка ПЦР-РВ для выявления ДНК наиболее распространенных патогенных микоплазм Mycoplasma bovis и M . bo-vigenitalium .
Ìåòîäèêà . Использовали образцы биологического материала (сыворотка крови, стабилизированная кровь, назальные и трахеальные смывы, фрагменты легких и трахеи, молоко, смывы с препуция, вагинальные смывы, суставная жидкость, абортированные и мертворожденные плоды, а также образцы спермы) от КРС разных возрастных групп. Референсные штаммы бактерий АТСС M. bovis (¹ 25523), M . bovigenitalium (¹ 19852), M . dispar (¹ 27140) получены из коллекции ФГБУ ВНИИЗЖ, Mycoplasma mycoides subsp. mycoides SC (MmmSC) штамм Madugri-8 получен из коллекции ФГБНУ ФИЦВиМ (Россия). Для оценки специфичности разработанных методик ПЦР-РВ использовали различные бактериальные и вирусные патогены, инфицирующие КРС .
Суммарную ДНК выделяли с помощью коммерческого набора «Ам-пли Прайм РИБО-сорб» (ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Россия) согласно инструкции производителя.
Реакционная смесь для амплификации общим объемом 25 мкл содержала следующие компоненты: 2,5 мкл 10½ ПЦР-Буфер-Б для Taq ДНК-полимеразы (ООО «Синтол», Россия или аналог), 5,5 мкл 25 мМ раствора хлорида магния («Promega», США или аналог) с конечной концентрацией 5,5 мМ для M. bovis и 6,0 мкл 25 мМ раствора хлорида магния («Promega», США или аналог) с конечной концентрацией 6,0 мМ для M. bovigenitalium, 100 мМ водные растворы четырех дезоксинуклеозидтрифосфатов (дНТФ) — дАТФ, дГТФ, дТТФ, дЦТФ «Fermentas», Литва), готовится общая смесь дНТФ и разводится водой, свободной от нуклеаз, до концентрации каждого дНТФ 10 мМ; в реакционную смесь вносили 0,75 мкл 10 мМ дНТФ с конечной концентрацией 300 мкМ для M. bovis и 0,5 мкл 10 мМ дНТФ с конечной концентрацией 200 мкМ для M. bovi-genitalium, 0,4 мкМ прямого и обратного праймеров и 0,05 мкМ зонда для выявления ДНК Ì. bovis, 0,3 мкМ прямого и обратного праймеров и 0,15 мкМ зонда для выявления ДНК M. bovigenitalium (ООО «Синтол», Россия). Полученный объем реакционной смеси доводили до 20 мкл во- дой, свободной от нуклеаз («Invitrogen», США или аналог). После добавляли в подготовленные пробирки по 20 мкл реакционной смеси и по 5 мкл ДНК исследуемых образцов. Амплификацию проводили в программируемом амплификаторе Rotor-Gene Q («QIAGEN N.V.», Германия).
Для определения аналитической чувствительности системы тестировали 10-кратные последовательные разведения ДНК, выделенной из чистой культуры M . bovis (2,5½106 КОЕ/мл) и M . bovigenitalium (5,0½105 КОЕ/мл). Титры микоплазм определяли методом серийных разведений с посевом на плотные питательные среды и выражали в КОЕ/мл (32, 33).
Эффективность амплификации оценивали, используя последовательные 10-кратные разведения положительного образца биоматериала, содержащего ДНК микоплазм, в трех повторностях. Эффективность амплификации вычисляли согласно формуле Е = (101/slope - 1) ½ 100 %, где slope — наклон линейной области зависимости Ct от логарифма концентрации кДНК-матрицы.
Статистическую обработку данных проводили по 10 результатам измерений, вычисляли средние ( Ì ), их стандартные отклонения (±SD), выполняли регрессионный анализ, для оценки воспроизводимости и сходимости (повторяемости) рассчитывали коэффициент вариации ( Cv , %, не должен превышать 10 %). Для оценки промежуточной прецизионности в условиях повторяемости (сходимости) использовали один образец, который тестировали в 5 повторностях в трех повторных постановках ПЦР-РФ ( n = 15).
Ðåçóëüòàòû. На первом этапе мы разрабатывали подходы для идентификации ДНК микоплазм, для чего c помощью алгоритма множественного выравнивания последовательностей MAFFT были проанализированы генетические последовательности из базы данных GenBank NCBI . В результате для M. bovis в качестве целевого был выбран ген fusA (93 п.н.), кодирующий фактор элонгации G, который необходим при трансляции мРНК, а для M. bovige-nitalium — межгенная спейсерная область для 16S-23S рРНК (127 п.н.).
Для повышения чувствительности и специфичности ПЦР-РВ при выявлении ДНК M . bovis и M . bovigenitalium были подобраны оптимальные концентрации следующих компонентов: хлорида магния, дНТФ, праймеров, флуоресцентного зонда, а также температурно-временной режим реакции, при которых наблюдалась наивысшая интенсивность ответного флуоресцентного сигнала при высокой специфичности.
Ионы магния важны для функционирования ДНК-полимеразы, к тому же они оказывают значительное влияние на специфичность гибридизации праймеров, в то время как дНТФ представляют собой важнейшие структурные единицы молекул нуклеиновых кислот (34). Для оптимизации концентраций растворов хлорида магния и дНТФ комбинировали разные объемы 25 мM хлорида магния (от 2 до 6 мкл с шагом 0,5 мкл) с разными объемами 10 мМ дНТФ (от 0,25 до 2 мкл с шагом 0,25 мкл). Мы установили, что оптимальным при проведении ПЦР-РВ было добавление к смеси 5,5 мМ и 6,0 мМ раствора MgCl 2 , 300 мкМ и 200 мкМ раствора дНТФ соответственно для M. bovis и M. bovigenitalium . Такое сочетание этих реагентов использовали на следующих этапах подбора концентраций компонентов в реакционной смеси.
Оптимальные концентрации праймеров и зонда для M . bovis и M . bo-vigenitalium определяли эмпирически. Для этого подбирали композицию из прямого и обратного праймеров (10 пмоль/мкл) различных объемов (от 0,5 до 1,5 мкл с шагом 0,25 мкл) и TaqMan-зонда (2,5 пмоль/мкл) в объеме от
0,5 до 2 мкл с шагом 0,5 мкл. В результате наименьшие значения Ct и изменение максимальных значений флуоресценции положительных проб на графике реакции были зафиксированы при добавлении к смеси 0,4 мкМ и 0,3 мкМ каждого из праймеров, 0,05 мкМ и 0,15 мкМ зонда соответственно для M . bovis и M . bovigenitalium .
1. Значения порогового цикла Сt для Mycoplasma bovis и M. bovigenitalium при оптимизации температуры отжига ПЦР-РВ
|
Стадия реакции |
Температура |
Время |
Число циклов |
Среднее значение Ct |
|
|
M. bovis |
M. bovigenitalium |
||||
|
1-й |
режим |
||||
|
Прогрев реакционной смеси |
95 ° С |
10 мин |
1 |
||
|
Денатурация |
95 ° С |
10 с |
40 |
29,62 |
34,26 |
|
Отжиг праймеров и элонгация |
60 ° С |
60 с |
|||
|
2-й |
режим |
||||
|
Прогрев реакционной смеси |
95 ° С |
5 мин |
1 |
||
|
Денатурация |
95 ° С |
10 с |
41 1 4 |
||
|
Отжиг праймеров |
60 ° С |
20 с |
40 |
||
|
Элонгация |
72 ° С |
20 с |
|||
|
3-й |
режим |
||||
|
Прогрев реакционной смеси |
95 ° С |
5 мин |
1 |
||
|
Денатурация |
95 ° С |
10 с |
31 49 |
39 13 |
|
|
Отжиг праймеров |
58 ° С |
20 с |
45 |
||
|
Элонгация |
72 ° С |
20 с |
|||
Оптимизация температурно-временного режима ПЦР-РВ проводилась с ранее оптимизированными концентрациями хлорида магния для получения средних значений Сt. Результаты подбора температуры отжига представлены в таблице 1.
На основании выбранного в опытах сочетания времени и температуры в оптимизированном варианте для постановки ПЦР-РВ для M . bovis и M. bovigenitalium использовали следующий режим: 10 мин при 95 °С (прогрев реакционной смеси), далее 40 циклов ПЦР, состоящих из денатурации ДНК в течение 10 с при 95 °С, отжига праймеров и элонгации кДНК в течение 60 с при 60 °С.
Для определения специфичности методик, разработанных для идентификации двух видов микоплазм, в выбранном нами режиме и с теми же праймерами и зондом были протестированы образцы с референсными штаммами M. bovis и M. bovigenitalium и гетерологичными бактериями и вирусами, инфицирующими КРС. Проведенные испытания продемонстрировали, что разработанные ПЦР-РВ не дают ложноположительных или ложноотрицательных результатов, что свидетельствует об их специфичности (табл. 2).
2. Определение специфичности праймеров для выявления геномов Mycoplasma bovis и M. bovigenitalium в ПЦР-РВ ( n = 3)
|
Объект |
Штамм/изолят |
Результаты ПЦР-РВ |
|
M. bovis M. bovigenitalium |
Изоляты
|
Mycoplasma bovis |
Калуга 2020 |
пол. |
отр. |
|
Mycoplasma bovis |
полевой изолят |
пол. |
отр. |
|
Mycoplasma bovigenitalium |
полевой изолят |
отр. |
пол. |
|
Mycoplasma gallisepticum |
S6 |
отр. |
отр. |
|
Mycoplasma synoviae |
WVU 1853 |
отр. |
отр. |
|
Штаммы |
|||
|
Mycoplasma bovis |
АТСС 25523 |
пол. |
отр. |
|
Mycoplasma bovigenitalium |
АТСС 19852 |
отр. |
пол. |
|
Mycoplasma dispar |
АТСС 27140 |
отр. |
отр. |
|
Escherichia coli |
ЕС-21 |
отр. |
отр. |
|
Pasteurella multocida |
¹ 1414 |
отр. |
отр. |
|
Mannheimia haemolytica |
¹ 1412 |
отр. |
отр. |
|
Bovine respiratory syncytial virus (BRSV) |
Вологда/2020 |
отр. |
отр. |
Ïðîäîëæåíèå òàáëèöû 2
|
Bovine alphaherpes virus (BoHV-1) |
ВНИИЗЖ |
отр. |
отр |
|
Bovine parainfluenza 3 virus (BPIV3) |
ВГНКИ-4 |
отр. |
отр |
|
Bovine viral diarrhea virus (BVDV) |
NADL |
отр. |
отр |
|
Mycoplasma mycoides subsp . mycoides SC (MmmSC) Madugri-8 |
отр. |
отр |
|
Примечание. отр. — геном M. bovis/M. bovigenitalium не выявлен; пол. — геном M. bovis/M. bovi-genitalium выявлен.
Эффективность амплификации оценивали в 3-кратной повторности с помощью серии последовательных 10-кратных разведений ДНК M. bovis и M. bovigenitalium , выделенных из бактериальной суспензии. На основе полученных средних величин пороговых циклов каждого разведения значение эффективности амплификации (Е) составило 90,94 % для M. bovis и 91,85 % для M. bovigenitalium .
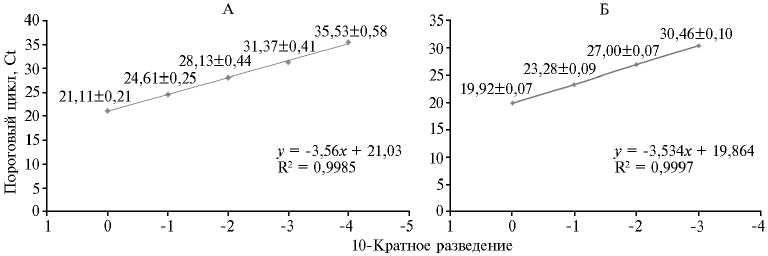
Рис. 1. График линейной зависимости результатов ПЦР-РВ при тестировании 10-кратных разведений ДНК Mycoplasma bovis (слева) и M. bovigenitalium (справа) ( n = 3, M ±SD).
Повторяемость (сходимость) результатов разработанных ПЦР-РВ оценивали по стандартному отклонению (±SD) значения Сt для каждого из разведений, которое для M. bovis варьировало от 0,21 до 0,58, для M. bovigenitalium — от 0,07 до 0,10. Коэффициент детерминации (R2) при этом составил 0,9985 для M . bovis и 0,9997 для M . bovigenitalium (рис. 1).
Воспроизводимость методик оценивали при исследовании ДНК M . bovis и M . bovigenitalium (одного положительного образца, который тестировали в 5 повторностях в трех постановках ПЦР-РВ) (табл. 3).
|
3. Вариабельность значений Ct в ПЦР-РВ для Mycoplasma bovis и M. bovigeni-talium ( n = 15) |
||||
|
Патоген |
Тест-система |
Ì Сt |
±SD |
Cv , % |
|
M. bovis |
Запуск 1-й |
31,01 |
0,47 |
1,51 |
|
Запуск 2-й |
31,66 |
0,31 |
0,98 |
|
|
Запуск 3-й |
31,77 |
0,28 |
0,88 |
|
|
Суммарно ( n = 15) |
31,48 |
0,48 |
1,52 |
|
|
M. bovigenitalium |
Запуск 1-й |
29,70 |
0,13 |
0,44 |
|
Запуск 2-й |
29,75 |
0,04 |
0,14 |
|
|
Запуск 3-й |
28,28 |
0,07 |
0,25 |
|
|
Суммарно ( n = 15) |
29,08 |
0,08 |
0,28 |
|
Можно отметить, что среднее значение порогового цикла (Ct) на протяжении трех повторных постановок ПЦР-РВ варьировало для M. bovis от 31,01 до 31,77 с разбросом стандартного отклонения (±SD) от 0,28 до 0,47 и для M. bovigenitalium от 28,28 до 29,75 с разбросом SD от 0,04 до 0,13. В среднем коэффициент вариации (Cv) составил 1,52 и 0,28 % соответственно для M. bovis и M. bovigenitalium, то есть полученные значения соответствуют требованиям (менее 10 %). Суммирование результатов трех повторных постановок ПЦР-РВ показало еще меньшую вариабельность: для M. bovis и M. bovigenitalium средние значения порогового цикла равны соответственно 31,48 и 29,08 при абсолютных значениях SD 0,48 и 0,08.
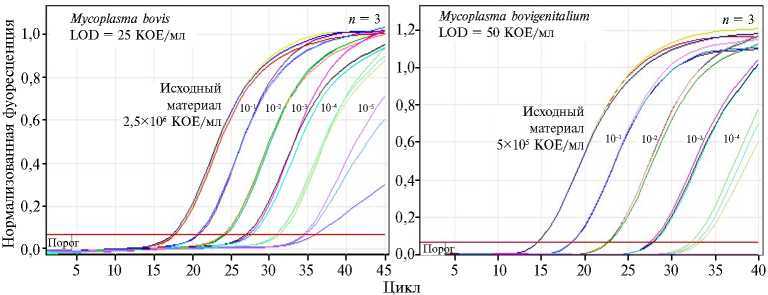
Рис. 2. Аналитическая чувствительность (LOD) ПЦР-РВ для выявления Mycoplasma bovis и M. bovi-genitalium ( n = 3, 25 и 50 КОЕ/мл).
Аналитическую чувствительность разработанных методик (предел обнаружения ДНК M . bovis и M . bovigenitalium ) определяли с ДНК, выделенной из нескольких последовательных 10-кратных разведений бактериальных суспензий с исходными концентрациями 2,5½106 и 5½105 КОЕ/мл соответственно для M . bovis и M. bovigenitalium . Каждое разведение исследовалось при трех повторных постановках ПЦР-РВ (рис. 2, табл. 4). Установлено, что для разработанных тест-систем на основе ПЦР-РВ предел обнаружения ДНК M . bovis составил 25 КОЕ/мл, M . bovigenitalium — 50 КОЕ/мл.
4. Аналитическая чувствительность ПЦР-РВ для выявления Mycoplasma bovis и M. bovigenitalium ( n = 3)
|
Разведение геномной ДНК |
M. bovis |
M. bovigenitalium |
||
|
Характеристика матрицы |
Сt ( Ì ±SD) |
Характеристика матрицы |
Сt ( Ì ±SD) |
|
|
10 |
2 500 000 КОЕ/мл |
17,56±0,19 |
500 000 КОЕ/мл |
14,55±0,00 |
|
10 - 1 |
250 000 КОЕ/мл |
20,68±0,10 |
50 000 КОЕ/мл |
18,43±0,08 |
|
10 - 2 |
25 000 КОЕ/мл |
24,09±0,22 |
5000 КОЕ/мл |
22,59±0,12 |
|
10 - 3 |
2500 КОЕ/мл |
27,33±0,34 |
500 КОЕ/мл |
27,71±0,19 |
|
10 - 4 |
250 КОЕ/мл |
30,96±0,25 |
50 КОЕ/мл |
32,74±0,54 |
|
10 - 5 |
25 КОЕ/мл |
35,00±0,83 |
5 КОЕ/мл |
– |
|
10 - 6 |
2,5 КОЕ/мл |
– |
– |
– |
Примечание. «–» — отрицательный результат реакции.
Исходя на наблюдаемых значениях Ct и стандартных кривых, можно утверждать, что разработанные нами методы продемонстрировали высокую чувствительность и специфичность, а эффективность амплификации (E) составила 90,94 % для M. bovis и 91,85 % для M. bovigenitalium . По данным А.Д. Козловой с соавт. (27), эти значения составили 99 и 87 % соответственно для M . bovis и M . bovigenitalium , а K. Chauhan с соавт. (31) сообщили, что для M. bovis и M. bovigenitalium эффективность амплификации в ПЦР-РВ составила соответственно 88,8 и 100,9 % в синглплексе и 96,8 и 97,9 % в мультиплексе.
В предыдущих исследованиях разные гены M. bovis, включая uvrC (26, 28, 35, 36, 39), gltX (40), fusA (38) и oppD (37), выбирались в качестве мишеней для выявления этого вида с помощью различных вариантов ПЦР. Было показано, что некоторые из этих мишеней не обладают специфичностью для M. bovis (41-44), а многие не прошли достаточной валидации с использованием полевых проб, полученных из дыхательных путей КРС (36, 38, 43). В нашем исследовании разработаны новые методы ПЦР в режиме реального времени на основе гена fusA M. bovis и гена 16S-23S рРНК M. bovigenitalium, и установлено, что эти методы ПЦР-РВ являются более быстрыми, чувствительными, специфичными и менее трудоемкими, чем классическая ПЦР.
В дополнение к этому, в нашей работе провели валидацию праймеров и зондов согласно MIQE (45), рассчитав такие критические валида-ционные параметры ПЦР-РВ, как эффективность амплификации на основе линейной регрессии и коэффициента наклона, воспроизводимость, повторяемость, вариабельность значений Ct при разных постановка ПЦР-РВ.
С помощью разработанных тест-систем мы исследовали 1342 пробы биоматериала от КРС с клиническими признаками репродуктивной и/или респираторной патологии, поступившие в ФГБУ ВНИИЗЖ из 32 субъектов Российской Федерации в период с 2020 по 2022 год. В результате частота выявления ДНК Ì . bovis составила 10,37 %, M . bovigenitalium — 11,08 %, что согласуется с ранее опубликованными нами данными (4).
Итак, для выявления ДНК Mycoplasma bovis и M . bovigenitalium методом ПЦР в реальном времени (ПЦР-РВ) мы разработали и валидировали тест-системы с высокой аналитической чувствительностью (100 %) и специфичностью (100 %). Предел обнаружения ДНК M. bovis и M. bovige-nitalium составил соответственно 25 и 50 КОЕ/мл, эффективность амплификации в ПЦР-РВ — соответственно 90,94 и 91,85 %. С помощью разработанных тест-систем на основе ПЦР-РВ ДНК M. bovis и M. bovigenitalium успешно выявлена в пробах биологического материала. Предложенные тест-системы могут применяться при скрининговых исследованиях на наличие инфекций, вызванных M. bovis и M. bovigenitalium .


