РАЗРАБОТКА УСТРОЙСТВА ДЛЯ НАСТРОЙКИ И ПРОВЕРКИ ОПТИЧЕСКОЙ СИСТЕМЫ ГЕНЕТИЧЕСКОГО АНАЛИЗАТОРА ДЛЯ МАССОВОГО ПАРАЛЛЕЛЬНОГО СЕКВЕНИРОВАНИЯ
Автор: Е. К. Васильева, И. В. Чубинский-Надеждин, В. Е. Курочкин, Я. И. Алексеев, Ю. В. Куликов
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Научные статьи, посвященные памяти Л.Н. Галль
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
Описана разработка устройства для настройки и тестирования оптической системы секвенатора ДНК для массового параллельного секвенирования. Устройство содержит микрофлюидную ячейку с флуоресцентными микросферами, иммобилизованными на плоской поверхности канала ячейки. Микросферы диаметром 1 мкм служат моделью флуоресцентных колоний фрагментов ДНК, образующихся в ходе амплификации и последующего секвенирования. Рассмотрен метод иммобилизации стабильного монослоя микросфер на поверхности канала ячейки.
Секвенатор ДНК, колонии ДНК, флуоресцентные микросферы, микрофлюидная ячейка, оптическая система, цифровые изображения
Короткий адрес: https://sciup.org/142242732
IDR: 142242732 | УДК: 57.08, 681.723.27
Текст научной статьи РАЗРАБОТКА УСТРОЙСТВА ДЛЯ НАСТРОЙКИ И ПРОВЕРКИ ОПТИЧЕСКОЙ СИСТЕМЫ ГЕНЕТИЧЕСКОГО АНАЛИЗАТОРА ДЛЯ МАССОВОГО ПАРАЛЛЕЛЬНОГО СЕКВЕНИРОВАНИЯ
Описана разработка устройства для настройки и тестирования оптической системы секвенатора ДНК для массового параллельного секвенирования. Устройство содержит микрофлюидную ячейку с флуоресцентными микросферами, иммобилизованными на плоской поверхности канала ячейки. Микросферы диаметром 1 мкм служат моделью флуоресцентных колоний фрагментов ДНК, образующихся в ходе амплификации и последующего секвенирования. Рассмотрен метод иммобилизации стабильного монослоя микросфер на поверхности канала ячейки.
Кл. сл. : секвенатор ДНК, колонии ДНК, флуоресцентные микросферы, микрофлюидная ячейка, оптическая система, цифровые изображения
ВВЕДЕНИЕ "цветов" в соответствии со спектром эмиссии при соединенных к нему в данном цикле меченых нук-
Один из современных методов массового параллельного секвенирования (Next Generation Sequencing, NGS) — секвенирование путем синтеза [1–5] — применяется при решении задач медицины и биологии, требующих расшифровки больших объемов нуклеотидных последовательностей ДНК. В генетических анализаторах, построенных на платформе компании Illumina® [2] и подобных, использующих эту технологию, в канале проточной микрофлюидной ячейки формируются десятки миллионов молекулярных колоний различных фрагментов ДНК. Каждая колония локализована в пределах площадки менее 1 мкм2 поверхности канала ячейки и представляет собой множество клоноводного отдельного фрагмента ДНК. Большое число колоний, расположенных с поверхностной плотностью до 106 шт/мм2, обеспечивает статистическую представительность ансамбля различных фрагментов расшифровываемой ДНК.
На следующем этапе производится циклический синтез комплементарных цепочек фрагментов ДНК в каждой колонии, при этом в одном цикле каждая цепочка колонии удлиняется на один комплементарный нуклеотид. Встраивающиеся в синтезируемые цепочки нуклеотиды несут флуоресцентные метки с разными спектральными диапазонами ("цветами") эмиссии — условно G, T, A, C по первым буквам соответствующих нуклеиновых оснований: гуанина, тимина, аденина, цитозина. Поэтому под действием возбуждающего лазерного излучения каждая колония в текущем цикле светится одним из четырех леотидов.
В каждом цикле регистрируют сигналы флуоресценции всех колоний, и последовательность "цветов" детектируемой эмиссии каждой колонии в нескольких десятках-сотнях циклов синтеза отражает уникальную последовательность встроенных нуклеотидов в данной колонии.
Одновременная детекция четырехцветной ла-зер-индуцированной флуоресценции большого числа колоний ДНК осуществляется методами цифровой люминесцентной микроскопии и компьютерной обработки цифровых микроскопических изображений ансамблей колоний. Оптическая система генетического анализатора должна обеспечивать построение изображений распределения колоний на поверхности канала микрофлю-идной ячейки площадью до десятков квадратных миллиметров с субмикронным пространственным разрешением, возбуждение и регистрацию их флуоресценции в четырех спектральных полосах в диапазоне приблизительно от 530 нм до 730 нм.
Для настройки такой сложной оптической системы и проверок правильности ее работы удобно иметь устройство, имитирующее микрофлюидную ячейку с выращенными молекулярными колониями, которое долговременно сохраняло бы свои характеристики. Например, в качестве моделей субмикронных флуоресцирующих колоний можно использовать подходящие флуоресцирующие полимерные микросферы, размещенные на внутренней поверхности ячейки.
Известные устройства для настройки оптических систем, работающих с флуоресцентными сигналами микрообъектов, такие как флуоресцентные оптические миры или пластины с лунками, содержащими окрашенные микросферы [6–7], как правило, могут быть использованы для тестирования только конкретных приборов.
Целью данной работы являлось создание подобного устройства тестирования на базе наборов флуоресцирующих микросфер для настройки и проверки оптической и сканирующей систем генетического анализатора "Нанофор СПС" (разработан ИАП РАН и ООО "Синтол").
Предложенное решение заключается в размещении микросфер на внутренней поверхности канала такой же микрофлюидной ячейки, которая используется для секвенирования в анализаторе "Нанофор СПС". Это обеспечивает проверку работы оптической системы в контролируемых условиях, полностью имитирующих свечение колоний ДНК в процессе секвенирования. Микросферы должны быть подобраны по размерам и по спектральным характеристикам флуоресценции, при этом флуоресценция должна быть долговременно стабильна при воздействии лазерного излучения. Важно зафиксировать необходимое количество частиц на рабочей внутренней поверхности канала мик-рофлюидной ячейки — микросферы не должны смещаться ни в ходе использования устройства, ни с течением времени.
ВЫБОР ПОДХОДЯЩИХ МИКРОСФЕР
Среди разнообразных коммерчески доступных наборов микросфер были выбраны частицы "Fluo-Spheres®" и "FocalCheck™ Thin-Ring Fluorescent Microspheres Kit" от производителя Thermo Fisher Scientific [8]. Они флуоресцируют в четырех спектральных диапазонах, которые достаточно близки к спектрам флуоресценции меченых нуклеотидов при секвенировании. Суспензии микросфер имеют высокую концентрацию (табл. 1), что удобно при создании нужной поверхностной плотности частиц на поверхности канала микрофлюидной ячейки. Микросферы имеют подходящий диаметр — 1.0 мкм.
Здесь целесообразно отметить, что длины волн лазерных источников возбуждения флуоресценции генетического анализатора составляют около 515 нм для каналов G, T и около 638 нм для каналов A, C. Эмитированное излучение регистрируется одновременно в четырех каналах в диапазонах 540–580 нм (G), 590–625 нм (T), 650–675 нм (A) и 680–730 нм (C).
Интенсивность свечения выбранных микросфер достаточна для визуализации одиночных частиц. Как указывает производитель, фотовыцветание микросфер под действием интенсивного лазерного излучения незначительно. Это подтвердили и наши многочисленные экспериментальные оценки при плотности мощности лазерного излучения до 200 мВт/мм2 (длина волны 515 нм).
Табл. 1. Характеристики флуоресцирующих микросфер
|
Краситель (условное название) |
Длина волны максимума возбуждения, нм |
Длина воны максимума эмиссии, нм |
Концентрация, частиц/мл |
Канал регистрации флуоресценции |
|
Зеленый |
540 |
560 |
4 × 1010 |
G |
|
Оранжевый |
580 |
605 |
4 × 1010 |
T |
|
Красный |
625 |
645 |
4 × 1010 |
A |
|
Темно-красный |
660 |
680 |
3 × 108 |
C |
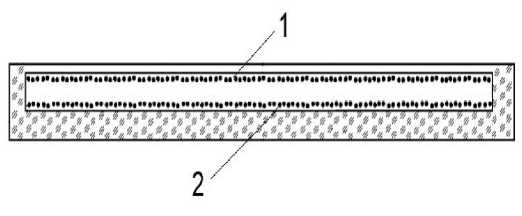
Рис. 1. Разрез рабочего участка канала микро-флюидной ячейки.
1 — колонии на верхней внутренней поверхности канала; 2 — колонии на нижней внутренней поверхности
Выбранные наборы микросфер представляют собой суспензии частиц в буферном растворе с различной концентрацией — от 0.02% до 2% твердого вещества. Для уточнения исходной концентрации микросфер во флаконах образцы с этими частицами разбавили в 104 раз и провели подсчет микросфер в камере Горяева в 15–20 полях зрения, используя прибор ДСКФ-01 [9]. Исходную концентрацию частиц FluoSpheres оценили около 4×1010 шт/мл, а частиц FocalCheck — 3×108 шт/мл (см. табл. 1).
УМЕНЬШЕНИЕ ПОДВИЖНОСТИ И ВЫБОР ОПТИМАЛЬНОЙ КОНЦЕНТРАЦИИ МИКРОСФЕР
Микрофлюидная ячейка в разрезе показана на рис. 1. Она представляет собой ячейку, у которой верхняя и нижняя внутренние поверхности канала параллельны друг другу. Ввод лазерного излучения и выход флуоресценции осуществляется через верхнюю прозрачную поверхность. Ячейка имеет порты для ввода и вывода аналита и реагентов. Молекулярные колонии при секвенировании локализованы на верхней и нижней плоских поверхностях канала (рис. 1). Соответственно, флуоресцирующие микросферы устройства тестирования должны быть локализованы аналогичным образом.
Одной из важных решенных задач стал способ иммобилизации микросфер на поверхностях канала ячейки и формирование из них монослоя, что обеспечило совпадение условий тестирования с условиями реальной процедуры секвенирования.
Для упрощения процедур настройки и тестирования прибора желательно, чтобы микросферы не смещались на внутренней поверхности канала в процессе сканирования образца и их взаимное расположение в разных полях зрения сохранялось. После ввода в канал буферного раствора с микросферами диаметром около 1 мкм и менее они обычно не оседают на дно канала (в отличие от микросфер размером более 3–5 мкм), а хаотически смещаются как вдоль поверхности, так и по глубине канала ячейки. С целью уменьшения подвижности микросфер была увеличена вязкость раствора, в котором они находятся.
При подборе вязкости суспензию с микросферами смешивали в различных соотношениях с прозрачным полимеризующим гелем на основе линейного N,N-полидиметилакриламида (ООО "Синтол", Москва). У используемого геля практически не обнаруживается собственная флуоресценция. Его добавляли к суспензии с микросферами в разных долях с целью найти такое соотношение геля и суспензии, при котором микросферы перестают заметно смещаться, но при этом могут за приемлемое время осесть на поверхность мик-рофлюидной ячейки, разместившись в виде монослоя частиц без образования при этом крупных агрегатов. При избыточной доле геля возникают затруднения при вводе микросфер в канал микро-флюидной ячейки.
Эксперименты проводили при регистрации на приборе ДСКФ-01 цифровых изображений внутренней рабочей поверхности камеры Горяева с введенными суспензиями микросфер. Прибор работал в режиме цифрового микроскопа [9] с объективом 20 × и обеспечивал пространственное разрешение не хуже 1 мкм при шаге дискретизации менее 0.4 мкм (рис. 2). Глубина резкости составляла несколько микрометров, что позволяло при сниженных подвижностях микросфер пренебречь дрейфом по "глубине" канала и следить только за проекциями смещений микросфер на горизонтальную плоскость (X, Y).
Оценку дрейфа частиц проводили (после калибровки шага дискретизации по сетке камеры Горяева) для нескольких десятков микросфер сразу после внесения образца в ячейку и через определенные промежутки времени — несколько раз в течение часа, через несколько часов, через сутки, через несколько дней.
При добавлении геля в суспензию с микросферами в долях от 10% до 25% микросферы сохраняли свою подвижность. Зафиксированы колебания, смещения и единичные длинные перемещения частиц в пределах кадра изображения.

Рис. 2. Фрагмент изображения микросфер в камере Горяева в проходящем свете
Табл. 2. Средняя величина смещения частиц по координатам Х и Y
|
Координата |
Смещение частиц, мкм/мин, при концентрации геля |
||
|
50% |
75% |
90% |
|
|
X |
1.2 ± 1.0 |
0.5 ± 0.6 |
0.0 |
|
Y |
0.9 ± 1.0 |
0.7 ± 0.7 |
0.0 |
Взаимное положение частиц полностью менялось в течение 5–10 мин, наблюдались агрегаты, составившие более 10% от частиц-синглетов.
При смешивании геля и суспензии в соотношении 50 : 50% и 75 : 25% подвижность микросфер значительно уменьшилась, были отмечены колебания и небольшие перемещения частиц — менее 1 мкм/мин. Конфигурация расположения микросфер со временем также радикально менялась и не была узнаваема визуально.
При добавлении 90% доли полимеризующего геля в смесь с микросферами отмечены практически полное прекращение движения частиц (табл. 2) и хорошая стабильность образца в течение нескольких дней, а также небольшое количество агрегатов — не более 1.5% от общего числа частиц.
При использовании микрофлюидной ячейки с флуоресцирующими микросферами для тестирования оптической системы секвенатора важно сформировать на внутренней поверхности канала монослой микросфер, толщина которого не превышает или соизмерима с глубиной резкости оптической системы. Расположение частиц в одной (фокальной) плоскости позволяет осуществлять адекватную настройку фокусировки изображений микронных и субмикронных объектов. В этой связи для более качественного и ускоренного осаждения микросфер на плоскость поверхности канала оказалось целесообразным центрифугировать суспензию с гелем в микрофлюидной ячейке при 4500 об/мин в течение 10–15 мин. Выбрать ту поверхность канала, на которой преимущественно будут осаждаться и фиксироваться микросферы, можно путем выбора ориентации микрофлюидной ячейки в центрифуге.
Концентрация микросфер в суспензии должна быть подобрана таким образом, чтобы после центрифугирования они распределялись равномерно на поверхности канала устройства тестирования, не образовывая крупных агрегатов (более 3–4 частиц), а расстояния между соседними микросферами превышали по крайней мере 2–3 их диаметра. При осаждении могут образовываться агрегаты по 2, 3 и больше частиц, но число указанных агре- гатов должно быть на порядок меньше общего количества осажденных и зафиксированных микросфер.
В принципе, количество микросфер на поверхности канала ячейки можно сделать сопоставимым с числом молекулярных колоний в канале во время секвенирования. Однако поверхностная плотность микросфер около 106 шт/мм2, обычная для колоний в микрофлюидной ячейке секвенатора, не подходит для устройства тестирования, где удобно иметь на поверхности канала преимущественно несоприкасающиеся единичные частицы. Подбором концентрации частиц в смеси геля и суспензии микросфер (от 105 шт/мл до 1010 шт/мл), вводимой в канал ячейки, можно обеспечить диапазон плотностей микросфер на поверхности канала от 102 шт/мм2 до 106 шт/мм2.
Изображения фрагмента поверхности канала устройства тестирования с флуоресцирующими микросферами и фрагмента канала микрофлюид-ной ячейки секвенатора со светящимися колониями ДНК представлены на рис. 3 и рис. 4 соответственно. Изображения получены с помощью оптической системы генетического анализатора "Нанофор СПС" [10]. Для удобства отображения цвета рисунков инвертированы — светящиеся микросферы или колонии на черном фоне представлены как темные круги на светлом поле. В нижней части рисунков показаны профили интенсивности флуоресценции частиц вдоль строки изображения, выделенной маркером. Расчетное значение шага дискретизации изображений равно 0.28 мкм/пиксель с учетом увеличения оптической системы. На графиках по горизонтальной оси — номер пикселя, по вертикальной — относительная интенсивность флуоресценции.
При сравнении общего вида цифровых изображений массивов флуоресцирующих частиц (рис. 3 и 4) и профилей сигналов флуоресценции микросфер и молекулярных колоний не обнаруживаются заметные отличия, которые могли бы повлиять на правильность настройки оптической системы секвенатора с помощью устройства тестирования с микросферами. Представляется, что успешная реализация устройства тестирования оптической
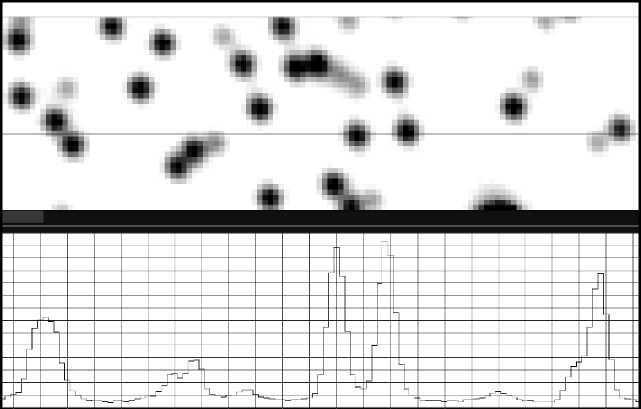
Рис. 3. Изображение фрагмента канала устройства тестирования с микросферами и профиль интенсивности флуоресценции вдоль выделенной строки
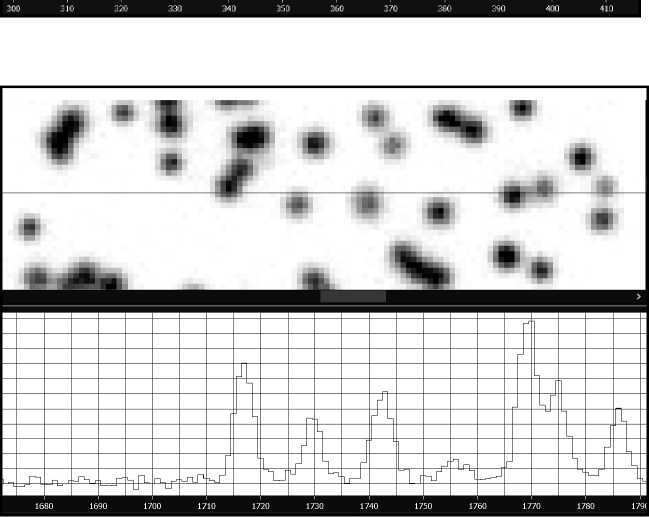
Рис. 4. Изображение фрагмента канала микрофлюидной ячейки с колониями ДНК и профиль интенсивности флуоресценции вдоль выделенной строки системы возможна при использовании описанных выше подходов.
ЗАКЛЮЧЕНИЕ
Таким образом, светящиеся колонии ДНК, формирующиеся в процессе секвенирования, могут быть смоделированы флуоресцентными микросферами микронного размера, зафиксированными на внутренней поверхности канала микро-флюидной ячейки генетического анализатора. Спектры эмиссии микросфер могут быть подобраны в близком соответствии со спектральными каналами регистрации флуоресцентных меток нуклеотидов, которые используются при синтезе фрагментов ДНК в процессе секвенирования. Суспензию из четырех типов микросфер смешивают с гелем для иммобилизации в виде монослоя частиц с концентрацией микросфер от 102 шт/мм2 до 106 шт/мм2.
Микрофлюидная ячейка генетического анализатора, в которую введена смесь (суспензия микросфер + гель), представляет собой устройство для тестирования оптической системы генетического анализатора для массового параллельного секвенирования.
Устройство позволяет настраивать фокусировку оптической системы в четырех спектральных каналах регистрации, производить коррекцию совмещения цифровых изображений различных спектральных каналов, тестировать оптическую систему на наличие аберраций, настраивать и проверять равномерность засветки поля зрения оптической системы в четырех спектральных каналах, проводить настройку и тестирование системы точного сканирования.
Список литературы РАЗРАБОТКА УСТРОЙСТВА ДЛЯ НАСТРОЙКИ И ПРОВЕРКИ ОПТИЧЕСКОЙ СИСТЕМЫ ГЕНЕТИЧЕСКОГО АНАЛИЗАТОРА ДЛЯ МАССОВОГО ПАРАЛЛЕЛЬНОГО СЕКВЕНИРОВАНИЯ
- 1. Bentley R.D., Balasubramanian S., Swerdlow H.P. et al. Accurate whole human genome sequencing using reversible terminator chemistry // Nature. 2008. Vol. 456, no. 6. P. 53–59. DOI: 10.1038/nature07517
- 2. Sequencing platforms. URL: https://www.illumina.com/systems/sequencingplatforms.html
- 3. Shendure J., Balasubramanian S., Church G.M., Gilbert W et al. DNA sequencing at 40: past, present and future // Nature. 2017. Vol. 550. P. 345–353. DOI: 10.1038/nature24286.
- 4. Ansorge W.J. Next-generation DNA sequencing techniques // New Biotechnology. 2009. Vol. 25, no. 4. P. 195–203. DOI: 10.1016/j.nbt.2008.12.009
- 5. Бородинов А.Г., Манойлов В.В., Заруцкий И.В., Петров А.И., Курочкин В.Е. Поколения методов секвенирования ДНК // Научное приборостроение. 2020. Т. 30. № 4. С. 3–20. URL: http://iairas.ru/mag/2020/abst4.php#abst1
- 6. Sammak P., Rosania G., Zana L., et al. Microbead-based test plates and test methods for fluorescence imaging systems. Патент США US20020098588A1.
- 7. Эрни Д.Г., Пинто Д.Ф., Боуэн М.Ш. и др. Testing device and method of its use. Патент РФ № RU2701875C1. URL: https://patents.google.com/patent/RU2701875C1/en
- 8. Thermo Fisher Scientific (дата обращения 12.09.2021). URL: https://www.thermofisher.com/
- 9. Курочкин В.Е., Чубинский-Надеждин И.В. и др. Выявление основных популяций лимфоцитов с помощью цитометрии по изображениям // Медицинская техника. 2019. Т. 53, № 3 (315). С. 5–8. URL: https://www.elibrary.ru/item.asp?id=38215577
- 10. Институт аналитического приборостроения. Каталог приборов. URL: http://iairas.ru/catalog.php


