Развитие большого мучного хрущака (Tenebrio molitor L.) под влиянием антибиотика цефтриаксона
Автор: Мечтаева Е.В., Зеров А.В., Дзюбенко В.В., Сорокоумов П.Н., Новикова М.В., Рябухин Д.С., Журавлва А.З., Ситнов В.Ю.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Технологии waste-to-profit
Статья в выпуске: 3 т.59, 2024 года.
Бесплатный доступ
Антибиотики, попадающие в почву с отходами, а из почвы в растения, способны оказывать влияние на насекомых в их естественной среде обитания. Кроме того, антибиотики часто содержатся в кормах, которые используются не только на животноводческих предприятиях, но и на фермах по выращиванию съедобных и кормовых насекомых. В отходах сельскохозяйственного производства может содержаться значительное количество антибиотиков, которые влияют на рост, развитие и микробиоту насекомых, используемых для их переработки. Цефтриаксон - это антибиотик цефалоспоринового ряда третьего поколения. Влияние антибиотиков цефалоспоринового ряда на насекомых мало изучено, при этом степень влияния зависит как от вида насекомого, так и от типа антибиотика. Большой мучной хрущак - съедобное насекомое, а также вредитель зерновой продукции, который чаще всего обитает в закромах мучных складов, пекарнях, на мельницах, комбикормовых заводах, также рассматривается его использование в биоконверсии отходов. В настоящей работе впервые показано воздействие различных концентраций антибиотика цефтриаксона в кормовом субстрате на массу и выживаемость личинок мучного хрущака, некоторые параметры состава личинок, метаморфоз и численность потомства. Впервые установлена способность T. molitor употреблять кормовой субстрат или перерабатывать отходы, содержащие цефтриаксон. Целью работы была оценка влияния антибиотика цефтриаксона на рост, развитие и размножение большого мучного хрущака. Опыты проводили в инсектарии Всероссийского НИИ пищевых добавок (г. Санкт-Петербург, Россия) с июля по октябрь 2022 года. До эксперимента насекомых выращивали при температуре 25±2 °C и относительной влажности воздуха 50±10 %. Для кормления использовали пшеничные отруби (пищевая ценность на 100 г продукта: белки - 16,0 г, жиры - 4,0 г, углеводы - 65,0 г; ГОСТ 7169-2017. М., 2018) с добавлением моркови в качестве источника влаги. Для исследования были выбраны следующие концентрации цефтриаксона («Биосинтез», Россия): 0; 0,1; 1; 10 и 100 мг/кг сухой массы корма. Для получения корма с определенным содержанием антибиотика готовили растворы цефтриаксона в воде с необходимой концентрацией, добавляли к пшеничным отрубям в соотношении 1:1 при перемешивании, затем отруби высушивали в конвекционном сушильном шкафу UF110plus («Memmert GmbH & Co.KG», Германия) при 40 °С в течение 1 сут при периодическом помешивании. Эксперимент включал три этапа: исследование скорости роста личинок, подсчет окуклившихся и превратившихся в имаго насекомых и оценку яйцекладущей активности T. molitor . Рассчитывали коэффициент конверсии корма (feed conversion ratio, FCR), коэффициент конверсии усвоенного корма (efficiency of conversion of digested food, ECD). Расчет FCR и ECD проводили с учетом влажного корма (моркови) и без учета (только по массе отрубей). Содержание воды в теле личинки определяли, высушивая навеску образцов насекомых на предварительно взвешенных алюминиевых чашечках в вакуумном сушильном шкафу Vacuum Oven OV-12 («Jeio Tech», Корея) при 40 °C до постоянной массы. Для определения зольности личинок высушенные образцы помещали в прокаленные до постоянной массы тигли и сжигали в муфельной печи SNOL 8,2/1100 («Umega Group, AB», Литва) при следующем режиме прокаливания: 60 мин при 250 °C + 6 ч при 550 °C. Жирнокислотный состав определяли методом газовой хроматографии с масс-спектрометрическим детектированием на газовом хроматографе Varian 450-GC («Varian Chromatography Systems», Нидерланды) с масс-спектрометрическим детектором Varian 240-MS («Varian, Inc.»,США). Метилирование и экстракцию жирных кислот из высушенных образцов (сушку проводили в вакуумном сушильном шкафу Vacuum Oven OV-12 при 40 °C) осуществляли с помощью 15 % раствора серной кислоты в метаноле и хлороформа. Было установлено, что добавление цефтриаксона в кормовой субстрат большого мучного хрущака в концентрации 100 мг/кг корма привело к небольшому ускорению набора массы личинками (р = 0,029). Зависимости между выживаемостью личинок T. molitor и концентрацией антибиотика не наблюдалось (р > 0,05). Не обнаружено статистически значимых различий между жирнокислотным составом, коэффициентами конверсии корма, зольностью и содержанием воды в теле личинок, питавшихся кормами с различным содержанием цефтриаксона (p > 0,05). Отсутствовала зависимость между концентрацией антибиотика (0-100 мг/кг) и продуктивностью большого мучного хрущака, а также не обнаружено изменений в процессах окукливания и превращения в имаго при добавлении антибиотика в кормовой субстрат (р > 0,05). Таким образом, T. molitor можно выращивать на кормах, в состав которых входит цефтриаксон, сохраняя при этом жизнеспособность и основные характеристики насекомых, необходимые для их дальнейшего использования в технологиях биоконверсии. Полученные данные также указывают на то, что присутствие антибиотика в естественных кормовых субстратах этого вредителя не препятствует его размножению.
Tenebrio molitor, большой мучной хрущак, антибиотики, цефтриаксон, личинки, имаго, яйцекладущая активность
Короткий адрес: https://sciup.org/142242463
IDR: 142242463 | УДК: 638.45:636.087 | DOI: 10.15389/agrobiology.2024.3.571rus
Текст научной статьи Развитие большого мучного хрущака (Tenebrio molitor L.) под влиянием антибиотика цефтриаксона
Антибиотики используются в сельском хозяйстве для профилактики и лечения инфекционных заболеваний, а также для стимуляции роста животных. Добавление антибиотиков в питьевую воду и корма для сельскохозяйственных животных приводит к их накоплению в тканях (1), молоке (2), перьях (1) и развитию антибиотикорезистентных бактерий в желудочно-кишечном тракте, а также в экскрементах (3). До 90 % некоторых антибиотиков выводятся из организма, не подвергаясь метаболизму (4). С навозом они попадают в почву и оттуда могут поглощаться растениями (4). Антибиотики также оказывают влияние на насекомых в их естественной среде обитания и часто содержаться в кормах для сельскохозяйственных животных, которые используются на фермах по выращиванию съедобных и кормовых насекомых. Помимо этого, в настоящее время изучается возможность биоконверсии навоза и других отходов животноводческих ферм с помощью личинок насекомых. В таких отходах может содержаться значительное количество антибиотиков (0,0004-1420,8 мг/кг) (4, 5), которые, в свою очередь, влияют на рост, развитие и микробиоту насекомых, используемых для их переработки (6-8).
Большой мучной хрущак ( Tenebrio molitor L . , Coleoptera: Tenebrio-nidae) — это весьма распространенный вредитель продукции зернопроиз-водства, но также съедобное насекомое, употребление которого в пищу разрешено в ряде стран, включая страны Евросоюза (9). Большой мучной хрущак содержит около 40 % белка и 30 % жира (10), в состав которого входят линолевая, олеиновая и пальмитиновая кислоты (11), витамины и минералы (12). Много работ посвящено использованию личинок T. molitor в кормах для сельскохозяйственных животных и в аквакультуре (10, 13, 14). Большой мучной хрущак может питаться зерном, мукой и отрубями и часто вредит запасам зерна, распространяясь на комбикормовых заводах, ухудшая качество продукции. При этом показана возможность использования T. molitor для переработки растительных отходов (13).
Влиянию антибиотиков цефалоспоринового ряда на насекомых посвящено мало исследований (чаще рассматриваются антибиотики группы тетрациклинов, сульфаниламидов и хинолонов), хотя степень влияния зависит как от вида насекомого, так и от типа антибиотика (15, 16). Цефтриаксон — это антибиотик цефалоспоринового ряда третьего поколения (2), который преимущественно используется для лечения человека, однако эффективен и для животных.
В настоящей работе впервые показано воздействие различных концентраций антибиотика цефтриаксона в кормовом субстрате на массу и выживаемость личинок мучного хрущака, некоторые параметры состава личинок, метаморфоз и численность потомства. Впервые установлена способность T. molitor употреблять кормовой субстрат или перерабатывать отходы, содержащие цефтриаксон.
Целью работы была оценка влияния антибиотика цефтриаксона на рост, развитие и размножение большого мучного хрущака.
Методика. Опыты проводили в инсектарии Всероссийского НИИ пищевых добавок с июля по октябрь 2022 года. Личинки большого мучного 572
хрущака были взяты из маточной колонии насекомых, содержащихся в инсектарии. До эксперимента насекомых выращивали при температуре 25±2 ° C и относительной влажности воздуха 50±10 %. Для кормления использовали пшеничные отруби (пищевая ценность на 100 г продукта: белки — 16,0 г, жиры — 4,0 г, углеводы — 65,0 г; ГОСТ 7169-2017. М., 2018) с добавлением моркови в качестве источника влаги.
Для исследования были выбраны следующие концентрации антибиотика цефтриаксона («Биосинтез», Россия): 0; 0,1; 1; 10 и 100 мг/кг сухой массы корма. Чтобы получить корм с определенным содержанием антибиотика, готовили водные растворы цефтриаксона необходимой концентрации, добавляли к пшеничным отрубям в соотношении 1:1 при перемешивании, затем отруби высушивали в конвекционном сушильном шкафу UF110plus («Memmert GmbH & Co.KG», Германия) при 40 ° С в течение 1 сут при периодическом помешивании.
Эксперимент включал три этапа: исследование скорости роста личинок, подсчет окуклившихся и превратившихся в имаго насекомых и оценку яйцекладущей активности T. molitor .
На первом этапе эксперимента личинки T. molitor в возрасте 5-7 нед в количестве 200-250 шт. (в каждом образце было известно точное число и масса насекомых) помещали в пластиковые контейнеры объемом 200 мл, содержащие 40,00 г сухого корма с различными концентрациями антибиотика. Контейнеры выдерживали в термостате IN75plus («Memmert GmbH & Co. KG», Германия) при 25±1 ° С и влажности 60±5 % в течение 4 нед. Влажный корм (морковь) выдавался дважды в неделю: по 1,50 г в первые 2 нед эксперимента, по 3,00 г — во вторые 2 нед. Для каждой концентрации антибиотика опыты проводили в 6 биологических повторностях. Через 1 и 2 нед после начала эксперимента по два контейнера для каждой концентрации цефтриаксона вынимали из термостата, личинок отделяли от корма, пересчитывали и взвешивали, после чего помещали обратно. По прошествии 4 нед, когда начали появляться первые куколки, все контейнеры вынимали из термостата. Просеиванием на ситах с разным диаметром отверстий (0,25; 0,5; 1; 3 мм) разделяли экскременты, оставшийся корм и насекомых, все компоненты взвешивали отдельно на аналитических весах GR-200 («AND Co., LTD», Япония). Личинок пересчитывали и по 100 особей возвращали в контейнеры для проведения второго этапа эксперимента (3 повторности из 6), остальных личинок замораживали при - 20 ° С.
На втором этапе по 100 насекомых, оставленных после первого этапа, культивировали в аналогичных условиях в течение 6 нед. В каждый контейнер добавляли по 10,00 г корма. Морковь выдавали по 1,50 г два раза в неделю. Для каждой концентрации антибиотика биологическая повторность была 3-кратной. Каждые 2 нед всех насекомых вынимали из термостата, отделяли от корма, разделяли по стадиям развития (личинки, куколки, имаго), пересчитывали и взвешивали. По прошествии 6 нед насекомых вынимали из контейнеров и замораживали. При этом в контейнерах оставались экскременты и яйца, отложенные жуками за время с момента их появления до окончания второго этапа исследования.
На третьем этапе в контейнеры с яйцами большого мучного хрущака, отложенными на втором этапе, добавляли измельченные пшеничные отруби без антибиотика в количестве 40,00 г и культивировали в течение 1 мес в термостате при 25 °С. Морковь выдавали два раза в неделю в избытке. По окончании эксперимента все личинки (второе поколение) отделяли от корма, пересчитывали и взвешивали. Потомство оценивали количественно делением общего числа личинок 2-го поколения на число имаго, которые были в контейнере с момента их появления до окончания второго этапа исследования, а также на общее число недель, которые имаго провели в контейнерах.
Коэффициент конверсии корма (feed conversion ratio, FCR) рассчитывали по формуле:
FCR = (т корма исх. — т корма кон. )/(Ш личинок кон. — Ш личинок исх. ), где m корма исх. — исходная масса корма, добавленная в контейнер, г; m корма кон. — масса корма, оставшегося после окончания эксперимента, г; m личинок кон. — общая масса личинок после окончания эксперимента, г; m личинок исх. — исходная масса личинок, помещенных в контейнер, г.
Коэффициент конверсии усвоенного корма (efficiency of conversion of digested food, ECD) рассчитывали по формуле:
ECD = (Шличинок кон. сух. - Шличинок исх. сух.)/(Шкорма исх. сух. — Шкорма кон. сух. — — Шэкскрем. кон. сух.), где mличинок кон. сух. — конечная сухая масса личинок, г; mличинок исх. сух. — исходная сухая масса личинок, г; mкорма исх. сух. — исходная сухая масса корма, г; mкорма кон. сух. — конечная сухая масса корма, г; mэкскрем. кон. сух. — сухая масса экскрементов в конце эксперимента, г.
Расчет FCR и ECD проводили с учетом влажного корма (моркови) и без учета (только по массе отрубей).
Содержание воды в теле личинки определяли, высушивая навеску насекомых на предварительно взвешенных алюминиевых чашечках в вакуумном сушильном шкафу Vacuum Oven OV-12 («Jeio Tech», Корея) при 40 ° C до постоянной массы, и рассчитывали по следующей формуле: Содержание воды = (m образца до сушки — Ш образца после сушки )/Ш образца до сушки ½ 100 %.
Для определения зольности личинок высушенные образцы помещали в прокаленные до постоянной массы тигли и сжигали в муфельной печи SNOL 8,2/1100 («Umega Group, AB», Литва) при следующем режиме прокаливания: 60 мин при 250 ° C + 6 ч при 550 ° C. Зольность рассчитывали по уравнению:
Зольность = m образца после сжигания /m образца до сжигания ½ 100 %.
Расчет коэффициентов конверсии корма и конверсии усвоенного корма, а также определение содержания воды и зольности проводили после 4 нед культивирования (первый этап) по результатам в 6 биологических повторностях (при определении зольности — в 4 повторностях).
Жирнокислотный состав определяли методом газовой хроматографии с масс-спектрометрическим детектированием на газовом хроматографе Varian 450-GC («Varian Chromatography Systems», Нидерланды) с масс-спектрометрическим детектором Varian 240-MS («Varian, Inc.», США). Использовали следующие материалы и оборудование: колонка капиллярная WCOT fused silica 50 м½0.25 мм ID Coating CP-WAX 58 (FFAP)-CB DF = 0.2 («Varian, Inc.», США), гелий марки 6.0 (ООО «Технология», Россия), серная кислота (хч, ООО «Щекиноазот», Россия), метанол (особой частоты для градиентной ВЭЖХ, ТД «ХИММЕД», Россия), хлороформ (осч, АО «ЭКОС1», Россия), вода деионизованная, стандарты метиловых эфиров жирных кислот CRM18918 F.A.M.E. Mix, C8-C24 («Sigma-Aldrich», США).
Метилирование и экстракцию жирных кислот из высушенных образцов (сушку проводили в вакуумном сушильном шкафу Vacuum Oven OV-12 при 40 ° C) осуществляли с помощью 15 % раствора серной кислоты в метаноле и хлороформа. Для анализа использовали личинок T. molitor после 4 нед культивирования, опыт проводили в 6 биологических повторностях.
Для всех исследованных параметров рассчитывали средние значения
( M ) и доверительные интервалы ( Δ ) при уровне значимости α = 0,05 с использованием программного обеспечения Microsoft Office Excel 2016. Статистическую значимость разницы между параметрами оценивали с помощью однофакторного дисперсионного анализа (ANOVA) в программном обеспечении RStudio. Различия считались значимыми при р < 0,05. В этом случае также проводили попарное сравнение разницы между средними значениями величин, полученными в каждом эксперименте, методом Тьюки (Tukey's HSD, honestly significant differences, достоверно значимая разница), результаты теста обозначены с помощью буквенных индексов (a, b).
Результаты. Добавление антибиотика цефтриаксона в кормовой субстрат T. molitor в концентрации 100 мг/кг корма привело к небольшому ускорению набора массы личинками (р = 0,029) (рис. 1). Данные по массе личинок на 10-й нед эксперимента отсутствуют, поскольку к этому моменту все личинки окуклились.
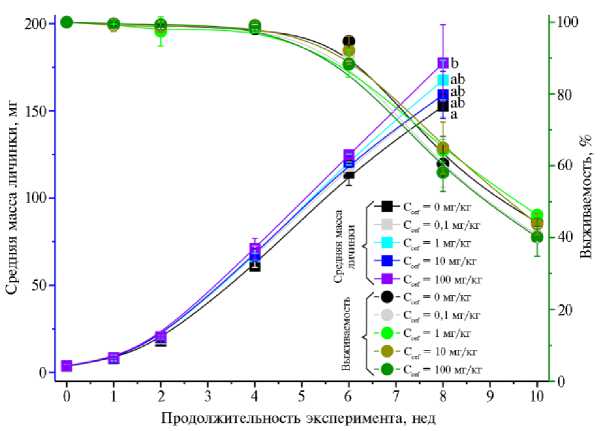
Рис. 1. Выживаемость и средняя масса личинок Tenebrio molitor , культивируемых в субстратах с разными концентрациями цефтриаксона (С cef ) ( n = 6, M ± Δ ) . Буквенные индексы (a, b) обозначают результаты теста Тьюки (если буквы одинаковые — разница незначимая, если разные — значимая).
Антибиотики используются в животноводстве для ускорения роста сельскохозяйственных животных (17). Для насекомых чаще наблюдается снижение массы особей, питающихся субстратами, содержащими антибиотики, или влияние отсутствует. Например, в работе R.A. Sherman с соавт. (15) показано, что высокие концентрации гентамицина приводили к уменьшению массы личинок Phaenicia sericata по сравнению с контрольной группой, тогда как ампициллин, цефазолин, цефтизоксим, клиндамицин, мезло-циллин, и ванкомицин не оказывали значительного влияния. Масса личинок Musca domestica уменьшалась при добавлении в рацион амоксицилина, гентамицина и левофлоксацина (6). Однако есть данные, показывающие положительное влияние антибактериальных препаратов на рост насекомых. Например, масса личинок шелкопряда Bombyx mori увеличивалась с повышением концентрации норфлоксацина, добавляемого в корм (исследовались концентрации 50 и 100 ppm) (18).
Ускоренное увеличение массы у личинок большого мучного хрущака при добавлении в кормовой субстрат цефтриаксона может быть связано с подавлением неблагоприятной микрофлоры (19). Например, D. PreuBer с соавт. (20) связывают повышение выживаемости личинок Calliphora vomitoria при кормлении субстратом, содержащим цефтриаксон и левофлоксацин в концентрациях 0,89-28,57 мг/кг, с подавлением или замедлением развития патогенной для личинок среды. В нашем исследовании не наблюдалось зависимости между выживаемостью личинок T. molitor и концентрацией антибиотика (р > 0,05) (см. рис. 1). Снижение выживаемости большого мучного хрущака после 6 нед эксперимента было вызвано началом процесса окукливания, который связан с увеличением смертности насекомых, а также с существенным возрастанием каннибализма (21).
Более быстрый набор массы личинками под воздействием цефтриаксона можно оценивать как положительный эффект в случае переработки отходов с использованием T. molitor , но это отрицательный фактор, если рассматривать большого мучного хрущака как вредителя. Так, наличие цефтриаксона в комбикорме, зараженном личинками T. molitor , ускорит развитие насекомого и, следовательно, порчу продукции.
Антибиотик в первую очередь активен в отношении микробного сообщества. Хотя взаимодействие микробиоты с насекомыми не описано детально, ее роль в их жизнедеятельности оценивается очень высоко (22). Исходя из этого, можно предполагать действие антибиотика на биохимический состав тела насекомого. В нашем опыте добавление цефтриаксона в субстрат в концентрации 0-100 мг/кг корма не оказало влияния на жирнокислотный состав большого мучного хрущака. Не наблюдалось статистически значимых различий между содержанием проанализированных жирных кислот в личинках, питавшихся кормами с разными концентрациями цефтриаксона (р > 0,05), за исключением линолевой кислоты (С 18:2 ). Количество линолевой кислоты немного снижалось с увеличением концентрации антибиотика согласно ANOVA (р = 0,008), однако метод Тьюки показал отсутствие значимых различий (рис. 2).
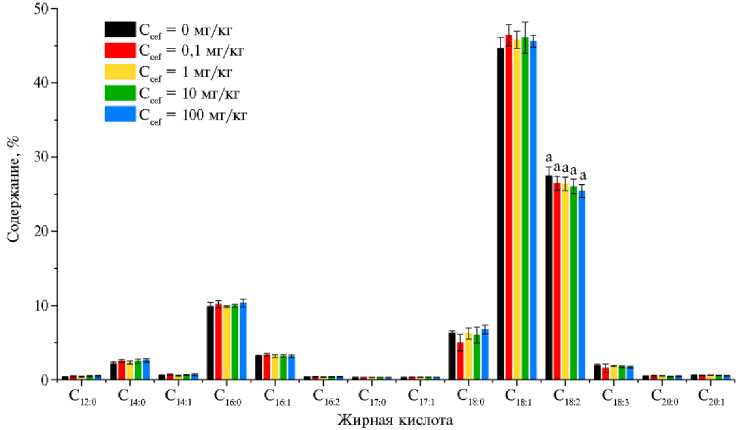
Рис. 2. Жирнокислотный состав личинок Tenebrio molitor после 4 нед культивирования в субстратах с разными концентрациями цефтриаксона (C cef ) ( n = 6, M ± Δ ) . Буквенные индексы (a) обозначают результаты теста Тьюки (если буквы одинаковые — разница незначимая, если разные — значимая).
Следует отметить, что влияние добавления антибиотиков в кормовой субстрат на состав насекомых в настоящее время практически не изучено. По данным L. Goane с соавт. (23), добавление ципрофлоксацина и пиперациллина в количествах 10 и 200 мкг/мл приводило к снижению содержание белка и жира в имаго Anastrepha fraterculus и не влияло на содержание углеводов. Введение в корм рокситромицина и триметоприма, а также пестицидов не оказало влияния на содержание жира в личинках Her-metia illucens (7).
Мы не обнаружили зависимости между концентрацией цефтриаксона в корме и такими параметрами, как зольность насекомых, коэффициенты конверсии корма, содержание воды в теле личинок большого мучного хрущака (p > 0,05) (табл. 1).
1. Коэффициенты конверсии корма, содержание воды и зольность личинок Tenebrio molitor после 4 нед культивирования в субстратах с разными концентрациями цефтриаксона (C cef ) ( M ± Δ )
|
C cef , мг/кг |
Содержание воды в теле личинки, % |
Зольность личинки, % |
FCR (отруби) |
FCR (отруби + морковь) |
ECD (отруби) |
ECD (отруби + морковь) |
|
0 |
60,5±1,8 |
3,8±0,2 |
2,6±0,1 |
3,7±0,1 |
0,39±0,03 |
0,34±0,02 |
|
0,1 |
58,6±3,2 |
3,7±0,3 |
2,8±0,2 |
3,9±0,2 |
0,38±0,10 |
0,31±0,08 |
|
1 |
58,8±2,0 |
3,4±0,3 |
2,7±0,2 |
3,8±0,2 |
0,37±0,01 |
0,33±0,01 |
|
10 |
59,6±2,9 |
3,5±0,1 |
2,7±0,2 |
3,7±0,3 |
0,35±0,02 |
0,32±0,02 |
|
100 |
59,4±3,2 |
3,6±0,2 |
2,6±0,2 |
3,6±0,2 |
0,38±0,02 |
0,34±0,02 |
Примечание. ECD — коэффициент конверсии усвоенного корма, FCR — коэффициент конверсии корма. Расчет ECD и FCR, а также определение содержания воды проводили по результатам 6 биологических повторностей ( n = 6), оценку зольности — по результатам 4 биологических повторностей ( n = 4). Значимых различий между величинами не обнаружено (p > 0,05).
Мы также изучили зависимость процессов окукливания и превращения T. molitor в имаго от концентрации цефтриаксона в кормовом субстрате. Результаты показали, что метаморфоз T. molitor не изменялся при добавлении цефтриаксона в концентрации 0,1-100 мг/кг корма (рис. 3). Согласно данным литературы, антибиотики способны негативно влиять на окукливание насекомых, замедляя процесс или снижая число куколок и вылупившихся имаго. Например, смесь сульфаниламидов в концентрации 10 мг/кг снижала число куколок и имаго черной львинки (8). D. PreuBer с соавт. (20) показали, что смесь цефтриаксона с левофлоксацином в концентрациях 28,57 и 3,57 мг/кг приводит к замедлению окукливания C. vomitoria . Однако в работе A.C.P. Ferraz с соавт. (24) продемонстрировано, что гентамицин в концентрациях 4,44; 13,33 и 66,66 мг/мл не влияет на окукливание и вылупление имаго Chrysomya putoria .
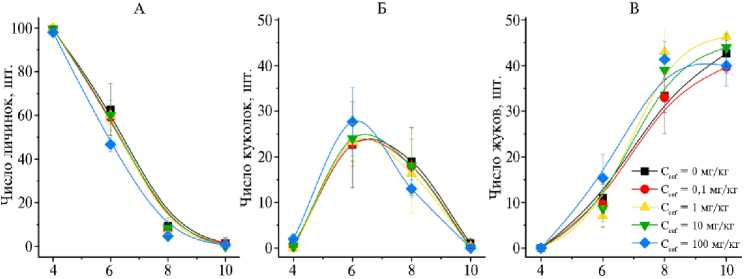
Продолжительность эксперимента, нсд
Рис. 3. Изменения числа личинок (А), куколок (Б) и имаго (В) Tenebrio molitor при культивировании в субстратах с разными концентрациями цефтриаксона (C cef ) ( n = 3, M ± Δ ).
Число и средняя масса личинок 2-го поколения большого мучного хрущака тоже не зависели от добавления антибиотика в кормовой субстрат (р > 0,05) (табл. 2). Широкий разброс значений средней массы личинок был вызван существенным различием в числе личинок 2-го поколения в биологических повторностях эксперимента и, как следствие, неодинаковым количеством и разной доступностью корма для каждой особи в процессе роста. Разница в числе личинок, вероятно, была обусловлена неодинаковым соотношением мужских и женских особей в повторностях.
2. Число и средняя масса личинок 2-го поколения Tenebrio molitor при культивировании в субстратах с разными концентрациями цефтриаксона (C cef ) ( n = 3, M ± Δ )
|
C cef , мг/кг |
Личинки |
2-го поколения |
|
число на 1 жука в нед, шт. |
||
|
средняя масса, мг |
||
|
0 |
1,9±0,4 |
12,6±0,3 |
|
0,1 |
1,5±0,4 |
18,2±5,2 |
|
1 |
1,9±0,8 |
16,3±8,4 |
|
10 |
1,9±0,3 |
11,9±3,4 |
|
100 |
2,5±0,5 |
9,6±0,9 |
|
Примечани е. Значимых различий между величинами не |
обнаружено (p > 0,05). |
|
В литературе чаще описывается негативное влияние антибиотиков на яйцекладущую активность насекомых. Например, L. Goane с соавт. (23) показали, что ципрофлоксацин (10 мкг/мл) и пиперацилин (200 мкг/мл) снижали число яиц, откладываемых самками A. fraterculus . Однако в той же, а также в некоторых других работах (25) авторы указывают, что влияние антибиотика на яйцекладущую активность насекомых зависит от питательности кормового субстрата и при наличии полного набора необходимых для насекомого аминокислот может отсутствовать. Следовательно, при использовании T. molitor для переработки отходов с низкой пищевой ценностью может проявиться негативное влияние. Однако в случае высокопитательного субстрата, содержащего антибиотик, например комбикорма, зерна или других продуктов зернопроизводства и растениеводства, вредителем которых может быть T. molitor , его размножение не замедлится.
Личинки большого мучного хрущака содержат значительное количество белка, поэтому изучается возможность их использования в качестве альтернативного источника белка в производстве продуктов питания (26, 27) и кормов для сельскохозяйственных животных (28, 29). Для эффективного выращивания T. molitor для этих целей в промышленных масштабах требуется определить влияние всех компонентов кормов на развитие насекомого. Многие корма для сельскохозяйственных животных содержат антибиотики, поэтому необходимо понимать вероятное воздействие различных антибиотиков на большого мучного хрущака. Например, показано (30), что антибиотик, полученный из Trichoderma harzianum и добавленный в кормовой субстрат T. molitor в количестве 1000 мг/кг, приводит к гибели 80 % насекомых уже через 17 сут.
Результаты нашего исследования показали, что цефтриаксон в концентрациях 0,1-100 мг/кг корма не оказывает негативного влияния на развитие большого мучного хрущака. Однако в литературе сообщается, что оно проявляется только при существенном увеличении количества антибиотика. Например, гентамицин в концентрации 4, 40, 400 мкг/мл не влиял на массу личинок Phaenicia sericata , однако при концентрации 4000 мкг/мл масса и выживаемость личинок, а также доля особей, превратившихся в имаго, существенно снижались (15). Кроме этого, антибиотики окситетрациклин и тилозин оказывали негативное влияние на выживаемость и репродуктивную способность трех представителей почвенной фауны ( Folsomia fumetaria , Enchytraeus crypticus и Aporrectodea caliginosa ) только при концентрациях выше 3000 мг/кг (16).
Таким образом, антибиотик цефтриаксон в концентрациях 0,1-
100 мг/кг корма не оказывал негативного влияние на рост, развитие и продуктивность большого мучного хрущака. Мы не выявили зависимости между выживаемостью личинок Tenebrio molitor и концентрацией антибиотика. Не обнаружено изменений в процессах окукливания и превращения в имаго при добавлении антибиотика в кормовой субстрат. Коэффициент конверсии корма, содержание воды в теле личинки, зольность и жирнокислотный состав личинок T. molitor после 4 нед культивирования также не зависели от концентрации антибиотика в субстрате. При этом при концентрации цефриаксона 100 мг/кг происходило увеличение средней массы личинки. Следовательно, для выращивания мучного хрущака можно использовать корма, содержащие цефтриаксон в концентрациях до 100 мг/кг. T. molitor способен перерабатывать отходы, в состав которых входит этот антибиотик, сохраняя жизнеспособность и основные характеристики, необходимые для его дальнейшего использования (масса, выживаемость, исследованные параметры химического состава, способность к размножению). Также эти результаты означают, что цефтриаксон не оказывает негативного воздействия на большого мучного хрущака как вредителя продуктов зернопроизводства и растениеводства.
Список литературы Развитие большого мучного хрущака (Tenebrio molitor L.) под влиянием антибиотика цефтриаксона
- Lakew A., Megersa N., Chandravanshi B.S. Trace level enrichment and clean-up of β-lactam antibiotic residues in edible chicken tissues and feathers by solid phase extraction for quantitative determination utilizing liquid chromatography. Bulletin of the Chemical Society of Ethiopia, 2022, 36(3): 503-519 (doi: 10.4314/bcse.v36i3.2).
- Ismail M.M. Pharmacokinetics, urinary and mammary excretion of ceftriaxone in lactating goats. Journal of Veterinary Medicine Series A, 2005, 52(7): 354-358 (doi: 10.1111/j.1439-0442.2005.00744.x).
- Levy S.B. Emergence of antibiotic-resistant bacteria in the intestinal flora of farm inhabitants. The Journal of Infectious Diseases, 1978, 137(5): 688-690.
- Kim K.-R., Owens G., Kwon S.-I., So K.-H., Lee D.-B., Ok Y.S. Occurrence and environmental fate of veterinary antibiotics in the terrestrial environment. Water, Air, & Soil Pollution, 2011, 214: 163-174 (doi: 10.1007/s11270-010-0412-2).
- De Liguoro M., Cibin V., Capolongo F., Halling-Sørensen B., Montesissa C. Use of oxytetracycline and tylosin in intensive calf farming: evaluation of transfer to manure and soil. Chemosphere, 2003, 52(1): 203-212 (doi: 10.1016/s0045-6535(03)00284-4).
- Li T., Zhang Q., Zhang X., Wan Q., Wang S., Zhang R., Zhang Z. Transcriptome and microbiome analyses of the mechanisms underlying antibiotic-mediated inhibition of larval development of the saprophagous insect Musca domestica (Diptera: Muscidae). Ecotoxicology and Environmental Safety, 2021, 223: 112602 (doi: 10.1016/j.ecoenv.2021.112602).
- Lalander C., Senecal J., Calvo M.G., Ahrens L., Josefsson S., Wibergb K., Vinnerås B. Fate of pharmaceuticals and pesticides in fly larvae composting. Science of the Total Environment, 2016, 565: 279-286 (doi: 10.1016/j.scitotenv.2016.04.147).
- Gao Q., Deng W., Gao Z., Li M., Liu W., Wang X., Zhu F. Effect of sulfonamide pollution on the growth of manure management candidate Hermetia illucens. PLoS ONE, 2019, 14(5): e0216086 (doi: 10.1371/journal.pone.0216086).
- EFSA Panel on Nutrition, Novel Foods and Food Allergens (NDA), Turck D., Castenmiller J., De Henauw S., Hirsch-Ernst K.I., Kearney J., Maciuk A., Mangelsdorf I., McArdle H.J., Naska A., Pelaez C., Pentieva K., Siani A., Thies F., Tsabouri S., Vinceti M., Cubadda F., Frenzel T., Heinonen M., Marchelli R., Neuhauser-Berthold M., Poulsen M., Prieto Maradona M., Schlatter J.R., van Lovaren H., Ververis E., Knutsen H.K. Safety of dried yellow mealworm (Tenebrio molitor larva) as a novel food pursuant to Regulation (EU) 2015/2283. EFSA Journal, 2021, 19(1): e06343 (doi: 10.2903/j.efsa.2021.6343).
- Khanal P., Pandey D., Næss G., Cabrita A.R.J., Fonseca A.J.M., Maia M.R.G., Timilsina B., Veldkamp T., Sapkota R., Overrein H. Yellow mealworms (Tenebrio molitor) as an alternative animal feed source: a comprehensive characterization of nutritional values and the larval gut microbiome. Journal of Cleaner Production, 2023, 389: 136104 (doi: 10.1016/j.jclepro.2023.136104).
- Siow H.S., Sudesh K., Murugan P., Ganesan S. Mealworm (Tenebrio molitor) oil characterization and optimization of the free fatty acid pretreatment via acid-catalyzed esterification. Fuel, 2021, 299: 120905 (doi: 10.1016/j.fuel.2021.120905).
- Nowak V., Persijn D., Rittenschober D., Charrondiere U.R. Review of food composition data for edible insects. Food Chemistry, 2016, 193(15): 39-46 (doi: 10.1016/j.foodchem.2014.10.114).
- Ramos-Elorduy J., González E.A., Hernández A.R., Pino J.M. Use of Tenebrio molitor (Coleoptera: Tenebrionidae) to recycle organic wastes and as feed for broiler chickens. Journal of Economic Entomology, 2002, 95(1): 214-220 (doi: 10.1603/0022-0493-95.1.214).
- Шайхиев И.Г., Свергузова С.В., Сапронова Ж.А., Святченко А.В., Ушакова Н.А. Использование биомассы насекомых для выращивания радужной форели в аквакультуре (краткий обзор зарубежной литературы). Вестник астраханского государственного технического университета. Серия: рыбное хозяйство, 2021, 1: 69-81 (doi: 10.24143/2073-5529-2021-1-69-81).
- Sherman R.A., Wyle F.A., Thrupp L. Effects of seven antibiotics on the growth and development of Phaenicia sericata (Diptera: Calliphoridae) larvae. Journal of Medical Entomology, 1995, 32(5): 646-649 (doi: 10.1093/jmedent/32.5.646).
- Baguer A.J., Jensen J., Krogh P.H. Effects of the antibiotics oxytetracycline and tylosin on soil fauna. Chemosphere, 2000, 40: 751-757 (doi: 10.1016/s0045-6535(99)00449-x).
- Aust M.-O., Godlinski F., Travis G.R., Hao X., McAllister T.A., Leinweber P., Thiele-Bruhn S. Distribution of sulfamethazine, chlortetracycline and tylosin in manure and soil of Canadian feedlots after subtherapeutic use in cattle. Environmental Pollution, 2008, 156(3): 1243-1251 (doi: 10.1016/j.envpol.2008.03.011).
- Rahmathulla V.K., Nayak P. Effect of antibiotic administration on growth and development of silk gland in mulberry silkworm (Bombyx mori L.). Munis Entomology & Zoology, 2017, 12(1): 41-49.
- Ahmad A., Broce A., Zurek L. Evaluation of significance of bacteria in larval development of Cochliomyia macellaria (Diptera: Calliphoridae). Journal of Medical Entomology, 2006, 43: 1129-1133 (doi: 10.1603/0022-2585(2006)43[1129:EOSOBI]2.0.CO;2).
- Preußer D., Bröring U., Fischer T., Juretzek T. Effects of antibiotics ceftriaxone and levofloxacin on the growth of Calliphora vomitoria L. (Diptera: Calliphoridae) and effects on the determination of the post-mortem interval. Journal of Forensic and Legal Medicine, 2021, 81: 102207 (doi: 10.1016/j.jflm.2021.102207).
- Ichikawa T., Kurauchi T. Larval cannibalism and pupal defense against cannibalism in two species of tenebrionid beetles. Zoological Science, 2009, 26(8): 525-529 (doi: 10.2108/zsj.26.525).
- Jordan H.R., Tomberlin J.K. Microbial influence on reproduction, conversion, and growth of mass produced insects. Current Opinion in Insect Science, 2021, 48: 57-63 (doi: 10.1016/j.cois.2021.10.001).
- Goane L., Salgueiro J., Pereyra P.M., Arce O.E.A., Ruiz M.J., Nussenbaum A.L., Segura D.F., Vera M.T. Antibiotic treatment reduces fecundity and nutrient content in females of Anastrepha fraterculus (Diptera: Tephritidae) in a diet dependent way. Journal of Insect Physiology, 2022, 139: 104396 (doi: 10.1016/j.jinsphys.2022.104396).
- Ferraz A.C.P., Dallavecchia D.L., Silva D.C., Figueiredo A.L., Proenc B., Silva-Filho R.G., Aguiar V.M. Effects of the antibiotics gentamicin on the postembryonic development of Chrysomya putoria (Diptera: Calliphoridae). Journal of Insect Science, 2014, 14(1): 279 (doi: 10.1093/jisesa/ieu141).
- Ben-Yosef M., Aharon Y., Jurkevitch E., Yuval B. Give us the tools and we will do the job: symbiotic bacteria affect olive fly fitness in a diet-dependent fashion. Proceedings of the Royal Society of London. Series B, Biological Sciences, 2010, 277: 1545-1552 (doi: 10.1098/rspb.2009.2102).
- Gantner M., Krol K., Piotrowska A., Sionek B., Sadowska A., Kulik K., Wiacek M. Adding mealworm (Tenebrio molitor L.) powder to wheat bread: effects on physicochemical, sensory and microbiological qualities of the end-product. Molecules, 2022, 27: 6155 (doi: 10.3390/molecules27196155).
- Kim H.-W., Setyabrata D., Lee Y.J., Jones O.G., Kim Y.H.B. Pre-treated mealworm larvae and silkworm pupae as a novel protein ingredient in emulsion sausages. Innovative Food Science and Emerging Technologies, 2016, 38(A): 116-123 (doi: 10.1016/j.ifset.2016.09.023).
- De Marco M., Martinez S., Hernandez F., Madrid J., Gai F., Rotolo L., Belforti M., Bergero D., Katz H., Dabbou S., Kovitvadhi A., Zoccarato I., Gasco L., Schiavone A. Nutritional value of two insect larval meals (Tenebrio molitor and Hermetia illucens) for broiler chickens: apparent nutrient digestibility, apparent ileal amino acid digestibility and apparent metabolisable energy. Animal Feed Science and Technology, 2015, 209: 211-218 (doi: 10.1016/j.anifeedsci.2015.08.006).
- Sarica S., Kanoglu B., Yildirim U. Defatted yellow mealworm larvae (Tenebrio molitor l.) meal as possible alternative to fish meal in quail diets. South African Journal of Animal Science, 2020, 50(3): 481-491 (doi: 10.4314/sajas.v50i3.15).
- Shakeri J., Fos H.A. Proteolytic activity and antibiotic production by Trichoderma harzianum in relation to pathogenicity to insects. Enzyme and Microbial Technology, 2007, 40: 961-968 (doi: 10.1016/j.enzmictec.2006.07.041).


