Развитие нейрохирургии геморрагического инсульта на современном этапе (обзор)
Автор: Щукри А.А., Ноговицина Е.М.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Нейрохирургия
Статья в выпуске: 2 т.18, 2022 года.
Бесплатный доступ
Цель: анализ тенденций развития нейрохирургии геморрагического инсульта (ГИ) на современном этапе. Исследования проведены с помощью баз Web of Science, Scopus, PubMed, CyberLeninka, eLibrary посредством поиска/анализа источников, опубликованных в течение трех лет, а также отдельных публикаций старше пяти лет (диапазон с 2014 по 2022 г.). Проведен анализ 50 литературных источников. Рассмотрены нейрохирургические подходы к лечению ГИ и актуальные подходы к изучению патологических механизмов, предикторов и факторов риска. Установлено, что большое внимание уделено сравнительному изучению исходов классических и малоинвазивных методов лечения патологии. Увеличение доли последних приводит к снижению уровня летальности при ГИ. Артериальная гипертензия является однозначным фактором риска при развитии патологии. Множество исследований посвящены потенциальным предикторам исходов ГИ (уровню преальбумина, гиперурикемии, соотношению лимфоцитов/нейтрофилов). Особое внимание уделяется механизмам формирования запрограммированных клеточных смертей в послеоперационный период. Не сформирован перечень молекулярно-клеточных предикторов, оптимальных для стратификации риска при ГИ. Необходим поиск терапевтических мишеней посредством углубленного изучения механизмов развития/ремиссии патологии на молекулярно-клеточном уровне.
Внутрижелудочковые кровоизлияния, гематомы, геморрагический инсульт, малоинвазивные методы
Короткий адрес: https://sciup.org/149141143
IDR: 149141143 | УДК: 616.831-005.1
Текст научной статьи Развитие нейрохирургии геморрагического инсульта на современном этапе (обзор)
-
1 Введение. Инсульт в мировом масштабе находится на 1–2-й позициях среди общей смертности и является ведущей причиной инвалидизации взрослого населения. Распространенность ГИ существенно (в 5 раз) ниже, чем таковая для ишемической разновидности. В то же время уровень (до 50% больных) летальности в первом случае гораздо выше, а приобретение инвалидности может достигать 75% по разным регистрам [1]. Чаще ГИ встречается у лиц трудоспособного возраста и проявляется в виде спонтанных субарахноидальных кровоизлияний (САК), внутримозговых гематом (ВМГ) и спонтанных экстра-субдуральных гематом. Причиной САК в 7080% случаев являются артериальные аневризмы головного мозга (ГМ) [2]. Традиционные факторы риска возникновения геморрагического инсульта подраз-
Ответственный автор — Ноговицина Екатерина Михайловна Тел.: +7 (912) 9840767
E-mail: shukry_ali_@spbu. s деляются на модифицируемые (наличие у пациента гипертонии, сахарного диабета, высокий уровень холестерина в крови, сердечно-сосудистые заболевания, мерцательная аритмия, малоподвижный образ жизни, курение/употребление алкоголя) и немодифицируемые (возраст, пол) [3].
Целью настоящего обзора является анализ тенденций развития нейрохирургии геморрагического инсульта на современном этапе.
Локализация ВМГ чаще обнаруживается в зоне подкорковых узлов ГМ. Данные образования по отношению к внутренней капсуле классифицируются на латеральные (путаменальные), медиальные (таламические), субкортикальные (лобарные). Их распространенность в мире по указанным группам среди больных ГИ составляет 55, 10 и 15% соответственно [4].
Исследования проведены посредством поиска и анализа русско- и англоязычной литературы с по-
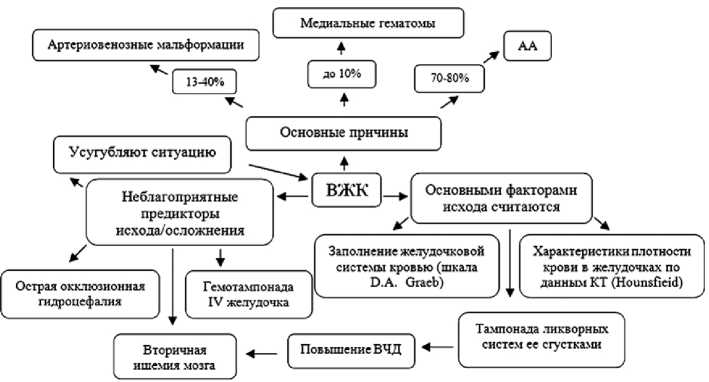
Рис. 1. Внутрижелудочковые кровоизлияния как основной фактор осложнения геморрагического инсульта. Схема составлена по данным [2, 4]: ВЧД — внутричерепное давление, АА — артериальные аневризмы, КТ — компьютерная томография
мощью баз данных Web of Science, Scopus, PubMed, CyberLeninka, eLibrary. Поиск проведен с задачей выявить современные тенденции исследований в сфере ГИ. Данные некоторых авторов оформлялись схематически для улучшения восприятия материала. В отдельные схемы включены несколько оригинальных статей. Это позволило обобщить свежие результаты ряда аспектов изучения ГИ. В основном анализ литературы проводили за 2021– 2022 гг. с включением некоторых источников, опубликованных в течение трех лет, а также единичных публикаций старше пяти лет. Всего рассмотрены 50 литературных источников.
Осложнения, возникающие при геморрагическом инсульте . Наиболее тяжелыми осложнениями ГИ считаются внутрижелудочковые кровоизлияния (ВЖК) (рис. 1), исход которых диагностируется посредством нескольких методов. Летальность при ВЖК составляет 50% и приводит к серьезной инвалидизации выживших [5]. ВЖК преимущественно рассматриваются как независимый предиктор неблагоприятного исхода [6]. Чаще всего (77,8%) ВЖК развиваются при массивных САК, а также иногда при медианной гематоме объемом 29,8±5,6. Частотно встречается II степень тяжести ВЖК, распространенность которой составляет более 60%, остальное приходится на степени I и III по критериям кровяного заполнения и характеристикам плотности сгустка в желудочках мозга по шкалам оценок Graeb и Hounsfield [7]. К другим осложнениям ГИ относят следующие: (1) синдром дислокации срединных структур более 5 мм, (2) признаки компрессии ствола, (3) деформация цистерн.
Текущие стандарты лечения больных ГИ основываются на положениях, отраженных в разработанных в 2020 г. отечественных клинических рекомендациях «Геморрагический инсульт» (URL: ext/Guidelines/, в которых детально описаны операционные возможности при лечении ГИ в зависимости от периода САК: (1) острый (14 дней), в нем выделяют острейший период (0–72 ч, срок до возникновения вазоспазма); (2) по- дострый (15–31 дней, регрессия основные осложнений САК); (3) холодный (≥1 мес., остаточные нарушения). Показанная операция на аневризме, согласно указанным действующим российским клиническим рекомендациям, допускается в острый период, если тяжесть САК I–IV или V по шкале Hunt — Hess. Последняя степень тяжести САК должна быть в комплексе с данными по шкале комы Глазго (Glasgow Coma Scale) 8 баллов, объема ВМГ ≥30 мл. Откладывание операционного вмешательства необходимо при крайне тяжелом состоянии (≥7 баллов по шкале комы Глазго). Важно отметить, что реализация сосудистой программы в Российской Федерации способствовала снижению смертности от острого нарушения мозгового кровообращения в целом, при этом объем хирургической помощи при ГИ увеличился в 7 раз с 2007 по 2016 г. [8].
Немедленное и точное обнаружение ВЖК — ключевая диагностическая составляющая результативности дальнейшего лечения. Разработан алгоритм обнаружения ВЖК «Canon AUTO Stroke», посредством искусственного интеллекта позволяющий точно идентифицировать пациентов с ВЖК и без такового и обнаружить интрапаренхимальные, внутрижелудочковые, субдуральные и САК. Применение алгоритма может значительно улучшить время лечения пациентов с ВЖК [9]. Расширение ВЖК после их возникновения — независимый предиктор худшего исхода. Тяжесть (оценка Graeb ≥5) связана с худшим исходом во время выписки из больницы в отличие от более низкой тяжести (оценка Graeb 1–4) [10]. Примерно у 30% пациентов с ВЖК отмечается расширение гематомы в течение 6 ч после начала неврологического дефицита [11]. Наличие, степень и распределение ВЖК связаны с негативными исходами при аневризматическом САК, а радиоактивность желудочков у пациентов с аневризматическим САК и ВЖК наряду с оценкой шкалы комы Глазго и возрастом, может служить предиктором клинического исхода [12].
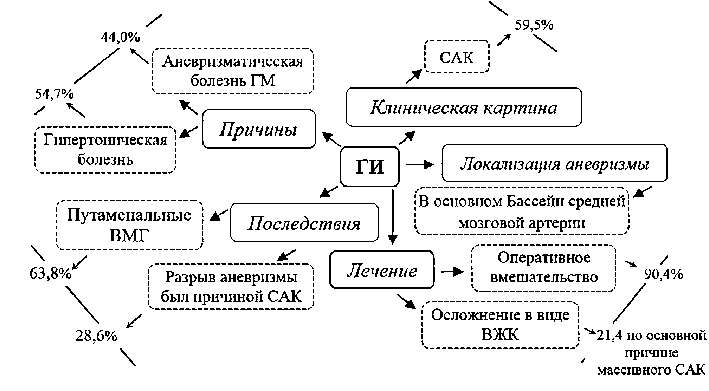
Рис. 2. Структура геморрагического инсульта. Схема составлена по данным М. С. Мустафина с соавт. [2]. Проанализированы 84 истории больных
Проблемы современной нейрохирургии при геморрагическом инсульте. ГИ в целом характеризуется высоким процентом осложнений (рис. 2), что возводит данную патологию в ранг наиболее актуальных проблем в неврологии [2]. Уровни неблагоприятных исходов при ГИ на текущем этапе развития медицины остаются очень высокими: летальность в первые трое суток от его дебюта и через 30 дней — 38-74 и 44-52% соответственно, инвалидизация составляет 70-80% [8, 13].
Первый показатель при ишемическом инсульте составляет только 10-15%. Можно выделить две основные тенденции усовершенствования технологий устранения последствий ГИ: (1) происходит постоянное развитие/внедрение методов диагностики/ле-чения; (2) в результате расширения возможностей борьбы с патологией и в связи с неэффективностью консервативной терапии неуклонно увеличивается процент хирургического лечения ГИ. Ранее 2015 г. диапазон применения операционных вмешательств варьировал от 0 до 20% в разных медицинских учреждениях [14].
Основная проблема лечения ГИ — поиск возможностей усовершенствования хирургического лечения, в основном посредством развития малоинвазивных нейрохирургических технологий. Разработка новых подходов, направленных на операционное вмешательство, подразумевает решение двух задач: удаление гематом/сгустков крови и минимизация повреждения паренхимы мозга. Последняя необходима для уменьшения количества осложнений и послеоперационной летальности [2]. Пункционная аспирация и локальный фибринолиз глубинных паренхиматозных кровоизлияний — основные современные малоинвазивные методы хирургического лечения ГИ с улучшенными исходами по сравнению с открытыми видами оперативных вмешательств [4]. В связи с этим анализ опыта хирургического лечения и факторов риска потенциальных осложнений, их частоты и исходов имеет большое значение для совершенствования тактики ведения больных ГИ [2]. Установлено, что риски медицинских осложнений ГИ включают один определенный провоцирующий фактор, которым часто становится как артериальная гипертензия, так и сахарный диабет. Осложнения при ГИ отмечаются у 75% пациентов с факторами риска. Смертность женщин превышает таковую у мужчин [15]. Начало инсульта >3 ч назад, кровотечение из желудочно-кишечного тракта и инфекция мочевыводящих путей — независимые предикторы плохого прогноза при ГИ [16].
Современные методы лечения геморрагического инсульта. Основные малоинвазивные методы лечения ГИ на современном этапе развития медицинских технологий включают пункционную аспирацию, эндоскопическое удаление гематом под контролем нейронавигационного оборудования, локальный фибринолиз. Данные способы рекомендованы как самые эффективные [2]. Выбор вмешательства зависит от задач и целей нейрохирургического лечения. Так, лечение ВЖК результативно только посредством хирургического метода, а консервативный подход не эффективен. Выбор варианта вмешательства зависит от степени проявления осложнения (рис. 3). В исследованиях М. С. Мустафина с соавт. [2] отсроченные операции выполняются чаще, чем вмешательства в острейший период, а малоинвазивные методы — примерно у половины больных ГИ. Соответственно действующим клиническим рекомендациям «Геморрагический инсульт» в острый период включают следующие оперативные вмешательства: эндоваскулярные операции под наркозом, установку наружного вентрикулярного дренажа при острой гидроцефалии и необходимости купирования внутричерепной гипертензии. Хирургическое лечение больных с осложненным течением САК по шкале Hunt — Hess IV и V тактически затруднительно в связи с тем, что прямое хирургическое вмешательство сопряжено с рисками травматизации отечного мозга и усугублением церебрального вазоспазма, поэтому предпочтительнее эндоваскулярная операция, только в единичных (удаление ВМГ, декомпрессивная трепанация черепа) используется микрохирургическая операция. Два указанных метода допускается применять вторым этапом в холодный период САК.
При исследовании исходов ГИ установлено, что после эндоскопической аспирации ВМГ уровень летальности существенно ниже, чем после открытого удаления (рис. 4). В целом при более щадящем методе удаления гипертензивных субкортикальных ВМГ больше пациентов отличались хорошим восстановлением. Эффективность дополняется простотой исполнения метода [17].
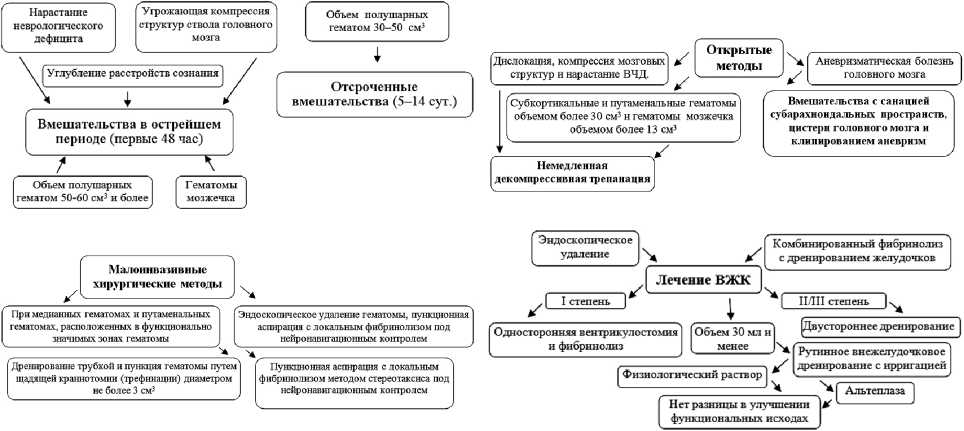
Рис. 3. Основные вмешательства при лечении геморрагического инсульта на современном этапе и лечение внутрижелудочковых кровоизлияний как осложнения геморрагического инсульта. Схемы составлены по данным источников [2, 5–7]
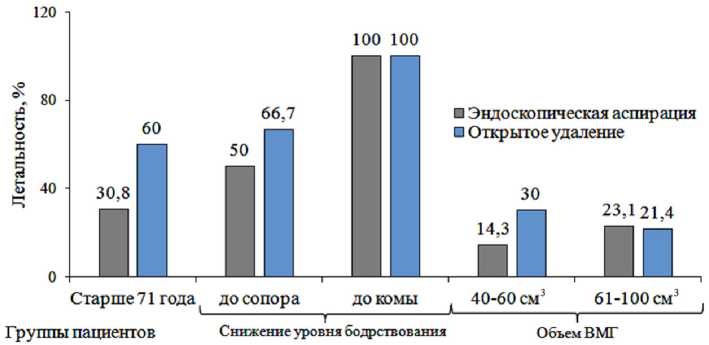
Рис. 4. Сравнительные исследования лечения геморрагического инсульта посредством эндоскопической аспирации или открытого удаления внутримозговых гематом. Гистограмма составлена по данным В. Г. Дашьян с соавт. [18]
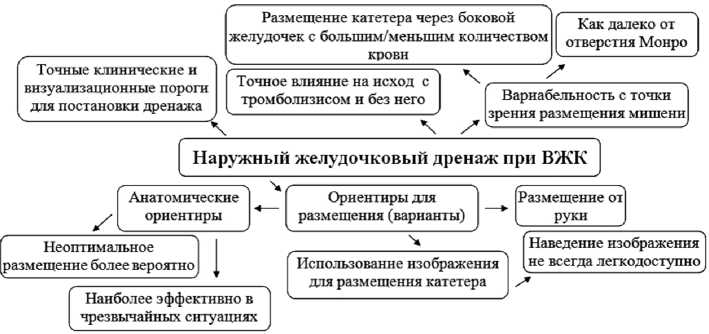
Рис. 5. Вариативность размещения наружного дренажа при геморрагическом инсульте
Необходимы дальнейшие исследования для выявления корреляции между увеличением частоты полного удаления ВЖК с помощью алтеплазы и улучшением функционального статуса [7]. В большинстве случаев повышенное ВЧД и острая гидроцефалия, вызванные ВЖК, управляются размещением наружного желудочкового дренажа [14], в отношении которого до сих пор продолжаются дискуссии (рис. 5).
Эффективность и безопасность хирургического лечения внутримозгового кровоизлияния (ICH) уже давно являются предметом исследований и дискуссий. Недавние результаты исследования minimally invasive surgery plus alteplase for intracerebral hemorrage evacuation (MISTIE) III продемонстрировали безопасность процедуры и снижение смертности по сравнению с медикаментозным лечением. Хотя улучшение функциональных результатов не было показано, исследование показало, что преимущества вмешательства зависят от хирургической эффективности: большее снижение ICH, определяемое как ≤15 мл объема ICH в конце лечения или >70% уменьшения объема, коррелировало со значительным функциональным улучшением. Недавние метаанализы показали преимущества нейрохирургической эвакуации гематомы, особенно при выполнении ранее и с использованием малоинвазивных процедур. В MISTIE III, чтобы подтвердить гемостаз и снизить риск повторного кровотечения, среднее время от начала до операции и завершения лечения заняло 47 и 123 ч соответственно. Теоретически, чем раньше удаляется гематома, тем лучше результат. Таким образом, более высокая скорость уменьшения гематомы в течение более раннего периода может быть полезной. Нейроэндоскопиче-ская хирургия позволяет менее инвазивно удалять ICH при прямой визуализации. Малоинвазивные процедуры продолжают развиваться при поддержке передовых систем наведения и устройств в пользу лучшей хирургической эффективности. Текущие рандомизированные контролируемые исследования с использованием новых малоинвазивных методов, таких как раннее малоинвазивное удаление внутримозгового кровоизлияния (ENRICH), малоинвазивное эндоскопическое хирургическое лечение с помощью Apollo/Artemis у пациентов с кровоизлиянием в мозг (INVEST) и Голландское исследование хирургии внутримозгового кровоизлияния (DIST), могут предоставить значительную информацию об оптимальном лечении ICH.
Локальный фибринолиз проводится посредством различных агентов, в частности пуролазой. Реже при ГИ применяется наружное дренирование желудочков или эндоскопическая тривентрикулостомия, например, при гематомах мозжечка с окклюзией IV желудочка/сильвиева водопровода и развитием гидроцефалии [2]. Известно, что данное вмешательство необходимо проводить до регресса окклюзионной гидроцефалии и восстановления проходимости желудочковой системы [4, 5]. Двустороннее вмешательство требует установки инвазивного оборудования на двух сторонах: в зоне гемотампонады — катетер для вентрикулотромболизиса, на противоположном участке — нейромониторинг посредством вентрикулодренажа или вентрикулярного датчика.
Послеоперационный мониторинг ГИ обязательно включает: (1) компьютерную томографию в динамике (после и через 24 ч после фибринолиза), затем на 7-е и 21-е сутки, если в осложнениях было ВЖК; (2) мониторирование ВЧД до его стойкой нормализации (менее 20 мм рт. ст.) [2].
По-прежнему остаются спорными вопросы в пользу быстрого или постепенного дренирования, а также необходимости чередования закрытия/от-крытия дренажа и ранней установки после САК. Данные подходы приводят к постепенному или быстрому оттоку ликвора. Стратегия ранней установки и периодического дренирования, возможно, является наиболее успешной для пациентов, которым не потребуется длительное отведение спинномозговой жидкости
-
[20]. Имеющиеся данные свидетельствуют также о том, что эндоскопическая операция по удалению ВЖК может быть альтернативой наружного дренажа при сравнении пациентов с равными объемами гематом и с диагнозом ВЖК средней и тяжелой степеней [21].
В целом внедрение малоинвазивных методов лечения ГИ приводит к снижению госпитальной послеоперационной летальности. Так, в исследованиях С. А. Чугуновой с соавт. [22] выявлено снижение показателей в 1,5 раза (с 30,6 до 19,8%) за 2017-2019 гг. В качестве хирургических методов для пациентов с САК использованы микрохирургическое клипирование и микроспиральная эмболизация церебральных аневризм, а также транскраниальное удаление гематом. Минимально инвазивная хирургия, включая эндоскопическую хирургию и стереотаксический тромболизис, стала доступна с развитием техники визуализации, которая позволяет точно достичь назначенного положения и установить рабочий канал для очистки гематомы. Доказано, что малоинвазивная хирургия в некоторых отношениях превосходит консервативное лечение или краниотомию. При этом достигается: (1) уменьшение повреждения тканей ГМ и хирургической травмы; (2) снятие компрессии гематомы путем непосредственного нацеливания на ее область; (3) лечение пациентов с внутричерепной глубокой гематомой; (4) ускорение удаления гематомы; (5) снижение смертности и побочных эффектов, а также улучшение хирургического прогноза. Напротив, некоторые исследования показали, что минимально инвазивная хирургия не снижает смертность и не улучшает отдаленные исходы по сравнению с консервативным лечением или трепанацией черепа, но в целом больше отмечается тенденция улучшения исходов [23].
Гемостатические агенты для уменьшения кровотечения при спонтанном ВЖК, в частности, включают десмопрессин, транексамовую кислоту и rFVIIa (рекомбинантный фактор VIIa). Поставка агентов в течение первых нескольких часов оказывает наибольшее влияние на рост ВЖК и потенциальный исход. Объединенные анализы показывают, что более раннее удаление ВЖК, скорее всего, будет полезным, однако нет подтверждающих это крупных исследований. Будущее терапии ВЖК должно быть направлено на ускоренное обеспечение медикаментозных/хирургических методов [24]. Методы малоинвазивной хирургии разрабатываются с целью снижения заболеваемости из-за осложнений хирургических манипуляций. Механическая малоинвазивная хирургия включает использование трубчатых ретракторов и инструментов малого диаметра для удаления ВМГ. Фармакологические методы заключаются в размещении катетера внутри полости гематомы для ее пассивного дренирования в течение нескольких дней. Одним из наиболее благоприятных подходов для выполнения минимально инвазивных хирургических операций является использование естественных коридоров для достижения поражения, таких как транс-сулькальный парафасциальный доступ. Данный подход обеспечивает анатомическое рассечение субъективных трактов белого вещества, вызывая наименьшее количество повреждений при эвакуации гематомы [25]. Впервые использовано и задокументировано аспирационное устройство с боковой резкой для эндоскопического подхода с целью эвакуации большой гематомы с помощью нейрона- вигации для планирования хирургической траектории доступа. Метод был выбран в связи с данными о рисках и неоптимальных результатах открытой краниотомии. Эвакуация проходила в три основных этапа: (1) начало в центре сгустка для удаления объема; (2) мобилизация сгустков из паренхиматозных стенок в безопасную зону посредством аспирации с последующей гомогенизацией сгустка; (3) повторное расширение полости посредством непрерывного орошения для визуализации дальнейших сгустков. Двойные функциональные возможности устройства (всасывание и всасывание + функции боковой резки) позволили безопасно выполнять ключевые маневры (гомогенизацию сгустка, контроль силы аспирации). Почти полная эвакуация гематомы была достигнута без повреждения окружающей паренхимы. Метод может быть перспективным дополнением к арсеналу малоинвазивной хирургии для эвакуации ВМГ [26].
Хирургическая эффективность при супратенториальном внутримозговом кровоизлиянии остается неизвестной. Сравнение по шкале комы Глазго через семь дней и шесть месяцев после проведения эндоскопии и краниотомии не показало различий, однако время операции значительно сократилось в группе пациентов с эндоскопическим вмешательством по сравнению с группой больных, подвергнутых краниотомии [27]. Установлено, что молодой возраст, отсутствие ВЖК, локализация доли и время эвакуации были независимо связаны с хорошим долгосрочным функциональным исходом у пациентов, перенесших малоинвазивную эндоскопическую эвакуацию супратенториального внутримозгового кровоизлияния. Вместе с тем каждый дополнительный час времени эвакуации приводил к снижению шансов на достижение благоприятного исхода на 5% [28]. Остается актуальным подбор хирургического подхода, обеспечивающего минимизацию рисков интраоперационного кровотечения при минимально инвазивной хирургии [29]. Оптимальные сроки эвакуации гематомы и время до максимального ее удаления остаются неясными и по-прежнему трудно индивидуальное лечение для каждого пациента. Выделяют эндоскопическую эвакуацию (быстрый процесс уменьшения объема гематомы) и стереотаксическую аспирацию (постепенный процесс уменьшения объема гематомы) [30]. Стереотаксическая аспирация спонтанной ВМГ может свести к минимуму повреждение ткани ГМ вследствие операции. Описаны примеры успешного применения метода без антикоагулянта после 24 ч после начала ГИ, с нормализацией уровня сознания у пациентов, ограниченным повреждением мозговой ткани, более короткой продолжительностью операции, более быстрым послеоперационным заживлением и лучшим функциональным улучшением. При этом выбор пациента играет важную роль в определении выбора техники [31]. Так, установлено, что показатель 6-месячной смертности в группе пациентов с ВМГ после эндоскопической аспирации был ниже, чем после краниотомии, но разница не была значимой. В результате анализа подгрупп по объему гематомы установлено, что смертность в группе проведения эндоскопической аспирации была значительно ниже, чем в группе применения стереотаксической аспирации. Наблюдалась тенденция к увеличению смертности в подгруппе больших гематом группы после краниотомии по сравнению с пациентами группы после эндоскопической аспирации. Последний метод может снизить 6-месячную смертность от спонтанного кровоизлияния в базальные ганглии, особенно у пациентов с объемом гематомы ≥40 мл [32]. В другом исследовании установлено, что по сравнению с группой эндоскопической эвакуации 6-месячная смертность была значительно выше в группе стереотаксической аспирации и открытой трепанации черепа (краниотомии). Возраст и грыжа были независимыми предикторами смертности. Не обнаружено достоверной разницы в неврологическом функциональном исходе в группе стереотаксической аспирации и краниотомии по сравнению с группой эндоскопической эвакуации. Таким образом, эндоскопическая эвакуация значительно снизила 6-месячную смертность у пациентов с кровоизлиянием ≥40 мл и результатом по шкале комы Глазго ≤8 [33].
Факторы риска, предикторы и механизмы геморрагического инсульта на современном этапе. Проведен анализ факторов риска неблагоприятного исхода хирургического лечения ГИ и ведущих факторов генеза, среди которых выделяют среди 98,7% больных гипертоническую и аневризматическую болезни ГМ [2]. Наличие в анамнезе сопутствующей патологии сердца (артериальная гипертензия, в частности) или легких (хронические патологии), сахарного диабета, почечной недостаточности. Предоперационные факторы риска: (1) изменение сознания; (2) объем ВМГ; (3) степень поперечной дислокации структур мозга. Их неблагоприятные предикторы включают (1) угнетение до сопора/комы; (2) >50см 3 ; (3) до 10 мм соответственно. К послеоперационным факторам риска относят массивное вентрикулярное кровоизлияние, деформация цистерн ствола мозга, наличие отека/набухания ГМ, развитие гипостатической пневмонии, гнойного трахеобронхита, экссудативного плеврита [2, 34].
Безусловно, ведущую роль в предотвращении развития внутримозговых кровоизлияний играет своевременное и рациональное лечение артериальной гипертензии, общая распространенность которой может составлять 88% [34, 35]. Тенденция линейного возрастания риска ГИ при повышении уровней артериального давления (АД) отмечена также у пациентов c сахарным диабетом I типа [36]. Крупные рандомизированные клинические исследования ранее не демонстрировали преимущества снижения АД, но следует учитывать сопутствующие заболевания, исходное АД и механизм инсульта, а время и цель снижения АД должны быть индивидуализированы на основе этой информации. Когда реперфузия достигается путем тромболизиса или тромбэктомии, снижение АД снижает риск геморрагических осложнений [37]. Гиперхолестеринемия относится к факторам риска, однако выявлено, что уровни общего холестерина и липопротеинов низкой плотности в крови обратно пропорциональны риску развития ГИ [38].
Сравнение летальности в зависимости от типа хирургического вмешательства показало, что применение малоинвазивных методов позволяет сократить долю неблагоприятных исходов в 1,1 и 1,8 раза сократить послеоперационную летальность по сравнению с методами открытого оперативного удаления ВМГ и наружного вентрикулярного дренирования соответственно [14].
Среди патофизиологических механизмов послеоперационных исходов ГИ особое внимание заслуживает рассмотрение клеточно-молекуляр-
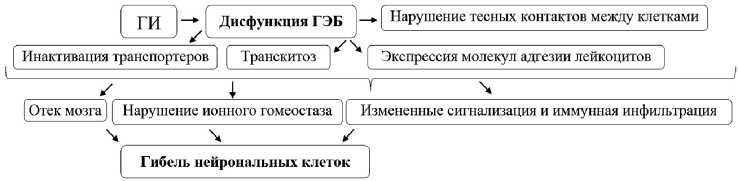
Рис. 6. Схема патофизиологических механизмов после ГИ при неблагоприятных исходах в послеоперационный период: ГЭБ — гематоэнцефалический барьер
ного уровня, так как недавно было обнаружено, что такие запрограммированные клеточные смерти как некро-, пиро- и ферроптоз играют важную роль в исходах лечения (рис. 6).
Установлено, что некро-, пиро- и ферроптоз участвуют в гибели клеток после САК и внутримозгового кровоизлияния. В результате возникает эндотелиальная дисфункция, которая может быть критическим фактором при повреждении гематоэнцефалического, степень дисфункции которого играет критическую роль после ГИ [39]. Необходимо дальнейшее изучение молекулярно-клеточных механизмов развития ГИ и послеоперационного восстановления. Так, выявлено, что рецептор P2X7 может регулировать запрограммированную гибель клеток и его генетическая делеция/фармакологическая блокада способствует нейропротекции [40].
В настоящее время рассматриваются многие предикторы исходов ГИ, в частности отношение периферических нейтрофилов к лимфоцитам (НЛР) как показатель воспаления становится все более распространенным в лечении инсульта. При ГИ повышенное отношение периферических нейтрофилов к лимфоцитам соответствует более высокой вероятности летального исхода [41]. В острой фазе ГИ примерно у ⅓ пациентов может наблюдаться гиперури-кемия. Ее можно считать фактором риска инсульта из-за связи с сердечно-сосудистыми патологиями, но обнаружение повышенных показателей мочевой кислоты не сопоставляется с тяжестью ГИ и краткосрочными исходами [42]. Выявлено, что регулярные измерения сывороточного преальбумина у пациентов с ГИ могут быть полезным индикатором для определения клинического состояния и прогноза. Показатель белка был достоверно ниже у пациентов с ГИ при наличии инфекций и желудочно-кишечных кровотечений и выше — у пациентов с хорошим выздоровлением при выписке, чем для больных с плохим восстановлением [43].
Такие факторы, как хроническая артериальная гипертензия, церебральная амилоидная ангиопатия и антикоагуляция, обычно связаны с ГИ. Хроническая артериальная гипертензия представляет собой основной фактор риска кровотечения, однако заболеваемость ГИ, которая связана с гипертонией, снижается в ряде данных региональной статистики из-за улучшений в лечении хронической артериальной гипертензии. Существует и обратная тенденция развития ГИ в результате приема антагонистов витамина К и новых пероральных антикоагулянтных препаратов, на которые в настоящее время приходится более 15% всех случаев патологии. Хотя вопросы, касающиеся оптимального медицинского и хирургического лечения внутримозговых кровоизлияний, все еще остаются, но недавние клинические испытания, изучающие гемостатическую терапию, контроль АД и методы эвакуации гематомы, продвинули понима- ние устранения последствий ГИ [44]. Установлено также, что гипергликемия приема (при поступлении в стационар) связана с краткосрочной смертностью у пациентов с первичным внутримозговым кровоизлиянием. Не ясно то, связан ли фактор с фактическими особенностями тяжести последнего (объемом гематомы, внутрижелудочковым расширением), или ассоциация со смертностью не зависит от клинических и рентгенологических особенностей ВМГ. Бóльшая часть доказательств основана на однократном измерении глюкозы при поступлении. Установлено, что у пациентов с ГИ без диабета ранняя персистирующая гипергликемия является независимым предиктором краткосрочной смертности независимо от локализации гематомы [45]. Пожилой возраст является фактором риска заболеваемости ГИ и предиктором худшего исхода. Когнитивные нарушения до проявления патологии были идентифицированы как независимый предиктор худших исходов после лечения, поскольку в этом случае пациенты по шкале комы Глазго начинают с более низкого исходного уровня, а у 20% пациентов происходит ухудшение на два или более баллов по шкале комы Глазго между первоначальной оценкой неотложной медицинской помощи и прибытием в отделение неотложной помощи. Данное падение показателей называется неврологическим ухудшением [46]. Основное внимание в существующем лечении уделяется профилактике расширения гематомы, а прогресс состоит в поддерживающем лечении, контроле АД и своевременной отмене антикоагулянтов [47].
Таким образом, большинство авторов указывают, что малоинвазивная нейрохирургия — более эффективный/безопасный подход к лечению ГИ, чем консервативное лечение и краниотомия. Отмечается, что последний метод более травматичен, поэтому связан со значительной потерей крови и требует применения более длительной анестезии [48]. При проведении метаанализа эффективности таких малоинвазивных методов лечения ГИ, как эндоскопическая эвакуация и стереотаксический тромболизис, установлено, что в целом и по отдельности данные методы дают более позитивные результаты в плане уровня летальности, чем медикаментозное лечение и традиционная краниотомия [49]. Однако роль открытой краниотомии для раннего дренирования гематомы после ГИ остается предметом горячих споров. Отдельные специалисты утверждают, что краниотомия для дренирования гематомы остается спасительной мерой в критических ситуациях [50]. Своевременное и агрессивное лечение в острой фазе может смягчить вторичную травму ГМ. Первоначальное лечение должно включать: начальную медицинскую стабилизацию; быструю, точную нейровизуализацию для установления диагноза и выяснения этиологии; стандартизированную неврологическую оценку для определения исходной тяжести; профи- лактику расширения гематомы (управление АД и реверсирование коагулопатии); рассмотрение раннего хирургического вмешательства; профилактику вторичной травмы ГМ [44].
Заключение. Малоинвазивные хирургические методики лечения ГИ отличаются высокой эффективностью. Применение нейронавигационного оборудования позволяет существенно упростить организацию инвазивного вмешательства. Важно отметить, что выявление точной локализации гематомы вкупе с минимизацией размеров трепанационного окна обеспечивает сокращение продолжительности операции и риска затрагивания функционально значимых зон ГМ. Необходимы дальнейшие исследования различных стратегий установки катетера при проведении дренирования посредством анализа контроля ВЧД, закупорки катетера и скорости удаления сгустков крови. Важным является то, что на текущий момент не сформирован перечень молекулярно-клеточных предикторов, оптимальных для стратификации риска при ГИ, а следовательно, и его исходов. Необходим дальнейший поиск потенциальных терапевтических мишеней для лечения ГИ посредством углубленного изучения механизмов развития/ремис-сии заболевания на молекулярно-клеточном уровне. В итоге основная направленность нейрохирургии ГИ — минимизация инвазивных вмешательств. Способам оптимизации молекулярной диагностики уделяется меньше внимания, но предпринимаются попытки поиска эффективного спектра биомаркеров для анализа первоначального состояния пациента и прогноза восстановления.
Список литературы Развитие нейрохирургии геморрагического инсульта на современном этапе (обзор)
- Stakhovskaya LV, Kotova SV. Stroke. A guide for doctors. Moscow: MIA, 2014; p. 234–260. Russian (Стаховская Л. В., Котова С. В. Инсульт. Руководство для врачей. М.: МИА, 2014; C. 234–260).
- Mustafin MS, Novikova LB, Akopyan AP, Shakirov RR. Neurosurgical aspects of hemorrhagic stroke. Annals of Clinical and Experimental Neurology 2018; (1): 19–23. Russian (Мустафин М. С., Новикова Л. Б., Акопян А. П., Шакиров Р. Р. Нейрохирургические аспекты геморрагического инсульта. Анналы клинической и экспериментальной неврологии 2018; (1): 19–23).
- Donkor ES. Stroke in the 21st century: a snapshot of the burden, epidemiology, and quality of life. Stroke Res Treat 2018; (2018): 3238165.
- Krylov VV, Dashyan VG, Godkov IM. Endoscopic surgery for hemorrhagic stroke. Moscow: Binom, 2014; 96 p. Russian (Крылов В. В., Дашьян В. Г., Годков И. М. Эндоскопическая хирургия геморрагического инсульта. М.: Бином, 2014; 96 с.).
- Gaberel T, Magheru C, Parienti JJ, et al. Intraventricular fibrinolysis versus external ventricular drainage alone in intraventricular hemorrhage: A meta-analysis. Stroke 2011; 42 (2): 2776–81.
- Hanley DF, Lane K, McBee N, et al. Thrombolytic removal of intraventricular haemorrhage in treatment of severe stroke: results of the randomised, multicentre, multiregion, placebocontrolled CLEAR III trial. Lancet (London, England) 2017; 389 (10069): 603–11.
- Dey M, Jaffe J, Stadnik A, Awad IA. External ventricular drainage for intraventricular hemorrhage. Current Neurology and Neuroscience Reports 2012; 12 (1): 24–33.
- Skvortsova VI, Shetova IM, Kakorina EP, et al. Reduction in stroke death rates through a package of measures to improve medical care for patients with vascular diseases in the Russian Federation. Profilakticheskaya Meditsina 2018; 21 (1): 4–10. Russian (Скворцова В. И., Шетова И. М., Какорина Е. П. и др. Снижение смертности от острых нарушений мозгового кровообращения в результате реализации комплекса мероприятий по совершенствованию медицинской помощи пациентам с сосудистыми заболеваниями в Российской Федерации. Профилактическая медицина 2018; 21 (1): 4–10).
- Rava RA, Seymour SE, LaQue ME, et al. Assessment of an artificial intelligence algorithm for detection of intracranial hemorrhage. World Neurosurgery 2021; (150): e209–17.
- Trifan G, Arshi B, Testai FD. Intraventricular hemorrhage severity as a predictor of outcome in intracerebral hemorrhage. Front Neurol 2019; (10): 217.
- Song L, Qiu, XM, Guo TT, et al. Association between anatomical location and hematoma expansion in deep intracerebral hemorrhage. Front Neurol 2022; (12): 749931.
- Nguyen HS, Li L, Patel M, et al. Radiodensity of intraventricular hemorrhage associated with aneurysmal subarachnoid hemorrhage may be a negative predictor of outcome. Journal of Neurosurgery 2018; 128 (4): 1032–6.
- Yarikov AV, Balyabin AV, Morev AV. Modern surgical methods for the treatment of hemorrhagic stroke. MediAl magazine 2016; 1 (18): 91–6. Russian (Яриков А. В., Балябин А. В., Морев А. В. Современные хирургические методы лечения геморрагического инсульта. МедиАль 2016; 1 (18): 91–6).
- Yarikov AV, Balyabin AV. Surgical treatment options for hemorrhagic stroke in the Nizhny Novgorod Neurosurgical Center. Medical Almanac 2015; 4 (39): 139–42. Russian (Яриков А. В., Балябин А. В. Варианты хирургического лечения геморрагического инсульта в Нижегородском нейрохирургическом центре. Медицинский альманах 2015; 4 (39): 139–42).
- Sidhartha JM, Purma AR, Reddy LVPK, et al. Risk factors for medical complications of acute hemorrhagic stroke. Journal of Acute Disease 2015; 4 (3): 222–5.
- Pinzon RT, Wijaya VO. Complications as poor prognostic factors in patients with hemorrhagic stroke: A hospital-based stroke registry. Int J Neurol Neurother 2020; (7): 96.
- Yarikov AV, Balyabin AV. Recurrence of traumatic intracranial hematomas. Questions of Traumatology and Orthopedics 2014; 2 (9): 18–20. Russian (Яриков А. В., Балябин А. В. Рецидивы травматических внутричерепных гематом. Вопросы травматологии и ортопедии 2014; 2 (9): 18–20).
- Dashyan VG, Kryachev RYu, Shesterikov YaA, et al. Results of endoscopic and open removal of hypertensive subcortical hematomas. Russian Sklifosovsky Journal of Emergency Medical Care 2021; (1): 100–7. Russian (Дашьян В. Г., Крячев Р. Ю., Шестериков Я. А. и др. Результаты эндоскопического и открытого удаления гипертензивных субкортикальных гематом. Журнал имени Н. В. Склифосовского «Неотложная медицинская помощь» 2021; (1): 100–7).
- Kobata H, Ikeda N. Recent updates in neurosurgical interventions for spontaneous intracerebral hemorrhage: minimally invasive surgery to improve surgical performance. Front Neurol 2021; (12): 703189.
- Chung DY, Mayer SA, Rordorf GA. External ventricular drains after subarachnoid hemorrhage: Is less more? Neurocritical Care 2018; 28 (2): 157–61.
- Zhu J, Tang C, Cong Z, et al. Endoscopic intraventricular hematoma evacuation surgery versus external ventricular drainage for the treatment of patients with moderate to severe intraventricular hemorrhage: a multicenter, randomized, controlled trial. Trials 2020; 21 (1): 640.
- Chugunova SA, Im EV, Sharina SF, et al. Results of introducing new methods of treating stroke in the regional vascular center of Yakutia over a ten-year period. Vestnik of North-Eastern Federal University. Series: Medical Sciences 2021; 1 (22): 76–85. Russian (Чугунова С. А., Им Е. В., Шарина С. Ф. и др. Результаты внедрения новых методов лечения инсульта в региональном сосудистом центре Якутии за десятилетний период. Вестник Северо-Восточного федерального университета им. М. К. Аммосова. Сер.: Медицинские науки 2021; 1 (22): 76–85).
- Hou D, Lu Y, Wu D, et al. Minimally invasive surgery in patients with intracerebral hemorrhage: A meta-analysis of randomized controlled trials. Front Neurol 2022; 12: 789757.
- Broderick J, Grotta J, Naidech A, et al. The story of intracerebral hemorrhage: from recalcitrant to treatable disease. Stroke 2021; 52 (5): 1905–14.
- Marenco-Hillembrand L, Suarez-Meade P, Ruiz Garcia H, et al. Minimally invasive surgery and transsulcal parafascicular approach in the evacuation of intracerebral haemorrhage. Stroke and Vascular Neurology 2019; 5 (1): 40–9.
- Shao J, Witek A, Borghei-Razavi H, et al. Endoscopic evacuation of intracerebral hematoma utilizing a side-cutting aspiration device. Operative Neurosurgery (Hagerstown, Md.) 2020; 18 (6): E248–54.
- Katsuki M, Kakizawa Y, Nishikawa A, et al. Endoscopic hematoma removal of supratentorial intracerebral hemorrhage under local anesthesia reduces operative time compared to craniotomy. Sci Rep 2020; (10): 10389.
- Kellner CP, Song R, Ali M, et al. Time to evacuation and functional outcome after minimally invasive endoscopic intracerebral hemorrhage evacuation. Stroke 2021; 52 (9): e536–9.
- Kellner CP, Schupper AJ, Mocco J. Surgical evacuation of intracerebral hemorrhage: the potential importance of timing. Stroke 2021; 52 (10): 3391–8.
- Xu X, Zheng Y, Chen X, et al. Comparison of endoscopic evacuation, stereotactic aspiration and craniotomy for the treatment of supratentorial hypertensive intracerebral haemorrhage: study protocol for a randomised controlled trial. Trials 2017: (18): 296.
- Fahmi A, Subianto H, Suroto N, et al. Stereotactic aspiration of spontaneous intracerebral hematoma: Case series. International Journal of Surgery Case Reports 2020; (72): 229–32.
- Guo W, Liu H, Tan Z, et al. Comparison of endoscopic evacuation, stereotactic aspiration, and craniotomy for treatment of basal ganglia hemorrhage. J Neurointerv Surg 2020; (12): 55–61.
- Liu H, Wu X, Tan Z, et al. Long-term effect of endoscopic evacuation for large basal ganglia hemorrhage with GCS scores ≦ 8. Front Neurol 2020; (11): 848.
- Dong H, Liu S, Jing L, et al. Hypertension among hemorrhagic stroke patients in northeast China: A populationbased study 2017–2019. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research 2020; (26): e926581.
- Karpova OV, Udalov YuD, Radionova DM. Stem hemorrhagic stroke: treatment approaches and opportunities for rehabilitation. Saratov Journal of Medical Scientific Research 2019; 15 (4): 986–9. Russian (Карпова О. В., Удалов Ю. Д., Радионова Д. М. Стволовой геморрагический инсульт: подходы к лечению и возможности восстановления. Саратовский научно-медицинский журнал 2019; 15 (4): 986–9).
- Hägg-Holmberg S, Dahlström EH, Forsblom CM, et al. The role of blood pressure in risk of ischemic and hemorrhagic stroke in type 1 diabetes. Cardiovascular Diabetology 2019; 18 (1): 88.
- Seung K, Ho W, Yeon K, et al. Blood pressure management in stroke patients. Journal of Neurocritical Care 2020; (13): 69–79.
- Rist PM, Buring JE, Ridker PM, et al. Lipid levels and the risk of hemorrhagic stroke among women. Neurology 2019; 92 (19): e2286–94.
- Fang Y, Gao S, Wang X, et al. Programmed cell deaths and potential crosstalk with blood-brain barrier dysfunction after hemorrhagic stroke. Frontiers in cellular neuroscience 2020: (14): 68.
- Zhao H, Chen Y, Feng H. P2X7 receptor-associated programmed cell death in the pathophysiology of hemorrhagic stroke. Current Neuropharmacology 2018; 16 (9): 1282–95.
- Song SY, Zhao XX, Rajah G, et al. Clinical significance of baseline neutrophil-to-lymphocyte ratio in patients with ischemic stroke or hemorrhagic stroke: an updated meta-analysis. Front Neurol 2019; (10): 1032.
- Mapoure YN, Ayeah CM, Ba H, et al. The prognostic value of serum uric acid in the acute phase of hemorrhagic stroke patients in black Africans. The Pan African Medical Journal 2019; (32): 165.
- Zhang SQ, Peng B, Stary CM, et al. Serum prealbumin as an effective prognostic indicator for determining clinical status and prognosis in patients with hemorrhagic stroke. Neural Regeneration Research 2017; 12 (7): 1097–1102.
- de Oliveira MAL, Goffi A, Zampieri FG, et al. The critical care management of spontaneous intracranial hemorrhage: A contemporary review. Crit Care 2016; (20): 272.
- Forti P, Maioli F, Zoli M. Association of early glycemic change with short-term mortality in lobar and non-lobar intracerebral hemorrhage. Sci Rep 2021; (11): 16059.
- Al-Mufti F, Thabet AM, Singh T, et al. D: Clinical and radiographic predictors of intracerebral hemorrhage outcome. Intervent Neurol 2018; (7): 118–36.
- McGurgan IJ, Ziai WC, Werring DJ, et al. Acute intracerebral haemorrhage: diagnosis and management. Practical Neurology 2021; (21): 128–36.
- Sorogovets AI, Tsirkunova AG, Zubareva AD, Kurash IA. Application of minimally invasive surgery for hypertensive intracerebral hemorrhage. Young Scientist 2018; 46 (232): 92–4. Russian (Сороговец А. И., Циркунова А. Г., Зубарева А. Д., Кураш И. А. Применение малоинвазивной хирургии при гипертензивном внутримозговом кровоизлиянии. Молодой ученый 2018; 46 (232): 92–4).
- Scaggiante J, Zhang X, Mocco J, Kellner CP. Minimally invasive surgery for intracerebral hemorrhage. Stroke 2018; 49 (11): 2612–20.
- de Oliveira Manoel AL. Surgery for spontaneous intracerebral hemorrhage. Crit Care 2020; (24): 45.


