Развитие технологии прижизненного получения ооцитов у коров: современное состояние и направления исследований (обзор)
Автор: Чинаров Р.Ю.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы
Статья в выпуске: 2 т.59, 2024 года.
Бесплатный доступ
Трансплантация эмбрионов - это эффективный метод генетического совершенствования крупного рогатого скота, получивший широкое распространение во всем мире (C. Smith, 1988; Н.А. Зиновьева с соавт., 2020). В 2015 году производство эмбрионов, получаемых in vitro (IVP-эмбрионы), впервые превысило число эмбрионов, получаемых по традиционной технологии MOET (IVD-эмбрионы), после чего продолжило расти, достигнув в 2021 году 79,7 % от общего объема произведенных эмбрионов (J.H.M. Viana, 2022). При этом 98,6 % IVP-эмбрионов получают из ооцитов, извлеченных посредством трансвагфинальной УЗИ-ассистированной пункции фолликулов (Ovum Pick-Up, OPU) (Р.Ю. Чинаров с соавт., 2023). В этой связи особую актуальность приобретает повышение результативности OPU/IVP в отношении количественных и качественных характеристик извлекаемых ооцит-кумулюсных комплексов (ОКК) (L.B. Ferré с соавт., 2023). Для повышения результативности OPU находят применение различные подходы: оптимизация технических параметров проведения OPU; проведение OPU на определенной стадии роста и развития фолликулов; увеличение числа одновременно растущих и созревающих фолликулов с помощью гонадотропинов; применение биомаркеров для отбора коров-доноров. Целью настоящего обзора стало рассмотрение факторов и приемов, которые влияют на количественные и качественные характеристики ооцит-кумулюсных комплексов, получаемых посредством трансвагинальной УЗИ-ассистированной пункции фолликулов, для определения направлений и методических подходов совершенствования технологии OPU/IVP. Показано влияние на результативность OPU таких параметров, как диаметр аспирационной иглы и давление вакуума (В.К. Пестис с соавт., 2016; F.A. Ward с соавт. 2000; Р.Ю. Чинаров с соавт., 2022), при этом оптимальные значения параметров зависят от типа оборудования и особенностей проведения процедуры оператором. Установлено, что результативность OPU может быть повышена при извлечении ОКК непосредственно после проявления фолликулярной волны до селекции доминантного фолликула (O.J. Ginther с соавт., 1996), при этом отмечена тенденция повышения компетенции яйцеклеток к развитию с увеличением размера фолликулов (L.J. Hagemann с соавт., 1999). По мнению других авторов, качество ооцитов не зависит от размера фолликулов, а в большей степени определяется фолликулярной фазой донора (M.M. Seneda с соавт., 2001). К технологическим приемам, используемым для приведения коров-доноров в нужную стадию полового цикла, относятся проведение OPU с определенным интервалом между сессиями, удаление доминантного фолликула и гормональная синхронизации полового цикла (M. Qi с соавт., 2013). В качестве способа повышения эффективности OPU заслуживает внимания стимуляция одновременного роста и развития большего числа фолликулов с помощью экзогенных гонадотропинов - фолликулостимулирующего гормона (ФСГ) и хорионического гонадотропина лошадей (лХГ) (G.A. Bó с соавт., 2014; L.B. Ferré с соавт., 2023), при этом ФСГ в большинстве случаев более эффективен (F. Rivera с соавт., 2011; Ongaratto F.L. с соавт., 2015; Г.Н. Сингина с соавт., 2019). Перспективным подходом повышения результативности OPU считается использование биомаркеров (G. Mazzoni с соавт., 2017; S. Umer с соавт., 2019; R. Kowsar с соавт., 2021). Таким образом, в настоящее время трансвагинальная пункция фолликулов под контролем УЗИ (OPU) - это основной источник яйцеклеток для коммерческого производства эмбрионов коров во всем мире, что обусловливает проведение исследований по повышению результативности OPU. Успехи в развитии технологии OPU/IVP значительны, но необходимо продолжить эксперименты с учетом генетических особенностей пород крупного рогатого скота для определения оптимальных значений технических и технологических параметров процедуры.
Коровы-доноры, ovum pick-up, фолликулы, трансвагинальная узи-ассистированная пункция, получение эмбрионов in vitro, ivp
Короткий адрес: https://sciup.org/142242464
IDR: 142242464 | УДК: 636.22/.28:591.16 | DOI: 10.15389/agrobiology.2024.2.194rus
Текст обзорной статьи Развитие технологии прижизненного получения ооцитов у коров: современное состояние и направления исследований (обзор)
В настоящее время получение эмбрионов in vitro (IVP) с использованием ооцитов, извлекаемых из яичников животных методом трансвагинальной УЗИ-ассистированной пункции фолликулов (Ovum Pick-Up, OPU) (1, 2), рассматривается в качестве альтернативы традиционной технологии
MOET (multiple ovulation and embryo transfer) (3), которая предусматривает вымывание эмбрионов у коров-доноров после полиовуляции и искусственного осеменения (IVD-эмбрионы) (4, 5). OPU — это технология извлечения яйцеклеток из фолликулов яичников коров посредством введения иглы в фолликул яичника и последующей аспирации фолликулярной жидкости при помощи вакуума (рис. 1). По данным международного общества эмбриональных технологий (The International Embryo Technology Society, IETS), c 1998 по 2021 год производство IVP-эмбрионов увеличилось с 85,0 тыс. до более 1,5 млн, превысив в 3,9 раза число получаемых IVD-эмбрионов (6), при этом на долю OPU/IVP-эмбрионов приходилось 98,6 % от общего числа IVP-эмбрионов (7). Конкурентным преимуществом технологии OPU/IVP по сравнению с традиционной технологией MOET служит возможность получения большего числа эмбрионов за определенный период времени даже без использования суперстимуляции, что и стало одной из основных причин постепенного вытеснения с рынка IVD-эмбрионов и их замещения OPU/IVP эмбрионами (6).
Рис. 1. Проведение пункции фолликула у коровы-донора ( Bos taurus ) тагильской породы . Показаны последовательные (с интервалом 0,5 с) фотоизображения яичника лактирующей коровы-донора в процессе пункции фолликула; фолликулы отмечены стрелками, место вхождения иглы в сектор сканирования — звездочкой, кончик иглы — пунктирной стрелкой, пунктируемый фолликул обведен пунктирной линией; интервал фиксации фотоизображений в секундах, начиная с момента визуализации кончика иглы в секторе сканирования, приведен в левом верхнем углу фотографий (фото Р.Ю. Чинарова).
Эффективность технологии OPU/IVP во многом определяется числом и качеством ооцит-кумулюсных комплексов (ОКК), которые могут быть получены от одного донора за сессию. Количество ОКК может быть повышено, с одной стороны, за счет увеличения числа годных к аспирации фолликулов к моменту проведения сессий OPU, с другой — благодаря повышению степени извлечения ОКК.
Качество ооцитов определяют их компетенцией к развитию. Это понятие включает в себя пять уровней компетенций ооцитов, которые представляют ключевые этапы, характеризующие способность ооцитов к дальнейшему развитию: 1 — способность возобновлять мейоз, 2 — способность к делению после оплодотворения, 3 — способность развиваться до стадии бластоцисты, 4 — способность индуцировать и сохранять беременность, 5 — способность к развитию с высоким статусом здоровья (8).
Для повышения количества и качества получаемых ОКК применяются различные подходы, которые подразделяются на четыре группы: 1 — оптимизация технических параметров проведения OPU; 2 — проведение OPU на определенной стадии роста и развития фолликулов; 3 — увеличение количества одновременно растущих и созревающих фолликулов с использованием гонадотропинов; 4 — применение биомаркеров для отбора коров-доноров (рис. 2).
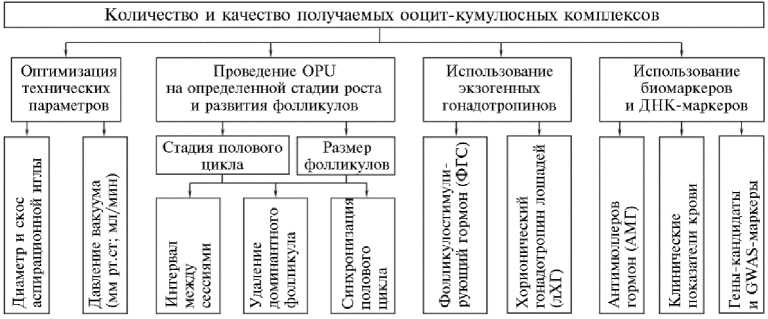
Рис. 2. Подходы, используемые для повышения результативности трансвагинальной УЗИ-асси-стированной пункции фолликулов (Ovum Pick-Up, OPU) у коров. GWAS — полногеномные ассоциативные исследования.
Целью настоящего обзора стало установление факторов и приемов, которые влияют на количественные и качественные характеристики ооцит-кумулюсных комплексов, получаемых посредством трансвагинальной УЗИ-ассистированной пункции фолликулов, для определения направлений и методических подходов дальнейшего совершенствования технологии OPU/IVP.
Технические параметры, оказывающие влияние на результативность OPU, включают диаметр и скос аспирационной иглы (9), давление вакуума (10, 11). Показано, что при увеличении давления вакуума, как правило, повышается степень извлечения ОКК, однако при этом наблюдается тенденция снижения качества ОКК вследствие негативного влияния вакуума на жизнеспособность ооцитов (12). Значения технических параметров в исследованиях разных авторов варьируют (табл. 1), поэтому использованию нового оборудования должно предшествовать тестирование нескольких значений давления вакуума и различных типов игл с целью выбора наиболее оптимальных параметров с учетом конкретного типа оборудования и особенностей работы оператора.
1. Оборудование для трансвагинальной УЗИ-ассистированной пункции фолликулов (Ovum Pick-Up, OPU) у коров
|
Сканнер (производитель, страна) |
ТВ-зонд, МГц |
Вакуумная система (производитель, страна) |
Калибр иглы (диаметр½дли-на, мм) |
Вакуум, мм. рт. ст. (мл/мин) |
Ссылка |
|
Aloka SSD-500V («BCF», Великобритания) |
5,0 |
Craft Duo-vac («Rocket Medical plc.», Великобритания) |
20G |
70-80 |
(13) |
|
Scanner 200 Vet («Pie Medical Imaging BV», Нидерланды) |
7,5 |
VMAR-5100 («Cook Veterinary Products», Австралия) |
19G (1,1½40 мм) |
Нет данных (10-12) |
(14) |
|
Scanner 100S («Pie Medical Imaging BV», Нидерланды) |
7,5 |
VMAR-5100 («Cook Veterinary Products», Австралия) |
20G (0,9½40 мм) |
65 (15) |
(15, 16) |
|
DP 2200 («Mindray», Китай) |
7,5 |
BV 003d («WTA», Бразилия) |
Нет данных |
Нет данных |
(17) |
|
Aloka SSDV 500 («Aloka», Япония) |
5,0 |
«WTA», Бразилия |
20G (0,9½40 мм) |
85-90 |
(18) |
|
Aloka SSDV 500 («Aloka», Япония) |
5,0 |
«WTA», Бразилия |
18G (1,2½50 мм) |
100 |
(19) |
|
ProSound 2 («Aloka», Япония) |
5,0 |
«Minitube», Германия |
18G (1,2½75 мм) 20G (0,9½70 мм) |
80-90 |
(20) |
|
ProSound 2 («Aloka», Япония) |
7,5 |
CRAFT suction unit («Rocket Medical plc.», Великобритания) |
20G (0,9½70 мм) |
Нет данных (25) |
(21) |
Примечание. ТВ-зонд — трансвагинальный зонд.
Определение оптимальной стадии роста и развития фолликулов для проведения OPU, а также разработка приемов приведения животных-доноров в нужную стадию к моменту выполнения процедуры требует обобщения знаний из разных областей наук, включая эмбриологию, репродуктивную биологию и биотехнологию крупного рогатого скота. Необходимо понимание морфологических, физиологических, этологических и других изменений, происходящих в организме самки в течение полового цикла (22).
Как известно, продолжительность полового цикла (интервал между овуляциями) у коров в среднем составляет 18-24 сут (23). С началом половой цикличности в яичниках присутствует популяция как нерастущих (примордиальных), так и растущих фолликулов. Последние, в свою очередь, подразделяются на первичные (преантральные), вторичные (антральные) и третичные (преовуляторные). Известно, что рост фолликулов имеет волнообразный характер. В течение каждой фолликулярной волны происходит превращение одних типов фолликулов в другие в результате процессов, получивших название рекрутирование, отбор, доминирование и атрезия (24, 25). Количество рекрутированных фолликулов у разных животных может существенно различаться, однако у одних и тех же животных этот показатель характеризуется высокой повторяемостью (26, 27).
Фолликулярный резерв формируется в процессе развития плода. Максимальное число примордиальных фолликулов достигается в первом триместре беременности, после чего некоторые из них вступают в дифференцировку (90-е по 140-е сут) (28). Число фолликулов в яичнике при рождении составляет около 130 тыс. и сильно варьирует между животными (29). На число фолликулов могут влиять эпигенетические факторы, такие как обеспеченность матери питательными веществами, заболевания. Известно также о породоспецифических различиях в размере популяции фолликулов. Так, у зебувидного скота ( Bos indicus ) число антральных фолликулов, выявленных в яичниках в начале фолликулярной волны, 2-кратно превышало их число у Bos taurus (30).
Каждая фолликулярная волна приводит к образованию доминантного фолликула, однако в зависимости от стадии полового цикла доминантный фолликул затем или подвергается атрезии, или овулирует. Если фолликулярная волна происходит в лютеальную фазу на фоне функционирующего желтого тела, то вследствие ингибирующего действия гормона прогестерона, синтезируемого желтым телом, передняя доля гипофиза продуцирует лишь ограниченные количества фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ), недостаточные для дальнейшего развития фолликула и овуляции, в результате чего доминантный фолликул регрессирует. На его месте образуется фолликулярная киста (31). Если фолликулярная волна развивается на фоне регрессии желтого тела и связанного с этим прекращения ингибирующего эффекта прогестерона, то доминантный фолликул продолжает расти, становясь зрелым фолликулом, способным к овуляции (рис. 3).
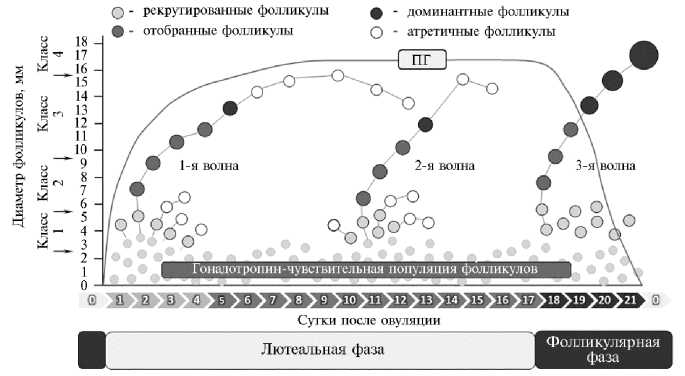
Рис. 3. Схематическое изображение полового цикла у самок крупного рогатого скота (цит. по 32 с изменениями) : 0-е сут — эструс (овуляции), 1-3-е сут — метэструс, 5-17-е сут — диэструс, 18-21-е сут — проэструс; ПГ — относительная динамика содержания циркулирующего прогестерона.


Класс 3


Зрелый* фолликул, готовый к овуляции
Фолликулы, способные к овуляции, что обеспечивается достаточной плотностью рецепторов ЛГ на клетках гранулезы
Фолликулы содержат некоторое количество рецепторов Л Г на клетках гранулезы, поэтому при резком угнетении функции желтых тел (например, при экзогенном воздействии препаратами ПГР2а), они способны к овуляции
Фолликулы, не способные к овуляции, в связи с отсутствием на клетках гранулезы специфических рецепторов к ЛГ
Рис. 4. Характеристика фолликулов разных классов. Звездочкой обозначен зрелый (Граафов, третичный, преовуляторный) фолликул; ЛГ — лютеинизирующий гормон.
Ряд авторов подразделяют растущие фолликулы в зависимости от их размера на четыре класса (32, 33) (рис. 4).
Установлено, что у коров в половом цикле может наблюдаться разное число фолликулярных волн, чаще всего две или три. В исследованиях Н.И. Гавриченко с соавт. (34) на коровах черно-пестрой породы третьей-пятой лактаций у 46,8 % животных было выявлено наличие двух, у 40 % — трех фолликулярных волн; у 6,7 % животных происходило по одной и четыре фолликулярные волны. M.G. Murphy с соавт. (35) отмечают, что при двухволновом половом цикле первая волна роста фолликулов начинается с даты овуляции, вторая — на 9-10-е сут. По данным S.A. Hamilton с соавт. (36) и А.Г. Нежданова (37), первая волна завершается на 11-14-е сут. Р.Г. Кузьмич с соавт. (38) полагают, что при двухволновых половых циклах первая волна роста фолликулов происходит в период с 3-4-х по 10-12-е сут полового цикла. По мнению M.G. Murphy с соавт. (35), при трехволновом половом цикле вторая волна роста начинается на 8-9-е сут, 3-я — на 1617-е сут. У коров черно-пестрой породы белорусской селекции начало второй волны роста фолликулов при двухволновом половом цикле происходило на 10,7±1,4 сут, при трехволновом половом цикле — на 7,0±1,0 сут; начало третьей волны роста фолликулов приходилось на 14,0±0,8 сут (34). Р.Г. Кузьмич с соавт. (38) указывают, что при наличии трех фолликулярных волн каждая из них обычно длится в пределах 2-5, 7-12 и 14-16 сут полового цикла.
В результате второй (при двухволновом цикле) или третьей волны (при трехволновом цикле) доминантный фолликул последней волны роста, который отличается более крупным размером (17,1±1,0 мм), вступает в финальную стадию развития, созревает и в конце полового цикла овулирует (38). Некоторые авторы указывают на то, что половой цикл с меньшим числом волн, как правило, короче. Так, по данным С.П. Перерядки-ной с соавт. (39), продолжительность полового цикла y мясных коров пород казахская белоголовая, шевроле и герефорд с увеличением числа фолликулярных волн возрастала и составляла 19 сут при одной фолликулярной волне, 21 сут — при двух, 24 сут — при трех, 28 сут — при четырех фолликулярных волнах. В то же время у коров черно-пестрой породы белорусской селекции не было выявлено достоверных различий в длительности полового цикла при двух и трех фолликулярных волнах: 20,0±0,4 против 20,8±0,7 сут (40), 21,1±0,9 против 22,9±0,8 сут (34). Продолжительность первой и второй фолликулярных волн в разных исследованиях составляла соответственно 9,5±1,2 и 10,5±1,3 сут (40), 10,7±1,4 и 10,4±1,8 сут (34); первой, второй и третьей — соответственно 6,4±0,7, 8,6±1,1 и 5,8±0,6 сут (40); 6,7±0,9, 7,9±0,7 и 8,3±0,6 сут (34). Также не выявлено различий в диаметре доминантного фолликула при двух и трех фолликулярных волнах: 19,2±1,0 и 19,4±1,0 (40); 17,1±1,0 17,0±1,1 мм (34).
Хотя известно, что жизнеспособные ОКК могут быть получены на любой стадии полового цикла (4, 41), полагают, что компетенция ооцитов к развитию поступательно повышается по мере увеличения размера фолликула и приближения к всплеску ЛГ (42, 43). Было показано, что во время роста в ооцитах коров происходит накопление определенных мРНК и белков, необходимых для поддержания первых нескольких клеточных циклов раннего эмбрионального развития (44, 45). Следовательно, в развитии фолликулов может существовать идеальный период, когда использование ооцитов для получения IVP-эмбрионов оптимально (46).
В этой связи ряд исследований были посвящены определению оптимальной стадии полового цикла для OPU. Высказывалось предположение, что для получения наибольшего числа пригодных для пункции фолликулов оптимальное время для проведения OPU — непосредственно после проявления фолликулярной волны до селекции доминантного фолликула (47, 48).
В работе Р.Ю. Чинарова с соавт. (49) на лактирующих коровах тагильской породы, подвергшихся гормональной синхронизации полового цикла, было установлено, что фаза роста фолликулов наблюдается до 34-х сут индуцированной фолликулярной волны, после чего происходит селекция доминантного фолликула.
M.C. Pieterse с соавт. (50) в течение 3-месячного периода проводили пункцию фолликулов диаметром 3 мм и более на 3-4-е, 9-10-е и 15-16-е сут после начала охоты. Средняя продолжительность полового цикла после начала охоты составила 22,2±0,3 сут, среднее число пунктированных фолликулов за половой цикл — 12,6±0,3. Наибольшее число пунктированных фолликулов наблюдалось на 3-4-е сут полового цикла (5,1±0,3). Степень извлечения ОКК из 541 пунктированного фолликула составила 55 %. Большее число ооцитов было получено из фолликулов диаметром менее 10 мм.
L.J. Hagemann с соавт. (51) извлекали ооциты из фолликулов диаметром 3 мм и более на 2-е, 7-е, 10-е и 15-е сут полового цикла синхронизированных молочных коров, полагая, что 2-е и 10-е сут соответствуют фазе роста фолликулов, в то время как 7-е и 15-е сут — фазе доминирования (выделению и росту доминантного фолликула). Эти же авторы предполагали, что 2-е и 7-е сут соответствуют первой, а 10-е и 15-е сут — второй фолликулярной волне. В качестве контроля использовали ооциты, отобранные на случайной выборке без учета стадии полового цикла. Отбор ооцитов в фазу роста фолликулов на 2-е и 10-е сут полового цикла приводил к повышению выхода бластоцист по сравнению с ооцитами, отобранными в фазу доминирования на 7-е и 15-е сут полового цикла: 44,7 против 31,2 % для общего числа бластоцист (p < 0,001) и 36,0 против 25,1 % для бластоцист, пригодных для пересадки (p < 0,002). Полученные результаты свидетельствуют о значительном влиянии стадии эстрального цикла как на компетенцию ооцитов, так и на степень атрезии фолликулов.
P.J. Hendriksen с соавт. (52) изучали компетенции к развитию OPU-ооцитов, отобранных на трех стадиях индуцированной фолликулярной волны: на 2-е сут (фаза роста фолликулов), 5-е сут (ранняя фаза селекции доминантного фолликула) и 8-е сут (поздняя фаза наличия доминантного фолликула). Фолликулярные волны инициировались посредством пункции доминантного фолликула и всех остальных фолликулов размером ≥ 5 мм на 5-7-е сут полового цикла (приход в охоту — 0-е сут). OPU-сессии проводили между 8-ми и 14-ми сут полового цикла. Концентрации прогестерона в плазме крови не различались между сроками получения яйцеклеток: 4,0±1,8; 5,1±1,6 и 5,2±1,7 нг/мл соответственно на 2-е, 5-е и 8-е сут. Доля яйцеклеток, имеющих три и более слоев не экспандированного кумулюса, на 5-е сут (96 %) была выше, чем на 8-е сут (68 %), в то время как на 2-е сут этот показатель имел промежуточное значение (85 %). Доля яйцеклеток, способных к развитию до стадии бластоцисты в системе получения in vitro, на 2-е и 5-е сут была выше, чем на 8-е сут: 27 и 29 % против 15 % для ооцитов с хорошим кумулюсом и соответственно 23, 27 и 11 %, если учитывались все ооциты.
T. Demissie с соавт. (53) сравнивали результативность OPU у коров породы эфиопский боран на разных стадиях полового цикла. Коровы-доноры были синхронизированы с использованием двух последовательных инъекций 500 мг ПГF2 α с интервалом 11 сут. OPU выполняли при проявлении первых признаков охоты до овуляции (1-я группа, n = 5) или через 7 сут после овуляции (2-я группа, n = 4) в течение 3 нед, дважды в неделю. Авторы не выявили достоверных различий между группами по числу фолликулов, полученных ОКК, а также по степени созревания и степени дробления. В качестве тенденции следует отметить несколько большее количество фолликулов, выявленное в 1-й группе (10,39±0,7 против 9,44±0,64), 200
которое достигалось главным образом за счет увеличения числа мелких фолликулов размером 3-4 мм (4,51+0,43 против 3,41+0,23 мм).
G.D. Goncalves с соавт. (54) изучали влияние стадии гормонально индуцированного полового цикла на выход бластоцист у коров породы вагю. Ооциты, аспирированные на 4-е и 18-е сут после гормонально индуцированной овуляции, имели лучшие компетенции к развитию по сравнению с ооцитами, аспирированными на 8-е сут: выход бластоцист составил соответственно 32,17±16,51 и 25,44±15,96 против 13,82±16,74 (p = 0,0025). Выход бластоцист из ооцитов, аспирированных на 14-е сут после овуляции, составил 20,76±21,33. Авторы сделали вывод, что ооциты, отобранные в начале первой фолликулярной волны, а также в начале и конце второй фолликулярной волны имеют лучшие компетенции в отношении развития до стадии бластоцисты по сравнению с ооцитами, отобранными в конце первой фолликулярной волны.
Поскольку размер фолликулов имеет прямую связь со стадией их роста и развития (см. рис. 2), в качестве критерия для определения оптимальной стадии проведения OPU может быть использован размер фолликулов (51, 55, 56).
A. Pavlok с соавт. (55) в зависимости от размера относили фолликулы к трем классам: А — большие (> 4-8 мм), Б — средние (> 2-4 мм), С — маленькие (> 1-2 мм). Было установлено, что с уменьшением размера фолликулов с 2-8 до 1-2 мм компетенция ооцитов к развитию снижалась. Степень оплодотворения ооцитов снизилась с 84,9 и 83,6 % в группах А и Б до 61,7 % в группе С, степени дробления — с 68,9 и 64,3 % до 19,7 %, доля эмбрионов на 5-8-клеточной стадии — с 36,9 и 32,7 % до 0,4 %, доля бластоцист на 7-е сут — с 27,7 и 20,9 % до 0 %. Степень стельности после пересадки бластоцист групп А и Б составила соответственно 52,6 и 50,0 %. Эти данные позволили сделать вывод о том, что эмбрионы, полученные из фолликулов размером 2-4 и 4-8 мм, имеют аналогичный потенциал развития. Ооциты, извлеченные из фолликулов диаметром 1-2 мм, напротив, обладали значительно меньшей способностью к созреванию и оплодотворению in vitro и в условиях эксперимента были полностью лишены способности к делению после 8-клеточной стадии.
Согласно результатам P. Lonergan с соавт. (42), из фолликулов диаметром > 6 мм по сравнению с фолликулами диаметром 2-6 мм было получено больше ооцитов с шестью и более слоями кумулюса (70,2 % против 46,8 %, p < 0,01), отмечался более высокий выход бластоцист (65,9 против 34,3 %, p <0,01). P. Blondin с соавт. (56) установили, что ни один из эмбрионов, для получения которых были использованы ооциты, извлеченные из фолликулов диаметром менее 3 мм, не достигал стадий более 16 клеток, в то время как при использовании фолликулов диаметром 3-5 мм и более 5 мм соответственно 17 и 21 % эмбрионов продолжали свое развитие. В то же время авторы не наблюдали различий в развитии эмбрионов в системе in vitro до стадии 16 клеток при использовании ооцитов, полученных из фолликулов на разных стадиях развития. Так, доля эмбрионов, достигших стадии 16 клеток, для фолликулов диаметром < 3, 3-5 и > 5 мм составила соответственно 20, 14 и 16 %. На основании полученных данных был сделан вывод, что яйцеклетки приобретают компетенции к развитию на поздних стадиях фолликулярной фазы, возможно, когда появляются первые признаки атрезии. Ооциты диаметром > 5 мм происходят из фолликулов, которые, как правило, атретичны и, следовательно, находятся на более поздних стадиях роста. Вероятно, такие ооциты дольше остаются в фолликулярном микроокружении и более дифференцированы (возможно, на цитоплаз- матическом уровне) по сравнению с другими классами ооцитов. L.J. Hage-mann с соавт. (51) при сравнении фолликулов разного диаметра (3-5, 6-8, 9-12 и > 13 мм) обнаружили, что компетенции ооцитов имели тенденцию к росту с увеличением размера фолликула (p < 0,1). В то же время, согласно данным M.M. Seneda с соавт. (46), качество ооцитов не зависело от размера фолликулов, а в большей степени определялось фолликулярной фазой донора.
К технологическим приемам, используемым для приведения коров-доноров в нужную стадию полового цикла, относятся проведение OPU с определенным интервалом между сессиями, удаление доминантного фолликула и использование гормональной синхронизации полового цикла (57). При определении оптимального интервала между сессиями OPU исходят из того, что аспирация фолликулов в случае удаления доминантного (при его наличии) и всех видимых фолликулов индуцирует запуск новой фолликулярной волны. При проведении сессий OPU один раз в неделю (1/w), в большинстве случаев происходит развитие доминантного фолликула, что приводит к регрессии других фолликулов, вступивших в стадию роста. Увеличение кратности сессий до 2 раз в неделю (2/w) препятствует развитию доминантного фолликула, поскольку все видимые фолликулы аспирируются в процессе OPU. При таком режиме происходит увеличение частоты фолликулярных волн, задержка эстрального цикла, созревания фолликулов и овуляции. Животные вступают в так называемое парафизиологическое состояние, при котором фолликулярные волны независимы от эстрального цикла (4). Увеличение кратности сессий OPU, кроме того, способно обеспечить повышение числа получаемых ОКК хорошего качества за определенный период времени использования доноров (58, 59).
Сравнительный анализ OPU в режиме 1/w и 2/w не выявил различий в числе аспирированных фолликулов, извлеченных ооцитов и бластоцист, полученных на 7-е сут культивирования, в расчете на одну корову за сессию. Однако в расчете на 1 нед все три показателя были значительно выше для режима 2/w по сравнению с 1/w (60-62). Сокращение интервала между сессиями OPU до 2 сут не давало дополнительных преимуществ, поскольку обусловливало снижение числа как пригодных для пункции фолликулов (63), так и извлеченных ооцитов (64), хотя при этом было установлено повышение степени извлечения и качества ооцитов (65). Детальное исследование влияния кратности сессий на результативность OPU было выполнено L.J. Ding с соавт. (66). При использовании пяти различных временных режимов отбора ооцитов для клонирования — 2/w, каждые 3-4 сут (1-я группа); каждые 5 сут (2-я группа); 1/w, каждые 7 сут (3-я группа); каждые 10 сут (4-я группа); 1/2w, каждые 14 сут (5-я группа) — до стадии бласто-цитсты развилось соответственно 23,1; 15,0; 10,9; 4,9 и 29,0 % реконструированных эмбрионов. Эти результаты показывают, что фолликулы одних и тех же доноров имеют неодинаковый потенциал к развитию при использовании различных временных режимов отбора ооцитов, по всей видимости, вследствие положительной связи между интервалом между сессиями OPU и степенью атрезии популяции фолликулов. В наших исследованиях (6) на телках-донорах симментальской породы наибольшее число визуализированных фолликулов наблюдалось при проведении аспирации фолликулов с интервалом 3 сут. В среднем за одну сессию было аспирировано 15,85 фолликула, что на 5,44 (p ≤ 0,001) и на 5,08 (p ≤ 0,001) фолликула превышало значения этого показателя при проведении пункций с интервалом соответственно 4 и 7 сут, при этом доля ОКК хорошего качества между группами существенно не различалась.
Принимая во внимание, что доминантный фолликул снижает способность к развитию ооцитов из субординатных фолликулов на относительно поздней стадии доминирования, его удаление (dominant follicle retrieval, DFR) может стать эффективным приемом программ OPU у коров, у которых отбор яйцеклеток проводится однократно или нерегулярно (52). Полагают, что удаление доминантного фолликула инициирует начало новой фолликулярной волны, что позволяет планировать OPU на оптимальной стадии роста фолликулов.
Так, F.L. Ongaratto с соавт. (67) не выявили различий в результативности OPU при использовании для синхронизации фолликулярной волны приема DFR по сравнению с гормональной обработкой бензоатом эстадиола и прогестероном P4. В эксперименте на коровах голштинской породы (68) было установлено, что доминантный фолликул (> 8 мм в диаметре) развивался у каждого донора в течение 3-5 сут после OPU. Среднее число развивающихся фолликулов (> 2 мм в диаметре) увеличивалось с 1-х по 9-е сут (1-е сут — 7,5±2,1; 3-и сут — 19,0±1,2; 5-е сут — 23,3±9,0; 7-е сут — 30,3±11,0; 9-е сут — 42,0±15,8; 11-е сут — 41,0±16,7; M ±SD, р < 0,05). Для оценки влияния удаления доминантного фолликула провели две последовательные сессии OPU с интервалом 7 сут. В 1-й группе (опытная) на 5-е сут после проведения первой сессии было выполнено удаление фолликулов диаметром более 8 мм, в то время как во 2-й группе (контрольная) эту манипуляцию не проводили. Хотя авторы не выявили различий между группами в день проведения OPU по среднему числу развивающихся фолликулов (47,8±23,0 против 39,3±6,2) и полученных ооцитов (27,0±11,6 против 26,5±5,4), число яйцеклеток 1-й и 2-й степеней в опытной группе по сравнению с контролем оказалось достоверно выше (83,6±1,5 против 63,2±14,2, р < 0,05). Существенных различий между группами по показателям дробления (60,0±37,2, 53,6±23,2) и выхода бластоцист (34,1±33,9, 34,4±16,8) выявлено не было (68). Полученные данные подтверждают, что удаление доминантного фолликула может быть эффективным приемом повышения качества ооцитов, извлекаемых посредством OPU.
Еще один технологический прием приведения коров-доноров в нужную стадию полового цикла для OPU — гормональная синхронизация (6770). Процесс синхронизации основан на управлении лютеиновой фазой полового цикла. С этой целью применяются два подхода: контролируемое удлинение лютеиновой фазы за счет использования экзогенных аналогов прогестерона и контролируемое завершение лютеиновой фазы посредством применения простагландина F2 α (ПГF2 α ) и его аналогов. По сути, все разработанные схемы для приведения доноров в нужную стадию полового цикла — это модификации таких подходов.
Прогестерон (ПГ) и бензоат эстрадиола (ЭБ) индуцируют супрессию ФСГ и атрезию фолликулов, и далее следует начало новой фолликулярной волны, которое наблюдается в среднем через 4 сут после обработки ЭБ + ПГ (71). Исходя из этого, при проведении пункции фолликулов через 2-3 сут после начала фолликулярной волны (то есть через 6-7 сут после инъекции ЭБ + ПГ) большинство аспирированных фолликулов будут иметь диаметр между 4 и 7 мм, что оптимально для достижения лучшей степени извлечения и качества ОКК после OPU (46).
F.L. Ongaratto с соавт. (67) обнаружили, что большее число и лучшее качество ОКК наблюдаются при проведении OPU непосредственно после проявления фолликулярной волны. С этой целью они исследовали влияние синхронизации появления фолликулярной волны посредством внутримышечного введения 2 мг ЭБ и 50 мг ПГ за 6 сут до OPU. В эксперименте участвовали нелактирующие коровы пород брангус (3/8 брама и 5/8 ангус, n = 13) и абердин-ангусская (n = 32). В группе доноров, подвергшихся гормональной обработке, по сравнению с контрольной группой было получено больше фолликулов (12,9±1,1 против 7,3±0,7), больше ОКК (7,9±1,3 против 3,2±0,5) и больше жизнеспособных ОКК (5,2±0,9 против 2,1±0,4, p < 0,05). Эти данные согласуются с результатами P.E. Bols с соавт. (10) и L.J. Hage-mann с соавт. (51), показавшими больший выход бластоцист при извлечении ОКК непосредственно после проявления волны, когда фолликулы еще не находятся под влиянием доминантного фолликула. Следует отметить наличие эффекта породы в отношении показателей результативности OPU при сравнении коров пород абердин-ангусская (Bos taurus) и брангус (1/3 Bos indicus ½ 2/3 Bos taurus). Такие различия появляются вследствие большего размера популяции антральных фолликулов у зебувидного скота по сравнению с B. taurus (72-74). Интересно, что породные различия были отмечены только в отсутствие суперстимуляции. При использовании суперстимуляции число аспирированных фолликулов и извлеченных ОКК между коровами-донорами пород абердин-ангусская и брангус не различались. Эти результаты согласуются с данными других авторов (75). Хотя коровам B. indicus требуются меньшие дозы ФСГ по сравнению с B. taurus, суперовуляторный ответ у них, как правило, сопоставим (75).
В качестве приема, направленного на повышение результативности OPU, нашла применение индукция лютеолиза с использованием ПГF2 α за 3-4 сут до проведения OPU с целью удаления или уменьшения диаметра желтого тела. Отсутствие желтого тела во время OPU приводит к уменьшению перфузии яичника и облегчает визуализацию и пункцию фолликулов.
F.L. Ongaratto с соавт. (67) оценили влияние ПГF2 α и дополнительного применения хорионического гонадотропина лошадей (лХГ) на результативность OPU у нелактирующих коров породы брангус ( n = 20). Цель эксперимента заключалась в тестировании влияния индукции лютеолиза за 3 сут до OPU (для исключения присутствия желтого тела в день OPU) и дополнительного стимулирования развития фолликулов посредством применения лХГ на число и качество ооцитов. Все доноры экспериментальных групп в 0-е сут получали 2,5 мг ЭБ и 50 мг ПГ. На 4-е сут доноры из одной группы получали ПГF2 α (150 мкг клопростенола), в то время как доноры из другой группы — ПГF2 α + 800 МЕ лХГ. OPU проводили на 7-е сут. Было показано, что применение ПГF2 α за 3 сут до OPU приводит к увеличению числа жизнеспособных ОКК (7,9±1,1), в то время как дополнительная обработка лХГ не оказывала влияния на число ОКК (4,5±1,0 против 4,7±0,7 ОКК, полученных в контрольной группе без гормональной обработки). Эти данные согласуются с результатами D. Bacelar с соавт. (76). Следует, однако, отметить, что индукция лютеолиза посредством ПГF2 α может привести к снижению концентрации прогестерона в плазме крови, что способно негативно сказаться на качестве яйцеклеток (77). Хотя такое неблагоприятное влияние на морфологию ОКК не было выявлено F.L. Ongaratto с соавт. (67), необходимы дальнейшие исследования для оценки влияния низкой концентрации прогестерона во время проведения OPU на выход бластоцист.
Увеличение числа одновременно созревающих фолликулов, которые могут быть пунктированы в процессе одной процедуры OPU, может быть достигнуто посредством использования гонадотропных гормонов (78-80). Применение гормональной обработки, направленной на стимуляцию роста фолликулов, уже в течение длительного времени служит традиционной практикой в программах MOET у крупного рогатого скота (81). Это обусловило проведение целого ряда работ, направленных на поиск эффективных 204
протоколов полиовуляции, которые обеспечивают повышение числа и качества овулирующих ооцитов и их компетенций к развитию. Гормональная стимуляция для проведения OPU ориентирована на увеличение к моменту начала процедуры числа фолликулов 2-3-го классов (см. рис. 2) без полиовуляции. Эта процедура получила название суперстимуляции.
Для суперстимуляции применяются препараты на основе фолликулостимулирующего гормона (ФСГ) и плацентарного (хорионического) гонадотропина (ХГ). ФСГ наряду с ЛГ синтезируются передней долей гипофиза, а ХГ синтезируется плацентой в период беременности. По химическому строению эти гормоны является гликопротеинами, состоящими из двух субъединиц — α и β, соединенных нековалентно. α -Субъединицы ФСГ, ЛГ, тиреотропного гормонов и ХГ полностью гомологичны, в то время как β-субъединицы уникальны и отличают эти гормоны друг от друга. ХГ способен связываться с рецепторами как к ФСГ, так и ЛГ, при этом лютеинизирующая активность значительно превышает фолликулостимулирующую, существенно превосходя активность ЛГ, продуцируемого передней долей гипофиза.
Для стимуляции роста фолликулов главным образом используются препараты на основе рекомбинантного ФСГ свиней (cФСГ), а также ХГ лошадей (лХГ), ранее известного как гонадотропин сыворотки жеребых кобыл (ГСЖК). Проведенные сравнительные исследования не выявили однозначных преимуществ использования препаратов ФСГ и лХГ в отношении суперовуляторного ответа. Если в некоторых работах наблюдалась более высокая результативность препаратов на основе ФСГ (82-84), то в ряде других исследований различий между применением ФСГ и лХГ не выявили (81, 85). Вместе с тем препараты на основе лХГ имеют ограниченное применение вследствие пролонгированной стимуляции яичников даже после единственной инъекции препарата, что обусловлено относительно длительным периодом полураспада лХГ (86). Было установлено, что период полураспада лХГ у коров составляет около 40 ч и лХГ персистирует в крови крупного рогатого скота до 10 сут (87). Такая продолжительная стимуляция яичников приводит к аномальным эндокринным профилям и снижению качества эмбрионов (88-90). Так, у животных, обработанных лХГ, чаще наблюдались аномальные профили ЛГ и прогестерона (89, 91), что приводило к снижению доли овулировавших фолликулов и оплодотворяемости по сравнению с использованием препаратов на основе ФСГ (92).
По сравнению с лХГ период полураспада ФСГ намного короче (около 5 ч) (93), что позволяет остановить стимуляцию фолликулов гонадотропинами за определенный период времени до аспирации. Установлено, что при отмене ФСГ за 36-48 ч до проведения OPU в результате процедуры, получившей название периода покоя («coasting»), или голодания ФСГ, компетенция ооцитов и выход бластоцист могут быть повышены (94, 95). P. Blondin с соавт. (94) полагают, что влияние гонадотропинового голодания на эффективность получения IVP-эмбрионов подобно эффекту фолликулярной стадии. Оно имитирует физиологические изменения, наблюдаемые непосредственно перед овуляцией, что приводит к повышению компетенции ооцитов. В отличие от ФСГ, использование для суперстимуляции коров препаратов лХГ не позволяет обеспечить период покоя, что, вероятно, и оказывает негативное влияние на качество ооцитов.
Еще одним существенным различием между препаратами лХГ и ФСГ, способным оказывать влияние на ответ коров на суперстимуляцию, служит активность ЛГ в препаратах лХГ. Установлено, что активность ФСГ и ЛГ может различаться не только в партиях лХГ, полученных от разных жеребых кобыл, но и от одних и тех же кобыл на разных стадиях жеребости (87). Была выявлена положительная корреляция между соотношением активности ФСГ/ЛГ в лХГ и ответом на суперовуляцию. Более низкие соотношения ФСГ/ЛГ приводили к пониженному овуляторному ответу у неполовозрелых крыс, а добавление ЛГ в препараты лХГ снижало суперовуляторный ответ у коров (87). Кроме того, высокие концентрации ЛГ в процессе суперстимуляции приводили к преждевременной активации ооцитов (90). Очищенные гипофизарные экстракты с низкой контаминацией ЛГ обеспечивают хороший ответ на суперовуляцию у коров (86). Как для препаратов ФСГ, так и для препаратов ЛГ показано влияние породы на результативность ответа на суперстимуляцию. Например, C.J. Arreseigor с соавт. (96) использовали лХГ в дозе 2500 МЕ для суперстимуляции яичников у коров-доноров пород шароле и герефорд в возрасте 3-7 лет. На каждой из пород было проведено по 24 сессии OPU. У коров породы шароле получили достоверно больше (p < 0,05) ОКК и эмбрионов за одну сессию, чем у породы герефорд: 27,25±6,84 против 18,40±3,87 ОКК и 8,25±2,39 против 4,54±1,12 эмбриона.
Целый ряд работ был направлен на поиск оптимальных протоколов суперстимуляции, обеспечивающих увеличение числа одновременно созревающих ооцитов с хорошими компетенциями к развитию. С учетом перечисленных недостатков препаратов на основе лХГ в подавляющем большинстве работ изучался ответ на гормональную обработку препаратами на основе ФСГ. Применяемые дозы гормональных препаратов для суперстимуляции, как правило, в 2 раза ниже, чем дозы, используемые для вызывания полиовуляции (15). Традиционные протоколы включают повторные инъекции ФСГ в физиологическом растворе с интервалом 12 или 24 ч (повторные инъекции необходимы вследствие короткого периода полураспада ФСГ для поддержания его повышенного уровня в крови) с последующим периодом голодания с целью оптимизации компетенций к развитию фолликулов и ооцитов. Использование пролонгаторов (см. ниже) позволяет сократить число инъекций до одной-двух (табл. 2).
2. Схемы гормональной обработки, используемые для суперстимуляции коров-доноров перед проведением трансвагинальной УЗИ-ассистированной пункции фолликулов (Ovum Pick-Up, OPU)
|
Препарат |
Действующее вещество |
Доза |
Схема введения |
Ссылка |
|
Ovagen («ICPBio Ltd.», |
Экв. NIADDK- |
9 мг |
2½1,01 мг, 2½0,79 мг, 2½0,45 мг (i.m.) с ин- |
(78) |
|
Новая Зеландия) Ovagen («ICPBio», |
oФСГ-17 Экв. NIADDK- |
9 мг |
тервалом 12 ч за 24 ча до OPU 2½4,5 мг (s.c.) с интервалом 24 ч за 4 сута |
(15) |
|
Новая Зеландия) Pluset («Laboratorios |
oФСГ-17 сФСГ/сЛГ |
500 МЕ |
до OPU 8½62,5 МЕ (i.m.) с интервалом 12 ч за |
(97) |
|
Calier SA», Испания) Folltropin-V («Bioniche |
сФСГ |
240 мг |
24 ча до OPU 6½40 мг (i.m.) с интервалом 12 ч за 44 ча |
(17) |
|
Animal Health Inc.», Канада) Folltropin-V («Bioniche |
сФСГ |
200 мг |
до OPU 4 инъекции по 57,1; 57,1; 42,9 и 42,9 мг |
(18) |
|
Animal Health», Канада) |
сФСГ |
200 мг |
(i.m.) с интервалом 12 ч за 72 ча до OPU 1 инъекция 40 мг/мл в 0,5 % растворе гиа- |
(19) |
|
сФСГ |
300 мг |
луроновой кислоты (i.m.) за 72 ча до OPU 1 инъекция 40 мг/мл в 0,5 % растворе гиа- |
(19) |
|
|
Stimufol («Reprobiol |
сФСГ/сЛГ |
250 мг/50 мг |
луроновой кислоты (i.m.) за 72 ча до OPU 2½60 мг сФСГ/12 мг сЛГ, 2½40 мг сФСГ/8 мг |
(84) |
SPRL», Бельгия) сЛГ, 2 ½ 25 мг сФСГ/5 мг сЛГ (i.m.) с ин- тервалом 12 ч за 24 ча до OPU
Примечани е. оФСГ — фолликулостимулирующий гормон овцы, сФСГ — фолликулостимулирующий гормон свиньи, сЛГ — лютеинизирующий гормон свиньи; i.m. — внутримышечное введение, s.c. — подкожное введение; а — указан период от последней инъекции препарата.
P. Lonergan с соавт. (42) установили, что введение донорам шести инъекций ФСГ в течение 3 сут до убоя приводило к значительному увеличению (p < 0,001) доли фолликулов диаметром > 6 мм (31,6 %) по сравнению с таковым у необработанных контрольных коров (6,6 %) и у животных, получивших только четыре инъекции ФСГ (9,4 %). Выход бластоцист из ооцитов, происходящих из фолликулов > 6 мм как от не стимулированных, так и от обработанных ФСГ животных был примерно вдвое выше, чем из ооцитов из фолликулов 2-6 мм: 42,9 против 22,8 % при 6-кратной инъекции ФСГ (p < 0,01); 62,5 против 32,8 % в контрольной группе (p < 0,05). K.L. Goodhand с соавт. (78) показали, что дополнительное применение ФСГ при проведении пункций один раз в неделю позволяло получать от телок симментальской породы в среднем за сессию 2,1 эмбриона против 1,0 эмбриона при отсутствии суперстимуляции. Авторы также отмечали, что проведение пункции фолликулов у тех же доноров с кратностью дважды в неделю позволяло за 1 нед получать сопоставимое число эмбрионов (в среднем 2,4 эмбриона).
Увеличение общего выхода эмбрионов за сеанс при суперстимуляции с использованием ФСГ у нелактирующих доноров B. taurus установили S. Sendag с соавт. (97). Применение ФСГ улучшало визуализацию фолликулов, компетенцию ооцитов и выход бластоцист (60, 80).
L.M. Vieira с соавт. (18) оценивали эффективность суперстимуляции при внутривенном введении ФСГ (Фоллитропин) на результативность OPU у лактирующих ( n = 15) и нелактирующих ( n = 15) коров-доноров голштинской породы. В произвольные сутки полового цикла все коровы получали внутривагинальное прогестероновое устройство и 2,0 мг ЭБ, введенного внутримышечно (0-е сут). Коровы контрольной группы не подвергались дальнейшим обработкам, в то время как коровы опытной группы получали общую дозу 200 мг ФСГ на 4-е и 5-е сут четырьмя уменьшающимися дозами с интервалом 12 ч (соответственно 57, 57, 43 и 43 мг). На 7-е сут прогестероновое устройство удаляли и в обеих группах проводили OPU (через 40 ч после последней инъекции ФСГ). Применение ФСГ не оказывало влияния на число аспирированных фолликулов (17,2±1,3 против 17,1±1,1 соответственно у коров контрольной и опытной групп). Однако у коров из опытной группы процент фолликулов среднего размера (6-10 мм) на момент OPU был выше, чем в контроле (55,1 против 20,8 %, р < 0,001). Хотя степень извлечения ооцитов у коров в опытной группе была ниже (60,0 против 69,8 %, р = 0,002), выход бластоцист у них оказался выше (34,5 против 19,8 %, р < 0,001). За один сеанс OPU в опытной группе по сравнению с контролем получили больше пригодных к трансплантации эмбрионов (3,0±0,5 против 1,8±0,4, р = 0,02). Независимо от обработки, у нелактирующих коров по сравнению с лактирующими выход бластоцист оказался выше (41,9 против 13,4 %, р = 0,001) и было получено больше пригодных к трансплантации эмбрионов за сеанс OPU (3,5±0,5 против 1,3±0,3, р = 0,003). Таким образом, суперстимуляция с использованием ФСГ приводила к повышению эффективности получения IVP-эмбрионов как у нелактирующих, так и у лак-тирующих коров-доноров голштинской породы. При этом у нелактирую-щих доноров отмечался более высокий процент развития бластоцист и было получено больше эмбрионов за сеанс OPU по сравнению с лактирующими коровами.
L.H. Oliveira с соавт. (17) исследовали влияние суперстимуляции посредством шести последовательных инъекций ФСГ на результативность OPU у нелактирующих коров голштинской породы. В опытной группе выполняли синхронизацию фолликулярной волны посредством удаления всех фолликулов диаметром > 7 мм с одновременной установкой ушного имплантата препарата Норгестомета. Обработку ФСГ (Folltropin-V, «Bioniche Animal Health», Канада) начинали через 36 ч (6 доз по 40 мг с интервалом 12 ч). OPU проводили через 44 ч после последней инъекции ФСГ (период покоя), пунктируя все фолликулы диаметром > 2 мм. Авторы не выявили достоверных различий между опытной и контрольной группами по общему числу ОКК (16,0 против 20,5±2,2) и количеству ОКК хорошего качества (10,7 против 12,3±1,6), а также количеству бластоцист, полученных в среднем от одной коровы за сессию (3,0 против 2,6±0,5) и выходу бластоцист (17,1 против 12,2±2,4 %). Был сделан вывод, что суперстимуляция фолликулов с помощью ФСГ с последующим периодом покоя у нелактирующих коров голштинской породы, подвергшихся синхронизации проявления фолликулярной волны, не приводила к улучшению качества ооцитов и получению бластоцист по сравнению с донорами, не подвергавшимися гормональной обработке.
T. Demissie с соавт. (53) изучали влияние двух доз экзогенного ФСГ (350 и 175 МЕ), формы введения (6 последовательных инъекций с интервалом 12 ч или одна инъекция ФСГ в суммарной дозе 350 МЕ) и различной продолжительности периода голодания ФСГ (48 и 72 ч) на результативность OPU у коров эфиопский породы боран. Однократная инъекция ФСГ не оказала достоверного влияния на число фолликулов, качественные и количественные показатели ОКК. В группе, получавшей 350 МЕ ФСГ в форме множественных инъекций, число фолликулов среднего (7,36±0,57) и большого (8,28±0,96) размера было достоверно выше (p < 0,05). В этой же группе были отмечены достоверно более высокие значения (p < 0,05) среднего числа ОКК 1-го класса (4,19±0,24) и 2-го класса (4,32±0,27), степени созревания ооцитов (70,41 %) и дробления эмбрионов (47,5 %). Продолжительность периода голодания ФСГ оказывала достоверное (p < 0,05) влияние на качество ОКК, но не на степень созревания ооцитов и степень дробления эмбрионов. Таким образом, использование экзогенного ФСГ в форме множественных инъекций служит эффективным методом повышения результативности OPU у коров породы боран.
Вследствие быстрого выведения препаратов ФСГ при использовании в качестве растворителя физиологического раствора (около 5 ч) (93), вне зависимости от введенной дозы (98), альтернативные протоколы основаны на изменении абсорбции препаратов. Для снижения степени абсорбции были исследованы различные модификации протоколов, включающие изменение способа введения (подкожная инъекция) (98) или смешивание ФСГ с полимерами, такими как поливинилпирролидон (99), гель гидроксида алюминия (100) или гиалуроновая кислота (101, 102). Снижение степени абсорбции делает возможным использование однократной инъекции ФСГ для достижения суперстимулирующего эффекта. Такие протоколы очень эффективны, удобны для исполнителей и минимизируют вероятность ошибки (103). Показано, что однократная инъекция ФСГ в 0,5 % растворе гиалуроновой кислоты за 48 или 72 ч до проведения OPU позволяет добиться сопоставимых значений показателей в отношении результативности OPU и получения IVP-эмбрионов по сравнению с традиционными протоколами введения ФСГ (4 инъекции с интервалом 12 ч) как у молочного (голштины) (19), так и у мясного скота (102).
-
L.M. Vieira с соавт. (19) сравнили различные протоколы суперстимуляции на основе ФСГ (Folltropin-V, «Bioniche Animal Health», Канада) у нелактирующих коров голштинской породы — традиционный протокол, предусматривающий 4-кратное введение ФСГ с интервалом 12 ч в общей дозе 200 мг (группа Ф200), и однократное введение ФСГ в дозе 200 или 208
300 мг соответственно в 5,0 или 7,5 мл 0,5 % раствора гиалоуроновой кислоты (группы Ф200ГК и F300ГК). Площадь под кривой (area under the curve, AUC) концентрации ФСГ у опытных животных всех трех групп была выше по сравнению с контролем, при этом между опытными группами различий в AUC не выявили. Следует отметить, что общий период, в течение которого наблюдались повышенные концентрации ФСГ в крови, был больше для группы Ф200 по сравнению с группами ГК. Группа Ф300ГК характеризовалась более высоким AUC по сравнению с Ф200ГК, при этом период, в течение которого наблюдались повышенные концентрации, в группах Ф200ГК и Ф300ГК были аналогичны. Вне зависимости от используемого протокола в группах коров, получивших инъекции ФСГ, наблюдалось большее число фолликулов среднего размера (6-10 мм) по сравнению с контролем. Также число фолликулов, извлеченных ооцит-кумулюсных комплексов, созревших ооцитов, степень дробления и выход бластоцист за одну сессию был выше в группах коров-доноров, обработанных ФСГ. В группе Ф200ГК по сравнению с группами Ф200, Ф300ГК и контролем наблюдалось большее число ОКК (15,6±1,7 против 12,2±1,2; 11,4±1,2 и 9,3±0,7) и выход бластоцист за сессию (4,7±0,7 против 3,7±0,7; 3,1±0,6 и 2,4±0,5). При использовании препаратов ФСГ пролонгированного действия степень стельности после пересадки OPU/IVP-эмбрионов была выше (54,6-60,0 %), чем при использовании традиционного протокола (39,1 %) и в контроле без использования ФСГ (33,3 %).
Для повышения качества получаемых ОКК некоторые авторы рекомендуют комплексное использование препаратов ФСГ и ПГ. L. Nasser с соавт. (104) выявили снижение качества эмбрионов у зебувидного скота при отсутствии применения экзогенного ПГ в процессе обработки коров ФСГ в течение 1-й фолликулярной волны. F. Rivera с соавт. (105) отмечали улучшение качества эмбрионов, получаемых от лактирующих молочных коров, суперстимулированных в процессе 1-й фолликулярной волны, при включении в протокол обработки экзогенного ПГ. В то же время у мясных коров введение интравагинального устройства для контролируемого высвобождения лекарств (controlled intra-vaginal drug releasing device, CIDR) в период проведения суперстимуляции не приводило к улучшению количественных и качественных характеристик ОКК (67).
В доступной литературе также представлены работы, посвященные изучению ответа на суперстимуляцию препаратами на основе лХГ. Поскольку породы коров-доноров, их физиологическое состояние (лактирую-щие, нелактирующие), а также применяемые дозы лХГ — от 200 МЕ (106), 400 МЕ (106), 800 МЕ (67, 106) и 1600 МЕ (16) до 2500 МЕ (96, 107) и 3000 МЕ (97) — сильно варьируют, то результаты исследований расходятся.
B.N. Ribas с соавт. (106) изучали влияние различных доз лХГ на развитие фолликулов, число и качество ооцитов, полученных посредством OPU, степень оплодотворения и раннее эмбриональное развитие in vitro на коровах породы брафорд. На 3-и сут после начала фолликулярной волны животным в опытной группе инъецировали 200, 400 или 800 МЕ лХГ, в то время как в контрольной группе лХГ не вводили. Процедуру OPU выполняли на 6-е сут. Авторы не выявили достоверных различий в числе фолликулов и ооцитов, а также в морфологическом качестве ооцитов. При этом в группе коров-доноров, получивших 800 МЕ лХГ, отмечалось большее число фолликулов размером > 6 мм, более высокая степень оплодотворения и меньшая доля полиспермии, однако различий в развитии эмбрионов по сравнению с контролем выявлено не было.
Применение лХГ в дозе 800 МЕ у телок породы брангус не при- водило к увеличению числа видимых фолликулов и получаемых ОКК (67). Более того, дополнительное использование лХГ на фоне синхронизации полового цикла вызывало снижение числа видимых фолликулов и получаемых ОКК, то есть негативное влияние лХГ на качество ооцитов может быть связано с избытком ЛГ во время стимуляции фолликулов и отсутствием периода покоя перед OPU (67). Аналогичная доза лХГ (800 МЕ) была использована для суперстимуляции фолликулов у нелактирующих коров пород бран-гус (n = 13) и абердин-ангусская (n = 15) (67). Действие лХГ оценивали в сравнении с ответом на обработку ФСГ. В группах коров-доноров EB/P4 + eCG и EB/P4 + FSH выполняли инъекцию 2,5 мг ЭБ и 50 мг ПГ на 0-е сут, а в группах DFR + eCG и DFR + FSH проводили аспирацию всех фолликулов диаметром > 8 мм на 3-и сут. На 4-е сут коровам-донорам всех групп вводили ПГF2α, в группах EB/P4 + eCG и DFR + eCG дополнительно вводили лХГ, в группах EB/P4 + FSH и DFR + FSH — 160 мг ФСГ (4 инъекции по 40 мг на 4-е и 5-е сут с интервалом 12 ч). OPU проводили на 7-е сут. Использование лХГ оказалось менее эффективным по сравнению с препаратами ФСГ в отношении как числа фолликулов (13,6±1,2 против 17,9±1,2), так и числа получаемых ОКК (7,3±0,8 против 10,0±0,8) и числа ОКК отличного качества (3,7±0,6 против 6,8±0,6).
J.F. Aller с соавт. (16) использовали лХГ в дозе 1600 МЕ в опытах на коровах абердин-ангусской породы с 40-х по 101-е сут стельности. Фолликулярную волну инициировали удалением всех фолликулов диаметром > 5 мм на 40-е сут после искусственного осеменения. На следующий день коровам опытной группы вводили лХГ, после чего на 4-е сут после гормональной обработки их подвергали OPU. Процедуру с использованием описанной схемы выполняли в пяти повторах с интервалом 2 нед. Таким образом, OPU проводили на 45-е, 59-е, 73-е, 87-е и 101-е сут стельности. Было установлено достоверно большее число фолликулов среднего (5-9 мм) и большого (> 10 мм) размера при применении лХГ по сравнению с контролем — соответственно 4,3±0,9 против 0,9±0,1 и 2,5±0,4 против 0,9±0,1, в то время как число маленьких фолликулов (< 5 мм), напротив, было меньше в опытной группе по сравнению с контролем — 2,8±0,4 против 5,7±0,5. В опытной группе по сравнению с контролем получили больше ОКК (2,2±0,2 против 1,0±0,2) и больше ОКК хорошего качества (1,6±0,4 против 0,9±0,2). Проведение OPU не оказало негативного влияния на стельность.
D.S. Son с соавт. (107) исследовали влияние введения 2500 МЕ лХГ на 14-е сут полового цикла (0-е сут — приход в охоту) на результативность получения клонированных эмбрионов методом переноса ядер соматических клеток (somatic cell nuclear transfer, SCNT) с использованием OPU-ооцитов в качестве цитопластов. Пункцию фолликулов проводили через 40 ч. В контрольной группе OPU выполняли на той же стадии полового цикла, что и в опытной группе. Суперстимуляция приводила к увеличению числа фолликулов диаметром > 6 мм (4,73±0,45 против 3,18±0,18) и извлеченных ОКК (4,40±0,30 против 2,24±0,18), а также степени созревания ооцитов (73,78 против 69,99 %) и выхода бластоцист (23,82 против 18,06 %), полученных методом SCNT. Был сделан вывод, что однократная инъекция лХГ способствует эффективному получению клонированных эмбрионов коров.
S. Sendag с соавт. (97) оценивали влияние экзогенного лХГ в сравнении с ФСГ на овариальный ответ, выход ооцитов и морфологические характеристики OPU-ооцитов у коров голштинской породы. Схема опыта предусматривала введение коровам опытной группы 3000 МЕ лХГ за 4 сут ( - 4-е сут) до проведения OPU (0-е сут). В другой группе коровам вводили 500 МЕ ФСГ в форме 8 последовательных инъекций по 62,5 МЕ с интервалом 12 ч, 210
начиная с - 5-х сут. Для индукции лютеолиза желтого тела коровам обеих групп вводили 625 мкг аналога ПГF2 α — клопростенола на - 2-е сут, после чего на - 1-е сут вводили и гонадотропный релизинг-гормон (ГнРГ). OPU выполняли через 24 ч после последней инъекции. Была обнаружена тенденция худшего ответа коров-доноров на введение лХГ по сравнению с ФСГ в отношении как числа фолликулов (7,7±5,6 против 13,8±7,7), так и полученных ОКК (6,2±4,8 против 10,3±5,0). Кроме того, при введении лХГ отмечалась существенно меньшая доля ооцитов хорошего качества класса А (более 3 слоев компактного кумулюса и однородная ооплазма) по сравнению с ФСГ (15,9 против 74,8 %). На основании полученных результатов был сделан вывод, что использование лХГ для суперстимуляции с целью OPU менее эффективно по сравнению с ФСГ.
Данные о результативности различных протоколов гормональной синхронизации полового цикла и суперстимуляции в отношении технологии OPU обобщены в таблице 3.
-
3. Результативность трансвагинальной УЗИ-ассистированной пункции фолликулов (Ovum Pick-Up, OPU) у крупного рогатого скота при применении различных протоколов суперстимуляции
Порода (группа)
Число
Протокол
аспирированных
ОКК
Ссылка
фолликулов
всего
пригодных
SIM
C4: OPU (1/w)
14,7±2,3
12,0±2,0
5,6±1,2
(78)
C4, C7: OPU (2/w)
C1: ФСГ (2½1,01 мг)
C2: ФСГ (2½0,79 мг)
C3: ФСГ (2½0,45 мг)
27,4±3,1*
21,8±2,7*
8,9±1,5*
C4: OPU (1/w в течение 6 нед)
23,1±2,8
20,1±2,6
6,1±1,2
HOL
C0: CIDR + ЭБ (2,0 мг) — все группы
(18)
C4: ФСГ (2½57,1 мг)
C5: ФСГ (2½42,9 мг)
C7: удаление CIDR + OPU
17,1±1,1
10,3
C7: удаление CIDR + OPU
17,2±1,3
12,0
ANG
C0: ЭБ (2,5 мг) + ПГ (50 мг)
C6: OPU
9,6±0,6
4,8±0,6
2,9±0,5
(67)
BRG
C0: ЭБ (2,5 мг) + ПГ (50 мг)
C6: OPU
14,5±1,5
9,4±1,4
6,2±1,1
BRG, ANG
C0: ЭБ (2,5 мг) + ПГ (50 мг)
(67)
(среднее по
C6: OPU
12,9±1,1
7,9±1,3
5,2±0,9
двум породам)
Контроль: без обработки, OPU
7,3±0,7
3,2±0,5
2,1±0,4
BRG
C0: ЭБ (2,5 мг) + ПГ (50 мг) — все опытные группы
(67)
C4: ПГF2 α (150 мг)
C7: OPU
18,3±1,4
11,4±1,2
7,9±1,1
C4: ПГF2 α (150 мг) + 800 МЕ лХГ
C7: OPU
11,8±1,4
7,5±1,4
4,5±1,0
Контроль: без обработки, OPU
12,1±0,8
7,1±0,8
4,7±0,7
BRG, ANG
C0: ЭБ (2,5 мг) + ПГ (50 мг)
(67)
(среднее по
C4: ПГF2 α (150 мг)
двум породам)
C4-C5: ФСГ (4½40 мг)
C3: DFR > 8 мм
C4: ПГF2 α (150 мг)
C4-C5: ФСГ (4½40 мг)
C7: OPU
C0: ЭБ (2,5 мг) + ПГ (50 мг)
C4: ПГF2 (150 мг) + 800 МЕ лХГ
C3: DFR > 8 мм
17,9±1,2
10,0±0,8
6,8±0,6
C4: ПГF2 α (150 мг) + 800 МЕ лХГ
C7: OPU
13,6±1,2
7,3±0,8
3,7±0,6
BRG, ANG
C0: DFR + ПГF2 α (150 мг) — все группы
(67)
(среднее по
C0: + CIDR (1,9 мг ПГ)
двум породам)
C1-C2: ФСГ (4½40 мг)
C4: OPU
C0: без CIDR
15,4±1,2
8,6±0,9
6,3±0,7
C1-C2: ФСГ (4½40 мг)
C4: OPU
15,9±1,2
8,3±0,9
5,8±0,7
Продолжение таблицы 3
HOL (НЛК)
C0: ЭБ (2,0 мг), C0-C7: ПГ (1 г) — все группы
Контроль: без суперстимуляции
OPU 16,1±1,1 13,1±1,0
C4: ФСГ (2½57,1 мг)
C5: ФСГ (2½42,9 мг)
C7: OPU 20,4±1,4 16,5±1,2
C4: ФСГ (200 мг) + 0,5 % ГК (5 мл)
C7: OPU 23,2±2,3 19,5±2,1
C4: ФСГ (300 мг) + 0,5 % ГК (7,5 мл)
C7: OPU 19,6±1,6 15,4±1,4
9,3±0,7
12,2±1,2
15,6±1,7
11,4±1,2
(19)
ANG (ЛК 35-77 )
C0: DFR > 8 мм — все группы
Контроль: без суперстимуляции,
OPU 8,0±0,5
C1-C2: ФСГ (по 4,5 мг Ovagen), s.c.
C5: OPU 4,4±0,4
(15)
HOL (НЛК)
Контроль: без обработки, OPU 20,5±2,2
C0: DFR > 7 мм + norgestomet
ушной имплантат
C1,5-C4: ФСГ (6½40 мг)
C5,5: OPU (удаление имплантата) 16,0
12,3±1,6
10,7
(17)
BOR
С - 11 (за 11 сут до прихода в охоту: ПГF2 α (500 мг), C0: ПГF2 α (500 мг) — все группы
C0: OPU (контроль) 3-4 мм: 4,51+0,43 2,35±0,21
5-9 мм: 3,56+0,29 2,89±0,33 Всего
> 9 мм: 2,89+0,22 1,72±0,16 4,17±0,59
C1: ФСГ (2½87,5 МЕ)
C2: ФСГ (2½52,5 МЕ)
C3: ФСГ (2½35 МЕ)
C5 (через 48 ч), OPU + 6 нед 3-4 мм: 4,30±0,57 4,19±0,24
(2/w): OPU (среднее) 5-9 мм: 7,36±0,57 4,32±0,27 Всего
>9 мм: 8,28±0,96 1,32±0,22 5,89±0,55
C0: DFR
C1: ФСГ (2½87,5 МЕ)
C2: ФСГ (2½52,5 МЕ)
C3: ФСГ (2½35 МЕ)
C6 (через 72 ч): OPU + 6 нед 3-4 мм: 3,72±0,20 3,17±0,31
(1/w): OPU (среднее) 5-9 мм: 5,94±0,43 3,29±0,31 Всего
>9 мм: 6,81±0,55 1,24±0,13 5,06±0,56
C1: ФСГ (350 МЕ)
C3 (через 48 ч): OPU + 6 нед 3-4 мм: 3,67±0,42 2,95±0,24
(2/w): OPU (среднее) 5-9 мм: 3,55±0,28 2,34±0,38 Всего
>9 мм: 2,88±0,22 0,31±0,28 3,41±0,66
C0: DFR
C1-C2: ФСГ (2½35 МЕ)
C3: ФСГ (2½17,5 МЕ)
C5 (через 48 ч): OPU + 6 нед 3-4 мм: 3,30±0,17 3,06±0,32
(1/w): OPU 5-9 мм: 5,02±0,16 3,32±0,18 Всего
> 9 мм: 5,74±0,22 0,99±0,43 4,64±1,11
(53)
HOL
C0: лХГ (3000 МЕ)
C2: ПГF2 α (625 мкг);
C2: ГнРГ (10 мкг)
C4: OPU 7,7±5,6 6,2±4,8
C0: ФСГ (2½62,5 МЕ)
C1-C3: ФСГ (2½62,5 МЕ)
C3: ПГF2 α (625 мкг);
C4: ГнРГ (10 мкг)
C5: OPU 13,8±7,7 10,3±5,0
Всего
Ga — 15,9 %
Gb — 17,0 %
Gc — 54,6 %
Gd — 12,5 %
Всего
Ga — 74,8 %
Gb — 9,7 %
G C — 2,9 %
Gd — 12,6 %
(97)
ANG (СТ 40-100 )
C0: FA
C5: OPU < 5 мм: 5,7±0,5
5-9 мм: 0,9±0,1 Всего
> 10 мм: 0,9±0,1 2,2±0,2
C0: FA
C1: лХГ (1600 МЕ)
C5: OPU < 5 мм: 2,8±0,4
5-9 мм: 4,3±0,9 Всего
> 10 мм: 2,5±0,4 1,0±0,2
Всего 1,6±0,4
Всего 0,9±0,2
(16)
BRF
C0: ЭБ (2 мг) + ПГF2 α (12,5 мг) + CIDR — все группы Контроль, OPU 8,62±3,80 7,88±1,45
C3: 200 МЕ лХГ
C6: удаление CIDR + OPU 8,56±3,40 6,57±1,18
C3: 400 МЕ лХГ
C6: удаление CIDR + OPU 11,00±4,20 7,25±1,00
C3: 800 МЕ лХГ
C6: удаление CIDR + OPU 8,88±4,20 5,75±0,75
6,25±1,12
5,44±1,20
6,06±0,85
4,87±0,84
(106)
Продолжение таблицы 3 HRF C0: CIDR + ПГ (100 мг) + ЭБ (2 мг) (96)
C1: 2500 МЕ лХГ C4: OPU
C0: CIDR + ПГ (100 мг) + ЭБ (2 мг)
C1: 2500 МЕ лХГ
C4: OPU – 18,40±3,87 4,54±1,12
CHR C0: CIDR + ПГ (100 мг) + ЭБ (2 мг)
C1: 2500 МЕ лХГ
C4: OPU – 27,25±6,84 8,25±2,39
Примечание. Породы: SIM — симментальская, HOL — голштинская, BOR — эфиопский боран, BRG — брангус, ANG — абердин-ангусская, BRF — брафорд, HRF — герефордская, CHR — шароле; ЛК — лактирующие коровы, НЛК — нелактирующие коровы (в нижнем индексе указан период после отела), СТ — стельные коровы (в нижнем индексе указан срок стельности); * — приведены данные в расчете за 1 нед; ГК — гиалуроновая кислота; С — день выполнения манипуляции (цифра после буквы указывает, на какие сутки выполнялись манипуляции); 1/w — один раз в неделю, 2/w — два раза в неделю; лХГ — хорионический гонадотропин лошадей, ПГ — прогестерон; ПГF2 α — простагландин F2 α , ФСГ — фолликулостимулирующий гормон, ЭБ — эстрадиол бензоат; СIDR — интравагинальное устройство для контролируемого высвобождения лекарств (controlled intra-vaginal drug releasing device); DFR — удаление доминантного фолликула, FA — удаление фолликулов посредством OPU; i.m. — внутримышечно, s.c. — подкожное введение; класс ОКК: G A — >3 слоев компактного кумулюса и гомогенная ооплазма, G B — 3 слоя кумулюса и в основном гомогенная ооплазма, G C — 1-2 слоя кумулюса, ооплазма с отдельными включениями гранул, G D — денудированные ооциты или ооциты с экспандированным кумулюсом. Прочерки означают отсутствие информации о значениях показателей.
Таким образом, проведение суперстимуляции с использованием экзогенных гонадотропинов в большинстве случаев эффективно для увеличения числа и качества ОКК, получаемых посредством OPU. Однако многообразие протоколов гормональной обработки и различия в ответе на суперстимуляцию в зависимости от индивидуальных особенностей доноров требуют оптимизации протоколов с учетом породы, возраста и физиологического состояния животных. Перспективно использование биомаркеров (108-110). Так, R. Kowsar с соавт. (111) обнаружили связь клинических показателей крови во время проведения OPU с выходом IVP-эмбрионов, в связи с чем эти показатели могут быть использованы при отборе телок-доноров с более высоким потенциалом формирования бластоцист. В качестве потенциального предиктора фертильности, суперовуляции и размера популяции фолликулов у домашних животных могут быть использованы концентрации антимюллерова гормона (АМГ) в крови доноров (109, 112). Этот гормон, который у самок крупного рогатого скота экспрессируется исключительно клетками гранулезы, отражает размер популяции гонадо-тропин-чувствительных фолликулов (113).
Итак, трансвагинальная УЗИ-ассистированная пункция фолликулов (OPU) служит основным источником яйцеклеток для коммерческого производства эмбрионов коров во всем мире, что обусловливает проведение работ по повышению эффективности OPU. На результативность OPU оказывают влияние множество факторов, включая технические и технологические параметры проведения процедуры, стадию роста и развития фолликулов, на которой выполняется извлечение яйцеклеток, использование или отсутствие гормональной стимуляции, породные и индивидуальные особенности доноров. Критерии выбора оптимальных технических параметров, включая диаметр аспирационной иглы и давление вакуума, не универсальны и зависят от типа используемого оборудования и навыков оператора. Среди технологических приемов, обеспечивающих приведение животных-доноров в оптимальную стадию полового цикла, находит применение подбор интервала между сеансами OPU, удаление доминантного фолликула с целью стимуляции новой волны роста фолликулов и гормональная синхронизация полового цикла. Повышение результативности OPU может быть достигнуто с помощью экзогенных гонадотропинов, включая фолли- кулостимулирующий гормон и хорионический гонадотропин лошадей. Перспективным приемом отбора доноров служит использование биомаркеров. Несмотря на существенные успехи, достигнутые в повышении количественных и качественных характеристик извлекаемых ооцит-кумулюсных комплексов, необходимы дальнейшие исследования для определения оптимальных значений технологических параметров проведения процедуры, в том числе с учетом генетических особенностей различных пород крупного рогатого скота.
Список литературы Развитие технологии прижизненного получения ооцитов у коров: современное состояние и направления исследований (обзор)
- Зиновьева Н.А., Позябин С.В., Чинаров Р.Ю. Вспомогательные репродуктивные технологии: история становления и роль в развитии генетических технологий в скотоводстве (обзор). Сельскохозяйственная биология, 2020, 55(2): 225-242 (doi: 10.15389/agrobiology.2020.2.225rus).
- Boni R. Ovum pick-up in cattle: a 25 years retrospective analysis. Animal Reproduction, 2012, 9(3): 362-369.
- Smith C. Applications of embryo transfer in animal breeding. Theriogenology, 1988, 29(1): 203-212 (doi: 10.1016/0093-691X(88)90040-4).
- Kruip T.A., Pieterse M.C., Van Beneden T.H., Vos P.L.A.M., Yurth Y.A., Taverne M.A.M. A new method for bovine embryo production: a potential alternative to superovulation. Vet. Rec., 1991, 128(9): 208-210.
- Ferré L., Kjelland M., Strøbech L., Hyttel P., Mermillod P., Ross P. Review: Recent advances in bovine in vitro embryo production: reproductive biotechnology history and methods. Animal, 2019, 14(5): 991-1004 (doi: 10.1017/S1751731119002775).
- Чинаров Р.Ю., Луканина В.А. Производство эмбрионов крупного рогатого скота с использованием прижизненно получаемых ооцитов: мировые тренды и перспективы (обзор). Достижения науки и техники АПК, 2023, 37(9): 31-38.
- Viana J.H.M. 2021 Statistics of embryo production and transfer in domestic farm animals. Embryo Technology Newsletter, 2022, 40(4): 22-40.
- Sirard M.-A., Richard F., Blondin P., Robert C. Contribution of the oocyte to embryo quality. Theriogenology, 2006, 65(1): 126-136 (doi: 10.1016/j.theriogenology.2005.09.020).
- Bols P.E., Van Soom A., Ysebaert M.T., Vandenheede J.M., de Kruif A. Effects of aspiration vacuum and needle diameter on cumulus oocyte complex morphology and developmental capacity of bovine oocytes. Theriogenology, 1996, 45(5): 1001-1014 (doi: 10.1016/0093-691X(96)00028-3).
- Bols P.E., Ysebaert M.T., Van Soom A., de Kruif A. Effects of needle tip bevel and aspiration procedure on the morphology and developmental capacity of bovine compact cumulus oocyte complexes. Theriogenology, 1997, 47(6): 1221-1236 (doi: 10.1016/S0093-691X(97)00102-7).
- Ward F.A., Lonergan P., Enright B.P., Boland M.P. Factors affecting recovery and quality of oocytes for bovine embryo production in vitro using ovum pick-up technology. Theriogenology, 2000, 54(3): 433-446 (doi: 10.1016/S0093-691X(00)00360-5).
- Пестис В.К., Голубец Л.В., Дешко А.С., Кысса И.С., Попов М.В. Получение ооцитов коров путем трансвагинальной пункции фолликулов. Доклады национальной академии наук Беларуси, 2016, 60(1): 123-128.
- Goodhand K.L., Staines M.E., Hutchinson J.S.M., Broadbent P.J. In vivo oocyte recovery and in vitro embryo production from bovine oocyte donors treated with progestagen, oestradiol and FSH. Animal Reproduction Science, 2000, 63(3-4): 145-158 (doi: 10.1016/S0378-4320(00)00186-X).
- Pontes J.H.F., Nonato-Junior I., Sanches B.V., Ereno-Junior J.C., Uvo S., Barreiros T.R.R., Oliveira J.A., Hasler J.F., Seneda M.M. Comparison of embryo yield and pregnancy rate between in vivo and in vitro methods in the same Nelore (Bos indicus) donor cows. Theriogenology, 2009, 71(4): 690-697 (doi: 10.1016/j.theriogenology.2008.09.031).
- Aller J.F., Mucci N.C., Kaiser G.G., Ríos G., Callejas S.S., Alberio R.H. Transvaginal follicular aspiration and embryo development in superstimulated early postpartum beef cows and subsequent fertility after artificial insemination. Animal Reproduction Science, 2010, 119(1-2): 1-8 (doi: 10.1016/j.anireprosci.2009.11.009).
- Aller J.F., Mucci N.C., Kaiser G.G., Callejas S.S., Alberio R.H. Effect of repeated eCG treat-ments and ovum pick-up on ovarian response and oocyte recovery during early pregnancy in suckling beef cows. Animal Reproduction Science, 2012, 133: 10-15 (doi: 10.1016/j.anirepro-sci.2012.06.001).
- Oliveira L.H., Sanches C.P., Seddon A.S., Veras M.B., Lima F.A., Monteiro P.L.J. Jr., Wilt-bank M.C., Sartori R. Short communication: Follicle superstimulation before ovum pick-up for in vitro embryo production in Holstein cows. Journal of Dairy Science, 2016, 99(11): 9307-9312 (doi: 10.3168/jds.2016-11306).
- Vieira L.M., Rodrigues C.A., Castro Netto A., Guerreiro B.M., Silveira C.R.A., Moreira R.J.C., Sá Filho M.F., Bó G.A., Mapletoft R.J., Baruselli P.S. Superstimulation prior to the ovum pick-up to improve in vitro embryo production in lactating and non-lactating Holstein cows. Theri-ogenology, 2014, 82(2): 318-324 (doi: 10.1016/j.theriogenology.2014.04.013).
- Vieira L.M., Rodrigues C.A., Castro Netto A., Guerreiro B.M., Silveira C.R.A., Freitas B.G., Bragança L.G.M., Marques K.N.G., Sá Filho M.F., Bó G.A., Mapletoft R.J., Baruselli P.S. Ef-ficacy of a single intramuscular injection of porcine FSH in hyaluronan prior to ovum pick-up in Holstein cattle. Theriogenology, 2016, 85(5): 877-886 (doi: 10.1016/j.theriogenology.2015.10.036).
- Чинаров Р.Ю., Луканина В.А. Влияние технических параметров на результативность прижизненного получения ооцитов у телок симментальской породы. Достижения науки и техники АПК, 2022, 36(1): 46-50.
- Голубец Л.В., Дешко А.С., Кысса И.С., Драгун Т.Ю., Сехина М.А., Харитоник Д.Н. Морфологические особенности ооцит-кумулюсных комплексов, полученных путем трансваги-нальной пункции фолликулов. Зоотехническая науки Беларуси: сборник научных трудов, 2023, т. 58, ч. 1: 49-55.
- Грачев В.С. О некоторых теоретических вопросах в области воспроизводства сельскохозяйственных животных. Сб. науч. тр. по мат. межд. науч.-практ. конф. «Научное обеспечение развития АПК в условиях импортозамещения». СПб, 2020, т. 1: 172-176.
- Сарсадских А.А., Абрамов С.В. Регуляция воспроизводства крупного рогатого скота с помощью гормональных препаратов на основе бусерелина и D-клопростенола. Молочное и мясное скотоводство, 2015, 3: 29-32.
- Kanitz W., Brüssow K.P., Becker F., Torner H., Schneider F., Kubelka M., Tomek W. Compar-ative aspects of follicular development, follicular and oocyte maturation and ovulation in cattle and pigs. Achieves of Animal Breeding, 2001, 44 (Special issue): 9-23.
- Kanitz W. Follicular dynamic and ovulation in cattle: a review. Archive Tierzucht, 2003, 46(2): 187-198 (doi: 10.5194/aab-46-187-2003).
- Mossa F., Jimenez-Krassel F., Walsh S., Berry D.P., Butler S.T., Folger J., Smith G.W., Ire-land J.L., Lonergan P., Ireland J.J., Evans A.C. Inherent capacity of the pituitary gland to pro-duce gonadotropins is not influenced by the number of ovarian follicles 3 mm in diameter in cattle. Reproduction, Fertility and Development, 2010, 22: 550-557 (doi: 10.1071/RD09100).
- Mossa F., Walsh S.W., Butler S.T., Berry D.P., Carter F., Lonergan P., Smith G.W., Ireland J.J., Evans A.C. Low numbers of ovarian follicles 3 mm in diameter are associated with low fertility in dairy cows. Journal of Dairy Science, 2012, 95(5): 2355-2361 (doi: 10.3168/jds.2011-4325).
- Rüsse I. Oogenesis in cattle and sheep. Bibl. Anat., 1983, 24: 77-92.
- Erickson B.H. Development and senescence of the postnatal bovine ovary. Journal of Animal Science, 1966, 25(3): 800-805 (doi: 10.2527/jas1966.253800x).
- Evans A.C., Mossa F., Walsh S.W., Scheetz D., Jimenez-Krassel F., Ireland J.L., Smith G.W., Ireland J.J. Effects of maternal environment during gestation on ovarian folliculogenesis and con-sequences for fertility in bovine offspring. Reproduction in Domestic Animals, 2012, 47(Suppl. 4): 31-37 (doi: 10.1111/j.1439-0531.2012.02052.x).
- Баймишев Х.Б. Морфология яичников и репродуктивные качества телок в зависимости от возраста и двигательной активности. Ветеринария, 1999, 11: 33-34.
- Lucy M.C., Staples C.R., Michel F.M., Thatcher W.W. Energy balance and size and number of ovarian follicles detected by ultrasonography in early postpartum dairy cows. Journal of Dairy Science, 1991, 74: 473-482.
- Варенников М.В., Чомаев А.М., Оборин А.Е. Управление воспроизводством в молочном животноводстве. Изд. 2-е дополненное. М., 2014.
- Гавриченко Н.И., Турчанова Л.Н. Особенности течения фолликулогенеза в период полового цикла в яичниках коров с различным уровнем плодовитости. Актуальные проблемы интенсивного развития животноводства, 2014, 17(2): 193-198.
- Murphy M.G., Enright W.J., Crowe M.A., McConnell K., Spicer L.J., Boland M.P., Roche J.F. Effect of dietary intake on pattern of growth of dominant follicles during the oestrous cycle in beef heifers. J. Reprod. Fert., 1991, 92(2): 333-338 (doi: 10.1530/jrf.0.0920333).
- Hamilton S.A., Garverick H.A., Kesler D.H., Xu Z.Z., Loos K., Youngquist R.S., Salfen B.E. Characterization of ovarian follicular cysts and associated endocrine profiles in dairy cows. Biology of Reproduction, 1995, 53(4): 890-898 (doi: 10.1095/biolreprod53.4.890).
- Нежданов А.Г. Современное представление о половом цикле самок животных. Ветерина-рия, 2003, 11: 32-36.
- Кузьмич Р.Г., Ходыкин Д.С., Гарганчук А.А., Бычкова Т.К. Особенности функциональных нарушений яичников у молочных коров после родов и эффективность использования про-стагландиновой программы для индукции половой охоты. Ученые записки УО ВГАВМ, 2022, 58(2): 17-23.
- Перерядкина С.П., Авдеенко В.С., Кочарян В.Д., Кемешев Ж.О. Особенности фоллику-логенеза у коров мясных пород (казахская белоголовая, шевроле и герефорд) в контексте восстановления плодовитости. Известия Нижневолжского агроуниверситетского ком-плекса: наука и высшее профессиональное образование, 2018, 2(50): 227-235.
- Гавриченко Н.И., Левченко А.А. Особенности фолликулярного роста в течение полового цикла у коров с синдромом повторения половой охоты. Ученые записки УО ВГАВМ, 2021, 57(1): 13-16.
- Bungartz L., Lucas-Hahn A., Rath D., Nieman H. Collection of oocytes from cattle via follicular aspiration aided by ultrasound with or without gonadotropin pretreatment and in different repro-ductive stages. Theriogenology, 1995, 43(3): 667-675 (doi: 10.1016/0093-691X(94)00072-3).
- Lonergan P., Monaghan P., Rizos D., Boland M.P., Gordon I. Effect of follicle size on bovine oocyte quality and developmental competence following maturation, fertilization, and culture in vitro. Mol. Reprod. Dev., 1994, 37(1): 48-53 (doi: 10.1002/mrd.1080370107).
- Caixeta E.S., Ripamonte P., Franco M.M., Junior J.B., Dode M.A.N. Effect of follicle size on mRNA expression in cumulus cells and oocytes of Bos indicus: an approach to identify marker genes for developmental competence. Reproduction, Fertility and Development, 2009, 21: 655-664 (doi: 10.1071/RD08201).
- Brevini Gandolfi T.A., Gandolfi F. The maternal legacy to the embryo: cytoplasmic components and their effects on early development. Theriogenology, 2001, 55(6): 1255-1276 (doi: 10.1016/s0093-691x(01)00481-2).
- Dieleman S.J., Hendriksen P.J.M., Viuff D., Thomsen P.D., Hyttel P., Knijn H.M. Wren-zycki C., Kruip T.A.M., Niemann H., Gadella B.M., Bevers M.M., Vos P.L.A.M. Effects of in vivo prematuration and in vivo final maturation on developmental capacity and quality of pre-implantation embryos. Theriogenology, 2002, 57(1): 5-20 (doi: 10.1016/S0093-691X(01)00655-0).
- Seneda M.M., Esper C.R., Garcia J.M., de Oliveira J.A., Vantini R. Relationship between follicle size and ultrasound-guided transvaginal oocyte recovery. Animal Reproduction Science, 2001, 67: 37-43 (doi: 10.1016/s0378-4320(01)00113-0).
- Ginther O.J., Knopf L., Kastelic J.P. Temporal associations among ovarian events in cattle during oestrous cycles with two and three follicular waves. J. Reprod. Fert., 1989, 87: 223-230 (doi: 10.1530/jrf.0.0870223).
- Ginther O.J., Wiltbank M.C., Fricke P.M., Gibbons J.R., Kot K. Selection of the dominant follicle in cattle. Biology of Reproduction, 1996, 55(6): 1187-1194 (doi: 10.1095/biolreprod55.6.1187).
- Чинаров Р.Ю., Луканина В.А., Джагаев А.Ю., Сингина Г.Н. Определение оптимальной стадии полового цикла для проведения трансвагинальной УЗИ-ассистированной пункции фолликулов у лактирующих коров генофондной тагильской породы. Молочное и мясное скотоводство, 2023, 5: 24-27 (doi: 10.33943/MMS.2023.50.14.004).
- Pieterse M.C., Vos P.L.A.M., Kruip T.A.M., Wurth Y.A., van Beneden T.H., Willemse A.H., Taverne M.A.M. Transvaginal ultrasound guided follicular aspiration of bovine oocytes. Theri-ogenology, 1991, 35(4): 19-24 (doi: 10.1016/0093-691X(91)90426-E).
- Hagemann L.J., Beaumont S.E., Berg M., Donnison M.J., Ledgard A., Peterson A.J., Schur-mann A., Tervit H.R. Development during single IVP of bovine oocytes from dissected follicles: interactive effects of estrous cycle stage, follicle size and atresia. Mol. Reprod. Dev., 1999, 53: 451-458 (doi: 10.1002/(SICI)1098-2795(199908)53:4<451::AID-MRD11-3.0.CO;2-3).
- Hendriksen P.J., Steenweg W.N., Harkema J.C., Merton J.S., Bevers M.M, Vos P.L.A.M., Die-leman S.J. Effect of different stages of the follicular wave on in vitro developmental competence of bovine oocytes. Theriogenology, 2004, 61(5): 909-920 (doi: 10.1016/s0093-691x(03)00278-4).
- Demissie T., Yilma T., Degefa T., Wirtu G., Lemma A. Effect of follicular ablation and gonad-otropin priming on the recovery and quality of oocytes in Boran cows. International Journal of Veterinary Science and Research, 2021, 7(2): 138-143 (doi: 10.17352/ijvsr.000093).
- Gonçalves G.D., da Silva N.C., Costa C.B., Stolf R.L., de Almeida Rossignolo E.A., Cava-lieri F.L.B., Morotti F., Seneda M.M. Relationship between the time of OPU and in vitro embryo production. Anim. Reprod., 2022, 19(2 spe): e22077.
- Pavlok A., Lucas-Hahn A., Niemann H. Fertilization and developmental competence of bovine oocytes derived from different categories of antral follicles. Mol. Reprod. Dev., 1992, 31(1): 63-67 (doi: 10.1002/mrd.1080310111).
- Blondin P., Sirard M.A. Oocyte and follicular morphology as determining characteristics for de-velopmental competence in bovine oocytes. Mol. Reprod. Dev., 1995, 41(1): 54-62 (doi: 10.1002/mrd.1080410109).
- Qi M., Yao Y., Ma H., Wang J., Zhao X., Liu L., Tang X., Zhang L., Zhang S., Sun F. Trans-vaginal ultrasound guided Ovum Pick-up (OPU) in cattle. Journal of Biomimetics Biomaterials and Tissue Engineering, 2013, 18(2): 1000118.
- Чинаров Р.Ю., Луканина В.А., Сингина Г.Н., Тарадайник Н.П. Результативность получе-ния ооцитов коров при использовании различных временных режимов трансвагинальной пункции фолликулов. Достижения науки и техники АПК, 2020, 34(2): 57-60 (doi: 10.24411/0235-2451-2020-10212).
- Голубец Л.В. Эффективность различных режимов использования доноров при получении эмбрионов крупного рогатого скота in vitro в системе трансвагинальной аспирации ооци-тов (ТАО). Ученые записки УО ВГАВМ, 2021, 57(2): 87-91 (doi: 10.52368/2078-0109-2021-57-2-87-91).
- Chaubal S.A., Molina J.A., Ohlrichs C.L., Ferre L.B., Faber D.C., Bols P.E.J., Riesen J.W., Tian X., Yang X. Comparison of different transvaginal ovum pick-up protocols to optimise oocyte retrieval and embryo production over a 10-week period. Theriogenology, 2006, 65(8): 1631-1648 (doi: 10.1016/j.theriogenology.2005.07.020).
- Lopes A.S., Martinussen T., Greve T., Callesen H. Effect of days post-partum, breed and ovum pick- up scheme on bovine oocyte recovery and embryo development. Reproduction of Domestic Animals, 2006, 41(3): 196-203 (doi: 10.1111/j.1439-0531.2006.00683.x).
- Li F., Chen X., Pi W., Liu C., Shi Z. Collection of oocytes through transvaginal ovum pick-up for in vitro embryo production in Nanyang Yellow cattle. Reproduction of Domestic Animals, 2007, 42(6): 666-670 (doi: 10.1111/j.1439-0531.2006.00842.x).
- Boni R., Roelofsen M.W.M., Pieterse M.C., Kogut I., Kruip T.A.M. Follicular dynamics, re-peatability and predictability of follicular recruitment in cows submitted to repeated follicular puncture. Theriogenology, 1997, 48(2): 277-289 (doi: 10.1016/s0093-691x(97)84075-7).
- Boni R., Zicarelli L., Kruip T.A.M. Impact of Ovum Pick-Up (OPU) technique for research and animal breeding. In: Reproduction and Animal Breeding: Advances and Strategy /G. Enne, G.F. Greppi, A. Lauria (eds.). Elsevier, Amsterdam, 1995: 211-221.
- Simon L., Burgartz L., Rath D., Niemann H. Repeated bovine oocyte collection by means of a permanently rinsed ultrasound guided aspiration unit. Theriogenology, 1993, 39(1): 312 (doi: 10.1016/0093-691x(93)90167-4).
- Ding L.-J., Tian H.-B., Wang J.-J., Chen J., Sha H.-Y., Chen J.-Q., Cheng G.-X. Different intervals of ovum pick- up affect the competence of oocytes to support the preimplantation de-velopment of cloned bovine embryos. Molecular Reproduction and Development, 2008, 75(12): 1710-1715 (doi: 10.1002/mrd.20922).
- Ongaratto F.L., Rodriguez-Villamil P., Tribulo A., Bó G.A. Effect of follicle wave synchronization and gonadotropin treatments on the number and quality of cumulus-oocyte complex obtained by ultrasound-guided ovum pick-up in beef cattle. Anim. Reprod., 2015, 12(4): 876-883.
- Imai K., Tagawa M., Matoba S., Narita M., Kanayama K. Follicular growth, subsequent Ovum Pick-Up, and dominant follicle removal in cows. Reproduction, Fertility and Development, 2006, 18(2): 246-246 (doi: 10.1071/RDv18n2Ab277).
- de Carvalho Fernandes C.A., Miyauchi T.M., Silva de Figueiredo A.C., Palhão M.P., Varago F.C., Nogueira E.S.C., Neves J.P., Miyauchi T.A. Hormonal protocols for in vitro pro-duction of Zebu and taurine embryos. Pesq. Agropec. Bras., 2014, 49(10): 813-817 (doi: 10.1590/S0100-204X2014001000008).
- Cavalieri F.L.B., Morotti F., Seneda M.M., Colombo A.H.B., Andreazzi M.A., Emanuelli I.P., Rigolon L.P. Improvement of bovine in vitro embryo production by ovarian follicular wave syn-chronization prior to ovum pick-up. Theriogenology, 2018, 117: 57-60 (doi: 10.1016/j.theriogenol-ogy.2017.11.026).
- Caccia M., Bó G.A. Follicle wave emergence following treatment of CIDR-B implanted beef heifers with estradiol benzoate and progesterone. Theriogenology, 1998, 49(1): 341 (doi: 10.1016/S0093-691X(98)90694-X).
- Dayan A., Watanabe M.R., Watanabe Y.F. Fatores que interferem na produção comercial de embriões FIV. Arquivos da Faculdade de Veterinária UFRGS, 2000, 28: 181-185.
- Bó G.A., Baruselli P.S., Martinez M.F. Pattern and manipulation of follicular development in Bos indicus cattle. Animal Reproduction Science, 2003, 78(3-4): 307-326 (doi: 10.1016/s0378-4320(03)00097-6).
- Silva-Santos K.C., Siloto L.S., Santos G.M.G., Morotti F., Marcantonio T.N., Seneda M.M. Comparison of antral and preantral ovarian follicle populations between Bos indicus and Bos indicus taurus cows with high or low antral follicles counts. Reproduction in Domestic Animals, 2014, 49(1): 48-51 (doi: 10.1111/rda.12222).
- Baruselli P.S., de Sa Filho M.F., Martins C.M., Nasser L.F., Nogueira M.F.G., Barros C.M., Bó G.A. Superovulation and embryo transfer in Bos indicus cattle. Theriogenology, 2006, 65(1): 77-88 (doi: 10.1016/j.theriogenology.2005.10.006).
- Bacelar D., Max M.C., Padilha L.C., Barreiros T.R.R., Seneda M.M. Incremento na obtenção de oócitos em novilhas Nelore (Bos taurus indicus) tratadas com progesterona injetável e benzoato de estradiol. Semina: Ciências Agrárias, 2010, 31(1): 163-172 (doi: 10.5433/1679-0359.2010v31n1p163).
- Denicol A.C., Lopes G., Mendonça L.G.D., Rivera F.A., Guagnini F., Perez R.V., Lima J.R., Bruno R.G.S., Santos J.E.P., Chebel R.C. Low progesterone concentration during the develop-ment of the first follicular wave reduces pregnancy per insemination of lactating dairy cows. Journal of Dairy Science, 2012, 95(4): 1794-1806 (doi: 10.3168/jds.2011-4650).
- Goodhand K.L., Watt R.G., Stainer M.E., Hutchinson J.S.M., Broadbent J.P. In vivo oocyte recovery and in vitro embryo production from bovine donors aspirated at different frequencies or following FSH treatment. Theriogenology, 1999, 51(5): 951-961 (doi: 10.1016/S0093-691X(99)00041-2).
- van de Leemput E.E., Vos P.L.A.M., Zeinstra E.C., Severs M.M., van der Weijden G.C., Diele-man S.J. Improved in vitro embryo development using in vivo matured oocytes from heifers superovulated with a controlled preovulatory LH surge. Theriogenology, 1999, 52(2): 335-349 (doi: 10.1016/s0093-691x(99)00133-8).
- Blondin P., Vigneault C., Nivet A.L., Sirard M.A. Improving oocyte quality in cows and heifers — what have we learned so far? Anim Reprod., 2012, 9: 281-289.
- Mapletoft R., Pawlyshyn V., Garcia A., Bó G., Willmott N., Saunders J., Schmutz S. Comparison of four different gonadotropin treatments for inducing superovulation in cows with 1:29 translo-cation. Theriogenology, 1990, 33: 282.
- Monniaux D., Chupin D., Saumande J. Superovulatory responses of cattle. Theriogenology, 1983, 19(1): 55-81 (doi: 10.1016/0093-691X(83)90124-3).
- De Roover R., Bols P.E.J., Genicot G., Hanzen C.H. Characterisation of low, medium and high responders following FSH stimulation prior to ultrasound-guided transvaginal oocyte retrieval in cows. Theriogenology, 2005, 63(7): 1902-1913 (doi: 10.1016/j.theriogenology.2004.08.011).
- Сингина Г.Н., Гавличек В., Тарадайник Н.П., Чинаров Р.Ю., Тарадайник Т.Е., Шедова Е.Н. Трансвагинальная аспирация фолликулов и способность OPU-ооцитов коров к эмбрио-нальному развитию в условиях in vitro. Молочное и мясное скотоводство, 2019, 6: 17-19 (doi: 10.33943/MMS.2019.6.39670).
- Goulding D., Williams D., Roche J., Boland M. Factors affecting superovulation in heifers treated with PMSG. Theriogenology, 1996, 45(4): 765-773 (doi: 10.1016/0093-691x(96)00006-4).
- Bó G.A., Mapletoft R.J. Historical perspectives and recent research on superovulation in cattle. Theriogenology, 2014, 81(1): 38-48 (doi: 10.1016/j.theriogenology.2013.09.020).
- Murphy B.D., Martinuk S.D. Equine chorionic gonadotropin. Endocrine Reviews, 1991, 12(1): 27-44 (doi: 10.1210/edrv-12-1-27).
- Schams D., Menzer D., Schalenberger E., Hoffman B., Hahn J., Hahn R. Some studies of the pregnant mare serum gonadotrophin (PMSG) and on endocrine responses after application for superovulation in cattle. In: Control of reproduction in the cow /J.M. Sreenan (ed.). Martinus Nijhoff, The Hague, 1978: 122-142.
- Mikel-Jenson A., Greve T., Madej A., Edqvist L.-E. Endocrine profiles and embryo quality in the PMSG-PGF2a-treated cow. Theriogenology, 1982, 18(1): 33-34 (doi: 10.1016/0093-691X(82)90046-2).
- Moor R., Kruip T., Green D. Intraovarian control of folliculogenesis: limits to superovulation? Theriogenology, 1984, 21(1): 103-116 (doi: 10.1016/0093-691X(84)90310-8).
- Greve T., Callesen H., Hyttel P., Hoier R., Assey R. The effects of exogenous gonadotropins on oocyte and embryo quality in cattle. Theriogenology, 1995, 43(1): 41-50 (doi: 10.1016/0093-691X(94)00013-K).
- Callesen H., Greve T., Hyttel P. Preovulatory endocrinology and oocyte maturation in superov-ulated cattle. Theriogenology, 1986, 25(1): 71-86 (doi: 10.1016/0093-691X(86)90184-6).
- Demoustier M.M., Beckers J.-Fr., Van Der Zwalmen P., Closset J., Gillard J.-L., Ectors F. Determination of porcine plasma follitropin levels during superovulation treatment in cows. The-riogenology, 1988, 30(2): 379-386 (doi: 10.1016/0093-691x(88)90185-9).
- Blondin P., Bousquet D., Twagiramungu H., Barnes F., Sirard M.-A. Manipulation of follicular development to produce developmentally competent bovine oocytes. Biology of Reproduction, 2002, 66(1): 38-43 (doi: 10.1095/biolreprod66.1.38).
- Nivet A.-L., Bunel A., Labrecque R., Belanger J., Vigneault C., Blondin P., Sirard M.-A. FSH withdrawal improves developmental competence of oocytes in the bovine model. Reproduction, 2012, 143(2): 165-171 (doi: 10.1530/REP-11-0391).
- Arreseigor C.J., Gutiérrez-Reinoso M.A., Driedger B., Pereira A., Arza-Spinzi F., Garcia-Her-reros M. Differential oocyte recovery rates after ovum pickup and in vitro embryo production in Charolais and Hereford cattle breeds. Anim Reprod., 2023, 20(2): 4.
- Sendag S., Cetin Y., Muhammet A., Hadeler K.G., Niemann H. Effects of eCG and FSH on ovarian response, recovery rate and number and quality of oocytes obtained by ovum pick-up in Holstein cows. Animal Reproduction Science, 2008, 106(1-2): 208-214 (doi: 10.1016/j.anirepro-sci.2008.01.007).
- Hiraizumi S., Nishinomiya H., Oikawa T., Sakagami N., Sano F., Nishino O., Kurahara T., Nishimoto N., Ishiyama O., Hasegawa Y., Hashiyada Y. Superovulatory response in Japanese Black cows receiving a single subcutaneous porcine follicle-stimulating hormone treatment or six intramuscular treatments over three days. Theriogenology, 2015, 83(4): 466-473 (doi: 10.1016/j.theriogenology.2014.09.012).
- Chasombat J., Sakhong D., Nagai T., Parnpai R., Vongpralub T. Superstimulation of follicular growth in Thai native heifers by a single administration of follicle stimulating hormone dissolved in polyvinylpyrrolidone. Journal of Reproduction and Development, 2013, 59(3): 214-218 (doi: 10.1262/jrd.2012-119).
- Hashimoto S., Kimura K., Kuramochi T., Aoyagi K., Hirako M., Kawaguchi M., Iwata H., Hirao M., Kitada K., Hirasawa K., Ueda M. Responsiveness of rabbits to superovulation treat-ment by a single injection of follicle-stimulating hormone with aluminum hydroxide gel. Mol. Reprod. Dev., 2007, 74(9): 1208-1212 (doi: 10.1002/mrd.20672).
- Tríbulo A., Rogan D., Tríbulo H., Tríbulo R., Mapletoft R.J., Bó G.A. Superovulation of beef cattle with a split-single intramuscular administration of Folltropin-V in two concentrations of hyaluronan. Theriogenology, 2012, 77(8): 1679-1685 (doi: 10.1016/j.theriogenology.2011.12.013).
- Ongaratto F.L., Tribulo A., Ramos M., Rodriguez P., Bó G.A. Oocyte recovery rates and in vitro blastocyst production in cattle treated with a single injection of folltropin-v diluted in a slow-release formulation. Reproduction, Fertility and Development, 2011, 23(1): 202-203 (doi: 10.1071/RDv23n1Ab207).
- Bó G.A. Simplified superstimulation programs for in vivo and in vitro embryo production in cattle. Proc. 31st World Buiatrics Congress. Madrid, 2022, K80: 56-57.
- Nasser L., Sá Filho M., Reis E., Rezende C., Mapletoft R., Bó G., Baruselli P.S. Exogenous progesterone enhances ova and embryo quality following superstimulation of the first follicular wave in Nelore (Bos indicus) donors. Theriogenology, 2011, 76(2): 320-327 (doi: 10.1016/j.theri-ogenology.2011.02.009).
- Rivera F., Mendonca L., Lopes G., Santos J., Perez R., Amstalden M., Correa-Calderón A., Chebel R.C. Reduced progesterone concentration during growth of the first follicular wave affects embryo quality but has no effect on embryo survival post-transfer in lactating dairy cows. Repro-duction, 2011, 141(3): 333-342 (doi: 10.1530/REP-10-0375).
- Ribas B.N., Missio D., Junior Roman I., Neto N.A., Claro I. Junior, dos Santos Brum D., Leivas F.G. Superstimulation with eCG prior to ovum pick-up improves follicular development and fertilization rate of cattle oocytes. Animal Reproduction Science, 2018, 195: 284-290 (doi: 10.1016/j.anireprosci.2018.06.006).
- Son D.-S., Choe C.-Y., Cho S.-R., Choi S.-H., Kim H.-J., Hur T.-Y., Jung Y.-G., Kang H.-G., Kim I.-M. A CIDR-based timed embryo transfer protocol increases the pregnancy rate of lactat-ing repeat breeder dairy cows. Journal of Reproduction and Development, 2007, 53(6): 1313-1318 (doi: 10.1262/jrd.19066).
- Ferré L.B., Alvarez-Gallardo H., Romo S., Fresno C., Stroud T., Stroud B., Lindsey B., Kjel-land M.E. Transvaginal ultrasound-guided oocyte retrieval in cattle: State-of-the-art and its im-pact on the in vitro fertilization embryo production outcome. Reproduction in Domestic Animals, 2023, 58(3): 363-378 (doi: 10.1111/rda.14303).
- Monniaux D., Barbey S., Rico C., Fabre S., Gallard Y., Larroque H. Anti-Müllerian hormone: a predictive marker of embryo production in cattle? Reproduction, Fertility and Development, 2010, 22(7): 1083-1091 (doi: 10.1071/RD09279).
- Mazzoni G., Salleh S.M., Freude K., Pedersen H.S., Stroebech L., Callesen H., Hyttel P., Ka-darmideen H.N. Identification of potential biomarkers in donor cows for in vitro embryo produc-tion by granulosa cell transcriptomics. PLoS ONE, 2017, 12(4): e0175464 (doi: 10.1371/jour-nal.pone.0175464).
- Kowsar R., Komeili M., Sadeghi N., Sadeghi K. Multistep analysis reveals the relationship be-tween blood indices at the time of ovum pick-up and in vitro embryo production in heifers. Theriogenology, 2021, 159: 153-164 (doi: 10.1016/j.theriogenology.2020.10.026).
- Umer S., Zhao S.J., Sammad A., Sahlu B.W., Pang Y., Zhu H. AMH: Could it be used as a biomarker for fertility and superovulation in domestic animals? Genes, 2019, 10(12): 1009 (doi: 10.3390/genes10121009).
- Stojsin-Carter A., Mahboubi K., Costa N.N., Gillis D.J., Carter T.F., Neal M.S., Miranda M.S., Ohashi O.M., Favetta L.A., King W.A. Systemic and local anti-Mullerian hormone reflects dif-ferences in the reproduction potential of Zebu and European type cattle. Animal Reproduction Science, 2016, 167: 51-58 (doi: 10.1016/j.anireprosci.2016.02.003).


