Реакции бромидов бутен[бис(трифенилфосфония)] и пентан[бис(трифенил-фосфония)] с аренсульфоновыми кислотами
Автор: Шарутин В.В., Механошина Е.С., Вершинина Е.А., Захарченкова В.П.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 2 т.16, 2024 года.
Бесплатный доступ
Реакцией эквимолярных количеств бромидов тетраорганилфосфония с аренсульфоновыми кислотами в воде с выходом до 89 % получены ионные аренсульфонаты тетраорганилфосфония [Ph3PCH2CH=CHCH2PPh3][OSO2C9H3N(OH-4)(I-7)]2 ∙ 4H2O (1), [Ph3P(CH2)5PPh3][OSO2С6H4(COOH-2)][Br] (2). Особенности строения комплексов 1, 2 установлены методом РСА. Кристаллы 1 [C58H54I2N2O12P2S2, M 1350,89; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 9,506(8), b = 11,323(12), c = 13,662(10) Å; a = 82,21(4)°, β = 89,26(2)°, g = 72,60(4)°, V = 1390(2) Å3, Z = 2; rвыч = 1,614 г/см3], 2 [C48H45O5P2SBr, M 875,75; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 10,307(7), b = 14,226(9), c = 16,291(10) Å; a = 67,07(3)°, β = 83,74(3)°, g = 74,65(3)°, V = 2122(2) Å3, Z = 2; rвыч = 1,371 г/см3] состоят из катионов тетраорганилфосфония и аренсульфонатных анионов с тетраэдрическим атомом серы. В кристалле комплекса 2 присутствуют также анионы [Br]-. Длины связей P-C варьируют в интервале 1,779(3)-1,815(4) Å. Валентные углы СРС принимают значения 104,33(15)-112,00(10)°. Расстояния S-О изменяются в пределах 1,4397(18)-1,4576(19) Å. Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2164291 (1), № 2165072 (2), deposit@ccdc.cam.ac.uk; http://www.ccdc. cam.ac.uk).
Бромид тетраорганилфосфония, аренсульфоновая кислота, аренсульфонат тетраорганилфосфония, синтез, строение, рентгеноструктурные исследования
Короткий адрес: https://sciup.org/147244635
IDR: 147244635 | УДК: 546.87+547.29+548.312.5 | DOI: 10.14529/chem240205
Текст научной статьи Реакции бромидов бутен[бис(трифенилфосфония)] и пентан[бис(трифенил-фосфония)] с аренсульфоновыми кислотами
Известно, что фосфорорганические соединения широко используются в синтетической и практической химии [1–12]. Наиболее известными производными пятивалентного фосфора являются фосфониевые соли, которые получаются с хорошим выходом кватернизацией соответствующего фосфина в результате реакции с электрофилом или кислотой Бренстеда [13‒16]. По другому способу их можно получить из пентафенилфосфора и кислот [17‒20]. Однако данные методики имеют определенные недостатки, поэтому разработка новых простых методик получения солей фосфония, содержащих разнообразные функциональные группы, является актуальным направлением современной органической химии. В работах [21 - 25] нами был получен и структурно охарактеризован ряд аренсульфонатов тетраорганилфосфония из галогенидов тетраорганилфос-фония и аренсульфоновых кислот. Достоинствами данного одностадийного способа являются мягкие условия проведения эксперимента и высокие выходы комплексов.
В настоящей работе представлен синтез новых ионных аренсульфонатов тетраорганилфосфония [Ph 3 PCH 2 CH=CHCH 2 PPh 3 ][OSO 2 C 9 H 3 N(OH-4)(I-7)] 2 • 4H 2 O ( 1 ), [Ph 3 P(CH 2 ) 5 PPh 3 ][OSO 2 C 6 H 4 (COOH-2)][Br] ( 2 ), особенности строения которых установлены методом РСА.
Экспериментальная часть
В работе использовали бромиды тетраорганилфосфония и аренсульфоновые кислоты производства фирмы Alfa Aesar. Соединения 1 и 2 синтезировали по методике, описанной в [21].
Гидрат 7-иод-8-оксихинолин-5-сульфоната бутилен бис (трифенилфосфония) (1). Желтые кристаллы, (80 %), Тпл = 143 °С. ИК-спектр ( у , см - 1): 3356, 3086, 3063, 3040, 2930, 2880, 1585, 1489, 1439, 1398, 1371, 1315, 1196, 1142, 1113, 1038, 997, 841, 816, 793, 746, 714, 689, 658, 600, 544, 492, 418. Найдено, %: C 51,45; Н 4,09. C 58 H 54 I 2 N 2 O 12 P 2 S 2 . Вычислено, %: С 51,52; Н 4,00.
2-Карбоксибензолсульфонат пентан( бис )трифенилфосфония бромид (2). Бесцветные кристаллы, (75 %), Т пл = 144 °С. ИК-спектр ( v , см - 1): 3418, 2957, 2934, 2870, 1748, 1741, 1587, 1490, 1393, 1213, 1192, 1142, 1092, 1040, 972, 953, 918, 903, 858, 845, 812, 772, 725, 710, 683, 656, 625, 604, 534, 517, 436, 419. Найдено, %: С 65,62; Н 5,23. C 48 H 45 BrO 5 P 2 S. Вычислено, %: С 65,77; Н 5,14.
Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter.
ИК-спектры соединений 1 , 2 записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S в таблетке KBr в области 4000 - 400 см - 1.
Рентгеноструктурный анализ ( РСА ) проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K „ -излучение, X = 0,71073 A, графитовый монохроматор) при 293 K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus . Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC и OLEX2 [26‒28]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)). Кристаллографические данные и результаты уточнения структур приведены в табл.
Кристаллографические данные, параметры эксперимента и уточнения структур 1, 2
|
Параметр |
1 |
2 |
|
Формула |
C 58 H 54 I 2 N 2 O 12 P 2 S 2 |
C 48 H 45 O 5 P 2 SBr |
|
М |
476,59 |
875,75 |
|
Сингония |
Триклинная |
Триклинная |
|
Пр. группа |
P– 1 |
P– 1 |
|
a , Å |
9,506(8) |
10,307(7) |
|
b, Å |
11,323(12) |
14,226(9) |
|
c, Å |
13,662(10) |
16,291(10) |
|
α, град. |
82,21(4) |
67,07(3) |
|
β, град. |
89,26(2) |
83,74(3) |
|
γ, град. |
72,60(4) |
74,65(3) |
|
V , Å3 |
1390(2) |
2122(2) |
|
Z |
2 |
2 |
|
ρ (выч.), г/см3 |
1,614 |
1,371 |
|
–1 µ , мм |
1,329 |
1,140 |
|
F (000) |
680,0 |
908,0 |
|
Размер кристалла, мм |
0,3 × 0,1 × 0,09 |
0,3 × 0,25 × 0,17 |
|
Область сбора данных по θ , град. |
6,7–56,64 |
5,9‒56,62 |
|
Интервалы индексов отражений |
–12 ≤ h ≤ 12, –14 ≤ k ≤ 15, –17 ≤ l ≤ 18 |
–13 ≤ h ≤ 13, –18 ≤ k ≤ 18, –21 ≤ l ≤ 21 |
|
Измерено отражений |
36412 |
36162 |
|
Независимых отражений |
6858 |
9762 |
|
R int |
0,0692 |
0,0346 |
|
Переменных уточнения |
362 |
515 |
|
GOOF |
1,015 |
1,024 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0421, wR 2 = 0,0843 |
R 1 = 0,0339, wR 2 = 0,0767 |
|
R -факторы по всем отражениям |
R 1 = 0,0789, wR 2 = 0,0963 |
R 1 = 0,0507, wR 2 = 0,0829 |
|
Остаточная электронная плотность (min/max), e /Å3 |
1,54/–0,69 |
0,24/–0,51 |
Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2164291 ( 1 ), № 2165072 ( 2 );
; .
Обсуждение результатов
Мы нашли, что прибавление к прозрачному горячему водному раствору дибромида бис (трифенилфосфония) водного раствора 7-иод-8-оксихинолин-5-сульфокислоты приводит к образованию целевого комплекса 1 , который после концентрации раствора и высушивания представляли собой устойчивые на воздухе прозрачные кристаллы, хорошо растворимые в хлороформе, диэтиловом эфире, этаноле, аренах, ацетонитриле, тетрагидрофуране, четыреххлористом углероде и плохо - в воде при комнатной температуре.
[Ph 3 PR]Br 2 + 2 HOSO 2 Ar ⎯⎯⎯-> [Ph PR][OSO Ar] ∙ 4H O
-HBr
R = CH 2 CH=CHCH 2 PPh 3 , Ar = C 9 H 3 N(OH-4)(I-7) ( 1 )
Производные 7-иод-8-оксихинолин-5-сульфокислоты ионного типа описаны в литературе [29–33]. Меньшим числом представлены ее комплексные соединения [34, 35] и ковалентные производные [36]. К комплексам последнего типа и относится полученный нами гидрат 7-иод-8-оксихинолин-5-сульфоната бутен[ бис (трифенилфосфония)].
Мы показали, что в случае избыточного количества исходного бромсодержащего соединения в реакционной смеси может наблюдаться замещение только одного атома брома, как, например, при взаимодействии дибромида пентан[ бис (трифенилфосфония)] с 2-сульфобензойной кислотой, приводящего к образованию комплекса, содержащего как сульфоанионы, так и анионы брома.
[Ph 3 PR]Br 2 + HOSO 2 Ar ⎯⎯⎯-> [Ph PR][OSO Ar]Br
-HBr
R = (CH 2 ) 5 PPh 3 , Ar = С 6 H 4 (COOH-2) ( 2 )
В ИК-спектре комплекса 1 наблюдается полоса поглощения высокой интенсивности при 3356 см–1, характеризующие молекулы гидратной воды, а для комплексов 1 и 2 – при 3086‒3040 см– 1, соответственно, отвечающие валентным колебаниям связей CAr–H. Полосы при 1192‒992 и 858‒725 см–1 относятся соответственно к плоскостным и внеплоскостным деформационным колебаниям этих же связей. Также присутствуют характерные полосы валентных колебаний углеродного скелета ароматических фрагментов в области 1585‒1489 см–1. Валентным колебаниям метиленовых групп соответствуют полосы при 2957‒2870 см–1, деформационным колебаниям ‒ при 1485‒1456 см–1. Полосы поглощения сильной интенсивности при 1489-1439 и 1113-1038 см-1 отвечают асимметричным и симметричным валентным колебаниям сульфонатной группы SO3. Интенсивные полосы при 714 и 710 см–1 соответствуют валентным колебаниям связи S‒O. Валентным колебаниям связей C Ar –S и C Ar –P отвечают полосы высокой интенсивности при 544, 534 и 746‒714 см–1 соответственно [37, 38].
По данным РСА кристаллы 1 и 2 состоят из фосфониевых катионов и аренсульфонатных анионов с тетраэдрическим атомом серы (рис. 1, 2). Соединение 1 является гидратом, молекулы воды в котором участвуют в структурировании кристалла (расстояния Н∙∙∙О изменяются в интервале 2,08 - 2,87 Å). Катион соединения 2 центросимметричен (центр инверсии находится на середине двойной связи С(8)=С(8)). Длины связей P-C варьируют в интервале 1,786(4)-1,815(4) Å. Валентные углы СРС принимают значения 104,33(15)°-112,00(10)°. Расстояния S-О изменяются в пределах 1,4397(19)-1,4576(2) Å. Длины связей S - C составляют 1,779(3) и 1,797(2) Å соответственно.
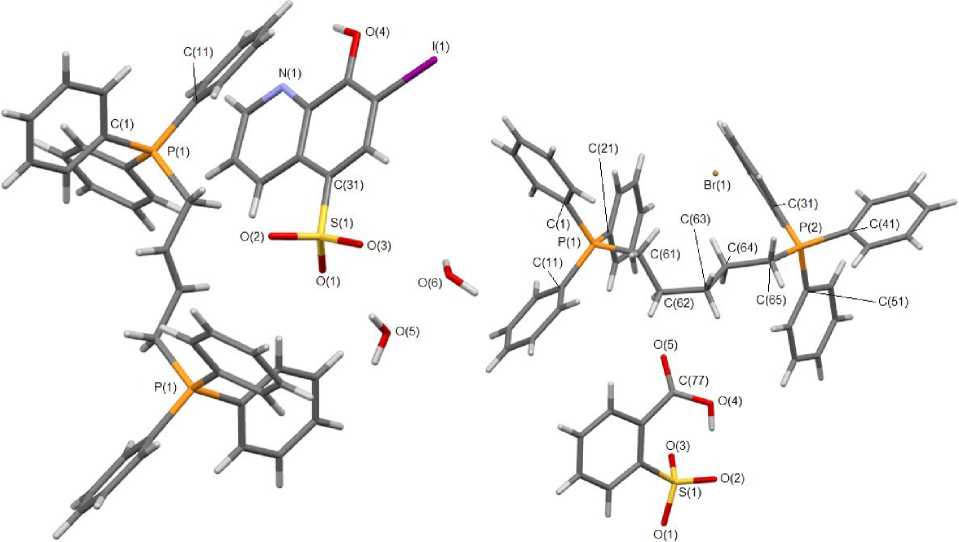
Рис. 1. Общий вид гидрата 7-иод-8-оксихинолин-5-сульфоната бутилен бис (трифенилфосфония) (1)
Рис. 2. Общий вид 2-карбоксибензолсульфоната пентан( бис )трифенилфосфонийбромида (2)
Выводы
Взаимодействие бромидов тетраорганилфосфония с аренсульфоновыми кислотами в воде приводит, в зависимости от соотношения исходных реагентов, к замещению одного или двух атомов брома на аренсульфонатную группу, при этом образуются ионные комплексы аренсуль-фонатов тетраорганилфосфония, строение которых установлено методом РСА.
Список литературы Реакции бромидов бутен[бис(трифенилфосфония)] и пентан[бис(трифенил-фосфония)] с аренсульфоновыми кислотами
- Hartley F.R. The Chemistry of Organophosphorus Compounds. Vol. 3. Phosphonium Salts, Ylides and Phosphoranes / F.R. Hartley. John Wiley & Sons, Ltd., 1983. 458 p.
- Moritz R., Wagner M., Schollmeyer D. et al. // Chem. Eur. J. 2015. Vol. 21. P. 9119. DOI: 10.1002/chem.201406370.
- Werner T. // Adv. Synth. Catal. 2009. Vol. 351. P. 1469. DOI: 10.1002/adsc.200900211.
- Cordovilla C., Bartolome C., Martinez-Ilarduya J.M. et al. // ACS Catal. 2015. Vol. 5. P. 3040. DOI: 10.1021/acscatal.5b00448.
- Chong C.C., Hirao H., Kinjo R. // Angew. Chem. Int. Ed. 2015. Vol. 127. P. 192. DOI: 10.1002/ange.201408760.
- Luiz J.F., Spikes H. // Tribology Letters. 2020. Vol. 68. P. 75. DOI: 10.1007/s11249-020-01315-8.
- Zhu Ch.-L., Zhang F.-G., Meng W. et al. // Angew. Chem. Int. Ed. 2011. Vol. 50. P. 5869. DOI: 10.1002/anie.201100283.
- Cassity C.G., Mirjafari A., Mobarrez N. et al. // Chem. Commun. 2013. Vol. 49, No. 69. P. 7590. DOI: 10.1039/c3cc44118k.
- Canac Y., Duhayon C., Chauvin R. // Angew. Chem. Int. Ed. 2007. Vol. 46. P. 6313. DOI: 10.1002/anie.200701490.
- Milenkovic M., Warzajtis B., Rychlewska U. et al. // Molecules. 2012. Vol. 17. No. 3. P. 2567. DOI: 10.3390/molecules17032567
- Pavlova J.A., Khairullina Z.Z., Tereshchenkov A.G. et al. // Antibiotics. 2021. Vol. 10. P. 489. DOI: 10.3390/antibiotics10050489.
- Tsepaeva O.V., Salikhova T.I., Grigor’eva L.R. et al. // Med. Chem. Res. 2021. Vol. 30. P. 925. DOI: 10.1007/s00044-020-02674-6.
- Sodano F., Rolando B., Spyrakis F. et al. // ChemMedChem. 2018. Vol. 13. P. 1238. DOI: 10.1002/cmdc.201800088.
- Mironov V.F., Nemtarev A.V., Tsepaeva O.V. et al. // Molecules. 2021. Vol. 26. P. 6350. DOI: 10.3390/molecules26216350.
- Khasiyatullina N.R., Gubaidullin A.T., Shinkareva A.M. et al. // Russ. Chem. Bull., Int. Ed. 2020. Vol. 69. P. 2140. DOI: 10.1007/s11172-020-3012-3.
- Romanov S., Aksunova A., Bakhtiyarova Y. et al. // J. Organomet. Chem. 2020. Vol. 910. P. 121130. DOI: 10.1016/j.jorganchem.2020.121130
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общей химии. 2009. Т. 79. С. 80. DOI: 10.1134/S1070363209010125
- Шарутин В.В., Шарутина О.К., Рыбакова А.В. и др. // Журн. общей химии. 2018. Т. 88, № 8. С. 1308. DOI: 10.1134/S0044460X18080139
- Шарутин В.В., Мукушева Н., Уржумова А.В. // Вестник ЮУрГУ. Серия «Химия». 2018. Т. 10, № 2. С. 48. DOI: 10.14529/chem180206
- Шарутин В.В., Шарутина О.К., Губанова Ю.О. // Изв. вузов. Химия и хим. технология. 2019. Т. 62, № 2. С. 4. DOI: 10.6060/ivkkt.20196202.5823
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 2. С. 41. DOI: 10.14529/chem220205.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. общей химии. 2022. Т. 92, № 6. С. 885. DOI: 10.31857/S0044460X22060087.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. структурной химии. 2022. Т. 63, № 10. С. 99532. DOI: 10.26902/JSC_id99532.
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 1. С. 31. DOI: 10.14529/chem230103
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 2. С. 55. DOI: 10.14529/chem230204
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. Vol. 42. P. 339. DOI: 10.1107/S0021889808042726.
- Smith G., Wermuth U.D., Healy P.C. // Acta Cryst. 2007. V. C63, o405. DOI: 10.1107/S0108270107025772.
- Smith G., Wermuth U.D., Healy P.C. // Acta Cryst. 2004. V. E60, o1040. DOI: 10.1107/S1600536804011274.
- Smith G. // Acta Cryst. 2012. V. E68, o3349. DOI: 10.1107/S1600536812046247.
- Hemamalini M., Muthiah P.T., Bocelli G., Cantoni A. // Acta Cryst. 2004. V. C60, o284. DOI: 10.1107/S0108270104001295.
- Smith G., Wermuth U.D., Healy P.C. // Acta Cryst. 2007. V. C63, o405. DOI: 10.1107/S0108270107025772.
- Liu H.-Y., Wu H., Ma J.-F. // Acta Cryst. 2006. V. E62, m1036. DOI: 10.1107/S1600536806012943.
- Balasubramani K., Hemamalini M., Francis S. et al. // J. Chem. Cryst. 2010. V. 40. P. 316. DOI: 10.1007/s10870-009-9653-6
- Balasubramani K., Thomas P., Bocelli G., Cantoni A. // J. Coord. Chem. 2005. V. 58. P. 1689.
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Васильев А.В., Гриненко Е.В., Щукин А.О. и др. Инфракрасная спектроскопия органических и природных соединений: учебное пособие. СПб.: СПбГЛТА, 2007. 54 с.

![Реакции бромидов бутен[бис(трифенилфосфония)] и пентан[бис(трифенил-фосфония)] с аренсульфоновыми кислотами Реакции бромидов бутен[бис(трифенилфосфония)] и пентан[бис(трифенил-фосфония)] с аренсульфоновыми кислотами](/file/cover/147244635/reakcii-bromidov-buten-bis-trifenilfosfonija-i-pentan-bis-trifenil-fosfonija-s.png)
