Реакции хлоридов ацетонилтрифенилфосфония и 2-бутен-1,4-бис(трифенилфосфония) с азотной кислотой
Автор: Шарутин В.В., Шевченко Д.П., Хажиева К.Р.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.16, 2024 года.
Бесплатный доступ
Взаимодействием хлоридов ацетонилтрифенилфосфония и 2-бутен-1,4-бис(трифенилфосфония) с азотной кислотой синтезированы алкилтрифенилфосфониевые нитраты [Ph3PCH2С(O)Me]NO3 (1) и [Ph3PCH2CH=CHCH2PPh3][NO3]2 ∙ 2H2O (2) соответственно. Полученные соединения охарактеризованы методами ИК-спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, нитрат ацетонилтрифенилфосфония (1) [C21H20NO4P, M = 381,35; моноклинная сингония, пр. гр. С2/с; параметры ячейки: a = 14,301(13) Å, b = 12,756(11) Å, c = 21,40(2) Å; a = 90,00°, β = 90,66(3)°, g = 90,00°, V = 3904(8) Å3, Z = 8; rвыч = 1,298 г/см3; m = 0,167 мм-1; F(000) = 1600,0; обл. сбора по 2q: 5,7-56,96°; -16 ≤ h ≤ 19, -17 ≤ k ≤ 17, -28 ≤ l ≤ 28; всего отражений 46344; независимых отражений 4894 (Rint = 0,0808); GOOF = 1,034; R-фактор 0,0631] и гидрат нитрата (2-бутен-1,4-бис(трифенилфосфония) (2) [C40H40N2O8P2, M = 738,68; триклинная сингония, пр. гр. P-1; параметры ячейки: a = 9,259(7) Å, b = 9,514(6) Å, c = 12,247(9) Å; a = 68,43(4)°, β = 72,47(5)°, g = 84,06(3)°, V = 956,7(12) Å3, Z = 1; rвыч = 1,282 г/см3; m = 0,168 мм-1; F(000) = 388,0; обл. сбора по 2q: 5,9-54,34°; -11 ≤ h ≤ 11, -12 ≤ k ≤ 12, -15 ≤ l ≤ 15; всего отражений 21543; независимых отражений 4219 (Rint = 0,0354); GOOF = 1,029; R-фактор 0,0493] имеют ионное строение и состоят из органилтрифенилфосфониевых катионов с несколько искаженной тетраэдрической координацией атома фосфора (углы CPC варьируются в пределах 104,99(11)-112,25(12)° для 1 и 107,61(11)-111,28(11)° для 2; расстояния P-C составляют 1,792(3)-1,802(3) Å и 1,792(2)-1,815(2) Å соответственно) и плоских тригональных нитрат-анионов (суммы углов ONO равны 359,5° и 360° соответственно). Полные таблицы координат атомов, длин связей и валентных углов нитратов 1 и 2 депонированы в Кембриджском банке структурных данных (CCDC 2155176 (1), 2335887 (2); deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
Нитраты алкилтрифенилфосфония, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147246068
IDR: 147246068 | УДК: 546.185+547.53.024+548.312.3 | DOI: 10.14529/chem240406
Текст научной статьи Реакции хлоридов ацетонилтрифенилфосфония и 2-бутен-1,4-бис(трифенилфосфония) с азотной кислотой
Аннотация. Взаимодействием хлоридов ацетонилтрифенилфосфония и 2-бутен-1,4-бис(трифенилфосфония) с азотной кислотой синтезированы алкилтрифенилфосфониевые нитраты [Ph3PCH2С(O)Me]NO3 (1) и [Ph3PCH2CH=CHCH2PPh3][NO3]2 ∙ 2H2O (2) соответственно. Полученные соединения охарактеризованы методами ИК-спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, нитрат ацетонилтрифенилфосфония (1) [C21H20NO4P, M = 381,35; моноклинная сингония, пр. гр. С2/с; параметры ячейки: a = 14,301(13) Å, b = 12,756(11) Å, c = 21,40(2) Å; а = 90,00°, в = 90,66(3)°, Y = 90,00°, V = 3904(8) A3, Z = 8; рвыч = 1,298 г/см3; ц = 0,167 мм-1; F(000) = 1600,0; обл. сбора по 20: 5,7-56,96°; -16 < h < 19, -17 < k < 17, -28 < l < 28; всего отражений 46344; независимых отражений 4894 (Rint = 0,0808); GOOF = 1,034; R-фактор 0,0631] и гидрат нитрата (2-бутен-1,4-бис(трифенилфосфония) (2) [C40H40N2O8P2, M = 738,68; триклинная сингония, пр. гр. P-1; параметры ячейки: a = 9,259(7) A, b = 9,514(6) A, c = 12,247(9) A; а = 68,43(4)°, в = 72,47(5)°, Y = 84,06(3)°, V = 956,7(12) A3, Z = 1; рвыч = 1,282 г/см3; ц = 0,168 мм-1; F(000) = 388,0; обл. сбора по 20: 5,9-54,34°; -11 < h < 11, -12 < k < 12, -15 < l < 15; всего отражений 21543; независимых отражений 4219 (Rint = 0,0354); GOOF = 1,029; R-фактор 0,0493] имеют ионное строение и состоят из ор-ганилтрифенилфосфониевых катионов с несколько искаженной тетраэдрической координацией атома фосфора (углы CPC варьируются в пределах 104,99(11)-112,25(12)° для 1 и 107,61(11)-111,28(11)° для 2; расстояния P-C составляют 1,792(3)-1,802(3) A и 1,792(2)-1,815(2) A соответственно) и плоских тригональных нитрат-анионов (суммы углов ONO равны 359,5° и 360° соответственно). Полные таблицы координат атомов, длин связей и валентных углов нитратов 1 и 2 депонированы в Кембриджском банке структурных данных (CCDC 2155176 (1), 2335887 (2); ; .
Известно, что фосфорорганические соединения широко используются в качестве смазочных материалов, топливных присадок, антипиренов, пластификаторов, фармацевтических препаратов, реагентов в органическом синтезе [1–3]. Одними из наиболее исследованных органических производных фосфора являются соли тетраорганилфосфония [R 4 P]X (где R – одинаковые или отличающиеся заместители), которые преимущественно получают алкилированием/арилированием органофосфинов, а также по реакции пентаорганилфосфора с различными агентами [4, 5]. Важнейшей областью применения солей фосфония можно считать получение из них фосфорных илидов, используемых для синтеза алкенов заданного строения, кроме того, данные соединения широко применяются в качестве объемных катионов для стабилизации различных анионов [6–8], а также в качестве ионных жидкостей [9], межфазных катализаторов [10] и антипиренов [11]. Несмотря на значительный объем накопленных экспериментальных данных по тетраорганилфосфо-ниевым солям, кристаллическое строение нитратных производных [R4P]NO3 известны для небольшого числа примеров [12–18].
С целью продолжения данного направления нами описан синтез нитратов ацетонилтрифенилфосфония ( 1 ) и гидрата (2-бутен-1,4- бис (трифенилфосфония ( 2 ), строение которых доказано методами ИК-спектроскопии и рентгеноструктурного анализа.
Экспериментальная часть
Синтез нитратов алкилтрифенилфосфония осуществляли по методике, описанной в [18].
Нитрат ацетонилтрифенилфосфония [Ph 3 PCH 2 C(O)Me]NO 3 (1) – бесцветные кристаллы, выход 96 %, т. пл. 161 ° С. ИК-спектр (v, см - 1): 3090, 3049, 3022, 2905, 2860, 2367, 1721, 1585, 1485, 1437, 1385, 1337, 1192, 1159, 1109, 1028, 995, 934, 845, 829, 795, 783, 748, 716, 691, 615, 505, 496, 446, 409.
Нитрат гидрата (2-бутен-1,4- бис (трифенилфосфония) [Ph 3 PCH 2 CHCHCH 2 PPh 3 ][NO 3 ] 2 ∙ 2H2O (2) - бесцветные кристаллы, выход 96 %, т. пл. 101 - 138 ° С (т.разл. 153 ° С). Найдено (%): C 64,84; Н 5,49. Для C 20 H 20 NO 4 P рассчитано (%): С 64,98; Н 5,42. ИК-спектр (v, см - 1): 3462, 3059, 2932, 2882, 1647, 1585, 1485, 1437, 1369, 1335, 1195, 997, 974, 746, 719, 691, 544, 500, 444, 414.
ИК-спектры соединений 1 и 2 записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S; образцы готовили таблетированием с KBr (область поглощения 4000 - 400 см - 1).
Рентгеноструктурный анализ соединений 1 и 2 проводили на автоматическом четырехкружном дифрактометре Bruker D8 QUEST (Mo Ka-излучение, X = 0,71073 A, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [19]. Все расчеты по определе- нию и уточнению структур выполнены по программам SHELXL/PC [20] и OLEX2 [21]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1 и 2
|
Параметр |
1 |
2 |
|
Формула |
C 21 H 20 NO 4 P |
C 20 H 20 NO 4 P |
|
М |
381,35 |
369,34 |
|
Сингония |
Моноклинная |
Триклинная |
|
Пространственная группа |
С 2/ с |
P– 1 |
|
a , Å |
14,301(13) |
9,259(7) |
|
b, Å |
12,756(11) |
9,514(6) |
|
c, Å |
21,40(2) |
12,247(9) |
|
α, град. |
90,00 |
68,43(4) |
|
β, град. |
90,66(3) |
72,47(5) |
|
γ, град. |
90,00 |
84,06(3) |
|
V , Å3 |
3904(6) |
956,7(12) |
|
Z |
8 |
2 |
|
ρ выч , г/см3 |
1,298 |
1,282 |
|
µ , мм–1 |
0,167 |
0,168 |
|
F (000) |
1600,0 |
388,0 |
|
Форма кристалла (размер, мм) |
0,5 × 0,13 × 0,08 |
0,34 × 0,2 × 0,13 |
|
Область сбора данных по 2 θ , град. |
5,7–56,96 |
5,9–54,34 |
|
Интервалы индексов отражений |
–16 ≤ h ≤ 19, –17 ≤ k ≤ 17, –28 ≤ l ≤ 28 |
–11 ≤ h ≤ 11, –12 ≤ k ≤ 12, –15 ≤ l ≤ 15 |
|
Измерено отражений |
46344 |
21543 |
|
Независимых отражений ( R int ) |
4894 (0,0808) |
4219 (0,0354) |
|
Переменных уточнения |
245 |
238 |
|
GOOF |
1,034 |
1,029 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0631, wR 2 = 0,1468 |
R 1 = 0,0493, wR 2 = 0,1288 |
|
R -факторы по всем отражениям |
R 1 = 0,0950, wR 2 = 0,1630 |
R 1 = 0,0672, wR 2 = 0,1414 |
|
Остаточная электронная плотность (min/max), e /Å3 |
0,63/–0,56 |
0,52/–0,39 |
Таблица 2
Длины связей и валентные углы в структурах 1 и 2
|
Связь d , Å \ |
Угол ω , град |
||
|
1 |
|||
|
P(1)–C(21) |
1,792(2) |
C(21)P(1)C(1) |
110,03(11) |
|
P(1)–C(1) |
1,794(3) |
C(21)P(1)C(11) |
108,87(12) |
|
P(1)–C(11) |
1,799(3) |
C(21)P(1)C(7) |
111,75(13) |
|
P(1)–C(7) |
1,802(3) |
C(1)P(1)C(11) |
108,74(12) |
|
O(1)–C(8) |
1,204(3) |
C(1)P(1)C(7) |
112,25(12) |
|
O(2)–N(1) |
1,213(3) |
C(11)P(1)C(7) |
104,99(11) |
|
O(3)–N(1) |
1,224(4) |
O(2)N(1)O(3) |
124,1(3) |
|
O(4)–N(1) |
1,240(4) |
O(2)N(1)O(4) |
121,1(3) |
|
C(21)–C(26) |
1,383(3) |
O(3)N(1)O(4) |
114,3(3) |
|
2 |
|||
|
P(1)–C(11) |
1,792(2) |
C(11)P(1)C(21) |
108,38(11) |
|
P(1)–C(21) |
1,800(2) |
C(11)P(1)C(7) |
107,61(11) |
|
P(1)–C(7) |
1,815(2) |
C(11)P(1)C(1) |
110,56(10) |
|
P(1)–C(1) |
1,794(2) |
C(21)P(1)C(7) |
111,28(11) |
|
O(1)–N(1) |
1,228(3) |
C(1)P(1)C(21) |
109,96(11) |
|
O(2)–N(1) |
1,198(3) |
C(1)P(1)C(7) |
109,02(11) |
Окончание табл. 2
|
Связь d , Å |
Угол ω , град |
||
|
O(3)–N(1) |
1,238(3) |
O(1)N(1)O(3) |
120,8(2) |
|
C(8)–C(8a) |
1,312(4) |
O(2)N(1)O(1) |
120,6(3) |
|
C(11)–C(16) |
1,394(3) |
O(2)N(1)O(3) |
118,6(3) |
|
Преобразования симметрии: a1–x, 2–y, 1–z |
|||
Полные таблицы координат атомов, длин связей и валентных углов соединения 1 и 2 депонированы в Кембриджском банке структурных данных (№ 2155176 и 2335887; ; .
Обсуждение результатов
Известно, что реакции обмена галогенид-аниона в галогенидах органилтрифенилфосфония используются для получения различных комплексов [6, 22, 23]. Интересный случай замещения галогенид-аниона на остаток более сильной кислоты описан авторами работы [24], в которой описываются реакции галогенидов органилтрифенилфосфония с аренсульфоновыми кислотами в воде, приводящие к образованию аренсульфонатов органилтрифенилфосфония. Единственный пример замещения атома хлора на нитрогруппу приведен в работе [18], где действие азотной кислоты на хлориды цианометил- и ацетонилтрифенилфосфония приводит к образованию с хорошим выходом соответствующих нитратов.
В продолжение исследований в области реакций замещения хлор-аниона в производных фосфора [Ph3PR]Cl нами получены и структурно охарактеризованы нитраты ацетонилтрифенилфосфония [Ph 3 PCH 2 C(O)Me]NO 3 ( 1 ), о синтезе которого сообщалось ранее [18], и неизвестный ранее гидрат нитрата 2-бутен-1,4- бис (трифенилфосфония) [Ph 3 P(CH 2 CHCHCH 2 PPh 3 ][NO 3 ] 2 ∙ 2H 2 O ( 2 ):
[Ph 3 PCH 2 C(O)Me]Cl + HNO 3 ⎯⎯⎯ [Ph 3 PCH 2 C(O)Me]NO 3
–HCl
[Ph 3 PCH 2 CHCHCH 2 PPh 3 ]Cl 2 + 2HNO 3 + 2H 2 O ⎯⎯⎯⎯ [Ph 3 PCH 2 CHCHCH 2 PPh 3 ][NO 3 ] 2 ∙ 2H 2 O –2HCl
Структура соединений 1 и 2 подтверждается данными ИК-спектров, которые содержат характерные для органилтрифенилфосфониевых солей полосы поглощения колебаний связей P–CPh в областях 1450-1435 см–1 и 1005–995 см–1: 1437, 995 см–1 ( 1 ) и 1437, 997 см–1 ( 2 ). ИК-спектр комплекса 1 содержит интенсивную полосу поглощения валентных колебаний карбонильной группы при 1728 см–1. Кроме того, в ИК-спектрах соединений 1 и 2 присутствуют полосы поглощения при 1323, 1377 см–1 ( 1 ) и 1335, 1369 см–1 ( 2 ), относящиеся к асимметричным валентным колебаниям N–O связи в анионах NO 3 –. Также наблюдается слабые полосы поглощения при 827 см–1 ( 1 ) и 830 см–1 ( 2 ), характерные для деформационных колебаний О–N–O нитратных анионов. ИК-спектры обоих комплексов содержат полосы поглощения при 3082, 2997 ( 1 ), 3059, 2932 см–1 ( 2 ), и 2907, 2839 ( 1 ), 2932, 2882 см–1 ( 2 ), относящиеся к валентным колебаниям связей C–H Ar и C–H Alk соответственно [25, 26]. Присутствие в ИК-спектре 2 интенсивной полосы при 3462 см–1 указывает на присутствие в кристалле сольватных молекул воды.
По данным РСА, комплексы 1 и 2 состоят из нитрат-анионов и органилтрифенилфосфоние-вых катионов с несколько искаженной тетраэдрической координацией атома фосфора (углы CPC варьируются в пределах 107,10(8) - 111,56(10) ° для 1 и 107,62(10) - 111,99(16) ° для 2 ; расстояния P–C составляют 1,791(2)–1,803(2) Å и 1,786(4)–1,803(4) Å соответственно и не превышают суммы ковалентных радиусов атомов фосфора и sp 3-гибридизованного углерода (1,88 Å [27]). В плоских тригональных нитрат-анионах суммы углов ONO равны 359,6 ° и 360 ° соответственно.
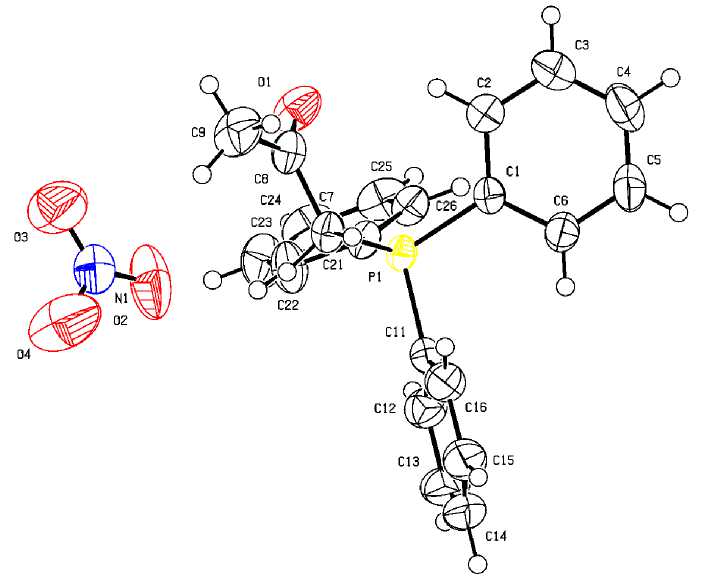
Рис. 1. Строение нитрата ацетонилтрифенилфосфония (1)
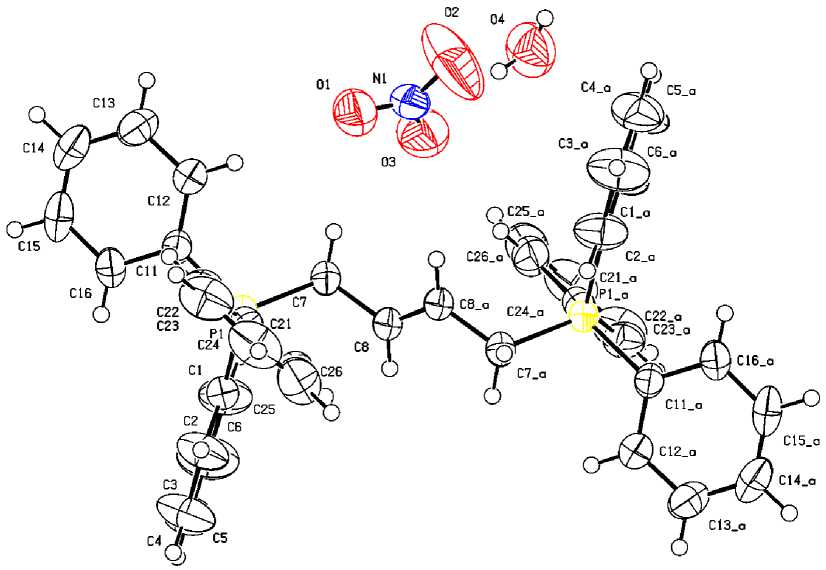
Рис. 2. Строение гидрата нитрата 2-бутен-1,4- бис (трифенилфосфония) (2)
Кристалл 2 содержит, кроме центросимметричных катионов с центром симметрии на середине связи C(8)–C(8a) и нитрат-анионов, еще и молекулы воды. Кристаллическая организация нитратов 1 и 2 в основном обусловлена водородными связями C–H∙∙∙O–NO2, длины которых варьируются в интервале 2,30–2,59 Å для 1 и 2,42–2,59 Å для 2, что не превышает суммы ван- дер-ваальсовых радиусов атомов водорода и кислорода (H∙∙∙O 2,62 Å [28]). Кристалл 2 имеет более сложную организацию из-за участия молекул воды, которые тесно контактируют с атомами кислорода нитратных групп O–H∙∙∙O–NO2 (2,1 Å).
Выводы
Таким образом, нами синтезированы и структурно охарактеризованы нитрат ацетонилтрифенилфосфония ( 1 ) и гидрат нитрата 2-бутен-1,4- бис (трифенилфосфония) ( 2 ), атомы фосфора в которых имеют слабо искаженную тетраэдрическую координацию, а нитрат-анионы - плоскую тригональную. Кристалл 2 имеет более сложную организацию из-за участия молекул воды в образовании водородных связей O–H∙∙∙O–NO 2 (2,1 Å).
Список литературы Реакции хлоридов ацетонилтрифенилфосфония и 2-бутен-1,4-бис(трифенилфосфония) с азотной кислотой
- Richardson R.J., Makhaeva G.F. // Encyclopedia of Toxicology: 3rd Ed. San Diego: Academic Press Inc., 2014. P. 714. DOI: 10.1016/B978-0-12-386454-3.00173-1
- Phosphorus Compounds: Advanced Tools in Catalysis and Material Sciences, ed. by M. Peruzzi-ni, L. Gonsalvi / New York: Springer, 2011. 470 p. DOI: 10.1007/978-90-481-3817-3.
- Razuvaev G.A., Osanova N.A., Brilkina T.G. et al. // J. Organomet. Chem. 1975. V. 99, No. 1. P. 93. DOI: 10.1016/S0022-328X(00)86365-2
- The Chemistry of Organophosphorus Compounds. Volume 3: Phosphonium Salts, Ylides and Phosphoranes, ed. by F.R. Hartley. New York: John Wiley & Sons, 1994. 442 p. DOI: 10.1002/047003436X
- Зыкова А.Р. // Вестник ЮУрГУ. Серия «Химия». 2020. Т. 12, № 4. С. 5. DOI: 10.14529/chem200401
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Журн. общ. химии. 2018. Т. 88, № 7. С. 1165. DOI: 10.1134/S0044460X1807017X.
- Szell P.M.J., Gabidullin B., Bryce D.L. // Acta Crystallogr. B: Struct. Sci. Cryst. Eng. Mater. 2017. V. 73, No. 2. P. 153. DOI: 10.1107/S2052520617000944.
- DiopM.B., Diop L., Oliver A.G. // Acta Crystallogr. E: Crystallogr. Commun. 2018. V. 74, No. 1. P. 69. DOI: 10.1107/S205698901701800X.
- Macarie L., Simulescu V., Ilia G. // ChemistrySelect. 2019. V. 4, No. 32. P. 9285. DOI: 10.1002/slct.201901712.
- Liu S., Kumatabara Y., Shirakawa S. // Green Chem. 2016. V. 18, No. 2. P. 331. DOI: 10.1039/C5GC02692J.
- Weil E.D., Levchik S.V. // J. Fire Sci. 2008. V. 26, No. 3. P. 243. DOI: 10.1177/0734904108089485.
- Ling I., Skelton B.W., Sobolev A.N. et al. // New J. Chem. 2020. V. 44, No. 25. P. 10220. DOI: 10.1039/D0NJ01975E.
- Ling I., Sobolev A.N., Skelton B.W., Raston C.L. // Cryst. Eng. Comm. 2020. V. 22, No. 44. P. 7704. DOI: 10.1039/D0CE01274B.
- Diop T., Diop L., KuceräkoväM., DusekM. // Acta Crystallogr. E: Crystallogr. Commun. 2013. V. 69, No. 2. P. o303. DOI: 10.1107/S1600536813002110.
- Neumüller B., Dehnicke K. // Z. Anorg. Allg. Chem. 2008. V. 634, No. 14. P. 2567. DOI: 10.1002/zaac.200800357.
- Mariyatra M.B., Panchanatheswaran K., Goeta A.E. // Acta Crystallogr. E: Crystallogr. Commun. 2002. V. 58, No. 8. P. o807. DOI: 10.1107/S1600536802011431
- Li S.-L., Mark T.C.W. // J. Mol. Struct. 1996. V. 384, No. 2-3. P. 135. DOI: 10.1016/S0022-2860(96)09348-9.
- Шевченко Д.П., Шарутин В.В. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 3. С. 62. DOI: 10.14529/chem220307
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726.
- Попкова М.А., Шарутин В.В. // Вестник ЮУрГУ. Серия «Химия». 2021. Т. 13, № 4. С. 110. DOI: 10.14529/chem210409.
- Шарутин В.В., Шарутина О.К., Ефремов А.Н. и др. // Коорд. химия. 2020. Т. 46, № 9. C. 554. DOI: 10.31857/S0132344X20090030.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 2. С. 41. DOI: 10.14529/chem220205.
- Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. Таблицы спектральных данных: пер. с англ. Б.Н. Тарасевича. М.: Мир, 2006. 440 с.
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Cordero B., Gómez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. No. 21. P. 2832. DOI: 10.1039/B801115J
- Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113, No. 19. P. 5806. DOI: 10.1021/jp8111556


