Реакции пентафенилсурьмы и пента-пара-толилсурьмы с каликсареном [4-t-BuC6H2OH(S-2)]4
Автор: Ефремов Андрей Николаевич, Шарутин Владимир Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.13, 2021 года.
Бесплатный доступ
Пентафенилсурьма и пента-пара-толилсурьма реагируют с каликсареном [4- t -BuC6H2OH(S-2)]4 (СArH) с отщеплением арена и образованием ионных продуктов [Ph4Sb]+[СAr]- × TolH (1), [ p -Tol4Sb]+[CAr]- × H2O (2) с выходом до 96 %. Соединения идентифицированы методом ИК-спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, соединения 1 и 2 представляют собой ионные комплексы с сольватными молекулами толуола (1) и воды (2). Катион имеет тетраэдрическую координацию атома сурьмы с арильными лигандами в вершинах полиэдра, анион представлен депротонированной формой п - трет -бутилтиакаликс[4]арена. Три трет -бутильные группы, фенильное кольцо и сольватированный толуол в структуре соединения 1 и два трет -бутильных фрагмента в структуре соединения 2 разупорядочены по двум позициям. Тетраэдрическая координация атомов сурьмы в катионах соединений 1 и 2 искажена в незначительной степени. Углы CSbC отклоняются от теоретического значения и варьируются в пределах 106,0(4)-117,7(4)° (1), 105,75(15)-112,84(15)° (2). Среднее значение длин связей Sb-C составляет 2,101(3) и 2,106(4) Å в структурах 1 и 2 соответственно. Анион [СAr]- находится в конформации конуса, верхний обод которого представлен трет- бутильными группами в пара -положении, а нижний - гидрокси-группами, одна из которых депротонирована. Длина одной связи СAr-O- (1,318(4) (1) и 1,326(4) (2) Å) меньше среднего значения длин связей СAr-OН (1,338(4) (1) и 1,343(4) (2) Å), что свидетельствует о повышении ее кратности и локализации отрицательного заряда именно на этом атоме кислорода. При этом протоны образуют внутримолекулярные водородные связи с соседним атомом кислорода. Расстояния H∙∙∙O составляют 2,16; 1,69; 1,77 Å в 1 и 1,92, 1,79 1,76 Å в 2. Двугранные углы между противоположными феноксидными кольцами составляют 60,64 и 87,07° (1) и 83,85 и 80,42° (2), что указывает на менее симметричный анион в структуре 1, чем в 2. Формирование пространственной структуры кристаллов обусловлено образованием водородных связей между ионами с участием атомов кислорода и серы, а также СН∙∙∙π-взаимодействий, при этом ионы в кристалле соединения 1 образуют цепочки, а в кристалле соединения 2 - слои. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1991199 (1); № 2013220 (2); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Пентафенилсурьма, пента-пара-толилсурьма, каликсарен, реакция замещения, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147234246
IDR: 147234246 | УДК: 549.242+547.53.024+548.312.2+548.312.5 | DOI: 10.14529/chem210105
Текст научной статьи Реакции пентафенилсурьмы и пента-пара-толилсурьмы с каликсареном [4-t-BuC6H2OH(S-2)]4
Пентафенилсурьма и пента-пара-толилсурьма реагируют с каликсареном [4-t-BuC6H2OH(S-2)]4 (СArH) с отщеплением арена и образованием ионных продуктов [Ph4Sb]+[СAr]- ⋅ TolH (1), [p-Tol4Sb]+[CAr]- ⋅ H2O (2) с выходом до 96 %. Соединения идентифицированы методом ИК-спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, соединения 1 и 2 представляют собой ионные комплексы с сольватными молекулами толуола (1) и воды (2). Катион имеет тетраэдрическую координацию атома сурьмы с арильными лигандами в вершинах полиэдра, анион представлен депротониро-ванной формой п-трет-бутилтиакаликс[4]арена. Три трет-бутильные группы, фенильное кольцо и сольватированный толуол в структуре соединения 1 и два трет-бутильных фрагмента в структуре соединения 2 разупорядочены по двум позициям. Тетраэдрическая координация атомов сурьмы в катионах соединений 1 и 2 искажена в незначительной степени. Углы CSbC отклоняются от теоретического значения и варьируются в пределах 106,0(4)-117,7(4)° (1), 105,75(15)-112,84(15)° (2). Среднее значение длин связей Sb–C составляет 2,101(3) и 2,106(4) Å в структурах 1 и 2 соответственно. Анион [СAr]- находится в конформации конуса, верхний обод которого представлен трет-бутильными группами в пара-положении, а нижний – гидрокси-группами, одна из которых депротонирована. Длина одной связи СAr–O- (1,318(4) (1) и 1,326(4) (2) Å) меньше среднего значения длин связей СAr–OН (1,338(4) (1) и 1,343(4) (2) Å), что свидетельствует о повышении ее кратности и локализации отрицательного заряда именно на этом атоме кислорода. При этом протоны образуют внутримолекулярные водородные связи с соседним атомом кислорода. Расстояния H∙∙∙O составляют 2,16; 1,69; 1,77 Å в 1 и 1,92, 1,79 1,76 Å в 2. Двугранные углы между противоположными феноксидными кольцами составляют 60,64 и 87,07° (1) и 83,85 и 80,42° (2), что указывает на менее симметричный анион в структуре 1, чем в 2. Формирование пространственной структуры кристаллов обусловлено образованием водородных связей между ионами с участием атомов кислорода и серы, а также СН∙∙∙π– взаимодействий, при этом ионы в кристалле соединения 1 образуют цепочки, а в кристалле соединения 2 – слои. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1991199 (1); № 2013220 (2); или .
Сурьмаорганические производные общей формулы Ar 4 SbX (где X – лиганд, связанный с атомом сурьмы через гетероатом) достаточно хорошо изучены методом рентгеноструктурного анализа [1–20]. К таким соединениям относится широкий ряд структурно охарактеризованных ароксидов тетраарилсурьмы [1, 2, 21–26]. Синтез таких производных осуществляют по реакциям деарилирования пентаарилсурьмы фенолом [21–23] или перераспределения лигандов между пен-таарилсурьмой и производным симметричного строения Ar3SbX2 [24–26].
В настоящей работе впервые по реакциям замещения из каликсарена [4- t -BuC 6 H 2 OH(S-2)] 4 (СArH) и пентаарилсурьмы синтезированы сурьмаорганические производные каликсарена [Ph 4 Sb]+ [СAr] - ⋅ TolH ( 1 ), [ p -Tol 4 Sb]+[CAr] - ⋅ H 2 O ( 2 ) и определены их структурные особенности методом рентгеноструктурного анализа.
Экспериментальная часть
Исходные реагенты - пентафенилсурьму и пента- пара -толилсурьму получали по методикам, описанным в монографии [27]. В работе использовали каликсарен производства фирмы Alfa Aesar.
Синтез [Ph4Sb]+[СAr]- ⋅ TolH (1).
Смесь 200 мг (0,394 ммоль) пентафенилсурьмы и 259 мг (0,394 ммоль) каликсарена [4- t -BuC 6 H 2 OH(S-2)] 4 в 3 мл толуола нагревали в запаянной ампуле на водяной бане при 80 °С в течение 3 часов. После медленного охлаждения вскрывали ампулу и оставляли до полного удаления растворителя. Получили 411 мг (96 %) бесцветных кристаллов соединения 1 с т. пл. 254 °С.
ИК-спектр, ν , см - 1: 3369, 3082, 3053, 3032, 2960, 2904, 2866, 1572, 1479, 1460, 1436, 1392, 1361, 1307, 1255, 1201, 1188, 1163, 1087, 1068, 1045, 1020, 995, 885, 831, 763, 752, 729, 688, 601, 547, 516, 455, 443, 416.
Найдено, %: С 68,64; Н 6,09. C 71 H 75 O 4 S 4 Sb. Вычислено, %: С 68,60; Н 6,04.
Синтез [ p -Tol 4 Sb]+[CAr] - ⋅ H 2 O ( 2 ) осуществляли по аналогичной методике. Выход 89 %, т. разл. 280 °С. Пригодные для рентгеноструктурного анализа кристаллы получены после перекристаллизации вещества из толуола, содержащего воду.
ИК-спектр, ν , см - 1: 3242, 3034, 2960, 2866, 1788, 1641, 1591, 1477, 1462, 1394, 1359, 1300, 1274, 1253, 1211, 1188, 1120, 1087, 1068, 1037, 1012, 887, 829, 802, 794, 763, 752, 721, 677, 638, 597, 584, 547, 518, 480, 416.
Найдено, %: С 66,71; Н 6,34. C 68 H 77 O 5 S 4 Sb. Вычислено, %: С 66,71; Н 6,35.
ИК-спектры соединений 1 и 2 записывали на ИК-спектрометре Shimadzu IR Affinity-1S в таблетках KBr в области 4000–400 см–1.
Рентгеноструктурный анализ (РСА) кристаллов соединений 1 и 2 проведен на дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [28]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [29], OLEX2 [30]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структур приведены в таблице. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1991199 для 1 и № 2013220 для 2; или .
Кристаллографические данные, параметры эксперимента и уточнения структур 1 и 2
|
Параметр |
1 |
2 |
|
М |
1242,30 |
1224,28 |
|
Сингония |
Моноклинная |
Моноклинная |
|
Пр. группа |
P2 1 /n |
P2 1 /n |
|
a , Å |
13,317(7) |
20,425(15) |
|
b , Å |
23,456(16) |
12,964(13) |
|
c , Å |
20,968(11) |
24,866(19) |
|
α, град. |
90 |
90 |
|
β, град. |
95,964(15) |
105,43(2) |
|
γ, град. |
90 |
90 |
|
V , Å3 |
6514(6) |
6347(9) |
|
Z |
4 |
4 |
|
ρ (выч.), г/см3 |
1,267 |
1,281 |
|
–1 µ, мм |
0,598 |
0,614 |
|
F (000) |
2592,0 |
2560,0 |
|
Размер кристалла, мм |
0,43 × 0,23 × 0,2 |
0,27 × 0,18 × 0,14 |
|
Область сбора данных по 2θ, град. |
6,05–49,496 |
5,574–57 |
|
Интервалы индексов отражений |
–15 ≤ h ≤ 15, –27 ≤ k ≤ 27, –24 ≤ l ≤ 24 |
–27 ≤ h ≤ 26, –17 ≤ k ≤ 17, –33 ≤ l ≤ 33 |
|
Измерено отражений |
98588 |
261219 |
|
Независимых отражений |
11108 ( R int = 0,0419) |
16082 ( R int = 0,0851) |
Окончание табл. 1
|
Параметр |
1 |
2 |
|
Переменных уточнения |
818 |
751 |
|
GOOF |
1,046 |
1,048 |
|
R -факторы по F2>2σ(F2) |
R 1 = 0,0391, wR 2 = 0,0992 |
R 1 = 0,0559, wR 2 = 0,1286 |
|
R -факторы по всем отражениям |
R 1 = 0,0524, wR 2 = 0,1095 |
R 1 = 0,0910, wR 2 = 0,1471 |
|
Остаточная электронная плотность (max/min), e/Å3 |
0,62/–0,55 |
1,41/–1,38 |
Обсуждение результатов
Известно, что наиболее эффективными методами синтеза ароксидов тетраарилсурьмы являются методы, в основе которых лежит реакция замещения. Из пентаарилсурьмы и фенолов получено достаточно большое количество указанных соединений [1, 2, 21–26]. Данный метод синтеза одностадийный и характеризуется мягкими условиями протекания реакций, высоким выходом и чистотой целевого продукта, однако реакции пентаарилсурьмы с каликсаренами ранее не изучались.
Мы нашли, что взаимодействие эквимолярных количеств каликсарена [4- t -BuC 6 H 2 OH(S-2)] 4 (СArH) с пентафенилсурьмой и пента- пара -толилсурьмой в толуоле приводит к образованию сурь-маорганических производных каликсарена [Ph 4 Sb]+ [СAr] - ⋅ TolH ( 1 ), [ p -Tol 4 Sb]+[CAr] - ⋅ H 2 O ( 2 ). Для завершения реакций требовалось нагревание реакционной смеси в течение 3 ч. При медленном охлаждении раствора исходных реагентов в толуоле наблюдалось образование кристаллов, пригодных для РСА:
Ar
Sb Ar
Ar Ar
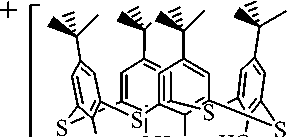
O OH OH HO
[4- t- BuC 6 H 2 OH(S-2)]4 + Ar 5 Sb TolH
ArH
Ar=Ph( 1 ), p -Tol( 2 )
Соединения 1 и 2 представляют собой бесцветные кристаллы, хорошо растворимые в ароматических углеводородах и полярных растворителях. Строение ионных комплексов 1 и 2 подтверждено методами ИК-спектроскопии и рентгеноструктурного анализа.
В ИК-спектрах соединений 1 и 2 наблюдается интенсивная полоса поглощения валентных колебаний связей Sb–C при 455 и 480 см–1 соответственно. Строение аниона можно охарактеризовать рядом полос поглощения высокой интенсивности: полосы при 1255 ( 1 ) и 1253 ( 2 ) см–1 описывают валентные колебания связи С–О, при 547 см–1 (в 1 и 2 ) – ν(С–S), уширенная полоса при 3369 ( 1 ) и 3242 ( 2 ) см–1 – ν(О–Н), при 1392 ( 1 ) и 1394 ( 2 ) см–1 – δ as (С t -Bu –H), при 1361 ( 1 ) и 1359 ( 2 ) см–1 – δ s (С t -Bu –H). Полосы поглощения средней интенсивности при 2960 ( 1 , 2 ) и 2866 ( 1 , 2 ) см–1 можно отнести к валентным асимметричным и симметричным колебаниям связей С–H метильных групп соответственно. ИК-спектры соединений также содержат характерные полосы валентных колебаний углеродного скелета ароматических фрагментов: 1572, 1479, 1436 ( 1 ) и 1591, 1477, 1462 ( 2 ) см–1. Валентным колебаниям связей C Ar –H отвечает полоса поглощения средней интенсивности при 3053 и 3034 см–1 в спектрах соединений 1 и 2 соответственно, а вне-плоскостным деформационным колебаниям этих же связей – полосы при 885, 831, 729, 688 ( 1 ) и 887, 829, 794, 752 см–1 [31, 32].
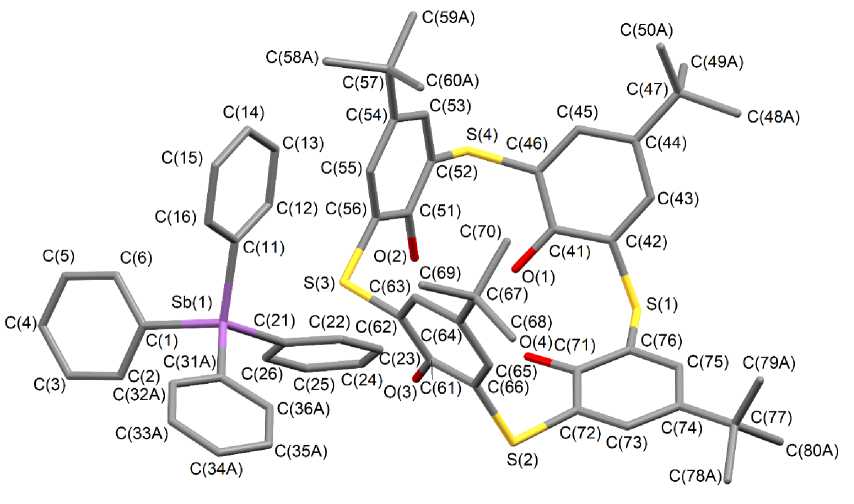
По данным РСА, соединения 1 и 2 представляют собой ионные комплексы с сольватными молекулами толуола (1) и воды (2). Катион имеет тетраэдрическую координацию атома сурьмы с арильными лигандами в вершинах полиэдра, анион представлен депротонированной формой п-трет-бутилтиакаликс[4]арена (рис. 1, 2). Три трет-бутильные группы, фенильное кольцо и сольватированный толуол в структуре соединения 1 разупорядочены по двум положениям. Уточненные соотношения вкладов положений в разупорядоченный фрагмент составляет 0,51/0,49, 0,54/0,46, 0,53/0,47 для t-Bu-групп, 0,64/0,36 для Ph лиганда и 0,56/0,44 для толуола. В структуре соединения 2 разупорядочены по двум положениям два трет-бутильных фрагмента с заселенностью атомов углерода 0,42/0,58.
0(47)
0(45)
0(44)
С(46)
С(52)
С(12) 0(56)
0(11)
С(69)
Sb(1)
0(4),
0(64)
0(72)
С(35А)
С(78А)|
С(60А) 0(53)
0(2)1
0(63)
0(21) 0(22) С(6^
0(51)
0(70)
/ С(31А)
-*0(2)__.
С(32А)
0(74)
0(73)
Z^0(41) 7 *о(1) 0(67) \ 0(68) -0(4)0(71)
> С(65^> -^-0(66)
^26) С(25) С(24)О(3^ > С(36А)
0(5)
С(59А)
0(14)
С(48А)
0(15)
0(43)
0(16)
0(42)
0(6)
С(79А)
0(77)
^*С(80А)
5(1)
0(76)
\ 0(75)
С(58А)_____
0(57)1
1 0(547
VC(13) 0(55) U
С(50А)
\/,С(49А)
С(ЗЗА)Х.
С(34А)
Рис. 1. Строение соединения 1
(атомы водорода, сольватная молекула толуола и разупорядоченные атомы не указаны)
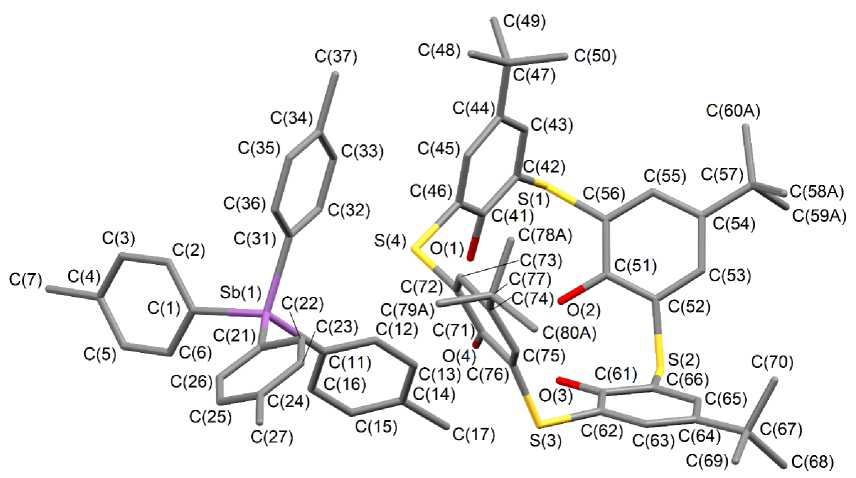
Рис. 2. Строение соединения 2
(атомы водорода, сольватная молекула воды и разупорядоченные атомы не указаны)
Те тр а э д ри че ск а я к о орд и нация атомов сурьмы в катионах соединений 1 и 2 искажена в незн а чи те л ьн ой с те п е н и . Углы CSbC отклоняются от теоретического значен и я и в а рьи ру ю тс я в пределах 106,0(4)-117,7(4)° ( 1 ), 105,75(15)-112,84(15)° ( 2 ). Среднее значение длин связей Sb–C составляет 2,101(3) и 2,106(4) Å в структурах 1 и 2 соответственно.
Однозарядный анион, представляющий собой апротонную форму [4-t-BuC6H2OH(S-2)]4, находится в конформации конуса, верхний обод которого представлен трет-бутильными группами в пара-положении, а нижний – гидрокси-группами, одна из которых депротонирована. Длина связи СAr–O- (1,318(4) (1) и 1,326(4) (2) Å) меньше среднего значения длин связей СAr–OН (1,338(4) (1) и 1,343(4) (2) Å), что свидетельствует о повышении ее кратности и локализации от- рицательного заряда именно на этом атоме кислорода. При этом протоны ОН-групп образуют внутримолекулярные водородные связи с соседним атомом кислорода. Расстояния H∙∙∙O составляют 2,16, 1,69, 1,77 Å в 1 и 1,92, 1,79 1,76 Å в 2. Значения длин связей C–S примерно равны и варьируют в пределах 1,783(3)–1,791(3) (1) Å и 1,780(3)–1,796(4) (2) Å. Двугранные углы между противоположными феноксидными кольцами составляют 60,64 и 87,07° (1) и 83,85 и 80,42° (2), что указывает на менее симметричный анион в структуре 1, чем в 2. Приведенные выше характеристики строения аниона практически не отличаются от аналогичных для ранее структурно охарактеризованных молекул каликс[4]аренов [33–37].
Ин те рес п ре д с т а в ляе т с рав н ить между собой упаковку ионов в кристалла х сое д и н е н и й 1 и 2 . Катион в структуре соединения 1 взаимодействует с верхним ободом аниона посредством СН∙∙∙π– взаимодействий, с нижним – п осре дс тв ом водородн ой связи C Ar –H∙∙∙OH (2,38 Å) (рис. 3). Данные взаимодействия струк турир уют ион ы в цеп очк и ти па Cat+An–Cat+An–, расположенные вдоль кристаллографической оси a . При э том пространственная ориентация аниона в це п очк е н е и зме н яе т ся. Отм ет и м, что верхн ий об од аниона экранирован катионом так, что одно и з е го ф е н и льн ых к о л е ц п ра к ти че ск и п о лн ос тью располагается в объеме конуса а н и он а п - трет -бутилтиакаликс[4]арена . С оль ватная м ол ек ул а тол уол а у ча с ти я в упаковке не принимает.
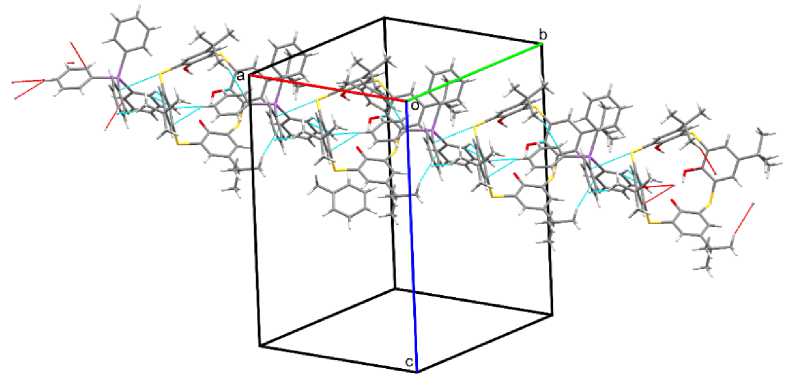
Рис. 3. Упаковка ионов в кристалле соединения 1 (показана только одна цепочка)
Органи за ц и я и он ов в к рис та лл е с оед и н е н и я 2 устроена более сложно. Один анион посредством СН∙∙∙π–в за и мод е й стви й и в од ородны х с в яз ей S∙∙∙H (2,97 Å) контактирует еще с тремя сосед н и ми а н и он а ми , п ри э том обра зу ются цепочки из анионов. Также анион взаим од е й с тв ует с двумя катионами: с одним – с о бр аз о ванием во до р о дны х связ ей S∙∙∙H (2,98, 2,83 Å) и О∙∙∙H (2,69, 2,72 Å), с другим – че ре з мол е к у лу с ол ьвати рованн ой воды (рис. 4).
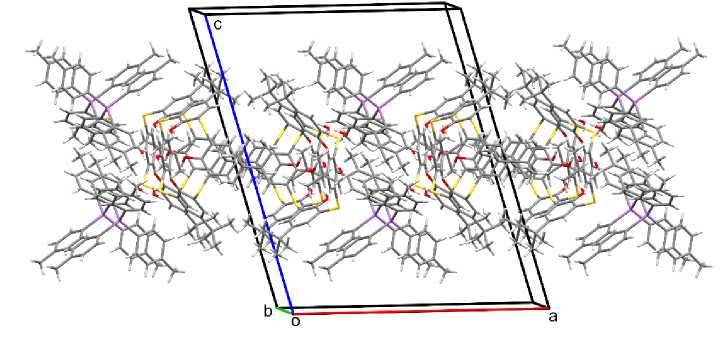
Рис. 4. Упаковка ионов в кристалле соединения 2 (показан только один слой)
Ан и он ы ори енти ров а ны в пространстве таким образом, что их нижни й о б од э кра н и ров ан только катионами, а верхний – трет -бутильной группой соседнего аниона (рис. 5).
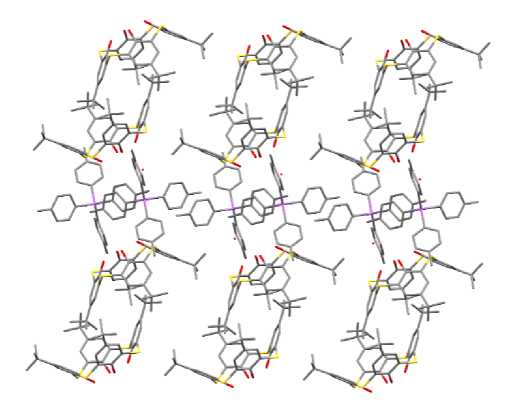
Рис. 5. Ориентация ионов в кристалле соединения 2
Выводы
Так и м обра зом , по ре ак ц ии з ам еще н и я и з пентаарилсурьмы и каликсарена [4- t -BuC 6 H 2 OH(S-2)] 4 (СArH) получены с высоким выходом ионные проду к ты [ Ph 4 Sb]+[СAr] - ⋅ TolH ( 1 ), [ p -Tol 4 Sb]+[CA] - ⋅ H 2 O ( 2 ). Координационные полиэдры атомов сурьмы представляют соб ой те тр а э д ры, в в е р ши н а х которых располагаются арильные лиганды . Формирование простра н с тв е н н ой с тру к т у ры к ри сталлов обусловлено образованием водородных с в язе й межд у и он ам и с у ча с ти е м а томов к и с лорода и серы, а также СН∙∙∙π–взаимодействий, при этом ионы в кристалле соединения 1 о бра зу ю т ц е п очк и , а в к ри с т а л ле с оед и н е н и я 2 – слои.
Финансирование работы
Раб от а выпол н е на при финансовой поддержке РФФИ в рамках н ау чн ого про ект а № 20-31-70001.
Список литературы Реакции пентафенилсурьмы и пента-пара-толилсурьмы с каликсареном [4-t-BuC6H2OH(S-2)]4
- Cambridge Crystallografic Datebase. Release 2020. Cambridge.
- Шарутин, В.В. Синтез, реакции и строение арильных соединений пятивалентной сурьмы / B.В. Шарутин, А.И. Поддельский, О.К. Шарутина // Журн. коорд. химии. - 2020. - Т. 46, № 10. - C. 579-648. DOI: 10.31857/S0132344X20100011.
- Синтез и строение цианамида тетрафенилсурьмы / И.В. Егорова, В.В. Жидков, И.П. Гри-нишак, А.А. Раханский // Журн. общей химии. - 2014. - Т. 84, № 7. - С. 1176-1178.
- Establishing the Coordination Chemistry of Antimony(V) Cations: Systematic Assessment of Ph4Sb(OTf) and Ph3Sb(OTf)2 as Lewis Acceptors / A.P.M. Robertson, S.S. Chitnis, H.A. Jenkins et al. // Chem. Eur. J. - 2015. - V. 21, № 21. - P. 7902-7913. DOI: 10.1002/chem.201406469.
- Pan, B. [Sb(C6F5)4][B(C6F5)4]: An Air Stable, Lewis Acidic Stibonium Salt That Activates Strong Element-Fluorine Bonds / B. Pan, F.P. Gabbai // J. Am. Chem. Soc. - 2014. - V. 136, № 27. - P. 95649567. DOI: 10.1021/ja505214m.
- Ortho-metallation of a Phenyl Ring with Antimony(V) / N. Dinsdale, J.C. Jeffrey, R.J. Kilby et al. // Inorg. Chim. Acta. - 2007. - V. 360, № 1. - P. 418-420. DOI: 10.1016/j.ica.2006.07.091.
- Influence of the Catalyst Structure in the Cycloaddition of Isocyanates to Oxiranes Promoted by Tetraarylstibonium Cations / M. Yang, N. Pati, G. Belanger-Chabot et al. // Dalton Trans. - 2018. -V. 47. - P. 11843-11850. DOI: 10.1039/C8DT00702K.
- Синтез, структурное и MAS ЯМР (13С, 15N) спектральное исследование комплексов тетрафенилсурьмы с ^^диалкилдитиокарбаматными лигандами: проявление канформационной изомерии / А.В. Иванов, А.П. Пакусина, М.А. Иванов и др. // Докл. акад. наук СССР. - 2005. -Т. 401, № 5. - С. 643-647.
- Structure and Dynamic Behavior of Neutral Hexacoordinate Antimony Compounds with Intramolecular Coordination / H. Yamamichi, S. Matsukawa, S. Kojima et al. // Heteroat. Chem. - 2011. -V. 22, № 3-4. - P. 553-561. DOI: 10.1002/hc.20721.
- Wang G.-C., Lu Y.-N., Xiao J., Yu L., Song H.-B., Li J.-S., Cui J.-R., Wang R.-Q., Ran F.-X. Synthesis, Crystal Structures and in vitro Antitumor Activities of Some Organoantimony Arylhydroxamates. J. Organomet. Chem,, 2005, vol. 690, no. 1, pp. 151-156. DOI: 10.1016/j.jorganchem.2004.09.002.
- Synthesis, Crystal Structures and in vitro Antitumor Activities of Some Arylantimony Derivatives of Analogues of Demethylcantharimide / G.-C. Wang, J. Xiao, L. Yu. et al. // J. Organomet. Chem. - 2004. - V. 689, № 9. - P. 1631-1638. DOI: 10.1016/j.jorganchem.2004.02.015
- Domasevitch, K.V. Organoantimony(V) Cyanoximates: Synthesis, Spectra and Crystal Structures / K.V. Domasevitch, N.N. Gerasimchuk, A. Mokhir // Inorg. Chem. - 2000. - V. 39, № 6. -P. 1227-1237. DOI: 10.1021/ic9906048.
- Syntheses, Characterizations and Crystal Structures of New Organoantimony(V) Complexes with Heterocyclic (S, N) Ligand / C. Ma, Q. Zhang, J. Sun et al. // J. Organomet. Chem. - 2006. -V. 691, № 11. - P. 2567-2574. DOI: 10.1016/j.jorganchem.2006.01.049.
- Synthesis, Characterization and Structure of Some Arylantimony Ferrocenylacrylates / J.-S. Li, R.-C. Liu, X.-B. Chi et al. // Inorg. Chim. Acta - 2004. - V. 357. - P. 2176-2180. DOI: 10.1016/j.ica.2003.12.012.
- Фторсодержащие карбоксилаты тетраарилсурьмы. Синтез и строение / В.В. Шарутин, О К. Шарутина, А.Н. Ефремов и др. // Журн. неорг. химии. - 2020. - Т. 65, № 4. - С. 482-486. DOI: 10.31857/S0044457X20040170.
- Особенности взаимодействия пентафенилсурьмы с бифункциональными кислотами. строение глутарата бис(тетрафенилсурьмы), сольвата 1,4-циклогександикарбоксилата бис(тетрафенилсурьмы) с бензолом, сольвата 3-гидроксибензоата тетрафенилсурьмы с диокса-ном и аддукта 3-гидроксибензоата тетрафенилсурьмы с 3-тетрафенилстибоксибензоатом тетрафенилсурьмы и толуолом / В.В. Шарутин, О.К. Шарутина, Ю.О. Губанова и др. // Журн. неорг. химии. - 2019. - Т. 64, № 9. - С. 957-964. DOI: 10.1134/S0044457X19090198.
- Шарутин, В.В. Синтез и строение сольвата 1,2-дифенилэтандиондиоксимата бис(тетрафенилсурьмы) с толуолом Ph4SbONC(Ph)С(Ph)ONSbPh4 • 2PhCH3 и 1,2-дифенил(2-окси)этаноноксимата тетрафенилсурьмы Ph4SbONC(Ph)CH(Ph)OH / В.В. Шарутин, О.В. Молокова, О.К. Шарутина // Журн. неорг. химии. - 2013. - Т. 58, № 4. - С. 460-467. DOI: 10.7868/S0044457X13040181.
- Шарутин, В.В. Синтез и строение пропиолатов три- и тетрафнилсурьмы / В.В. Шарутин, О.К. Шарутина, В С. Сенчурин // Коорд. химия. - 2014. - Т. 40, № 2. - С. 108-112. DOI: 10.7868/S0132344X14020108.
- Dihydroxybenzoic Acids as Polydentate Ligands in Phenylantimony (V) Complexes / V.V. Sharutin, O.K. Sharutina, Y.O. Gubanova et al. // Inorg. Chim. Acta. - 2019. - V. 494. - P. 211215. DOI: 10.1016/j.ica.2019.05.029
- Термохимические свойства Ph4Sb(OC(O)Ci0H15) и Ph3Sb(OC(O)Ci0H15)2 / Д.В. Лякаев, А.В. Маркина, Е В. Хабарова и др. // Журн. физ. химии. - 2018. - Т. 92, № 9. - С. 1384-1389. DOI 10.1134/S0044453718090170.
- Шарутин, В.В. Синтез и строение ароксидов тетрафенисурьмы Ph4SbOAr (Ar = QH4QH7, C6H2(Br2-2,6)(mpem-Bu-4), C6H3(NO2)2-2,4, C6H2(Br2-2,6)(NO2-4)) / В.В. Шарутин, О.К. Шарутина, ВС. Сенчурин // Журн. неорг. химии. - 2017. - Т. 62, № 3. - С. 290-295. DOI: 10.7868/S0044457X17030151.
- Шарутин, В.В. Новый способ получения ароксидов хлоротрифенилсурьмы Ph3SbCl(OAr) / В.В. Шарутин, О.К. Шарутина, В С. Сенчурин // Коорд. химия. - 2016. - Т. 42, № 1. - С. 34-38. DOI: 10.7868/S0132344X15120075.
- Синтез и строение у-фенилацетилацетоната тетрафенилсурьмы / В.В Шарутин, А.П. Пакусина, О.К. Шарутина и др. // Химия и комп. модел. Бутлеровские сообщ. - 2003. - Т. 4, № 1. -С. 34-35.
- Новые методы синтеза арокситетраарильных производных сурьмы / В.В. Шарутин, О.К. Шарутина, П.Е. Осипов и др. // Журн. общ. химии. - 2001. - Т. 71, № 6. - С. 1045-1046.
- Синтез и строение 2,4,6-трихлорфеноксидов тетра- и трифенилсурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин и др. // Журн. общ. химии. - 2016. - Т. 86, № 1. - С. 92-99.
- Синтез и строение пентафтор- и пентахлорфеноксидов тетра- и триарилсурьмы / B.В. Шарутин, О.К. Шарутина, А.Н. Ефремов и др. // Журн. неорг. химии. - 2017. - Т. 62, № 10. - C. 1330-1336. DOI: 10.7868/S0044457X17100075.
- Кочешков, К.А. Методы элементоорганической химии. Сурьма, висмут / К.А. Кочешков, А.П. Сколдинов, Н.Н. Землянский. - М.: Наука, 1976. - 483 с.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341. DOI: 10.1107/S0021889808042726.
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений / Б.Н. Тарасевич. - М.: МГУ, 2012. - 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е.В. Гриненко, А.О. Щукин и др. - СПб.: СПбГЛТА, 2007. - 54 с.
- Comparison of Inclusion Properties Between p-Tert-butylcalix[4]arene and p-tert-Butylthiacalix[4]arene towards Primary Alcohols in Crystals / N. Morohashi, K. Nanbu, A. Tonosaki et al. // Cryst. Eng. Comm. - 2015. - V. 17, № 26. - P. 4799-4808. DOI: 10.1039/C5CE00370A.
- A Novel One-dimensional Coordination Polymer Capturing Hydrated Co(II) Cations / D.-Q. Yuan, M.-Y. Wu, F.-L. Jiang et al. // J. Mol. Struct. - 2008. - V. 877, № 1-3. - P. 132-137. DOI: 10.1016/j.molstruc.2007.07.029.
- Bi, Y. Assembly of Supramolecular Compounds with Water-Soluble Calix[4]arenes / Y. Bi, W. Liao, H. Zhang // Cryst. Growth Des. - 2008. - V. 8, № 10. - P. 3630-3635. DOI: 10.1021/cg800177m.
- Thiacalix[4]arene-Based Three-Dimensional Coordination Polymers Incorporating Neutral Bridging Coligands / K. Kim, S. Park, K.-M. Park et al. // Cryst. Growth Des. - 2011. - V. 11, № 9. -P. 4059-4067. DOI: 10.1021/cg2006315.
- Unique Inclusion Properties of Crystalline Powder p-tert-Butylthiacalix[4]arene toward Alcohols and Carboxylic Acids / N. Morohashi, S. Noji, H. Nakayama et al. // Org. Lett. - 2011. - V. 13, № 13. - P. 3292-3295. DOI: 10.1021/ol200506p.

![Реакции пентафенилсурьмы и пента-пара-толилсурьмы с каликсареном [4-t-BuC6H2OH(S-2)]4 Реакции пентафенилсурьмы и пента-пара-толилсурьмы с каликсареном [4-t-BuC6H2OH(S-2)]4](/file/cover/147234246/reakcii-pentafenilsurmy-i-penta-para-tolilsurmy-s-kaliksarenom-4-t-buc6h2oh-s-2-4.png)
