Реакции пентафенилсурьмы с 1,2,3,4-тетрагидроакридин-9-карбоновой и кумарин-3-карбоновой кислотами
Автор: Шарутин В.В., Шарутина О.К., Зубарева В.В., Русских А.А., Кулясов А.Н., Доценко В.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.16, 2024 года.
Бесплатный доступ
Пентафенилсурьма взаимодействует с 1,2,3,4-тетрагидроакридин-9-карбоновой и кумарин-3-карбоновой кислотами в бензоле при комнатной температуре с образованием карбоксилатов тетрафенилсурьмы Ph4SbOC(O)R, R = C13H12N (1), C9H5O2 (2), строение которых установлено методом рентгеноструктурного анализа (РСА). По данным РСА, атомы сурьмы в молекулах 1 и 2 имеют координацию искаженной тригональной бипирамиды с тремя фенильными заместителями в экваториальной плоскости, аксиальные углы CSbO составляют 175,85(7)° и 177,6(6)°, суммы углов между экваториальными связями равны 356,31(8)° и 356,5(6)°. Экваториальные связи Sb-C (2,112(2)-2,125(2) Å для 1 и 2,128(16)-2,131(16) Å для 2 короче аксиальной(2,174(2) Å для 1 и 2,224(12) Å для 2. Длины связей Sb-O (2,2793(18) Å в 1 и 2,204(13) Å в 2) превосходят сумму ковалентных радиусов атомов сурьмы и кислорода. Установлено, что геометрические характеристики молекулы свободной кумарин-3-карбоновой кислоты (3) и остатка кислоты, входящего в комплекс 2, существенно различаются. РСА проводили на дифрактометре D8 Quest фирмы Bruker (MoKα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 293(2) К. Данные РСА: [(1) C38H32NO2Sb, M = 656,40; моноклинная сингония, пр. гр. Р21/c; размер кристалла 0,48´0,23´0,18 мм; параметры ячейки: a = 9,063(4) Å, b = 15,911(8) Å, c = 21,495(11) Å; β = 94,719(16)°, V = 3089(3) Å3, Z = 4; r(выч.) = 1,411 г/см3; m = 0,927 мм-1; F(000) = 1336,0; обл. сбора по 2q: 5,66-62,12°; -13 ≤ h ≤ 10, -23 ≤ k ≤ 23, -31 ≤ l ≤ 31; всего отражений 146090; независимых отражений 9883 (Rint = 0,0591); GOOF = 1,052; R-фактор 0,0338; (2) C34H24O4Sb, M = 619,29; триклинная сингония, пр. гр. Р-1; размер кристалла 0,61´0,42´0,29 мм; параметры ячейки: a = 9,533(4) Å, b = 10,560(4) Å, c = 16,397(6) Å; a = 97,431(13)°, β = 98,49(2)°, g = 108,962(12)°, V = 1516,1(9) Å3, Z = 2; r(выч.) = 1,357 г/см3; m = 0,944 мм-1; F(000) = 624,0; обл. сбора по 2q: 5,7-55,64°; -12 ≤ h ≤ 12, -13 ≤ k ≤ 13, -21 ≤ l ≤ 21; всего отражений 19837; независимых отражений 12162 (Rint = 0,0707); GOOF = 1,087; R-фактор 0,0543; (3) C10H6O4, M = 190,15; моноклинная сингония, пр. гр. Р21/n; размер кристалла 0,11´0,24´0,29 мм; параметры ячейки: a = 11,390(6) Å, b = 5,534(3) Å, c = 13,890(8) Å; a = 90,00°, β = 106,33(3)°, g = 90,00°, V = 840,1(7) Å3, Z = 4; r(выч.) = 1,503 г/см3; m = 0,118 мм-1; F(000) = 392,0; обл. сбора по 2q: 6,12-55,04°; -14 ≤ h ≤ 14, -7 ≤ k ≤ 7, -18 ≤ l ≤ 17; всего отражений 23991; независимых отражений 1917 (Rint = 0,0263); GOOF = 1,072; R-фактор 0,0406].
Пентафенилсурьма, 1, 2, 3, 4-тетрагидроакридин-9-карбоновая, кумарин-3-карбоновая кислота, карбоксилат тетрафенилсурьмы, молекулярная структура, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147246063
IDR: 147246063 | УДК: 546.865 | DOI: 10.14529/chem240402
Текст научной статьи Реакции пентафенилсурьмы с 1,2,3,4-тетрагидроакридин-9-карбоновой и кумарин-3-карбоновой кислотами
В связи с тем, что препараты на основе металлов часто имеют определенные преимущества перед чисто органическими соединениями в лекарственной терапии [1-4], в настоящее время они достаточно много исследуются. Сурьмаорганическим соединениям до последних десятилетий уделялось мало внимания, при этом большинство проведенных исследований было сосредоточено на неорганических производных и органических соединениях сурьмы(III) [5, 6]. Однако в XXI веке появилось много работ, посвященных органическим производным сурьмы(V). Сообщалось о комплексах сурьмы с хорошей противомикробной активностью [7-11], цитотоксично- стью и противоопухолевой активностью [12-22]. Установлено, что некоторые комплексы сурьмы могут влиять на восстановление двухцепочечного разрыва ДНК [23]. Появились публикации, в которых описаны целенаправленные синтезы производных сурьмы(V) с лигандами, обладающими доказанной биологической активностью, например, гетероциклическими соединениями [24-27].
Интерес к соединениям сурьмы(V) с полифункциональными карбоновыми кислотами, обусловлен не только их потенциальной биологической активностью, но и возможностью повышения координационного числа центрального атома за счет дополнительных взаимодействий, возникающих благодаря наличию гетероатомов с неподеленными электронными парами. С другой стороны, карбоновые кислоты гетероциклического ряда привлекают внимание как потенциальные комплексообразователи для получения соединений с люминесцентными свойствами [28].
В настоящем работе изучены реакции пентафенилсурьмы с 1,2,3,4-тетрагидроакридин-9-карбоновой и кумарин-3-карбоновой кислотами, содержащими в своем составе несколько потенциальных координирующих центров.
Экспериментальная частьРеакция пентафенилсурьмы с 1,2,3,4-тетрагидроакридин-9-карбоновой кислотой.
Смесь 0,1 г (0,20 ммоль) пентафенилсурьмы и 0,045 г (0,20 ммоль) 1,2,3,4-тетрагидроакридин-9-карбоновой кислоты в 5 мл бензола нагревали в запаянной ампуле при 80 ° С 1 ч. Медленно охлаждали, ампулу вскрывали и прибавляли 2 мл октана, далее медленно концентрировали раствор до объема ≈ 3 мл. Образовались 0,11 г (88 %) желтоватых кристаллов 1 с т. пл. 220 °С. Найдено (%): C 69,39; Н 4,92. Для C 38 H 32 NO 2 Sb рассчитано (%): С 69,51; Н 4,88. ИК-спектр (ν, см–1): 3061, 2929, 1627, 1618, 1576, 1497, 1478, 1432, 1357, 1300, 1261, 1022, 1068, 995, 769, 736, 690, 451, 401.
Аналогично проводили реакцию пентафенилсурьмы с кумарин-3-карбоновой кислотой (3) . Получили бесцветные кристаллы сольвата Ph 4 SbOC(O)C 9 H 5 O 2 ∙ ½C 8 H 18 ( 2 ), (73 %) с т. пл. 196°С. Найдено (%): C 65,34; Н 4,09. Для C 34 H 25 O 4 Sb рассчитано (%): С 65,91; Н 4,03. ИК-спектр (ν, см–1): 3070, 1736, 1636, 1609, 1568, 1478, 1456, 1432, 1326, 1274, 1250, 1157, 1136, 1065, 997, 864, 804, 761, 732, 693, 592, 447.
ИК-спектры соединений 1–3 записывали на ИК-спектрометре Shimadzu IRAffinity-1S в таблетках KBr в области 4000–400 см–1.
РСА кристаллов 1–3 проведен на дифрактометре D8 Quest фирмы Bruker (MoKα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [29]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [30] и OLEX2 [31]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника (Uизо(H) = 1,2Uэкв(C)). Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2333504 для 1, № 2336039 для 2, № 2336039 для 3; ; . Основные кристаллографические данные и результаты уточнения структур приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1 - 3
|
Параметр |
1 |
2 |
3 |
|
Стехиометрическая формула |
C 38 H 32 NO 2 Sb |
C 38 H 34 O 4 Sb |
C 10 H 6 O 4 |
|
М |
656,40 |
676,40 |
190,15 |
|
Сингония |
Моноклинная |
Триклинная |
Моноклинная |
|
Пространственная группа |
Р 2 1 / с |
Р– 1 |
Р 2 1 / n |
|
a , Å |
9,063(4), |
9,533(4), |
11,390(6), |
|
b , Å |
15,911(8), |
10,560(4), |
5,534(3), |
|
c, Å |
21,495(11) |
16,397(6) |
13,890(8) |
|
а , град. |
90,00 |
97,431(13) |
90,00 |
|
β, град. |
94,719(16) |
98,49(2) |
106,33(3) |
|
Y , град. |
90,00 |
108,962(12) |
90,00 |
|
V , Å3 |
3089(3) |
1516,1(9) |
840,1(7) |
Окончание табл. 1
|
Параметр |
1 |
2 |
3 |
|
Z |
4 |
2 |
4 |
|
ρ выч, г/см |
1,411 |
1,482 |
1,503 |
|
µ , мм–1 |
0,927 |
0,951 |
0,118 |
|
F (000) |
1336,0 |
690,0 |
392,0 |
|
Размер кристалла, мм |
0,48 × 0,23 × 0,18 |
0,61 × 0,42 × 0,29 |
0,11 × 0,24 × 0,29 |
|
Диапазон сбора данных по 2 θ , град. |
5,66–62,12 |
5,692–55,636 |
6,12–55,04 |
|
Диапазон индексов |
–13 ≤ h ≤ 10, –23 ≤ k ≤ 23, –31 ≤ l ≤ 31 |
–12 ≤ h ≤ 12, –13 ≤ k ≤ 13, –21 ≤ l ≤ 21 |
–14 ≤ h ≤ 14, –7 ≤ k ≤ 7, –18 ≤ l ≤ 17 |
|
Число измеренных рефлексов |
146090 |
19850 |
23991 |
|
Чисто независимых рефлексов |
9883 |
6874 |
1917 |
|
R int |
0,0591 |
0,0677 |
0,0263 |
|
GOOF |
1,052 |
1,125 |
1,072 |
|
Число параметров |
379 |
427 |
128 |
|
R -факторы по I > 2 σ ( I ) |
R 1 = 0,0338, wR 2 = 0,0640 |
R 1 = 0,0406, wR 2 = 0,0946 |
R 1 = 0,0406, wR 2 = 0,1042 |
|
R -факторы по всем рефлексам |
R 1 = 0,0664, wR 2 = 0,0757 |
R 1 = 0,1149, wR 2 = 0,1039 |
R 1 = 0,0478, wR 2 = 0,1112 |
|
Остаточная электронная плотность (max/min), e/A3 |
0,76/–0,38 |
0,85/–0,89 |
0,17/–0,24 |
Таблица 2
|
Связь \ |
d , Å 1 |
Угол 1 |
ω, град. |
|
1 |
|||
|
Sb(1)–O(1) |
2,2793(18) |
C(21)‒Sb(1)‒C(1) |
112,83(8) |
|
Sb(1)–C(1) |
2,125(2) |
C(21)‒Sb(1)‒C(11) |
131,57(8) |
|
Sb(1)–C(21) |
2,112(2) |
C(11)‒Sb(1)‒C(1) |
111,91(9) |
|
Sb(1)–C(11) |
2,119(2) |
C(31)‒Sb(1)‒O(1) |
175,85(7) |
|
Sb(1)–C(31) |
2,174(2) |
O(1)‒Sb(1)‒ C(1) |
84,18(7) |
|
O(1)–C(41) |
2,288(4) |
O(1)‒Sb(1)‒ C(11) |
82,19(7) |
|
O(2)–C(41) |
2,220(3) |
O(1)‒Sb(1)‒ C(21) |
84,76(7) |
|
N(1)–C(48) |
1,318(3) |
C(31)‒Sb(1)‒С(1) |
99,90(8) |
|
N(1)–C(49) |
1,355(3) |
C(31)‒Sb(1)‒С(11) |
95,49(8) |
|
C(31)‒Sb(1)‒С(21) |
94,30(8) |
||
|
C(48)‒N(1)‒С(49) |
118,2(2) |
||
|
2 |
|||
|
Sb(1)–C(1) |
2,119(3) |
О(1) - Sb(1)–C(21) |
178,36(11) |
|
Sb(1)–C(11) |
2,110(3) |
С(1) - Sb(1)–C(11) |
116,97(14) |
|
Sb(1)–С(21) |
2,179(3) |
С(11) - Sb(1)–C(31) |
122,39(14) |
|
Sb(1)–С(31) |
2,111(3) |
С(1) - Sb(1)–C(31) |
117,07(14) |
|
Sb(1)–O(1) |
2,236(2) |
О(1) - Sb(1)–C(1) |
82,35(11) |
|
О(1) - С(50) |
1,281(4) |
О(1) - Sb(1)–C(11) |
83,98(11) |
|
О(2) - С(50) |
1,221(4) |
О(1) - Sb(1)–C(31) |
84,70(11) |
|
О(3) - С(42) |
1,204(5) |
C(21) - Sb(1)–C(1) |
96,01(12) |
|
О(4) - С(42) |
1,371(4) |
C(21) - Sb(1)–C(11) |
96,71(12) |
|
О(4) - С(45) |
1,368(5) |
C(21) - Sb(1)–C(31) |
96,15(12) |
|
3 |
|||
|
O(1)–C(6) |
1,3282(16) |
O(2)‒C(6)‒O(1) |
120,49(11) |
|
O(2)–C(6) |
1,2069(17) |
C(2)‒O(4)‒C(3) |
121,72(9) |
|
O(3)–C(2) |
1,2241(15) |
O(3)‒C(2)‒C(1) |
124,86(11) |
|
O(4)–C(2) |
1,3595(15) |
O(3)‒C(2)‒О(4) |
116,51(11) |
|
O(4)–C(3) |
1,3834(14) |
O(1)‒C(6)‒C(1) |
116,99(11) |
|
С(1)–C(6) |
1,5048(17) |
O(2)‒C(6)‒C(1) |
122,51(12) |
Обсуждение результатов
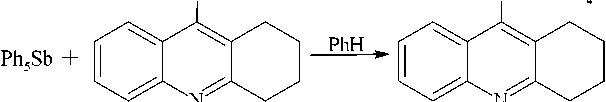
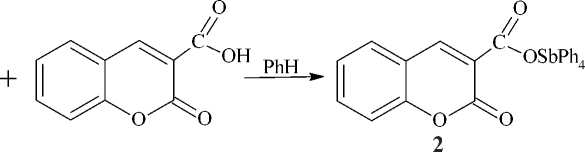
Установлено, что, как и большинство карбоновых кислот, 1,2,3,4-тетрагидроакридин-9-карбоновая и кумарин-3-карбоновая кислоты реагирует с пентафенилсурьмой с разрывом одной связи Sb - C и образованием карбоксилатов тетрафенилсурьмы 1 и 2 :
O
//
COSbPh
O
//
C OH
N
Ph5Sb
Длины связей и валентные углы в структурах 1–3
Дефенилирование пентафенилсурьмы происходит при непродолжительном нагревании реагентов в бензоле. Выход продуктов достаточно высокий и составляет 73 и 88 % соответственно. Образцы монокристаллов для проведения РСА получали кристаллизацией из бензола при добавлении октана (5:1 объемн.), при этом соединение 2 выделено в форме сольвата с октаном 2 ⋅ 0,5 С 8 Н 18 .
Кристаллы 1 и 2 хорошо растворимы в аренах, хлороформе, четыреххлористом углероде и очень плохо растворимы в алканах.
В ИК-спектрах соединений присутствуют характерные полосы поглощения средней интенсивности при 3061 см-1 ( 1 ) и 3070 см-1 ( 2 ), отвечающие валентным колебаниям связей CAr–H и полосы валентных колебаний углеродного скелета ароматических фрагментов в области 1576 см–1 ( 1 ) и 1568 см–1 ( 2 ) [32]. Интенсивные полосы поглощения при 1627 см–1 ( 1 ) и 1636 см–1 ( 2 ), соответствующие валентным колебаниям связи С=O, смещены в низкочастотную область, по сравнению с аналогичной полосой в ИК-спектре 1,2,3,4-тетрагидроакридин-9-карбоновой кислоты (1657 см–1) и кумарин-3-карбоновой кислоты (1686 см–1). Колебания связей Sb - C характеризуются полосами при 451 см - 1 для 1 и 447 см–1 для 2 .
По данным РСА, в молекулах 1 и 2 атомы сурьмы имеют координацию искаженной тригональной бипирамиды с фенильными заместителями в экваториальной плоскости и атомом кислорода карбоксильной группы в аксиальном положении (рис. 1, 2).
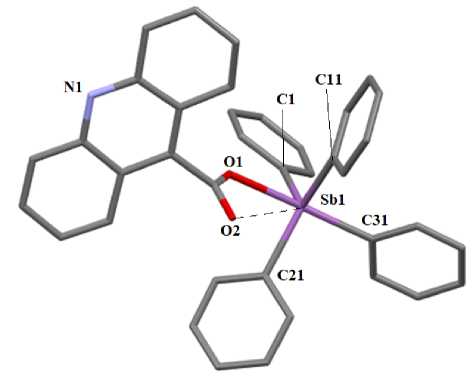
Рис. 1. Общий вид молекулы комплекса 1. Атомы водорода не показаны
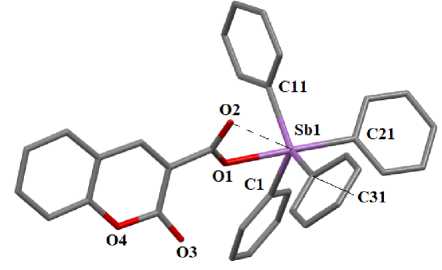
Рис. 2. Общий вид молекулы комплекса 2. Атомы водорода и сольватная молекула октана не показаны
Об искажении координации центрального атома свидетельствуют значения валентных углов при атоме сурьмы, которые отклоняются от теоретических. Так, аксиальные углы O(1)Sb(1)C(31) и O(1)Sb(1)C(21) равны 175,85(7) ° и 178,36(11) ° . Суммы углов CSbC экваториальных плоскостях составляют 356,31(8) ° и 356,43(14) ° в 1 и 2 соответственно. Атомы Sb выходят из соответствующих экваториальных плоскостей в сторону аксиального атома углерода на 0,233 и 0,232 Å, что сопровождается увеличением углов Сакс . SbCэкв . по сравнению с 90 ° (94,30(8); 95,49(8); 99,90(8) ° и 96,01(12), 96,15(12), 96,71(12) ° в 1 и 2 ) и уменьшением углов ОSbCэкв . по сравнению с этим значением (82,19(7); 84,18(7); 84,76(7) ° в 1 и 82,35(11), 83,98(11), 84,70(11) ° в 2 ).
В молекулах 1 и 2 имеет место удлинение аксиальных связей Sb - C (2,174(2) и 2,179(3) А) по сравнению с экваториальными (2,112(2) - 2,125(2) А; 2,110(3) - 2,119(3) А), что характерно для соединений типа Ar4SbX с пентакоординированным атомом металла. Связи Sb(1) - 0(1) равны 2,279(2) и 2,236(2) Å. Карбоксилатный лиганд проявляет анизобидентатный характер связывания, поскольку расстояния между центральным атомом и карбонильным атомом кислорода (Sb(1)∙∙∙O(2) 3,313(2) Å и 3,359(3) Å) значительно короче суммы ван-дер-ваальсовых радиусов указанных атомов (3,58 Å [32]). Наличие внутримолекулярного взаимодействия Sb∙∙∙O=С косвенно подтверждается увеличением валентного угла между связями в экваториальной плоскости со стороны контакта, так в молекуле 1 угол C(11)SbC(21) развернут до 131,57(8) ° , в 2 угол C(11)SbC(31) - до 122,39(14) ° , при этом наблюдается корреляция: чем короче расстояние Sb^^^O, тем больше соответствующий угол СSbC.
Расстояния С - О в карбоксильных группах (1,288(4) и 1,220(3) А в 1 и 1,281(4) и 1,221(4) А в 2 свидетельствуют об отсутствии полного перераспределения электронной плотности, как это наблюдается в карбоксилат-анионе. Связь О(3) - С(42) в карбонильной группе молекулы 2 составляет 1,204(5) А. Валентные углы в карбоксильных группах ОСО равны 126,4(2) ° и 125,9(3) ° в 1 и 2 соответственно.
В остатке 1,2,3,4-тетрагидроакридин-9-карбоновой кислоты угол между плоскостями бензольного и пиридинового колец составляет 2,29 ° , а угол между плоскостью пиридинового кольца и плоскостью карбоксильной группы - 81,40 ° . В гексановом цикле атомы С(43), С(44), С(47), С(48) лежат примерно в одной плоскости, из которой атом С(45) выходит на 0,301 Å.
Для сравнения геометрии молекулы кумарин-3-карбоновой кислоты в свободном и связанном состояниях было проведено рентгеноструктурное исследование монокристалла кислоты 3 (рис. 3).
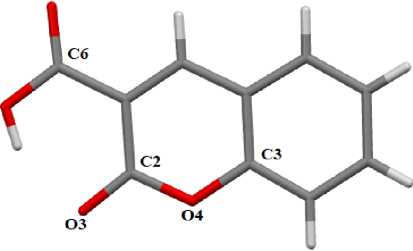
Рис. 3. Общий вид молекулы кумарин-3-карбоновой кислоты.
Атомы водорода не показаны
В кристалле 3 выход атомов из средней плоскости двух конденсированных колец находится в интервале 0,005-0,035 А, и на максимальное расстояние от указанной плоскости отклоняется атом кислорода О(4). Угол между плоскостью карбоксильной группы и средней плоскостью конденсированных колец составляет лишь 4,45°. В молекуле 2 отклонение атомов от средней плоскости конденсированных циклов также минимально (0,001-0,040 А), однако, плоскость карбоксильной группы образует с плоскостью циклов двугранный угол 38,10°. Связывание кислоты в комплекс приводит к заметному изменению длин связей. Так, связи С-О в карбоксильной группе кислоты 3 равны 1,2069(17) и 1,3282(16) Å, т. е. разность значений двойной и одинарной связей равна 0,1213 Å, в то время как в 2 эта разность составляет только 0.06 Å. Карбонильная связь С(2)-О(3) в молекуле 3 составляет 1,2241(15) Å и длиннее, чем в 2 (1,204(5) Å).
В кристалле 1 межмолекулярные взаимодействия обусловлены слабыми водородными связями тип N(1) ⋅⋅⋅ H(32) - C(32) (2,68 Å), благодаря которым формируются цепи из молекул, расположенные вдоль кристаллографической оси с . Между цепями имеют место слабые взаимодействия типа С - Н ⋅⋅⋅π (рис. 4).
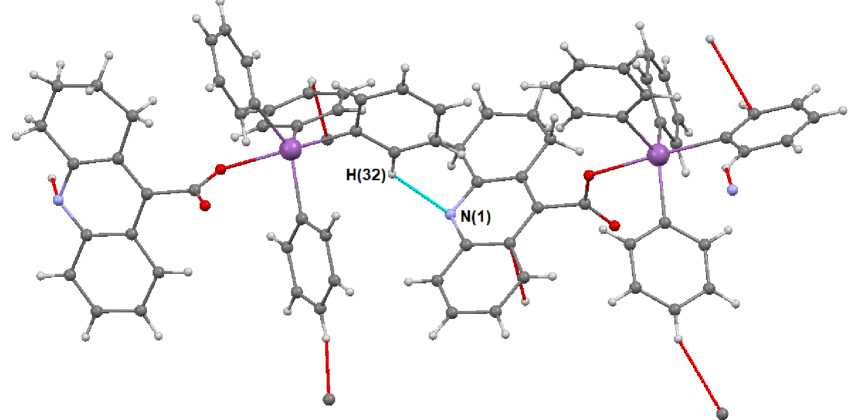
Рис. 4. Межмолекулярные взаимодействия N ⋅⋅⋅ H - C в кристалле 1
Структурная организация кристалла 2 формируется, в основном слабыми водородными связями О(2) ⋅⋅⋅ H(43) - C(43) (2,71 Å), О(3) ⋅⋅⋅ H(14) - C(14) (2,42 Å), О(3) ⋅⋅⋅ H(33) - C(33) (2,72 Å) между соседними молекулами (рис. 5) и многочисленными взаимодействия С - Н ⋅⋅⋅π -типа с участием ра-зупорядоченных молекул октана.
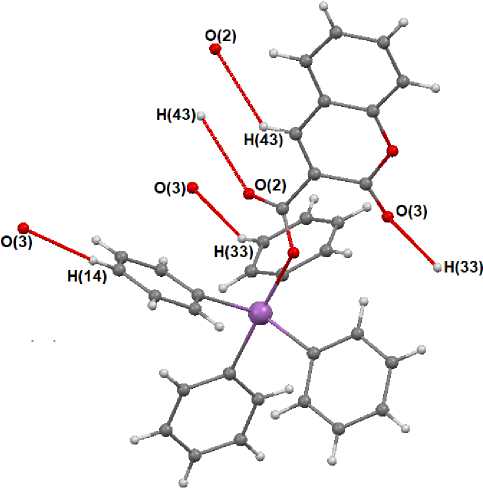
Рис. 5. Межмолекулярные взаимодействия O ⋅⋅⋅ H - C в кристалле 2
На рис. 6 приведена кристаллическая ячейка соединения 2 с разупорядоченными молекулами октана.
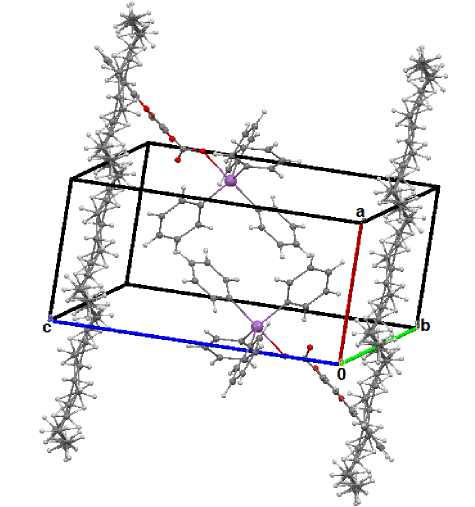
Рис. 6. Кристаллическая ячейка соединения 2 с разупорядоченными молекулами октана
В молекуле 3 имеет место внутримолекулярная водородная связь О(1) - Н(1)—О(3), образованная атомом водорода карбоксильной группы и атомом кислорода карбонильной. Расстояние Н(1) --- О(3) составляет 1,85 А, Q(1) --- Q(3) - 2,605(2) А, угол О(1) - Н(1) - О(3) равен 152 ° . Молекулы в кристалле располагаются параллельно друг другу вдоль кристаллографической оси b , при этом образуются два типа стопок, плоскости которых составляют двугранный угол 59,95 ° (рис. 7).
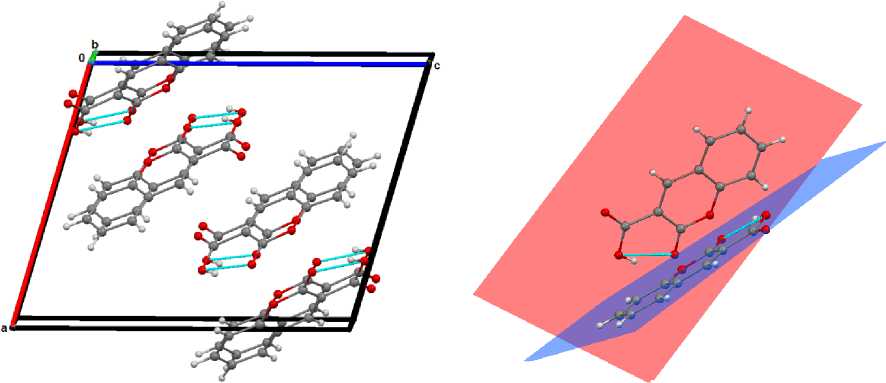
Рис. 7. Внутримолекулярные водородные связи и расположение молекул в кристалле 3
Выводы
Установлено, 1,2,3,4-тетрагидроакридин-9-карбоновая и кумарин-3-карбоновая кислоты де-фенилируют пентафенилсурьму в бензоле с образованием соответствующих карбоксилатов тет-рафенилсурьмы 1 и 2 с высоким выходом. В молекулах карбоксилатов тетрафенилсурьмы атом сурьмы имеет координацию искаженной тригональной бипирамиды, карбоксильная группа проявляет анизобидентатные свойства, координируясь на центральный атом крайне асимметрично (отношения длин связей Sb --- Q и Sb - О равны 1,45 и 1,50 в 1 и 2 соответственно). Формирование структур обусловлено, в основном, межмолекулярными водородными связями типа N - H—O, C - H—Q, а также взаимодействиями С - Н- п -типа.
Связывание кумарин-3-карбоновой кислоты в комплекс приводит к нарушению ее практически плоской геометрии: плоскость карбоксильной группы отклоняется от плоскости конденсированных циклов на значительный угол, кроме того, наблюдается выравнивание связей С - О в карбоксильной группе, при этом карбонильная связь укорачивается.
Список литературы Реакции пентафенилсурьмы с 1,2,3,4-тетрагидроакридин-9-карбоновой и кумарин-3-карбоновой кислотами
- Yang P., Guo M.L. // Coord. Chem. Rev. 1999. V. 185-186. P. 189. DOI: 10.1016/S0010-8545(98)00268-9
- GielenM. // Coord. Chem. Rev. 1996. V. 151. P. 41. DOI: 10.1016/S0010-8545(96)90193-9
- GielenM. // Appl. Organomet. Chem. 2002. V. 16, No. 9. P. 481. DOI: 10.1002/aoc.331
- Pellerito L., Nagy L. // Coord. Chem. Rev. 2002. V. 224. P. 111. DOI: 10.1016/S0010-8545(01)00399-X
- Breunig H.J, Rusler R. // Coord. Chem. Rev. 1997. V. 163. P. 33. DOI: 1016/S0010-8545(97)00008-8
- Silvestru C, Haiduc I. // Coord. Chem. Rev. 1996. V. 147. P. 117. DOI: 10.1016/0010-8545(95)01129-3
- Ali M.I., Rauf M.K., Badshah A. et al. // Dalton Trans. 2013. V. 42, No. 48. Р. 16733. DOI: 10.1039/C3DT51382C
- Mushtaq R., Rauf M., Bolte M. et al. // Appl. Organomet. Chem. 2016. V. 31, No. 5. e3606. DOI: 10.1002/aoc.3606
- Duffin R.N., Blair V.L., Kedzierskib L. et al // Dalton Trans. 2018. V. 47, No. 3. Р. 971. DOI: 10.1039/C7DT04171C
- Artem 'eva E.V., Duffin R.N., Munuganti S. et al. // J. Inorg. Biochem. 2022. V. 234. P. 111864. DOI: 10.1016/jjinorgbio.2022.111864
- Artem 'eva E.V., Efremov A.N., Sharutina O.K. et al. // Polyhedron. 2022. V. 213. P. 115627. DOI: 10.1016/j.poly.2021.115627
- Tiekink E. // Crit. Rev. Oncol. Hematol. 2002. V. 42, No. 3. Р. 217. DOI: org/10.1016/S1040-8428(01)00217-7
- Wang, F, Yin H, Yue C. et al. // J. Organomet. Chem. 2013. V. 738, No. 15. Р. 35. DOI: 10.1016/j.jorganchem.2013.03.046
- Islam A., Rodrigues B.L., Marzano I.M. et al. // Eur. J. Med. Chem. 2016. V.109, No. 15. P. 254. DOI: 10.1016/j.ejmech.2016.01.003
- Polychronis N.M., Banti C.N., Raptopoulou C.P. et al. // Inorg. Chim. Acta. 2019. V. 489, No. 1. P. 39. DOI: 10.1016/j.ica.2019.02.004
- Gkaniatsou E.I., Banti C.N., Kourkoumelis N. et al. // J. Inorg. Biochem. 2015. V. 150. P. 108. DOI: 10.1016/j.poly.2003.12.002
- Yu L., Ma Y., Liu R. et al. // Polyhedron. 2004. V. 23. P. 823. DOI: 10.1016/j.jinorgbio.2015.04.014
- Denizot F, Lang R. // J. Immunol. Methods. 1986. V. 89, No. 2. Р. 271. DOI: 10.1016/0022-1759(86)90368-6
- Wang G., Xiao J., Yu L. et al. // J. Organomet. Chem. 2004. V. 689, No. 9. P. 1631. DOI: 10.1016/j.jorganchem.2004.02.015
- Ma Y, Li J, Xuan Z. et al. // J. Organomet. Chem. 2001. V. 620, No. 9. P. 235. DOI: 10.1016/S0022-328X(00)00799-3
- Wang G., Lu Y, Xiao J. et al. // J. Organomet. Chem. 2005. V. 690, No. 1. P. 151. DOI: 10.1016/j.jorganchem.2004.09.002
- Geng H, Hong M., Yang Y. et al. // J. Coord. Chem. 2015. V. 68, No. 16. P. 2938. DOI: 10.1080/00958972.2015.1060322
- Takahashi S., Sato H., Kubota Y. et al. // Toxicology. 2002. V. 180, No. 3, P. 249. DOI: 10.1016/S0300-483X(02)00401 -8
- Mushtaq R., Rauf M.K., BondM. et al. // Appl. Organomet. Chem. 2016. V. 30, No. 1. Р. 465. DOI: 10.1002/aoc.3456
- Ma С., Zhang Q., Sun J. et al. // J. Organomet. Chem. 2006. V. 691, No. 9. P. 2567. DOI: 10.1016/j.jorganchem.2006.01.049
- Губанова Ю.О., Шарутин В.В., Шарутина О.К. и др. // Журн. общ. химии. 2020. Т. 90, № 9. С. 1407. DOI: 10.31857/S0044460X20090127
- Губанова Ю.О., Шарутина О.К., КимД.Г. и др. // Вестник ЮУрГУ. Серия «Химия». 2019. Т. 11. № 4. С. 49. DOI: 10.14529/chem190406
- Громак Н.А., Колоколов Ф.А., Доценко В.В. и др. // Журн. общ. химии. 2021. Т. 91, № 4. С. 613. DOI: 10.31857/S0044460X2104017X
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and processing software for the SMART system. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An integrated system for solving, refining and displaying crystal structures from diffraction data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726
- Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113, No. 19. P. 5806. DOI: 10.1021/jp8111556


