Реакция ацетилацетоната тетрафенилсурьмы с мезитиленсульфоновой кислотой
Автор: Шарутин В.В., Дегтярева Д.А.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 3 т.16, 2024 года.
Бесплатный доступ
Мезитиленсульфонат тетрафенилсурьмы (1) образуется с выходом 78 % из мезитиленсульфоновой кислоты (2) и ацетилацетоната тетрафенилсурьмы в водно-ацетоновом растворе. По данным рентгеноструктурного анализа, атомы сурьмы в комплексе 1 имеют координацию искаженной тригональной бипирамиды с аксиально расположенным мезитиленсульфонатным лигандом, при этом аксиальный угол CSbО составлял 173,99(5)°, а расстояние Sb-O равно 2,4717(15) Å. Кристалл 2 состоит из молекул гидратной воды и мезитиленсульфоновой кислоты. Кристаллографические характеристики 1 [C33H31O3SSb, M = 629,39; моноклинная сингония, пр. гр. P21/n; параметры ячейки: a = 10,098(5) Å, b = 14,125(6) Å, c = 20,777(11) Å; β = 100,59(2)°, V = 2913(2) Å3, Z = 4; r(выч.) = 1,435 г/см3; m = 1,050 мм-1; F(000) = 1280,0; обл. сбора по 2q: 5,92-55,02°; -13 ≤ h ≤ 13, -18 ≤ k ≤ 18, -26 ≤ l ≤ 26; всего отражений 80722; независимых отражений 6675 (Rint = 0,0313); GOOF = 1,078; R-фактор = 0,0222]; 2 [C9H15O5S, M = 235,27; ромбическая сингония, пр. гр. Pbca; параметры ячейки: a = 15,221(17) Å, b = 7,882(8) Å, c = 20,39(3) Å; a = 90,00°, β = 90,00°, g = 90,00°, V = 2446(5) Å3, Z = 8; r(выч.) = 1,278 г/см3; m = 0,264 мм-1; F(000) = 1000,0; обл. сбора по 2q: 6,16-54,46°; -19 ≤ h ≤ 19, -9 ≤ k ≤ 9, -26 ≤ l ≤ 26; всего отражений 32479; независимых отражений 2628 (Rint = 0,0768); GOOF = 1,025; R-фактор = 0,0650]. Полные таблицы координат атомов, длин связей и валентных углов соединений 1 и 2 депонированы в Кембриджском банке структурных данных (CCDC 2335253 и 2332598; deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
Реакция, ацетилацетонат тетрафенилсурьмы, мезитиленсульфоновая кислота, мезитиленсульфонат тетрафенилсурьмы, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147244643
IDR: 147244643 | УДК: 546.865 | DOI: 10.14529/chem240306
Текст научной статьи Реакция ацетилацетоната тетрафенилсурьмы с мезитиленсульфоновой кислотой
Интерес к способам синтеза соединений сурьмы во многом определяется расширяющимся потенциалом различных областей их применения в практической деятельности: в фармацевтической промышленности, в качестве биоцидов, фунгицидов, антиоксидантов, реагентов в тонком органическом синтезе, а также компонентов каталитических систем [1].
Одними из наиболее изученных среди органических соединений сурьмы являются производные общей формулы Ar 4 SbX (X – электроотрицательный лиганд), которые получают преимущественно деарилированием пентаарилсурьмы кислотами (НХ) либо по реакции перераспределения лигандов из пентаарилсурьмы и производных сурьмы симметричного строения Ar3SbX2 [1 - 31]. Показано, что синтез подобных соединений фосфора - аренсульфонатов алкилтрифенилфосфония – осуществляли из галогенидов алкилтрифенилфосфония и аренсульфоновых кислот в водно-ацетоновом растворе при комнатной температуре [32‒36].
В настоящей работе исследована реакция синтеза мезитиленсульфоната тетрафенилсурьмы из ацетилацетоната тетрафенилсурьмы и мезитиленсульфоновой кислоты в водно-ацетоновом растворе.
ИК-спектры соединений записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S таблетке KBr в области 4000 - 400 см - 1. Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter. Ацетилацетонат тетрафенилсурьмы Ph4Sbacac получали из пентафенил-сурьмы и ацетилацетона в растворе бензола. В работе использовали мезитиленсульфоновую кислоту производства фирмы Alfa Aesar.
РСА кристаллов 1, 2 проведен на дифрактометре D8 Quest фирмы Bruker (MoKα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [37]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [38] и OLEX2 [39]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Основные кристаллографические данные и результаты уточнения структур 1, 2 приведены в табл. 1, основные длины связей и валентные углы - в табл. 2. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2335253 (1), № 2332598 (2); ; .
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1 и 2
|
Параметр |
1 |
2 |
|
Формула |
C 33 H 31 O 3 SSb |
C 9 H 16 O 5 S |
|
М |
629,40 |
1206,69 |
|
Сингония |
Моноклинная |
Ромбическая |
Окончание табл. 1
|
Параметр |
1 |
2 |
|
Пространственная группа |
P 2 1 /n |
P bca |
|
a , Å |
10,098(5) |
15,221(17) |
|
b, Å |
14,125(6) |
7,882(8) |
|
c, Å |
20,777(11) |
20,39(3) |
|
α, град. |
90,00 |
90,00 |
|
β, град. |
100,59(2) |
90,00 |
|
γ, град. |
90,00 |
90,00 |
|
V , Å3 |
2913(2) |
2446(5) |
|
Z |
4 |
8 |
|
р(выч.), г/см3 |
1,435 |
1,278 |
|
ц, мм-1 |
1,050 |
0,264 |
|
F (000) |
1280,0 |
1000,0 |
|
Форма кристалла (размер, мм) |
0,34 × 0,21 × 0,2 |
0,36 × 0,21 × 0,14 |
|
Область сбора данных по 20, град. |
5,92–55,02 |
6,16–54,46 |
|
Интервалы индексов отражений |
–13 ≤ h ≤ 13, –18 ≤ k ≤ 18, –26 ≤ l ≤ 26 |
–19 ≤ h ≤ 19, –9 ≤ k ≤ 9, –26 ≤ l ≤ 26 |
|
Измерено отражений |
80722 |
32479 |
|
Независимых отражений ( R int) |
6675 (0,0313) |
2628 (0,0768) |
|
Переменных уточнения |
346 |
145 |
|
GOOF |
1,078 |
1,025 |
|
R -факторы по F 2 > 2о( F 2 ) |
R 1 = 0,0222, wR 2 = 0,0505 |
R 1 = 0,0650, wR 2 = 0,1775 |
|
R -факторы по всем отражениям |
R 1 = 0,0287, wR 2 = 0,0534 |
R 1 = 0,1001, wR 2 = 0,2130 |
|
Остаточная электронная плотность (min/max), e /Å3 |
0,31/-0,51 |
1,00/-0,36 |
Таблица 2
|
Связь |
d , Å |
Угол |
ω, град. |
|
1 |
|||
|
Sb1–O1 |
2,4717(15) |
C1‒Sb1‒О1 |
84,78(7) |
|
Sb1–C1 |
2,1128(18) |
C1‒Sb1‒C11 |
99,36(7) |
|
Sb1–C31 |
2,1099(18) |
C1‒Sb1‒С21 |
115,36(7) |
|
Sb1–C11 |
2,1468(18) |
C1‒Sb1‒C21 |
115,36(7) |
|
Sb1–C21 |
2,1243(19) |
C31‒Sb1‒С1 |
118,48(7) |
|
S1–O1 |
1,4759(14) |
C31‒Sb1‒C21 |
119,09(7) |
|
S1–О2 |
1,4406(17) |
C11‒Sb1‒О1 |
173,99(5) |
|
S1–О3 |
1,4338(17) |
О1‒S1‒C41 |
105,04(8) |
|
S1–C41 |
1,800(2) |
О2‒S1‒О1 |
110,51(9) |
|
2 |
|||
|
S1–O1 |
1,453(3) |
O1‒S1‒О2 |
110,00(18) |
|
S1–О2 |
1,454(3) |
O1‒S1‒C1 |
107,39(16) |
|
S1–О3 |
1,424(3) |
O2‒S1‒С1 |
105,81(17) |
|
S1–C1 |
1,773(4) |
O3‒S1‒O1 |
112,5(2) |
|
С1–C6 |
1,406(4) |
O3‒S1‒С1 |
108,78(17) |
|
С1–С2 |
1,412(5) |
C6‒C1‒S1 |
116,9(2) |
Длины связей и валентные углы в структурах 1 и 2
Cинтез мезитиленсульфоната тетрафенилсурьмы Ph 4 SbOSO 2 C 6 H 2 Me 3 -2,4,6 (1). К раствору 106 мг (0,2 ммоль) ацетилацетоната тетрафенилсурьмы в ацетоне прибавляли 47 мг (0,2 ммоль) водного раствора гидрата мезитиленсульфоновой кислоты и выдерживали 1 ч при комнатной температуре. Удаляли растворитель, остаток перекристаллизовали из воды, сушили и взвешивали. Получили 98 мг (78 %) бесцветных кристаллов мезитиленсульфоната тетрафенил-сурьмы с т. пл. 207 ° С. Найдено, (%): C 62,83; Н 4,99, для C33H31O3SSb рассчитано, (%): С 62,92; Н 4,93. ИК-спектр ( v , см - 1): 3057 ср., 2966 сл., 2932 сл., 1477 с., 1435 с., 1261 с., 1150 с., 1072 с., 995 с., 849 с., 743 с., 675 с., 577 ср., 546 ср., 527 ср., 449 ср.
Первый пример получения аренсульфоната тетраарилсурьмы из хлорида тетра( пара -толил)стибония с бензолсульфоновой кислотой был описан в работе [40], в которой показано, что при смешивании водно-ацетоновых растворов исходных реагентов образуется бензолсульфонат тетра( пара -толил)стибония с выходом 97 %.
(4-MeC 6 H4)4SbCl + HOSO 2 Ph ^ (4-MeC 6 H4)4SbOSO 2 Ph + HCl
Предполагая, что взаимодействие ацетилацетоната тетрафенилсурьмы с мезитиленсульфоно-вой кислотой может протекать по сходной схеме, мы провели реакцию между указанными реагентами в аналогичных условиях.
Показано, что в этом случае мезитиленсульфоновая кислота замещает ацетилацетоновый лиганд на мезитиленсульфонатную группу с образованием мезитиленсульфоната тетрафенилсурьмы ( 1 ):
Ph4Sbacac + HOSO2C6H2Me3-2,4,6 ^ Ph4SbOSO2C6H2Me3-2,4,6 + acacH, где acac – остаток ацетилацетона.
Так, прибавление раствора ацетилацетоната тетрафенилсурьмы в ацетоне к водному раствору мезитиленсульфоновой кислоты с последующим удалением растворителя и перекристаллизацией остатка из воды приводило к образованию с выходом 78 % соединения 1, которое представляло собой бесцветные кристаллы, хорошо растворимые в ароматических углеводородах и по- лярных растворителях.
В ИК-спектре соединения 1 в области 3057 - 2932 см-1 наблюдаются полосы поглощения, отвечающие валентным колебаниям связей С - Н, а также характерные полосы валентных колебаний углеродного скелета ароматических фрагментов в области 1601 и 1557 см–1. Также содержатся характерные полосы поглощения: 1261 и 1242 см-1 (полосы высокой интенсивности) и 1150 и 1072 см-1 (полосы средней интенсивности), которые относятся к асимметричным и симметричным валентным колебаниям сульфонатной группы SO3. Полоса поглощения, относящаяся к валентным колебаниям S‒O, проявляется в области 675 см–1. Интенсивная полоса поглощения при 577 см‒1 соответствуют валентным колебаниям связей C Ar –S.
По данным рентгеноструктурного анализа, атомы сурьмы в комплексе 1 имеют координацию искаженной тригональной бипирамиды с аксиально расположенным мезитиленсульфонатным лигандом (рис. 1), при этом аксиальный угол CSbO составлял 173,99(5) ° , а расстояние Sb - O равно 2,4717(15) Å.
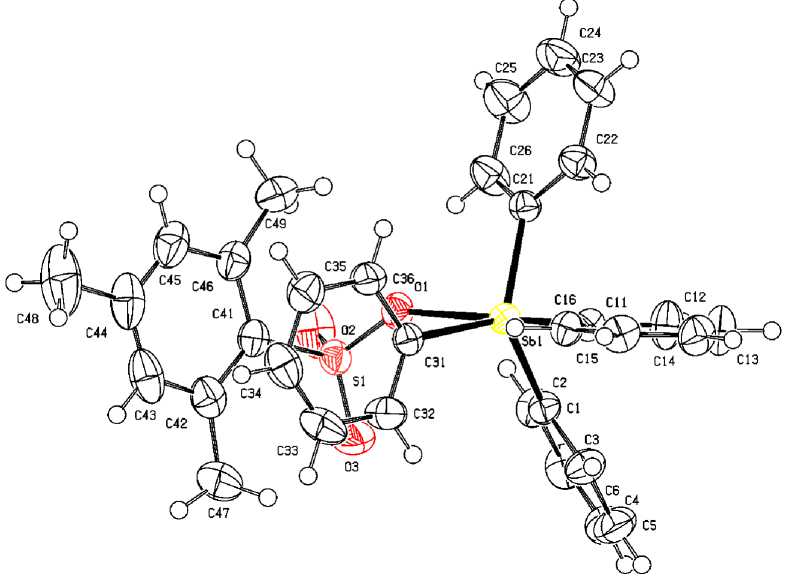
Рис. 1. Общий вид мезитиленсульфоната тетрафенилсурьмы Ph 4 SbOSO 2 C 6 H 2 Me 3 -2,4,6 (1)
Геометрические характеристики аренсульфонатного лиганда (длины связей и величины валентных углов) в кристалле 1 мало отличаются от наблюдаемых в кристалле 2 (рис. 2, табл. 2).
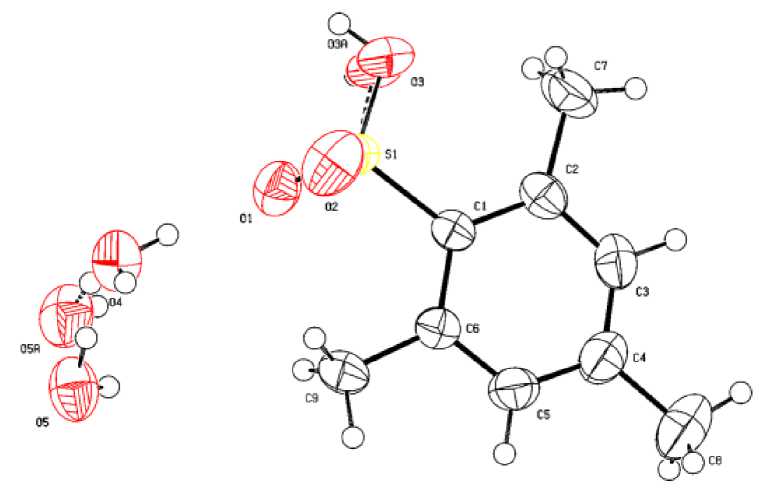
Рис. 2. Общий вид гидрата мезитиленсульфоновой кислоты НOSO 2 C 6 H 2 Me 3 -2,4,6 ∙ 2H 2 O (2)
Мезитиленсульфоновая кислота вытесняет из ацетилацетоната тетрафенилсурьмы Ph 4 Sbacac (acac – остаток ацетилацетона) слабую кислоту Hacac с образованием мезитилсульфоната тетра-фенилсурьмы.
Список литературы Реакция ацетилацетоната тетрафенилсурьмы с мезитиленсульфоновой кислотой
- Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46, № 10. С. 579. DOI: 10.31857/S0132344X20100011
- Шарутин В.В., Шарутина О.К., Молокова О.В. и др. // Журн. общ. химии. 2001. Т. 71, № 8. С. 1317.
- Шарутин В.В., Шарутина О.К., Молокова О.В. и др. // Журн. общ. химии. 2000. Т. 70, № 12. С. 1990. EDN: BNCLQF
- Шарутин В.В. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 1. С. 50–57. DOI: 10.14529/chem230105
- Шарутин В.В., Шарутина О.К., Осипов П.Е. и др. // Коорд. химия. 2001. Т. 27, № 7. С. 518.
- Шарутин В.В., Шарутина О.К., Осипов П.Е. и др. // Журн. общ. химии. 1997. Т. 67, № 9. С. 1528.
- Шарутин В. В., Шарутина О. К., Осипов П.Е. и др. // Журн. общ. химии. 2000. Т. 70, № 6. С. 931.
- Шарутин. В.В., Пакусина А.П., Пушилин М.А. и др. // Журн. общ. химии. 2003. Т. 73, № 4. С. 573. EDN: OYUUKB
- Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Коорд. химия. 2021. Т. 47, № 6. С. 356. DOI: 10.31857/S0132344X21060074
- Шарутин В.В., Шарутина О.К., Бондарь Е.А. и др. // Журн. общ. химии. 2003. Т. 73, № 3. С. 376. EDN: OYTHVT
- Шарутин В.В., Фукин Г.К., Захаров Л.Н. и др. // Журн. общ. химии. 2000. Т. 70, № 12. С. 1997.
- Шарутин В.В., Пакусина А.П., Платонова Т.П. и др. // Коорд. химия. 2002. Т. 28, № 11. С. 803. EDN: CYBNKD
- Шарутин В.В., Пакусина А.П., Платонова Т.П. и др. // Журн. общ. химии. 2003. Т. 73, № 2. С. 234.
- Шарутин В.В., Шарутина О.К., Бондарь Е.А. и др. // Коорд. химия. 2001. Т. 27, № 6. С. 423. DOI: 10.1023/A:1011395910599
- Шарутин В.В., Шарутина О.К., Бондарь Е.А. и др. // Журн. общ. химии. 2002. Т. 72, № 3. С. 419. EDN: VDGBNW
- Шарутин В.В., Шарутина О.К., Бондарь Е.А. и др. // Коорд. химия. 2002. Т. 28, № 5. С. 356. EDN: EOICYB
- Шарутин В.В., Пакусина А.П., Задачина О.П. и др. // Коорд. химия. 2004. Т. 30, № 6. С. 426. EDN: OWBOMB
- Шарутин В.В., Шарутина О.К., Бондарь Е.А. и др. // Журн. общ. химии. 2002. Т. 72, № 2. С. 245.
- Шарутин В.В., Галиуллина Д.Р., Головин М.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 2. С. 66. DOI: 10.14529/chem230205
- Шарутин В.В., Шарутина О.К., Задачина О.П. и др. // Журн. общ. химии. 2000. Т. 70, № 5. С. 746.
- Шарутин В.В., Шарутина О.К., Задачина О.П. и др. // Журн. общ. химии. 2000. Т. 70, № 10. С. 1672. EDN: LSAKZT
- Шарутин В.В., Шарутина О.К., Задачина О.П. // Коорд. химия. 2003. Т. 29, № 1. С. 8. EDN: OOFNJT
- Шарутин В.В., Шарутина О.К., Платонова Т.П. и др. // Журн. общ. химии. 2001. Т. 71, № 10. С. 1637. EDN: TOZCCK
- Шарутин В.В., Пакусина А.П., Егорова И.В. и др. // Коорд. химия. 2002. Т. 28, № 12. С. 883. EDN: GXYHXK
- Шарутин В.В. Шарутина О.К., Панова Л.П. и др. // Журн. общ. химии. 2002. Т. 72, № 1. С. 45.
- Шарутин В.В., Шарутина О.К., Панова Л.П., Бельский В.К. // Коорд. химия. 1997. Т. 23, № 7. С. 513.
- Шарутин В.В., Пакусина А.П., Егорова И.В. // Коорд. химия. 2003. Т. 29, № 5. С. 336. EDN: OOFOOD
- Шарутин В.В., Шарутина О.К., Пакусина А.П. и др. // Коорд. химия. 2004. Т. 30, № 1. С. 15. EDN: OVZSPL
- Сенчурин В.С., Шарутин В.В., Шарутина О.К., Красносельская В.В. // Коорд. химия. 2023. Т. 49, № 5. С. 315. DOI: 10.31857/S0132344X22600230
- Шарутин В.В., Шарутина О.К., Сенчурин В.С., Красносельская В.В. // Журн. неорган. химии. 2022. Т. 67, № 12. С. 1773. DOI: 10.31857/S0044457X22600803
- Шарутин В.В., Шарутина О.К. // Журн. общ. химии. 2022. Т. 92, № 5. С. 812. DOI: 10.31857/S0044460X22050171
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 2. С. 41. DOI: 10.14529/chem220205
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. общ. химии. 2022. Т. 92, № 6. С. 885. DOI: 10.31857/S0044460X22060087.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. структ. химии. 2022. Т. 63, № 10. С. 99532. DOI: 10.26902/JSC_id99532.
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 1. С. 31. DOI: 10.14529/chem230103.
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 2. C. 55. DOI: 10.14529/chem230204
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Display-ing Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726
- Шарутин В.В. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 4. С. 64. DOI: 10.14529/chem220406


