Реакция пентафенилфосфора с гексахлороплатиновой кислотой
Автор: Зыкова Ална Романовна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.13, 2021 года.
Бесплатный доступ
Взаимодействием пентафенилфосфора c гексахлороплатиновой кислотой в ацетоне синтезирован гексахлороплатинат тетрафенилфосфония (1). При перекристаллизации комплекса 1 из диметилсульфоксида получен диметилсульфоксидопентахлороплатинат тетрафенилфосфония (2). Соединения охарактеризованы методами ИК-спектроскопии и рентгеноструктурного анализа. В ИК-спектрах соединений, записанных на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000-400 см-1, имеются интенсивные полосы поглощения, характеризующие валентные колебания фенильных групп. По данным рентгеноструктурного анализа, кристаллографические параметры элементарной ячейки соединений: триклинная сингония, пространственная группа симметрии (1, 2), а = 10,205(10), b = 10,970(15), c = 12,160(11)Å (1), а = 7,767(4), b = 13,307(7), c = 14,256(7) Å (2), a = 73,65(4)°, β = 80,64(3)°, g = 77,48° (1), a = 80,97(4)°, β = 88,21(4)°, g = 89,19(4)° (2), V = 1272(2) Å3 (1), 1454 (13) Å3 (2). Кристаллы комплексов 1 и 2 сформированы из тетраэдрических катионов тетрафенилфосфония и октаэдрических анионов. В катионах тетрафенилфосфония атомы фосфора имеют мало искаженное тетраэдрическое окружение (CPC 107,8(3)-113,2(3)° (1), 105,9(3)-112,9(3)° (2), длины связей P-C составляют 1,785(6)-1,805(6) Å (1), 1,783(7)-1,791(6) Å (2). Атомы платины в анионах комплексов 1 и 2 гексакоординированы. В комплексе 2 диметилсульфоксидный лиганд координируется с атомом платины посредством атома серы (2,290(2) Å). Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (CCDC 1865783, 829586; http://www.ccdc.cam.ac.uk).
Пентафенилфосфор, гидрат гексахлороплатиновой кислоты, ацетон, тетрафенилфосфоний, комплекс, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147234244
IDR: 147234244 | УДК: 546.185+546.924+547.53+548.312.2 | DOI: 10.14529/chem210103
Текст научной статьи Реакция пентафенилфосфора с гексахлороплатиновой кислотой
Взаимодействием пентафенилфосфора c гексахлороплатиновой кислотой в ацетоне синтезирован гексахлороплатинат тетрафенилфосфония (1). При перекристаллизации комплекса 1 из диметилсульфоксида получен диметилсульфоксидопентахлороплатинат тетрафенилфосфония (2). Соединения охарактеризованы методами ИК-спектроскопии и рентгеноструктурного анализа. В ИК-спектрах соединений, записанных на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000–400 см–1, имеются интенсивные полосы поглощения, характеризующие валентные колебания фенильных групп. По данным рентгеноструктурного анализа, кристаллографические параметры элементарной ячейки соединений: триклинная сингония, пространственная группа симметрии P1 (1, 2), а = 10,205(10), b = 10,970(15), c = 12,160(11)Å (1), а = 7,767(4), b = 13,307(7), c = 14,256(7) Å (2), а = 73,65(4)°, в = 80,64(3)°, Y = 77,48° (1), а = 80,97(4)°, в = 88,21(4)°, Y = 89,19(4)° (2), V = 1272(2) Å3 (1), 1454 (13) Å3 (2). Кристаллы комплексов 1 и 2 сформированы из тетраэдрических катионов тетрафенилфосфония и октаэдрических анионов. В катионах тетрафенилфосфония атомы фосфора имеют мало искаженное тетраэдрическое окружение (CPC 107,8(3)-113,2(3)° (1), 105,9(3)-112,9(3)° (2), длины связей P-C составляют 1,785(6)-1,805(6) А (1), 1,783(7)-1,791(6) А (2). Атомы платины в анионах комплексов 1 и 2 гексакоординированы. В комплексе 2 диметилсульфоксидный лиганд координируется с атомом платины посредством атома серы (2,290(2) Å). Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (CCDC 1865783, 829586; .
В литературе достаточно подробно описаны реакции дефенилирования пентафенилфосфора неорганическими кислотами, оксидами неметаллов, галогенидами металлов, карбоновыми кислотами, арилсульфоновыми кислотами, в результате которых образуются производные тетрафенилфосфония [1–12].
Соли тетраорганилфосфония привлекают внимание из-за их широкого применения в каталитических процессах в качестве растворителей и медиаторов. Так, ионные жидкости на основе тетраорганилфосфония стабильны в основных средах за счет отсутствия кислотного протона и имеют высокую термическую активность [13]. В литературе представлены дезинфицирующие свойства солей тетраорганилфосфония [14–17]. Галогениды алкилтрифенилфосфония проявляют высокую антимикробную и антимикотическую активность в отношении штаммов патогенной микрофлоры: Pseudomonas aeruginosa, Proteus mirabilis, Escherichia coli, Staphyloccocus aureus и Candida albicans [17].
Комплексы платины(IV) также нашли широкое применение в медицине в качестве противоопухолевых агентов, поэтому синтез гексагалогеноплатинатов тетрафенилфосфония открывает широкие перспективы их применения.
Экспериментальная часть
Синтез [Ph 4 P] 2 [PtCl 6 ] (1). Раствор 0,041 г (0,1 ммоль) пентафенилфосфора в 4 мл ацетона приливали к раствору 0,05 г (0,1 ммоль) гидрата гексахлороплатиновой кислоты в 4 мл ацетона. Раствор концентрировали до объема 0,5 мл, образовавшиеся кристаллы фильтровали и сушили. Выход комплекса 0,090 г (83 %), оранжевые кристаллы, т. пл. 179 °С (с разл.).
ИК-спектр, ν , см–1: 3062, 2974, 2360, 1829, 1481, 1436, 1405, 1375, 1313, 1257, 1187, 1164, 1105, 994, 935, 760, 720, 612, 527. Найдено, %: С 52,89; Н 3,84. C 48 H 40 P 2 PtCl 6 . Вычислено, %: С 53,04; Н 3,68.
Синтез [Ph 4 P][PtCl 5 (dmso)] (2). 0,05 г (0,046 ммоль) комплекса 1 растворяли в 4 мл диметилсульфоксида. После испарения растворителя наблюдали образование кристаллов. Выход комплекса 0,030 г (81 %), оранжевые кристаллы, т. пл. 194 °С.
ИК-спектр, ν , см–1: 3079, 3056, 3011, 2923, 1626, 1585, 1482, 1437, 1395, 1316, 1296, 1175, 1107, 1028, 996, 763, 757, 724, 688, 527, 433. Найдено, %: С 39,22; Н 3,76. C 26 H 26 OSPPtCl 5 . Вычислено, %: С 39,52; Н 3,29.
ИК-спектры соединений 1 и 2 записывали на ИК-спектрометре Shimadzu IRAffinity-1S в таблетках KBr в области 4000–400 см–1.
Рентгеноструктурный анализ (РСА) проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [18]. Все расчеты по определению и уточнению структур выполнены с помощью программы SHELXL/PC [19]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника (U изо (H) = 1,2U экв (C)).
Кристаллы соединения 1 оранжевые, сингония триклинная, C 48 H 40 P 2 PtCl 6 , М = 1085,91 г/моль; a = 10,205(10), b = 10,970(15), c = 12,160(11) Å, α = 73,65(4)°, β = 80,64(3)°, γ = 77,48°, V = 1272(2) Å3, ρ выч = 1,529 г/см3, Z = 1, пространственная группа P 1 . Измерено 27973 отражений, из них 5202 независимых, μ = 3,188 мм–1. Окончательные значения факторов расходимости: R 1 = 0,0474 и wR 2 = 0,1258 (по всем рефлексам), R 1 = 0,0470 и wR 2 = 0,1252 (по рефлексам F2> 2 σ (F2).
Кристаллы соединения 2 оранжевые, сингония триклинная, C26H26OSPPtCl5, М = 789,51 г/моль; a = 7,767(4), b = 13,307(7), c = 1,256(7)Å, α = 80,97(4)°, β = 88,21(4)°, γ = 89,19(4)°, V = 1454(13) Å3, ρ выч = 1,811 г/см3, Z = 2, пространственная группа P 1 . Измерено 12166 отражений, из них 7672 независимых отражений, μ = 5,449 мм–1. Окончательные значения факторов расходимости: R 1 = 0,0941 и wR 2 = 0,1963 (по всем рефлексам), R 1 = 0,0683 и wR 2 = 0,1905 (по рефлексам F2> 2 σ (F2).
Полученные структуры депонированы в Кембриджской базе кристаллоструктурных данных (CCDC 1865783, 829586 . Геометрические характеристики приведены в таблице.
Длины связей ( d ) и валентные углы ( ω ) в структурах соединений 1, 2
|
Связь, d, Å |
Угол, ω , град. |
||
|
1 |
|||
|
Pt(1) - Cl(1) |
2,309(2) |
Cl(1)Pt(1)Cl(3) |
90,88(9) |
|
Pt(1) - Cl(3) |
2,317(2) |
Cl(1)Pt(1)Cl(6) |
180,0 |
|
Pt(1) - Cl(2) |
2,326(3) |
Cl(1)Pt(1)Cl(2) |
90,21(11) |
|
Pt(1) - Cl(4) |
2,311(2) |
Cl(3)Pt(1)Cl(4) |
179,999(1) |
|
Pt(1) - Cl(5) |
2,315(2) |
Cl(2)Pt(1)Cl(5) |
180,0 |
|
P(1) - C(11) |
1,805(6) |
Cl(6)Pt(1)Cl(2) |
89,79(11) |
|
P(1) - C(31) |
1,801(6) |
Cl(1)Pt(1)Cl(4) |
89,12(9) |
|
P(1) - C(1) |
1,802(6) |
C(31)P(1)C(11) |
113,2(3) |
|
P(1) - C(21) |
1,784(6) |
C(1)P(1)C(11) |
107,9(3) |
|
C(1)P(1)C(31) |
109,1(3) |
||
|
2 |
|||
|
Pt(1)–Cl(6) |
2,311(2) |
C(14)P(1)C(15) |
105,9(3) |
|
Pt(1)–Cl(3) |
2,321(2) |
Cl(5)Pt(1)Cl(4) |
90,87(9) |
|
Pt(1)–Cl(4) |
2,324(2) |
Cl(3)Pt(1)Cl(4) |
90,03(9) |
|
Pt(1)–Cl(1) |
2,326(2) |
Cl(5)Pt(1)Cl(1) |
88,99(9) |
|
Pt(1)–Cl(2) |
2,336(2) |
Cl(3)Pt(1)Cl(1) |
91,08(9) |
Окончание таблицы
|
Связь, d, А |
Угол, го , град. |
||
|
P(1)–C(17) |
1,785(7) |
Cl(4)Pt(1)Cl(1) |
178,88(8) |
|
P(1)–C(19) |
1,786(7) |
Cl(5)Pt(1)Cl(2) |
178,73(9) |
|
P(1)–C(14) |
1,788(6) |
Cl(3)Pt(1)Cl(2) |
88,98(10) |
|
P(1)–C(15) |
1,790(7) |
S(1)Pt(1)Cl(6) |
91,94(8) |
|
Pt(1)–S(1) |
2,290(2) |
S(1)Pt(1)Cl(3) |
178,15(8) |
|
S(1)–O(1) |
1,414(8) |
S(1)Pt(1)Cl(4) |
90,57(8) |
|
S(1)–C(9) |
1,763(10) |
S(1)Pt(1)Cl(1) |
88,32(8) |
|
S(1)–C(8) |
1,826(12) |
S(1)Pt(1)Cl(2) |
89,28(9) |
Обсуждение результатов
Установлено, что взаимодействие пентафенилфосфора с эквимолярным количеством гидрата гексахлороплатиновой кислоты в ацетоне приводит к количественному образованию гексахлороплатината тетрафенилфосфония ( 1 ), который представляет собой оранжевые кристаллы, выделенные из реакционной смеси с выходом 83 %:
2Ph 5 P + H 2 PtCl 6 ^6H 2 O ^ [Ph 4 P]+ 2 [PtCl 6 ]2- + 2PhH + 6H 2 O
При растворении соединения 1 в диметилсульфоксиде происходит реакция лигандного обмена в анионе [PtCl 6 ]2– с образованием диметилсульфоксидопентахлороплатината тетрафенилфосфония ( 2 ) с выходом 81 %:
dmso
[Ph 4 P]+ 2 [PtCl 6 ]2– [Ph 4 P]+[PtCl 5 (dmso)]– + [Ph 4 P]Cl
Аналогичные реакции имеют место при взаимодействии эквимолярных количеств гидрата гексахлороплатиновой кислоты с хлоридом тетрафенилфосфония в растворе ацетонитрила и диметилсульфоксида [20] или диэтилсульфоксида (deso) [21]:
CH 3 CN, dmso
[Ph 4 P]Cl + H 2 PtCl 6 ∙ 6H 2 O [Ph 4 P]+[PtCl 5 (dmso)]– + 2HCl + 6H 2 O
CH 3 CN, deso
2[Ph 4 P]Cl + H 2 PtCl 6 ∙ 6H 2 O [Ph 4 P]+ 2 [PtCl 6 ]2– ∙ CH 3 CN + 2HCl + 6H 2 O
В ИК-спектрах соединений 1 и 2 имеются полосы поглощения фенильных групп (С - H при 2974 см–1 ( 1 ), 2923 см–1 ( 2 ); С=С при 1481 и 1436 см–1 ( 1 ) и 1482 и 1437 см–1 ( 2 )), совпадающих со справочным значением [22].
По данным рентгеноструктурного анализа катионы тетрафенилфосфония в структурах 1 и 2 находятся в малоискаженной тетраэдрической конфигурации (рис. 1).
Валентные углы CPC изменяются в интервалах 107,8(3) - 113,2(3) ° для 1 , 105,9(3)-112,9(3)° для 2 . Расстояния P - C составляют 1,785(6) - 1,805(6) А ( 1 ), 1,783(7)-1,791(6) А ( 2 ).
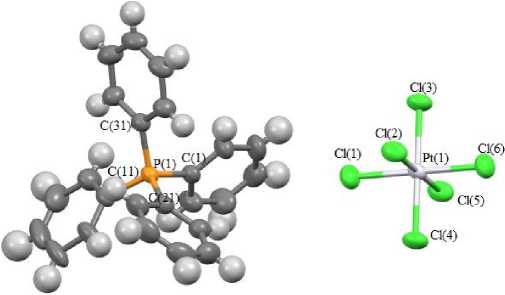
Рис. 1. Строение комплекса 1
Атомы платины в анионах комплексов 1 и 2 гексакоординированы. В кристалле 1 в центросимметричных октаэдрических анионах [PtCl6]2– транс -углы ClPtCl равны 180,0º, цис -углы (89,12(9) - 90,88(9)º) близки к идеальному значению. Длины связей Pt - Cl в 1 и 2 близки между собой и варьируются в пределах 2,309(2)–2,326(3) Å и 2,311(2)–2,336(2) Å соответственно. В кристалле 2 октаэдрическая координация искажена, так как значение транс -углов отклоняется от теоретического значения 180°: S(1)PtCl(3) 178,15(8)°, Cl(1)PtCl(4) 178,88(8)°, Cl(2)PtCl(5) 178,73(9)°. Цис -углы отличны от 90° (SPtCl 88,32(8)–91,94(8)°) и ClPtCl (88,98(10)–91,08(9)°). Связь между атомом платины и атомом серы диметилсульфоксидного лиганда Pt–S (2,290(2) Å) укорочена по сравнению с суммой ковалентных радиусов указанных атомов (2,31 Å [23]).
Параметры координированного диметилсульфоксидного лиганда отличаются от параметров свободной молекулы диметилсульфоксида. Углы OSC(8) и OSC(9) в комплексе 2 равны 111,7(6) и 111,2(6)° соответственно, в то время как в несвязанной молекуле диметилсульфоксида аналогичные углы равны 106,7(4)° и 106,8(4)° [24]. Угол С(8)SC(9) (101,9(6)°) отличается от величины этого угла в свободной молекуле диметилсульфоксида (97,4°). Длины связей S–C(8), S–C(9) (1,824(12), 1,765(10) Å) согласуются со значениями в свободной молекуле 1,771(8), 1,805(11) Å [24] и со значениями (1,775, 1,821 Å), полученными в работе [25]. При сравнении длин связей S–O наблюдаются различия между координированной и свободной молекулой диметилсульфоксида. В комплексе 2 эта связь (1,415(8) Å) существенно короче, чем в свободной молекуле (1,531 Å).
В кристаллах комплексов 1 и 2 наблюдаются водородные связи типа C–H⋅⋅⋅Cl 2,81–2,89 Å ( 1 ), 2,81–2,94 Å ( 2 ). Каждый катион в 1 имеет короткие контакты с тремя анионами, каждый катион в 2 – с четырьмя анионами. Анионы в кристаллах комплекса 2 связаны друг с другом посредством взаимодействий C(8)–H⋅⋅⋅Cl(3) 2,92 Å и C(9)–H⋅⋅⋅Cl(2) 2,79 Å (рис. 2).
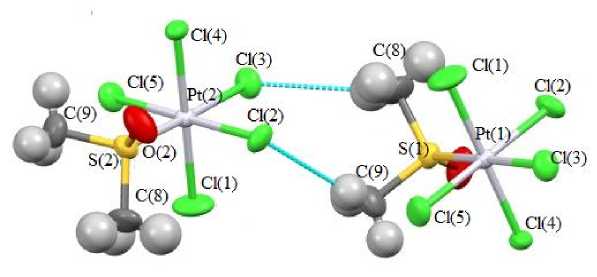
Рис. 2. Водородные связи между диметилсульфоксидными лигандами в кристалле комплекса 2
Выводы
Таким образом, дефенилированием пентафенилфосфора гидратом гексахлороплатиновой кислоты в ацетоне синтезирован гексахлороплатинат тетрафенилфосфония ( 1 ), при взаимодействии которого с диметилсульфоксидом имеет место реакция замещения атома хлора в анионе на молекулу диметилсульфоксида с образованием связи Pt-S.
Выражаю благодарность профессору В.В. Шарутину за проведенные рентгеноструктурные исследования.
Список литературы Реакция пентафенилфосфора с гексахлороплатиновой кислотой
- Разуваев, Г.А. Некоторые гетеролитические реакции пентафенилфосфора и пентафенил-сурьмы / Г.А. Разуваев, Н.А. Осанова, И.К. Григорьева // Изв. АНСССР. Сер. хим. - 1969. -№ 10.- С. 2234-2237.
- Alkyloxy- and Silyloxy-derivatives of P(V) and Sb(V) / G.A. Razuvaev, N.A. Osanova, T.G. Brilkina et al. // J. Organomet. Chem. - 1975. - V. 99, № 1. - P. 93-106.
- Шарутин, В.В. Роль стерических факторов в процессах термического разложения пента-фенильных соединений фосфора, сурьмы и висмута. Арилирование элементоорганических и органических соединений арильными производными пятикоординированного висмута / ВВ. Шарутин // Журн. общ. химии. - 1988. - Т. 58. - Вып. 10. - С. 2305-2311.
- Взаимодействие пентафенилфосфорана с параформом / В.В. Жидков, В.В. Шарутин, B.К. Бельский, Н.С. Магомедова // Журн. общ. химии. - 1995. - Т. 65, № 2. - С. 251-256.
- Шарутин, В.В. Пентафенильные соединения фосфора, сурьмы, висмута и их производные. Возможности применения в органическом синтезе: дис. ... д-ра хим. наук / В.В. Шарутин. - Иркутск, 1995. - 257 с.
- Шарутин, В.В. Термическое разложение пентафенилфосфорана в присутствии диоксида углерода / В.В. Шарутин, В.Т. Бычков, В.А. Лебедев // Журн. общ. химии. - 1986. - Т. 56, № 2. - C. 325-328.
- Шарутин, В.В. Карбоксилаты и сульфонаты тетрафенилфосфора. Синтез и строение / В.В. Шарутин, В С. Сенчурин, О.К. Шарутина // Журн. общ. химии. - 2009. - Т. 79, № 1. - С. 8089. DOI: 10.1134/S1070363209010125.
- Синтез и строение карбоксилатов тетрафенилфосфора / В.В. Шарутин, О.К. Шарутина, A.В. Рыбакова и др. // Журн. общ. химии. - 2018. - Т. 88, № 8. - С. 1308-1313. DOI: 10.1134/S0044460X18080139.
- Шарутин, В.В. Синтез и строение 2,4-динитробензолсульфоната тетрафенилфосфония / B.В. Шарутин, Н. Мукушева, А.В. Уржумова // Вестник ЮУрГУ. Серия «Химия». - 2018. - Т. 10, № 2. - С. 48-54. DOI: 10.14529/chem180206.
- Шарутин, В.В. Синтез и строение аренсульфонатов тетрафенилфосфония / В.В. Шарутин, О.К. Шарутина, Ю.О. Губанова // Изв. Высш. уч. завед. Серия: химия и хим. технология. -2019. - Т. 62, № 2. - С. 4-10. DOI: 10.6060/ivkkt.20196202.5823
- Tetraphenylphosphonium 2,4,5-Tricarboxybenzoate / G.D. Yang, J.C. Dai, W.S. Wu et al. // Acta Crystallogr. Sect. E: Struct. Rep. Online. - 2007. - V. E63. - P. 1010-1011. DOI: 10.1107/S1600536807004163.
- Muller, G. Crystal and Molecular Structure of P^^b • 0.5 THF / G. Muller, U.J. Bildmann // Z. Naturforsch., B: Chem. Sci. - 2004. - V. 59, № 11-12. - P. 1411-1414.
- Новые представители фероценсодержащих солей фосфония со стерически затрудненными катионами / Л.Р. Кадырголова, В.В. Ермолаева, М.Н. Хризанфоров и др. // Динамические процессы в химии элементоорганических соединений. -2018. - C. 109.
- Study of Quaternary Onium Salts Grafted on Polymers: Antibacterial Activity of Quaternary Phosphonium Salts Grafted on Geltype Styrene-Divinylbenzene Copolymers / А. Popa, С. Davidescu, R. Trif et al. // Reactive and Functional Polymers. - 2003. - V. 55. - P. 151-158.
- Patent JP, no. 2002308713. Amoeba-Killing Agents, Method for Controlling Amoeba and Method for Sterilizing Legionellaceae Bacterium / I. Masayo, I. Tomoo, K. Biyuuki. - 2002.
- Patent JP, no. 2000263706. Antibacterial Laminated Film / H. Satoshi, O. Hideto. - 2000.
- Галкина, И.В. Биологическая активность четвертичных солей фосфония и перспективы их медицинского применения / И.В. Галкина, С.Н. Егорова // Медицинский альманах. Фармация. - 2009. - Т. 8, № 3. - С. 142-145.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Синтез и строение комплексов платины [Ph4P]+[PtCl3(dmso)]- и [Ph4P]+[PtCl5(dmso)]- / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. неорган. химии. - 2013. - Т. 58, № 1. - С. 36-40. DOI: 10.1134/S0036023613010191.
- Ткачёва, А.Р. Реакции хлоридов тетраорганилфосфония и тетраэтиламмония с гидратом гексахлороплатиноводородной кислоты в растворах ацетонитрила и диэтилсульфоксида / А.Р. Ткачёва // Вестник ЮУрГУ. Серия «Химия». - 2019. - Т. 11, № 1. - С. 25-33. DOI: 10.14529/chem190103.
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений: справочные материалы / Б.Н. Тарасевич. - М.: МГУ имени М.В. Ломоносова, 2012. - 55 с.
- Dolomanov, O.V. OLEX2: a Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341. DOI: 10.1107/S0021889808042726.
- Thomas, R. The Molecular and Crystal Structure of Dimethylsulfoxide, (H3C)2SO / R. Thomas, C.B. Shoemaker, K. Eriks // ActaCryst. - 1966. - V. 21, № 1. - P. 12-20. DOI: 10.1107/S0365110X66002263.
- Кукушкин, Ю.Н. Химия координационных соединений / Ю.Н. Кукушкин. - М.: Высш. школа, 1985. - 456 с.


