Реакция пентафенилвисмута с флавиановой кислотой
Автор: Красносельская Вероника Валерьевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.14, 2022 года.
Бесплатный доступ
Взаимодействием эквимолярных количеств пентафенилвисмута и 2,4-динитронафтол-7-сульфокислоты (флавиановой кислоы) в бензоле получен и структурно охарактеризован после перекристаллизации из воды флавианат тетрафенилвисмута [Ph4Bi]+[OSO2C10H4O8(OH-1)(NO2)2-2,4]- (1). По данным рентгеноструктурного анализа, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD - детектор, Мо Kα-излучение, λ = 0,71073 Å, графитовый монохроматор), кристалл 1 [C34H25N2O8SBi, M 830,60; сингония триклинная, группа симметрии Р-1; параметры ячейки: a = 10,344(4), b = 11,424(8), c = 13,805(6) Å; α = 81,32(2) град., β = 77,906(14) град., γ = 79,743(19) град.; V = 1558,7(14) Å3; размер кристалла 0,25×0,13×0,08 мм; интервалы индексов отражений -15 ≤ h ≤ 15, -17 ≤ k ≤ 17, -20 ≤ l ≤ 20; всего отражений 100377; независимых отражений 11321; Rint 0,0494; GOOF 1,028; R1 = 0,0356, wR2 = 0,0710; остаточная электронная плотность 1,70/-0,94 e/Å3] содержит несколько искаженные тетраэдрические катионы тетрафенилвисмутония (СBiC 106,25(12)°-115,24(12)°, Bi-C 2,191(3)-2,203(3) Å) и флавианатные анионы. Структурная организация в кристалле 1 обусловлена слабыми межмолекулярными контактами типа О···Н (2,04-2,67 Å). Полные таблицы координат атомов, длин связей и валентных углов для структуры 1 депонированы в Кембриджском банке структурных данных (№ 2159998; deposit@ccdc.cam.ac.uk; https://www.ccdc.cam.ac.uk).
Пентафенилвисмут, 2, 4-динитронафтол-7-сульфокислота, флавианат тетрафенилвисмута, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147239537
IDR: 147239537 | УДК: 546.867+547.47+547.53.024+548.312.2 | DOI: 10.14529/chem220407
Текст научной статьи Реакция пентафенилвисмута с флавиановой кислотой
Методы синтеза и особенности строения арильных соединений висмута систематизированы и описаны в обзорах [1, 2]. Известно, что при действии кислот на пентафенилвисмут образуются соли тетрафенилвисмутония. Так, титрование пентафенилвисмута эфирным раствором хлористого водорода сопровождается исчезновением фиолетовой окраски, характерной для пентафенилвисмута, и образованием лабильных бесцветных кристаллов хлорида тетрафенилвисмута, разлагающихся при комнатной температуре до трифенилвисмута и хлорбензола [3]. Авторы работы [4] методом РСА установили его строение и нашли, что в тригонально-бипирамидальном окружении центрального атома хлор занимает аксиальное положение. Атом висмута выходит из экваториальной плоскости в направлении аксиально расположенного атома углерода. Длина связи Bi–Cl (2,9116(19) Å) превышает сумму ковалентных радиусов атомов висмута и хлора (2,50 Å), но существенно меньше суммы их ван-дер-ваальсовых радиусов (3,82 Å) [5]. Аналогичной структурой обладает и кинетически неустойчивый бромид тетрафенилвисмута, полученный из пентафенилвисмута и раствора бромистого водорода в ацетоне [6]. Взаимодействием пентафенилвисмута с эквимолярными количествами серной, 2,4-динитробензолсульфоновой и азотной кислот синтезированы гидросульфат тетрафенилвисмута (HОSO 3 )BiPh 4 , 2,4-динитробензолсульфонат тетрафенилвисмута (2,4-(NO 2 ) 2 C 6 H 3 SO 2 O)BiPh 4 и гидрат нитрата тетрафенилвисмута Ph 4 BiNO 3 ∙1/3H 2 O [ 7 ]. Кристаллические структуры соединений висмута определены методом рентгеноструктурного анализа. Если в первых двух атомы висмута пентакоординированы (окружение С 4 BiО), то в последнем присутствуют молекула нитратотетрафенилвисмута и два типа катионов тетрафенил-висмутония, один из которых координирован с нитрат-анионом и молекулой воды. С целью установления природы заместителей в ароксильной группе на значения валентных углов и длин связей при атоме висмута в ароксидах тетрафенилсурьмы был синтезирован ряд указанных производных по реакции пентафенилвисмута (толуол, 0,5-5 мин, 20 ° С) с фенолами, содержащими электроноакцепторные заместители [8]. Цвет раствора в результате взаимодействия реагентов изменялся на желтый или желто-коричневый; целевые продукты выделяли кристаллизацией из смеси бензол-октан. Ароксиды тетрафенилвисмута представляют собой устойчивые на воздухе кристаллические вещества желтого или желто-коричневого цвета, растворимые в алифатических и ароматических углеводородах. Выходы полученных ароксидов тетрафенилвисмута достигали
86 %. По аналогичной схеме были получены и бесцветные аренсульфонаты тетрафенилвисмута [9], которые можно синтезировать также по реакции перераспределения лигандов из пентафенилвисмута и бис (аренсульфонатов) трифенилвисмута [10].
Аренсульфоновые кислоты относятся к сильным кислотам (по кислотности сравнимы с серной кислотой). Неплоское тетраэдрическое строение сульфогруппы исключает π , π -сопряжение с бензольным ядром. Взаимодействие является индукционным и приводит к тому, что электрофильная сульфогруппа вызывает смещение электронов ароматического ядра. Наличие трех атомов кислорода обеспечивает эффективную делокализацию заряда в группе SO 3 и стабилизацию аниона, поэтому связь Bi - О в аренсульфонатах тетрафенилвисмута Ph4BiOSO2R имеет ионный характер. Расположение катиона и аниона в кристаллической ячейке, а также расстояние Bi ⋅⋅⋅ O (при наличии координации аниона и катиона) определяются влиянием факторов, обеспечивающих минимум энергии кристаллической решетки в целом [11].
Настоящая работа посвящена синтезу и установлению строения флавианата тетрафенилвисмута [Ph 4 Bi] + [OSO 2 C io H 4 O 8 (OH-1)(NO 2 ) 2 -2,4] - ( 1 ).
Экспериментальная часть
Элементный анализ на C и H выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108.
Температура плавления измерена на синхронном термоанализаторе Netzsch 449C Jupiter.
ИК-спектр соединения 1 записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000 - 400 см - 1.
Рентгеноструктурный анализ ( РСА ) кристалла 1 проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [12]. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC [13] и OLEX2 [14]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)). Кристаллографические данные и результаты уточнения структур приведены в табл. 1, геометрические характеристики координационного полиэдра атома сурьмы – в табл. 2. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2159998; depo-
; .
Синтез сольвата 1-окси-2,4-динитро-7-нафталин-сульфоната тетрафенилсурьмы [Ph 4 Bi] + [OSO2C10H4O8(OH-1)(NO2)2-2,4] - (1). Смесь 0,500 г (0,8 ммоль) пентафенилсурьмы и 0,270 г (0,8 ммоль) флавиановой кислоты в 15 мл бензола нагревали до образования прозрачного раствора, добавляли 2 мл октана и выдерживали 24 ч при комнатной температуре. При концентрировании раствора выделялись кристаллы, которые сушили и взвешивали. Получили 0,464 г (65 %) кристаллов 1 с т. разл. 164 °С (рис. 1).
ИК-спектр, ( ν , см - 1): 3032, 2480, 2187, 2090, 1967, 1942, 1890, 1869, 1683, 1558, 1516, 1471, 1436, 1398, 1328, 1300, 1232, 1157, 1130, 1082, 1035, 999, 731, 664, 640, 435, 418.
Найдено, %: C 49,08; H 3,10. Для C 34 H 25 N 2 O 8 SBi. Вычислено, %: C 49,12; H 3,01.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
|
Параметр |
Соединение 1 |
|
Формула |
C 34 H 25 N 2 O 8 SBi |
|
М |
830,60 |
|
Т , К |
293 |
|
Сингония |
Триклинная |
|
Пр. группа |
Р –1 |
|
a , Å |
10,344(4) |
|
b, Å |
11,424(8) |
|
c, Å |
13,805(6) |
|
α ,º |
81,32(2) |
|
β,º |
77,906(14) |
|
γ ,º |
79,743(19) |
|
V , Å3 |
1558,7(14) |
Окончание табл. 1
|
Параметр |
Соединение 1 |
|
Z |
2 |
|
ρ (выч.), г/см3 |
1,770 |
|
µ , мм–1 |
5,779 |
|
F (000) |
812,0 |
|
Размер кристалла, мм |
0,25 × 0,13 × 0,08 |
|
Область сбора данных по 2 θ , град. |
5,86 - 65,26 |
|
Интервалы индексов отражений |
- 15 ≤ h ≤ 15, - 17 ≤ k ≤ 17, - 20 ≤ l ≤ 20 |
|
Измерено отражений |
100377 |
|
Независимых отражений |
11321 |
|
R int |
0,0494 |
|
Переменных уточнения |
416 |
|
GOOF |
1,028 |
|
R -факторы по F2 > 2 σ (F2) |
R 1 = 0,0356, wR 2 = 0,0710 |
|
R-факторы по всем oтражениям |
R 1 = 0,0616, wR 2 = 0,0783 |
|
Остаточная электронная плотность (min/max), e/A3 |
1,70/ - 0,94 |
Таблица 2
|
Связь |
d , Å |
Угол |
ω , град. |
|
Bi(1) - С(21) |
2,198(3) |
C(21)Bi(1)С(1) |
110,53(12) |
|
Bi(1) - С(1) |
2,199(3) |
C(21)Bi(1)C(11) |
106,91(12) |
|
Bi(1) - С(31) |
2,191(3) |
C(1)Bi(1)C(11) |
115,24(12) |
|
Bi(1) - С(11) |
2,203(3) |
C(31)Bi(1)C(21) |
107,33(11) |
|
S(1) - C(48) |
1,783(3) |
C(31)Bi(1)С(1) |
106,25(12) |
|
S(1) - О(2) |
1,399(3) |
C(31)Bi(1)С(11) |
110,35(12) |
|
S(1) - О(1) |
1,498(6) |
O(2)S(1)С(48) |
106,78(18) |
|
S(1) - О(3) |
1,300(4) |
O(2)S(1)O(1) |
104,4(4) |
|
O(4) - С(41) |
1,328(4) |
O(1)S(1)С(48) |
104,1(2) |
|
O(6) - N(1) |
1,219(4) |
O(3)S(1)C(48) |
108,4(2) |
|
O(7) - N(2) |
1,215(4) |
O(3)S(1)O(2) |
122,7(4) |
|
O(5) - N(1) |
1,238(4) |
O(3)S(1)O(1) |
109,0(5) |
|
N(1) - C(42) |
1,458(4) |
C(22)C(21)Bi(1) |
118,7(2) |
Обсуждение результатов
Найдено, что продукт реакции пентафенилвисмута с 2,4-динитронафтол-7-сульфокислотой (флавиановой кислотой) в бензоле был получен и структурно охарактеризован после перекристаллизации из воды флавианата тетрафенилвисмута [Ph4Bi]+[OSO2C10H 4 O8(OH-1)(NO2)2-2,4] - ( 1 ).
Ph5Bi + HOSO2C10H4O8(OH-1)(NO2)2-2,4 ^ [Ph 4 Bi]+ [OSO2C10H4O8(OH-1)(NO2)2-2,4r + PhH
Бесцветные прозрачные кристаллы, устойчивые к действию влаги и кислорода воздуха, растворимые в ацетоне, ароматических углеводородах, хлороформе и диоксане, выделялись из реакционной смеси с выходом 65 %.
По данным РСА, в кристалле 1 присутствуют катионы тетрафенилвисмута, в которых атомы висмута имеют искаженную тетрагональную координацию (CBiC 106,25(12) - 115,24(12) ° и фла-вианатные анионы (рис. 2).
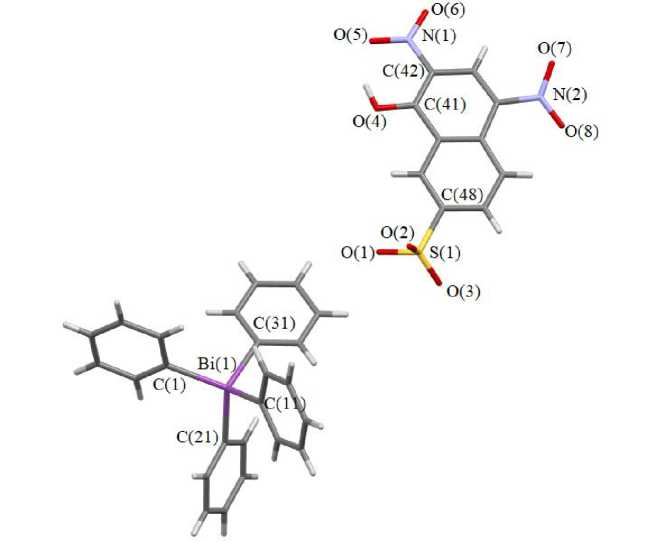
Рис. 2. Строение соединения 1
Расстояния Bi - C составляют 2,191(3) - 2,203(3) А, что значительно меньше суммы ковалентных радиусов атомов кислорода и сурьмы (2,36 Å [15]). Длины связей S=O в анионе 1 составляют 1,300(4), 1,399(3) и 1,498(6) А. Расстояние S - C равно 1,783(3) А, атом водорода гидроксильной группы координирован с атомом кислорода O(2) сульфогруппы (2,04 Å) (сумма ван-дер-ваальсовых радиусов атомов партнеров составляет 2,7 Å [16]), а плоскости нитрогрупп отклоняются от плоскости нафтола на 16,26 ° и 15,69 ° . Расстояния N - C (1,196(5) - 1,23 8(4) А) соответствуют длинам связей в NO 2 -группах [17]. Структурная организация в кристалле 1 обусловлена межмолекулярными контактами типа О···Н (2,44–2,67 Å).
Известно, что ИК-спектры сульфоновых кислот содержат характерные полосы поглощения: 1260 - 1150 см-1 (сильная полоса) и 1080 - 1010 см-1 (полоса средней интенсивности), - которые относят к асимметричным и симметричным валентным колебаниям сульфонатной группы SO 3 . Отмечено, что первая из этих полос обычно расщепляется, а положение полосы в интервале 1080—1010 см-1 практически не зависит от строения кислоты [18 - 20]. ИК-спектры комплекса 1 также содержат характерные для сульфогрупп полосы поглощения: 1233 см-1, 1130 см-1 и 1036 см-1. Очевидно, что смещение последней полосы в сторону меньших частот предполагает удлинение связей S=O и выравнивание трех связей в группе SO3, что и наблюдается в аренсульфонатном анионе.
Выводы
Установлено, что взаимодействием эквимолярных количеств пентафенилвисмута и 2,4-динитронафтол-7-сульфокислоты (флавиановой кислоты) в бензоле получен и структурно охарактеризован после перекристаллизации из воды флавианат тетрафенилвисмута [Ph 4 Bi]+[OSO 2 C 10 H 4 O 8 (OH-1)(NO 2 ) 2 -2,4] - ( 1 ), который состоит из тетраэдрических катионов тет-рафенилвисмутония и флавиат-анионов. Структурная организация в кристалле 1 обусловлена межмолекулярными контактами типа О···Н (2,44–2,67 Å).
Выражаю признательность профессору В.В. Шарутину за помощь в работе над публикацией и рентгеноструктурный анализ кристалла соединения 1 .
Список литературы Реакция пентафенилвисмута с флавиановой кислотой
- Шарутин В.В., Мосунова Т.В. Синтез, строение и применение арильных соединений висмута // Вестник ЮУрГУ. Серия: «Химия». 2020. Т. 12, № 3. С. 7-66. DOI: org/10.14529/chem2003.
- Шарутин В.В., Поддульский А.И., Шарутина О.К. Синтез, строение и применение органических соединений висмута // Коорд. химия. 2021. Т. 47. № 12. С. 719-788.
- Wittig G., Claub K. Pentaphenylwismut // J. Lieb. Ann. 1952. Vol. 59, no. 1. P. 136.
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. Синтез и строение производных тетрафенилвисмута (V) Ph4BiCl, [Ph4Bi DMSO-O] [PtBR3 DMSO-S] и [Ph4Bi]2[PtCl6] // Журн. общ. химии. 2020. Т. 65, № 11. С. 1516. DOI: 10.31857/S0044457X20110173.
- Бацанов С.С. Атомные радиусы элементов // Журн. неорг. химии. 1991. Т. 36, № 12. С. 3015-3037.
- Senchurin V.S., Sharutin V.V., Sharutina O.K. Phenyl bismuth(V) derivatives Ph3Bi[OC6H3(NO2)2-2,5]2 • 0.5PhH, Ph4BiOC6H3(NO2)2-2,5 and Ph4BiBr: synthesis and structure // Russian Journal of Inorganic Chemistry. 2020. Vol. 65, no. 3. P. 323-328. DOI: 10.1134/s0036023620030122.
- Sharutin V.V., Sharutina O.K., Senchurin V.S. Study of the crystal structures of tetraphenylbis-muth hydrosulfate, tetraphenylbismuth 2,4-dinitrobenzenesulfonate, and an adduct of tetraphenylbis-muth nitrate with water // J. Struct. Chem. 2020. Vol. 61, no. 5. P. 734-741. DOI: 10.1134/s0022476620050091.
- Tetraphenylbismuth aroxides: synthesis and structure / V.V. Sharutin, I.V. Egorova, O.K. Sharutina et al. // Russian Journal of Coordination Chemistry. 2008. Vol. 34, no. 2. P. 85-92. DOI: 10.1134/s1070328408020024.
- Синтез и строение аренсульфонатов тетрафенилвисмута / В.В. Шарутин, О.К. Шарутина, И.В. Егорова и др. // Журн. общ. хим. 1999. Т. 69, вып. 9. С. 1470-1473.
- Synthesis and structure of tetra- and triphenylbismuth arenesulfonates / V.V. Sharutin, O.K. Sharutina, I.V. Egorova, et al. // Russian Chemical Bulletin. 1999. Vol. 48, no. 12. P. 2325. DOI: 10.1007/bf02498282.
- Синтез и строение сурьма- и висмуторганических производных 4-сульфофенола и 2,4-дисульфофенола / В.В. Шарутин, И.В. Егорова, А.П. Пакусина и др. // Коорд. химия. 2007. Т. 33, № 3. С. 176-183.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: a Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. 2009. Vol. 42. P. 339-341. DOI: 10.1107/S0021889808042726.
- Covalent radii revisited / B. Cordero, V. Gómez, A.E. Platero-Prats et al. // Dalton Trans. 2008. Iss. 21. P. 2832-2838. DOI: 10.1039/B801115J.
- Consistent van der waals radii for the whole main group / M. Mantina, A.C. Chamberlin, R. Valero et al. // J. Phys. Chem. A. 2009. V. 113, no. 19. P. 5806-5812. DOI: 10.1021/jp8111556.
- Tables of bond lengths determined by X-ray and neutron diffraction. Part. 1. Bond Lengths in Organic Compounds / F.H. Allen, O. Kennard, D.G. Watson et al. // J. Chem. Soc. Perkin Trans. II. 1987, по. 12, pt. 2. P. S1-S19. DOI: 10.1039/P298700000S1.
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е.В. Гриненко, А.О. Щукин и др. СПб.: СПбГЛТА, 2007. 54 с.
- Spectral Database for Organic Compounds, SDBS. Release 2021. National Institute of Advanced Industrial Science and Technology.


