Реакция регионарных лимфатических узлов при проведении цистостомии у кроликов
Автор: Егорова Е.В., Хауни Надир, Шакирова Ф.В.
Статья в выпуске: 2 т.250, 2022 года.
Бесплатный доступ
Исследование проведено для оценки морфофункционального состояния регионарных лимфатических узлов после цистостомии, выполненной пяти кроликам. Кроме того, в послеоперационном периоде отслеживали изменения состава крови.
Лимфатические узлы, кролики, цистостомия, мочекаменная болезнь, исследования
Короткий адрес: https://sciup.org/142234203
IDR: 142234203 | УДК: 591.44:612.08:636.92
Текст научной статьи Реакция регионарных лимфатических узлов при проведении цистостомии у кроликов
В настоящее время заболевания нижних отделов мочевыводящих путей у мелких домашних животных занимают ведущее место среди незаразных болезней. В последние годы наблюдается тенденция роста количества больных уролитиазом животных [3]. Исследование увеличенных лимфатических узлов всегда таило большие трудности для морфологов [2].
Заболевание мочекаменной болезнью занимает одно из ведущих мест. Поэтому необходимо разрабатывать новые методики лечения, которые зарекомендуют себя как эффективные и менее травматичные при применении их в ветеринарной практике, чем ныне существующие.
Наиболее часто заболевание отмечается у кошек, проживающих в квартире, где они имеют высоко концентратный тип кормления, недостаточность водопоя, моциона, а также нерегулярность или отсутствие реализации половых функций. Известно, что среди клинических случаев патологий мочевыводящих путей мочекаменная болезнь обнаруживается в 7,7-11 % случаев.
Согласно данным исследования, среди кошек с патологиями мочевыводящих путей, мочекаменная болезнь была обнаружена в 15-23 % клинических случаев [6]. У кошек с признаками обструктивной уропатии этиологическим фактором в 59 % случаев являлась уретральная пробка, сформировавшаяся из песка и фибрина, в 12 % причиной развития болезни были уролиты.
Также существуют исследования, показывающие, что пропорциональная смертность у кошек, страдающих уролитиазом, выше, чем у людей и собак.
Любые экспериментальные и клинические данные требуют секционного подтверждения. Наиболее востребованной является животная модель – «кролик». Не имея базовых параметров по нормальной морфологии и физиологии иммунной системы кроликов, нельзя использовать их для моделирования и изучения механизма развития болезней различной этиологии животных и человека.
Цель исследований: дать морфофункциональную оценку состояния регионарных лимфатических узлов при проведении цистостомии у кроликов.
Для достижения цели были поставлены следующие задачи:
-
1. Изучить динамику морфологического состава крови у экспериментальных кроликов при проведении цистостомии на 30-е сутки эксперимента.
-
2. Оценить влияние оперативного вмешательства и нахождение катетера в полости мочевого пузыря на состояние мезентериальных лимфатических узлов.
Материал и методы исследований. Объектом исследования послужили 5 кроликов в возрасте 6 месяцев, живой массой 3000-3500 г., самцы, породы Советская шиншилла, полученных из питомника лабораторных животных г. Уфа. Для проведения экспериментального исследования был получен документ
Выписка из протокола № 9 Локальный Этический Комитет федерального государственного бюджетного образовательного учреждения высшего образования «Казанский государственный медицинский университет [5]. Все исследования проводили в центре экспериментальной хирургии КГАВМ.
Методы исследования:
-
- Клинические исследования. Проводили всем животным по общепринятой методике, оценивали состояние слизистых оболочек, выполняли пальпацию мочевого пузыря, определяли температуру, пульс, дыхание. При проведении предоперационного УЗИ исследования у всех 5 кроликов было обнаружено большое количество взвеси, представляющее собой кристаллы солей и клетки эпителия мочевого пузыря. Кролики являются хорошей моделью для проведения цистостомии.
-
- Гематологические исследования. У кроликов кровь брали на 1-е, и 30-е сутки из ушной вены, после оперативного вмешательства. Исследования проводили в лаборатории Веттест.
-
- Морфологические исследования. Фиксацию лимфатических узлов осуществляли в 10 % нейтральном формалине по Лилли или жидкости Карнуа. Согласно общепринятой методике, после соответствующей проводки по спиртам возрастающей концентрации, следовала обработка в ксилоле и заливка в парафин. На микротоме Leica SM 2000R изготавливали парафиновые срезы толщиной 4-5 мкм. Полученные препараты окрашивали гематоксилином и эозином, по Ван-Гизону и пиронином по Браше. Иммунно-морфологические реакции в структурных и клеточных элементах оценивали согласно алгоритму, разработанному для исследования реактивных гиперплазий лимфатических узлов [1]. Микроскопическое исследование проводили с использованием микроскопа «Carl Zeiss Axioscope».
Было изучено состояние наружных паховых и внутренних подвздошных лимфатических узлов кролика, полученные на 30 сутки после эксперимента. В качестве контроля послужили лимфатические узлы здоровых животных тех же регионов.
-
- Статистическая обработка проводилась с использованием пакета программ SPSS (ver. 18.0). Нормальность распределения данных оценивалась с помощью критерия Колмогорова-Смирнова. Сравнение показателей до и после операции проводилось с использованием парного критерия Стьюдента. Отличия полагались статистически значимыми при Р<0,05. Данные представлены в виде M±m, где M – среднее арифметическое значение, m – стандартная ошибка среднего.
Результат исследований. Все кролики хорошо перенесли оперативное вмешательство. Двигательная активность и пищевая возбудимость восстанавливалась через 6-8 часов.
В первые сутки после операции общее состояние животных было удовлетворительным. Восстановился аппетит и прием воды.
На 3-й день состояние животных улучшалось. Температура тела составляла 38,0-38,5 °C. Спустя 7 дней общее состояние животных было удовлетворительным. Сохранялась двигательная активность. Болезненность при мочеиспускании отсутствовала. Температура тела составляла 37,5-38,0 °C.
Спустя 14 дней общее состояние кроликов оценивалось как удовлетворительное. Температура тела составляла 37,5-38°C. Катетер самопроизвольно выпадал. Операционная рана заживала по первичному натяжению.
В ходе исследований на 30-ые сутки после проведения цистостомии у кроликов было выявлено, что показатели СОЭ, концентрация гемоглобина, количественный и качественный состав лейкоцитов находились в пределах референсных значений. Данная картина позволяет сделать вывод об отсутствии воспалительного процесса в органах мочевыделительной системы на отдаленных сроках после оперативного вмешательства. На 30-е сутки наблюдалась достоверная разница между показателями эритроцитов с дооперационными значениями, однако и эти показатели находились в пределах референсных значений (Таблица 1).
Таблица 1 – Количественный состав крови экспериментальных кроликов (n=5)
|
Показатель |
Референсные значения |
Данные |
||
|
ед. изм. |
норма |
до операции |
30 сутки после операции |
|
|
СОЭ |
мм/час |
1-3 |
0,5±0,0 |
1,0±0,5 |
|
Гемоглобин |
Г % |
10,05-16,0 |
15,0±1,6 |
16,4±0,5 |
|
Лейкоциты |
тыс./мкл |
2,6-9,9 |
7,2±2,1 |
8,1±1,9 |
|
Эритроциты |
млн./мкл |
5,2-7,8 |
3,7±0,5 |
5,3±0,3 (Р=0,048)* |
|
П |
% |
3,8±0,8 |
3,2±1,6 |
|
|
С |
% |
24,0±5,3 |
22,8±5,7 |
|
|
Мон |
% |
2-10 |
0,2±0,2 |
0,8±0,4 |
|
Л |
% |
25-85 |
64,2±7,5 |
69,2±6,7 |
|
Э |
% |
0-2 |
7,8±1,9 |
4,0±0,9 |
|
Б |
% |
0-4 |
0,0±0,0 |
0,0±0,0 |
* - Статистически достоверные отличия показателя до операции и на 30 сутки после операции
Морфологическая картина лимфатических узлов кролика в норме. Соединительнотканный остов лимфатического узла представлен капсульно-трабекулярным аппаратом и сетью ретикулиновых волокон, которые расположены во всех зонах узла (Рисунок 1).
Капсульно-трабекулярная основа состоит из коллагеновых, эластических и ретикулиновых волокон, а из клеточных элементов обнаруживаются фиброциты, фибробласты и единичные гладкомышечные клетки. Иногда капсульно-трабекулярная основа содержит участки жировой ткани. Соединительнотканный остов более выражен во внутренних подвздошных лимфатических узлах.
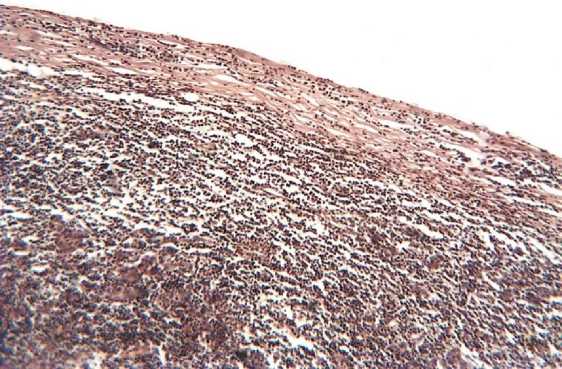
Рисунок 1 – Капсула лимфатического узла. Окраска по Ван Гизону. х 200.
Область, занимаемая кортикальной зоной, начинается сразу под субкапсулярным синусом и распространяется до паракортикальной зоны. Клеточный состав кортикальной зоны неоднороден и представлен практически всеми клеточными элементами, обнаруживаемыми в лимфоузле. Больше всего здесь средних и малых лимфоцитов, а также ретикулярных клеток. Содержание плазматических клеток в кортикальной зоне выше, чем в других структурных компонентах, за исключением мякотных тяжей, где также обнаруживается плазматизация. Между клеточными элементами кортикальной зоны часто обнаруживаются пучки коллагеновых волокон.
В кортикальной зоне находятся лимфоидные фолликулы, большая часть из которых без реактивных центров (первичные фолликулы) (Рисунок 2).
Рисунок 2
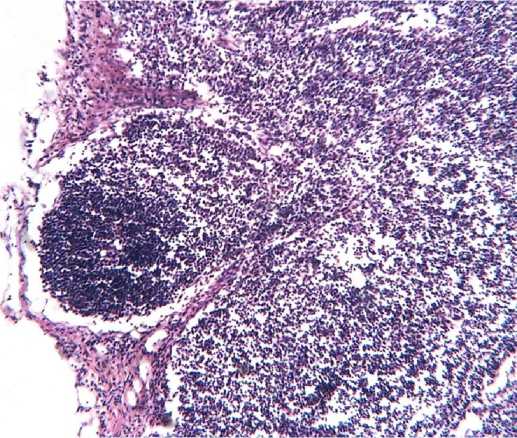
Первичный лимфоидный фолликул без реактивного центра. Окраска
гематоксилином и эозином. х 200.
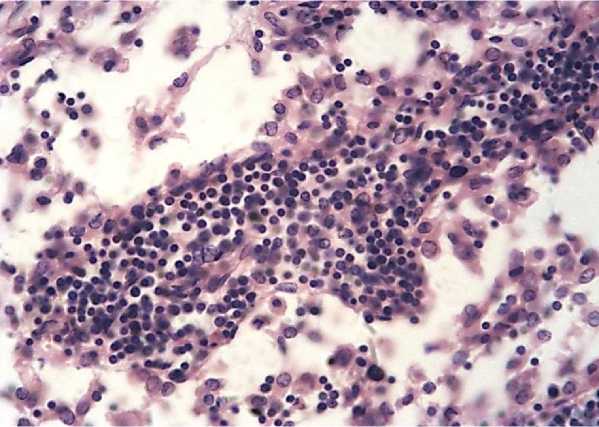
Рисунок 3 – Мякотный тяж. Окраска гематоксилином и эозином. х 400.
Клеточный состав фолликулов, не имеющих реактивных центров, в основном представлен малыми лимфоцитами. По сравнению с другими зонами здесь выше процент бластных форм, больших лимфоцитов и митотически делящихся клеток. В лимфатических узлах обнаружились отдельные фолликулы с реактивными центрами (вторичные фолликулы). По сравнению с первичными фолликулами в них увеличилось число плазмобластов и больших лимфоцитов.
Под кортикальной областью находится паракортикальная зона, клеточный состав которой характеризуется повышенным процентным содержанием малых лимфоцитов и наличием посткапиллярных венул, через которые осуществляется рециркуляция лимфоцитов.
Мякотные тяжи, которые расположены преимущественно в мозговом веществе лимфатического узла, характеризуются полиморфностью клеточного состава, с преимущественным содержанием средних лимфоцитов, ретикулярных и плазматических клеток (Рисунок 3).
Под капсулой лимфатического узла определяется субкапсулярный синус, а в корковом и мозговом веществе – промежуточные синусы (Рисунок 4).
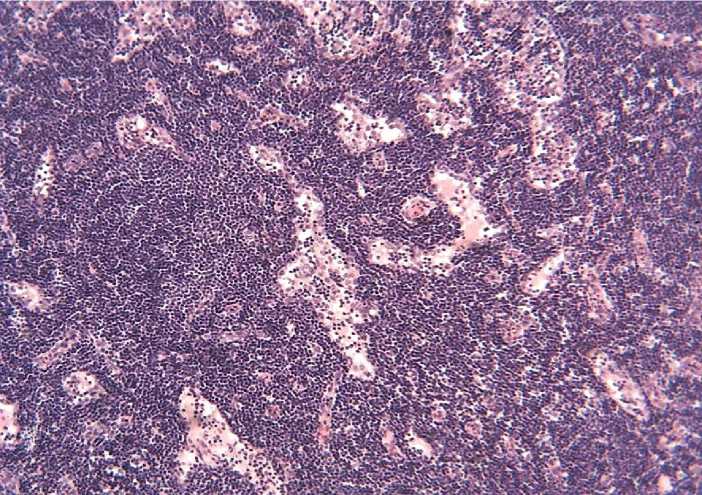
Рисунок 4 – Промежуточные синусы. Окраска гематоксилином и эозином. х 200.
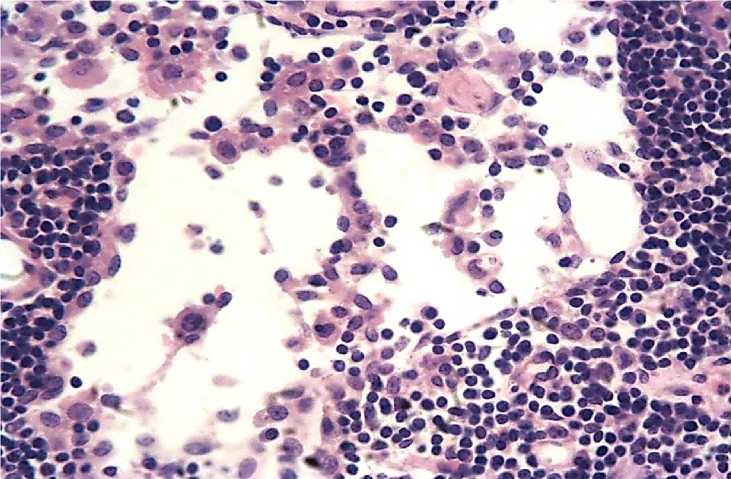
Рисунок 5 – Ретикулярные клетки синуса. Окраска гематоксилином и эозином. х 400.
Среди ретикулярных клеток в синусах иногда обнаруживаются фибробластические элементы, окруженные коллагеновыми волокнами. В подвздошных лимфатических узлах синусы несколько шире, чем в паховых.
Кровеносное микроциркуляторное русло лимфатического узла представлено как крупными сосудами артериального и венозного типа, расположенными в области ворот узла, так и артериолами, венулами и капиллярами в кортикальной зоне и мякотных тяжах.
При микроскопическом исследовании наблюдаемые на 30-е сутки эксперимента, в лимфатических узлах наружных паховых и внутренних подвздошных лимфатических узлов кролика в целом стереотипны. Прежде всего, следует отметить отсутствие воспалительной реакции. Имеет место умеренная реактивная гиперплазия, более выраженная во внутренних подвздошных лимфатических узлах.
В соединительнотканном остове лимфатических узлов отмечается незначительное утолщение капсулы и увеличение числа трабекул.
В кортикальной зоне наблюдается плазматизация и гиперплазия лимфоидных фолликулов с появлением крупных реактивных центров (Рисунок 6).
Клеточный состав таких фолликулов отличается от здоровой группы. Здесь увеличено содержание плазмобластов, больших лимфоцитов, макрофагов и митотически делящихся клеток (Рисунок 7).
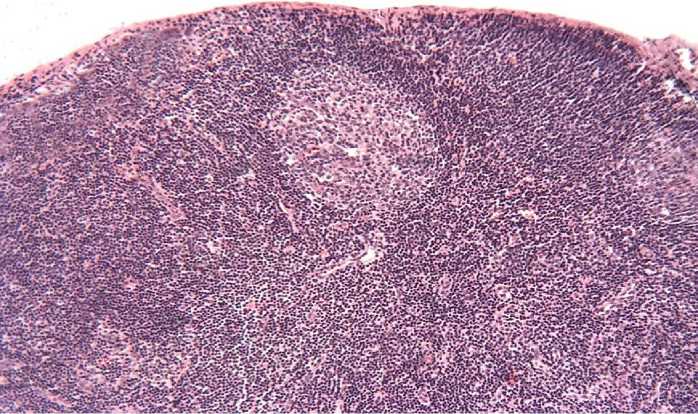
Рисунок 6 – Вторичный лимфоидный фолликул с реактивным центром. Окраска
гематоксилином и эозином. х 200.
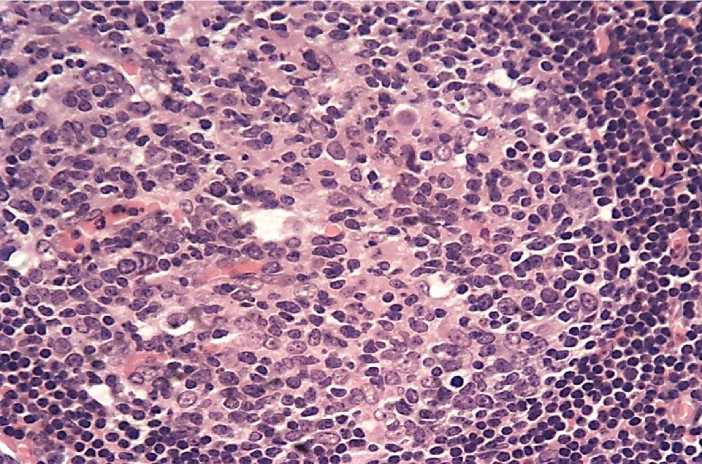
Рисунок 7 – Деталь рис. 5. Клеточный состав реактивного центра. х 400.
Определенные изменения, по сравнению со здоровыми кроликами, наблюдаются в паракортикальной зоне лимфатических узлов. Указанная зона гиперплазирована, здесь происходит увеличение числа бластных форм и нарастает содержание макрофагов, которые характеризуются наличием фагоцитированных включений в цитоплазме.
Площадь мякотных тяжей несколько уменьшается за счет увеличения площади паракортикальной зоны и синусов. Морфологические изменения, наблюдаемые в мякотных тяжах, сходны с таковыми в кортикальной зоне.
Наблюдается плазмобласттрансформация и плазматизация (Рисунок 8), а также увеличивается содержание макрофагов.
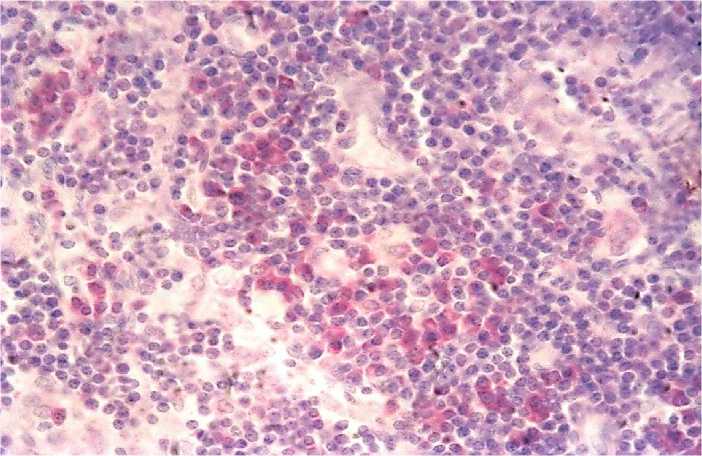
Рисунок 8 – Плазматизация мякотных тяжей. Окраска по Браше. х 400
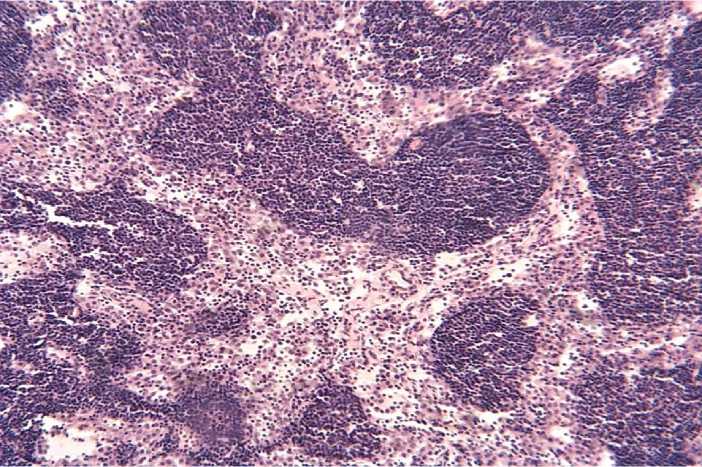
Рисунок 9 – Синусный гистиоцитоз. Окраска гематоксилином и эозином. х 200.
Синусы лимфатических узлов расширены и заполнены преимущественно плотно прилежащими друг к другу ретикулярными клетками, находящимися часто в состоянии фагоцитоза. Кроме того, здесь возросло содержание малых лимфоцитов, плазматических клеток и свободных макрофагов. Подобное состояние синусов определяется как
«синусный гистиоцитоз» (Рисунок 9).
В единичных случаях имеют место склеротические процессы или опустошение синусов и лимфостаз.
Некоторым изменениям подверглось кровеносное микроциркуляторное русло лимфатических узлов. Так, сосуды расширены и полнокровны (Рисунок 10).
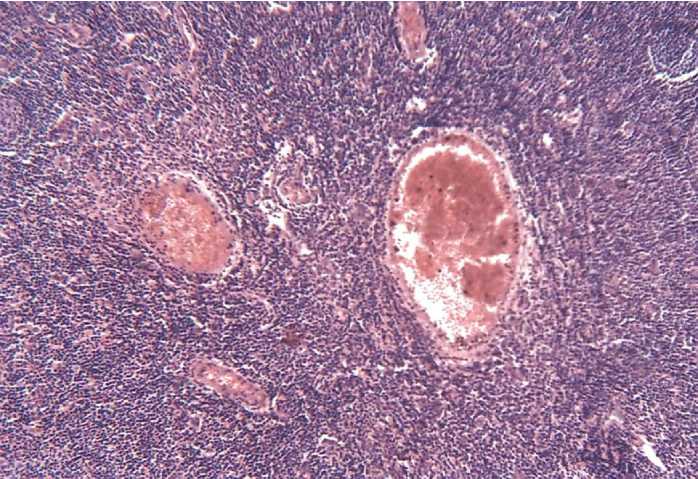
Рисунок 10 – Расширение просвета и полнокровие сосудов. Окраска гематоксилином и эозином. х 200.
Имеет место выход эритроцитов за пределы сосудистого русла, которые обнаруживаются свободно лежащими в лимфоидной ткани.
Заключение. Исходя из всех полученных данных следует, что цистостомия безопасна, не вызывает осложнений в послеоперационном периоде.
По результатам исследования крови можно сделать заключение, что незначительные изменения показателей не претерпевают значимых изменений, а находятся в пределах референсных значений.
В исследованиях лимфатических узлов имело место умеренная реактивная гиперплазия. Также регистрировалось незначительное утолщение капсулы лимфатических узлов. На основании морфологических исследований оперативное вмешательство и нахождение катетера в полости мочевого пузыря не влияют на структурные изменения в лимфатических узлах. А выявленные реактивные изменения, являются ответом на оперативное вмешательство и хирургическую травму.
Резюме
Исследование проведено для оценки морфофункционального состояния регионарных лимфатических узлов после цистостомии, выполненной пяти кроликам. Кроме того, в послеоперационном периоде отслеживали изменения состава крови.
Список литературы Реакция регионарных лимфатических узлов при проведении цистостомии у кроликов
- Бакланова, Д. А. Морфологические изменения в регионарных лимфатических узлах при имплантации остеофиксаторов с покрытием нитридами титана и гафния / Д. А. Бакланова, Ф. В. Шакирова, И. Ф. Ахтямов, Э. Б. Гатина // Вопросы нормативно-правового регулирования в ветеринарии. - 2013. - № 3. - С. 18-20.
- Белянин, В. Л. Диагностика реактивных гиперплазий лимфатических узлов / В. Л. Белянин, Д. Э. Цыплаков-СПб- Казань, 1999. - 328 с.
- EDN: VLSHVV
- Медведева, Л. В. Применение клеевой композиции "Сульфакрилат" при операциях на мочевом пузыре у кошек и собак / Л. В. Медведева, П. Б. Шестун // Вестник Алтайского государственного аграрного университета. - 2011. - № 6. - С. 73-77.
- Corgozinho, K. B. Catheter-induced urethral trauma in cats with urethral obstruction / K. B. Corgozinho, H. J. M. De Souza, A. N. Pereira [et al.] Journal of Feline Medicine and Surgery 9. - 2007. - P. 481-486.
- Sharirova, F. The cystostomy operation with new catheter for cats. / F. Sharirova, N. Khaouni, B. Tamimadarov, O. Gracheva // Ataturk University Journal of Veterinary Sciences. - ISSN 1306-6137.
- Griffin, D. W. Prevalence of bacterial urinary tract infection after perineal urethrostomy in cats / D. W. Griffin, C. R. Gregory // Journal of the American Veterinary Medical Association 200. - 1992. -P. 681-684.


