Реактивность клеток перитонеальной жидкости при моделировании асептического воспаления
Автор: Годовалов А.П., Морозов И.А., Карпунина Т.И.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Патологическая физиология
Статья в выпуске: 3 т.16, 2020 года.
Бесплатный доступ
Цель: оценить особенности ответной реакции перитонеальных лейкоцитов и тучных клеток (ТК) крыс при воспроизведении экспериментального асептического воспаления в апробируемой модели. Материалы и методы. Крысам 1-й группы (л=7) внутрибрюшинно вводили 1%-й тиогликолевый бульон, животным 2-й (л=7) -тот же бульон, предварительно разведенный 1:10. Крысы контрольной группы (п=8) получали равный объем физиологического раствора. После выведения животных из эксперимента в перитонеальной жидкости подсчитывали количество лейкоцитов и оценивали их жизнеспособность. Дегрануляцию ТК детектировали в препаратах, окрашенных толуидиновым синим. Все ТК делили по степени дегрануляции. Результаты. С помощью раствора тиогликолята натрия воспроизведена модель асептического воспаления брюшины. Установлено, что число лейкоцитов перитонеальной жидкости, особенно количество нежизнеспособных клеток, повышается более чем в 2 раза при увеличении концентрации элистирующего агента (р
Воспаление, дегрануляция, перитонеальная полость, тучные клетки
Короткий адрес: https://sciup.org/149135458
IDR: 149135458 | УДК: 616-002-07:616.155.36
Текст научной статьи Реактивность клеток перитонеальной жидкости при моделировании асептического воспаления
тем с каждым годом увеличивается встречаемость воспалительных заболеваний, при которых симптоматика выражена слабо или стерта, в связи с чем несвоевременность обращения пациентов за специализированной медицинской помощью усложняет выявление основного этиологического фактора, об- условившего воспалительный процесс. Хотя патогенез воспалительных заболеваний инфекционной этиологии описан достаточно детально, в то же время исключить действие асептического компонента, который часто возникает при травмах и аллергиза-ции, представляет определенные трудности. Интенсивность ответной реакции организма коррелирует со степенью активности ряда иммунокомпетентных клеток, среди которых ключевое место отводится моноцитарно-макрофагальному звену [1, 2]. Вместе с тем относительно мало внимания уделяется роли ТК при развитии асептического воспаления, хотя в исследованиях [3] указывается на их способность реагировать на микробные клетки и метаболиты путем секреции медиаторов без дегрануляции, что предполагает участие ТК в иммунном ответе.
В настоящее время разработано несколько моделей экспериментального воспаления у лабораторных животных. Привлекают внимание модели с использованием элистирующих агентов, основанных на методике [4], когда, например, крахмал или пептон вводят животным в брюшную полость. В экспериментальной фармакологии чаще используют в качестве раздражителя 3%-ю тиогликолевую среду [5], преследуя цель получения большого количества макрофагов для оценки их функциональной активности. Во всех случаях применение такого приема прежде всего рассчитано на получение в достаточном количестве клеток моноцитарно-макрофагального звена и нейтрофилов. Однако при этом практически не оценивают активность ТК, которую традиционно анализируют с помощью гистологической техники и приготовления серийных срезов, что не позволяет получить клетки в виде суспензии и изучить их активность в разных, в том числе экспериментальных условиях. В настоящем исследовании реализован подход с введением в брюшную полость экспериментальных крыс тиогликолята натрия, в том числе для накопления и получения в достаточном количестве ТК, с возможностью их дальнейшего изучения.
Цель исследования — оценить особенности ответной реакции перитонеальных лейкоцитов и ТК крыс при воспроизведении экспериментального асептического воспаления в апробируемой модели.
Материал и методы. Все исследования проведены на 22 белых крысах-самцах, средняя масса которых составляет 313±4 г. Работа проводилась с учетом требований Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в научных целях, Хельсинкской декларации 1975 г. (пересмотр 1983 г.). Крысам первой экспериментальной группы (n=7) внутрибрюшинно вводили 10 мл 1 %-го тиогликолевого бульона, животным 2-й группы (n=7) — равный объем тиоглико-левого бульона, предварительно разведенного 1:10. Крысы контрольной группы (n=8) получали 10 мл физиологического раствора NaCl. Все исследования проводили с соблюдением правил обращения с экспериментальными животными в условиях вивария. Выведение животных из эксперимента осуществляли передозировкой эфирного наркоза по истечению пяти дней, когда наблюдается максимально выраженный воспалительный ответ [6, 7]. В перитонеальную полость крыс вводили 10 мл раствора Хенкса без фенолового красного с добавлением гепарина (40 ЕД/мл), после чего собирали жидкость в пробирки. В перитонеальной жидкости подсчитывали количество лейкоцитов в камере Горяева. Жизнеспособность клеток определяли в тесте окраски трипа- новым синим. Для оценки состава отдельных типов лейкоцитов готовили препараты для микроскопии, которые фиксировали раствором Май-Грюнвальда и окрашивали по методу Романовского — Гимзы. Дегрануляцию ТК детектировали в препаратах, окрашенных толуидиновым синим. Все ТК делили по степени дегрануляции — без признаков дегрануляции, с частичной и полной дегрануляцией.
Статистический анализ проводился с помощью программного пакета Statistica 6.0. Вычислялась средняя арифметическая величина ( М ) и стандартная ошибка средней арифметической ( m ). Для проверки нормальности распределения использован критерий Шапиро — Уилка. В случае распределения, приближенного к нормальному, использовали t -критерий Стьюдента, в остальных — применяли критерий Манна — Уитни для оценки значимости различий. Критический уровень значимости ( p ) при проверке статистических гипотез принимался равным 0,05.
Результаты. С помощью тиогликолевого бульона воспроизведена модель асептического воспаления брюшины. У первой группы экспериментальных животных наблюдали развитие острого воспалительного процесса с резким снижением двигательной активности, нарушением грумминга, изменением пищевого поведения в виде снижения объема потребляемой пищи, а также гипертермией, напряженностью брюшной стенки, болезненностью при пальпации. При вскрытии серозные покровы брюшины гипере-мированы, сосуды полнокровны, близлежащие ткани отечны с явлениями лейкоцитарной инфильтрации. Отмечается увеличение Пейеровых бляшек и визуализация брыжеечных лимфатических узлов. У крыс 2-й группы отмечена менее выраженная клиническая картина ‒ симптомы проявлялись только частично и в умеренной степени. Так, объем съеденной пищи существенно не отличался от такового в контрольной группе, не установлено снижения двигательной активности и болезненности при пальпации брюшной стенки. В контрольной группе симптомов воспаления не выявлено.
Установлено статистически значимое увеличение числа лейкоцитов в перитонеальной жидкости экспериментальных животных при введении элисти-рующего агента. У крыс 1-й группы число клеток составило 23,2±1,6, у животных 2-й группы — 14,6±3,1, а в контроле — 8,1±0,3 тыс. в 1 мкл ( p <0,05 к 1-й и 2-й группам). Кроме этого, с увеличением тяжести воспаления увеличивалось число нежизнеспособных лейкоцитов (рис. 1). Состав клеток перитонеальной жидкости у крыс 2-й группы статистически значимо не отличался от такового в контрольной группе, одна-
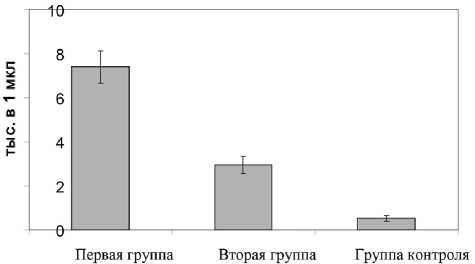
Рис. 1. Число нежизнеспособных перитонеальных лейкоцитов крыс при разной степени асептического воспаления ко выявлена тенденция к снижению числа макрофагов (рис. 2). У крыс 1-й группы происходило значимое повышение числа ТК более чем в 3 раза (35,5±4,6%, а в контроле — 9,0±2,2%; p<0,05), макрофагов и нейтрофилов, а также снижение в 2 раза количества лимфоцитов (p<0,05; рис. 2). У экспериментальных животных количество ТК, и особенно с признаками дегрануляции, статистически значимо увеличивалось более чем в 2 раза по мере увеличения тяжести воспалительного процесса (p<0,05; рис. 3).
Обсуждение. В ходе экспериментальных исследований апробирована эффективная модель, пригодная для создания воспалительного процесса, когда можно регулировать его тяжесть, что особенно важно для изучения заболеваний, протекающих субклинически или с минимумом клинических признаков. Кроме того, такая модель позволяет получить относительно большое количество клеток перитонеальной жидкости для изучения их функциональной активности (жизнеспособности или фагоцитарной способности), что практически не реализуемо при гистологических или цитохимических исследованиях.
Показано, что с увеличением тяжести воспаления растет число лейкоцитов в жидкости брюшной полости, а также содержание этих клеток с поврежденной мембраной, что указывает на утерю ими не только функциональной активности, но и жизнеспособности. Полученные данные о количественной и качественной характеристиках клеточной популяции в очаге асептического воспаления (перитонеальная жидкость) совпадают с результатами ряда исследований [6, 8], где использовали другие модели асептического воспалительного процесса, что дает основания утверждать об адекватности использованной нами модели и однозначности результатов.
Секреция медиаторов ТК при асептическом воспалении, как можно предположить, занимает одно из ключевых мест в патогенезе, и ее степень коррелирует с выраженностью клинической картины. Известно, что триптаза и химаза гранул ТК оказывают влияние на нервные окончания, вызывая чувство боли, а гистамин участвует в развитии сосудистых реакций и отека. Высвобождаемые в результате эк-зоцитоза биогенные амины, лизосомальные ферменты, протеазы, нейромедиаторы и нейропептиды раздражают брюшную стенку и оказывают влияние на различные типы рецепторов [2, 3]. Все эти феномены характерны и для воспалительных процессов неаллергической природы. В конечном итоге именно эти процессы формируют описанную клиническую картину у экспериментальных животных. Примечательно, что во 2-й группе животных с не столь выраженным клинически воспалением и дегрануляция ТК соответственно была ниже. Все это свидетельствует о существенном вкладе медиаторов ТК в развитие клинической картины воспалительного процесса. Более того, поскольку в одной и той же клетке наблюдали гранулы разных размеров, что обусловлено их неодновременным формированием, можно предположить, что выраженность воспалительного процесса зависит не только от числа ТК, но и от степени зрелости их гранул. Согласно данным литературы о том, что рецепторы ТК FcγR обладают сравнительно меньшей афинностью, чем FcεRI, можно предположить, что активация через FcγR краткосрочно и обратимо меняет функциональное состояние и реактивность ТК [9, 10]. В целом представляется, что при асептическом воспалении ТК активируются по IgE-независимому пути, когда сигнализация идет
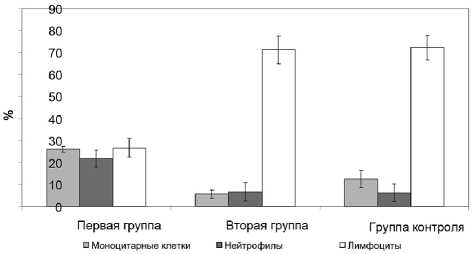
Рис. 2. Состав клеток перитонеальной жидкости крыс с экспериментальным асептическим воспалением
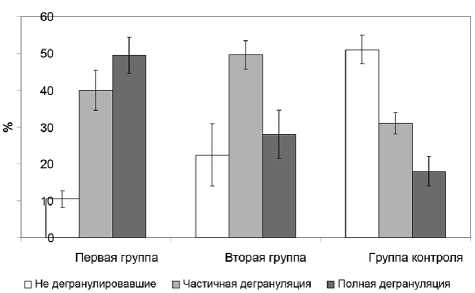
Рис. 3. Распределение тучных клеток перитонеальной жидкости крыс по степени дегрануляции через FcγR и РRRs, которая, в свою очередь, не приводит к полной дегрануляции и цитолизу ТК, а наоборот, к более медленной секреции и частичной дегрануляции.
Заключение. Таким образом, варьируя концентрацию тиогликолята натрия в бульоне при введении в брюшную полость экспериментальных животных можно воспроизвести модель асептического воспаления разной степени выраженности и получить достаточный объем клеток и жидкости для их дальнейшего изучения. Увеличение тяжести воспалительного процесса приводит к повышению числа лейкоцитов, особенно нежизнеспособных. Клиническая картина воспалительного процесса нарастает с увеличением степени дегрануляции ТК, что отражает их участие в развитии патологического процесса. Поскольку перитонеальная жидкость содержит в большом количестве разнообразные клетки иммунной системы и целый спектр гуморальных факторов, которые доступны для исследователя, представляется целесообразным расширение области использования апробированной экспериментальной модели.
Список литературы Реактивность клеток перитонеальной жидкости при моделировании асептического воспаления
- Морозов И.А., Карпунина Т.И., Годовалое А.П. Кадаверин как регулятор активности про- и эукариотических клеток. Аллергология и иммунология 2018; 3 (19): 149-50.
- Melnicoff MJ, Horan РК, Morahan PS. Kinetics of changes in peritoneal cell populations following acute inflammation. Cellular Immunology 1989; 118(1): 178-91.
- Laurin L, Brissette M, Lepage S, Cailhier J. Regulation of Experimental Peritonitis: A Complex Orchestration. Nephron Experimental Nephrology 2012; (120): 41-6.
- Hogg N, Parish С Surface antigens of the murine cytostatic peritoneal macrophage. Immunology 1980; 41 (1): 187-9.
- Касторнова A.E., Крышень К.Л., Мужикян А.А. и др. Модель острого воспаления: каррагениновый воздушный мешочек. Международный вестник ветеринарии 2015; (2): 78-87.
- Серебренникова С.Н., Семинский И.Ж., Клименков И.В., Семенов Н.В. Клеточные реакции и механизмы их регуляции в очаге экспериментального асептического воспаления. Бюллетень ВСНЦ СО РАМН 2012; (3): 309-11.
- Лебедева A.M., Муслимов С.А., Мусина Л.А. Экспериментальное моделирование хронического воспаления и фиброза. Биомедицина 2013; (4): 114-23.
- Jiang YC, Ye F, Tang ZX. Research progress of mast cell activation-related receptors and their functions. Sheng Li Xue Bao2019;71 (4): 645-56.
- Seneviratne S, Maitland A, Afrin L. Mast cell disorders in Ehlers-Danlos syndrome. Am.J. Med. Genet. О Semin. Med. Genet 2017; 175 (1): 226-36.
- Xu L, Cai Z, Yang F, Chen M. Activation-induced upregulation of MMP9 in mast cells is a positive feedback mediator for mast cell activation. Mol.Med. Rep 2017; 15 (4): 1759-64.


