Рецепторы соматостатина как потенциальная терапевтическая мишень в лечении распространенного адренокортикального рака. Клинический случай
Автор: Коломейцева Алина Андреевна, Делекторская Вера Владимировна, Орел Надежда Федоровна, Емельянова Галина Сергеевна, Бохян Ваган Юрикович, Феденко Александр Александрович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 2 т.17, 2018 года.
Бесплатный доступ
Актуальность. Адренокортикальный рак (АКР) - редкая злокачественная опухоль, исходящая из коркового слоя надпочечника. Терапевтические возможности при диссеминированном АКР ограничены. Изучение новых, более эффективных лекарственных комбинаций, а также поиск молекулярнобиологических мишеней, определяющих чувствительность опухоли к проводимому лечению, являются актуальной задачей. Цель исследования - изучить экспрессию SSTR 2А и 5-го подтипов в опухолевых образцах пациентов с АКР и возможность применения пролонгированных АС в лечении распространенного АКР. материал и методы. Отделением химиотерапии совместно с отделом паталогической анатомии опухолей человека ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России была проведена работа по определению экспрессии рецепторов соматостатина 2А и 5-го подтипов (SSTR 2А и SSTR 5) с помощью иммуногистохимического (ИГХ) исследования образцов ткани опухоли у пациентов с АКР, а также была изучена возможность применения пролонгированных аналогов соматостатина (АС) в лечении распространенного АКР. Результаты. ИГХ исследованию были подвергнуты образцы ткани опухоли коры надпочечника от 20 больных распространенным АКР. В исследованной группе пациентов АКР у 10 больных (50 %) определялся негативный (0) ИГХ статус рецепторов соматостатина 2А и 5-го подтипов в ткани опухоли. В 10 наблюдениях (50 %) в клетках опухоли выявлялась экспрессия рецепторов соматостатина 2А и/или 5-го типов различной степени выраженности. Уровень экспрессии рецепторов оценивался как низкий при слабой иммунореактивности и как высокий - при умеренной и сильной мембранной иммунореактивности. Высокий уровень экспрессии рецепторов соматостатина в опухоли определялся у 7 больных (35 %) из 20 исследованных наблюдений АКР. Заключение. Определение экспрессии SSTR 2А и SSTR 5 в опухолевой ткани больных АКР, а также изучение возможности применения пролонгированных АС в лечении больных распространенным АКР с высоким уровнем экспрессии рецепторов в опухоли является перспективным направлением, однако требуются дальнейшие исследования на большей популяции больных.
Рецепторы соматостатина, аналоги соматостатина
Короткий адрес: https://sciup.org/140254169
IDR: 140254169 | УДК: 616.45-006.04-08:577.17 | DOI: 10.21294/1814-4861-2018-17-2-111-117
Текст научной статьи Рецепторы соматостатина как потенциальная терапевтическая мишень в лечении распространенного адренокортикального рака. Клинический случай
В последние годы все большее внимание он‑ кологов сосредоточено на изучении редких форм злокачественных новообразований. Зачастую эти опухоли имеют агрессивное течение и неблагопри‑ ятный прогноз. Одним из таких заболеваний явля‑ ется АКР – злокачественная опухоль, исходящая из коркового слоя надпочечника. Заболеваемость АКР в мире составляет 0,7–2 новых случая на 1 млн на‑
селения [1]. В Российской Федерации АКР входит в список орфанных болезней. Эпидемиологические данные об онкологической заболеваемости в Рос‑ сии отсутствуют.
АКР является одной из самых злокачественных опухолей человека, на него приходится от 0,04 до 0,2 % всех случаев смерти от рака. Женщины болеют несколько чаще, чем мужчины. Пик заболе‑ ваемости приходится на возрастную группу 40–50 лет. Около 60–70 % опухолей взрослых являются гормонально активными. Лишь у 35 % пациентов АКР выявляется на ранних стадиях. У остальных пациентов диагностируется либо местнораспро‑ страненный процесс с инвазией в окружающие ткани (18 %), либо исходно определяются отда‑ ленные метастазы (47 %) [2].
Лечение АКР представляет сложную задачу. Только хирургический метод без интраоперацион‑ ного повреждения капсулы опухоли позволяет из‑ лечить больного. Однако даже в случае выполнения радикальной операции и добавления в послеопера‑ ционном периоде ингибитора стероидогенеза ми‑ тотана в качестве адъювантной терапии зачастую возникают рецидивы заболевания. Терапевтические возможности при диссеминированном АКР огра‑ ничены. В качестве монотерапии при небольшой опухолевой нагрузке может применяться митотан, который обладает как антистероидогенным, так и противоопухолевым эффектом [3]. При исходной обширной диссеминации процесса применяется комбинация митотана и противоопухолевых пре‑ паратов этопозида, доксорубицина и цисплатина (режим EDP‑M). Однако эффективность ее не пре‑ вышает 23 % [4, 5]. Во второй линии химиотерапии может применяться комбинация фторпиримидинов и гемцитабина на фоне приема митотана, однако объективный эффект, по данным исследования II фазы, получен только у 7 %, стабилизация болезни наблюдалась у 39,3 % больных [6]. Таким образом, ограниченное число цитостатических препаратов, эффективных при АКР, умеренная чувствитель‑ ность клеток опухоли к противоопухолевой те‑ рапии диктуют необходимость изучения новых, более эффективных лекарственных комбинаций, а также поиска молекулярно‑биологических ми‑ шеней, определяющих чувствительность опухоли к проводимому лечению.
Рецепторы к соматостатину (SSTR 1–5 под‑ типов) – это семейство G‑белок‑сопряженных рецепторов, посредством которых соматостатин реализует свои биологические эффекты в орга‑ низме. Рецепторы соматостатина присутствуют во многих опухолевых клетках, секретирующих гормоны. Наиболее часто избыточная экспрессия соматостатиновых рецепторов определяется на поверхности клеток нейроэндокринных опухолей. Рецепторы соматостатина являются мишенью для синтетических аналогов соматостатина (АС). Взаи‑ модействуя с определенным подтипом рецепторов,
АС не только подавляют избыточную секрецию гормонов, но и оказывают антипролиферативный эффект, тормозят ангиогенез, индуцируют апоптоз клеток опухоли [7–9]. В России в клинической практике широко применяются два аналога сомато‑ статина пролонгированного действия – октреотид и ланреотид. Оба препарата обладают высокой аффинностью к рецепторам SST2 и SST5.
Ряд исследований показывает, что клетки рака коры надпочечника экспрессируют рецепторы со‑ матостатина и могут представлять собой мишень для АС, расширяя терапевтические возможности при распространенном АКР [10, 11]. В 2017 г. в материалах ENETS отечественными учеными была опубликована работа, посвященная изучению экспрессии SSTR 2‑го и 5‑го подтипов на 10 после‑ операционных образцах опухолевой ткани больных АКР. Диффузная или фокальная экспрессия SSTR 2 и/или SSTR 5 определялась в 7 из 10 образцов (70 %). Экспрессия SSTR 2 была обнаружена в 3 (30 %), SSTR 5 – в 6 (60 %) случаях. Коэкспрессия рецепторов данных типов наблюдалась в 2 (20 %) образцах [12].
Отделением химиотерапии совместно с отделом патологической анатомии опухолей человека ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России проводится работа по определению экс‑ прессии SSTR 2А и 5‑го подтипов в опухолевых образцах пациентов с АКР, а также изучению воз‑ можности применения пролонгированных АС в лечении распространенного АКР.
Материал и методы
С целью выявления экспрессии рецепторов соматостатина 2А и 5‑го подтипов проведено иммуногистохимическое (ИГХ) исследование образцов ткани опухоли от 20 больных распро‑ страненным АКР (табл. 1). Для изучения экспрес‑ сии рецепторов соматостатина был использован операционный материал опухолей больных АКР. ИГХ исследование выполнялось на серийных па‑ рафиновых срезах опухолевой ткани с помощью биотин‑стрепавидинового иммунопероксидазного метода.
Для ИГХ анализа экспрессии рецепторов со‑ матостатина в клетках опухоли были использо‑ ваны моноклональные антитела к SSTR2A (клон UMB‑1) и SSTR5 (клон UMB‑4) («Epitomics»). При оценке иммунореактивности учитывалось только мембранное окрашивание опухолевых клеток. Реакция считалась негативной (0) при отсутствии окрашивания и позитивной (+) при окрашивании более 10 % опухолевых клеток. При этом позитив‑ ную иммунореактивность оценивали как 1+ при слабом окрашивании мембран, наблюдаемом при большом увеличении микроскопа (×400), 2+ при сильном (умеренном), но не полном мембранном окрашивании и 3+ при сильном окрашивании всей мембраны опухолевых клеток [13]. Оценка реак‑ таблица 1
характеристика пациентов с распространенным АКР
|
Параметры |
Число больных (n=20) |
|
Пол |
|
|
Мужчины |
10 (50 %) |
|
Женщины |
10 (50 %) |
|
Средний возраст (min‑max), лет |
48 ± 11,9 (27–68) |
|
ECOG |
|
|
0 |
6 (30 %) |
|
1 |
13 (65 %) |
|
2 |
1 (5 %) |
|
Количество проведенных линий химиотерапии |
|
|
1 линия |
14 (70 %) |
|
2 линии |
6 (30 %) |
|
Источник исследуемого образца опухоли |
|
|
Первичная опухоль |
11 (55 %) |
|
Метастатические узлы |
9 (45 %) |
Результаты ИГх анализа экспрессии sstr2a и sstr5
таблица 2
Результаты
У 10 больных (50 %) ИГХ статус рецепторов соматостатина 2А и 5‑го подтипов в ткани опухоли определялся как негативный. Из них в 8 образцах выявлялась зернистая цитоплазматическая реак‑ ция, возможно, за счет интернализации рецепто‑ ров. В оставшихся 10 опухолевых образцах (50 %) определялась экспрессия рецепторов соматоста‑ тина 2А и/или 5‑го подтипов, при этом уровень мембранной иммунореактивности значительно варьировал (от слабо‑ до сильнопозитивного). Под‑ робная характеристика результатов ИГХ‑анализа экспрессии SSTR2A и SSTR5 представлена в табл. 2. Высокий уровень экспрессии рецепторов соматостатина 2A и/или 5‑го подтипов в опухоли (2+/3+) выявлен у 7 (35 %) больных АКР, включая двух пациентов (10 %) с сильнопозитивной реак‑ цией и 5 больных (25 %) с умеренно позитивной реакцией в клетках опухоли.
Приводим клинический случай применения аналогов соматостатина у пациентки с распростра‑ ненным АКР и позитивным статусом экспрессии рецепторов соматостатина 2A и 5‑го подтипов в ткани опухоли надпочечника.
Пациентке Е., 61 год, в клинике факультетской хирургии им. Н.Н. Бурденко в ноябре 2011 г. по поводу рака коры левого надпочечника была выполнена адреналэктомия слева, тромбэктомия из левой почечной вены. В июле 2010 г. по поводу рецидива заболевания выполнено удаление рецидивного узла в забрюшинном пространстве, нефрэктомия слева. В марте 2011 г. выявлен продолженный рост опухоли. С апреля 2011 г. по март 2012 г. получала митотан со стабилизацией процесса. В июле и октябре 2012 г. по поводу прогрессирования заболевания в брюшной полости и забрюшинном пространстве выполнено удаление рецидивных опухолевых узлов. С мая по октябрь 2013 г. по поводу очередного прогрессирования в брюшной полости, появления очагов в легких проведено 5 курсов полихимиотерапии по схеме EDP-M: этопозид + доксорубицин + цисплатин на фоне непрерывного приема митотана со стабилизацией опухолевого процесса. В феврале–апреле 2014 г. выявлен рост и появление новых метастазов в брюшной полости и легких, по поводу чего было выполнено последовательное удаление рецидивных узлов в брюшной полости, торакоскопическая резекция
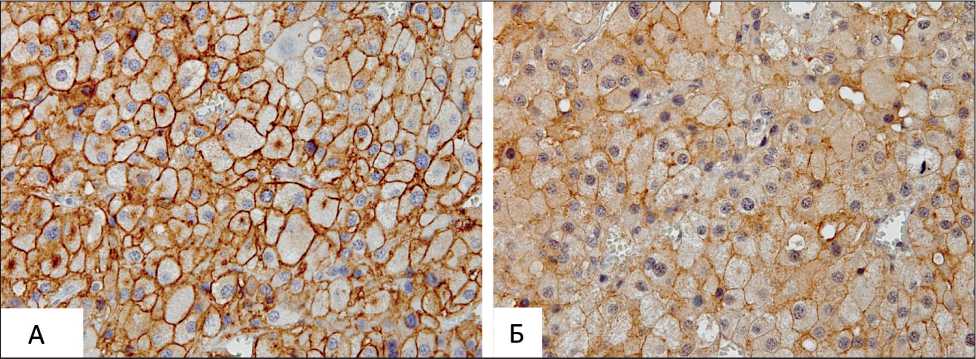
Рис. 1. Микрофото. Экспрессия рецепторов соматостатина в клетках АКР:
А) экспрессия SSTR2A в клетках опухоли в виде сильной полной мембранной реакции (3+); Б) экспрессия SSTR5 в клетках опухоли в виде умеренной неполной мембранной реакции (2+), ×400. Ядра клеток докрашены гематоксилином Майера
нижней доли правого легкого. Очередное прогрессирование – в сентябре 2016 г. В октябре 2016 г., феврале 2017 г. выполнялись удаление рецидивных узлов, атипичная резекция печени, холецистэктомия, спленэктомия, в марте 2017 г. – атипичная резекция верхней доли правого легкого, резекция боковых отрезков 3–4 ребер справа.
В послеоперационном периоде с целью определения лекарственной чувствительности к АС выполнено ИГХ-исследование удаленных из брюшной полости опухолевых узлов на наличие экспрессии рецепторов соматостатина 2А и 5-го подтипов. В результате ИГХ выявлено, что большинство клеток опухоли экспрессируют SSTR2A в виде полного сильного окрашивания мембраны (3+) (рис. 1а). Экспрессия SSTR5 наблюдалась в части клеток опухоли (около 30 %), была несколько слабее по интенсивности (2+) и более гетерогенна по сравнению с SSTR2A, с участками цитоплазматического окрашивания (рис. 1б). Таким образом, морфологическая картина опухоли соответствовала диагнозу адренокортикального рака с позитивным ИГХ статусом рецепторов соматостатина 2А и 5-го типов.
В мае 2017 г. отмечен изолированный рост опухолевого узла в ложе удаленного надпочечника. С июня 2016 г. начата биотерапия пролонгированным АС октреотидом ДЕПО в антипроли-феративной дозе 40 мг, внутримышечно, 1 раз в 28 дней. При контрольном исследовании после 2 введений, несмотря на проводимую терапию, выявлено прогрессирование опухолевого процесса в виде дальнейшего роста узла в забрюшинном пространстве, появление нового очага в мягких тканях грудной клетки справа, рост метастаза в верхней доле левого легкого. В связи с прогрессированием пациентке на фоне продолжения лечения пролонгированными АС начата химиотерапия 2-й линии.
Обсуждение
Поиск новых терапевтических мишеней при диссеминированном АКР является важной задачей. В исследовании для определения лекарственной чувствительности опухоли у больных АКР к АС проведено ИГХ‑исследование 20 послеопераци‑ онных образцов опухолевой ткани на наличие экс‑ прессии SSTR2A и SSTR5. Экспрессия различной степени выявлена в 50 % случаев, что несколько ниже аналогичного показателя, представленного отечественными авторами на ENETS 2017 [13]. Возможно, это связано с большим количеством больных, включенных в наше исследование.
По результатам нашей работы лишь у 7 (35 %) больных в опухоли определялся высокий уровень экспрессии рецепторов соматостатина. По анало‑ гии с нейроэндокринными опухолями, в лечении которых широко применяются аналоги соматоста‑ тина [7–9], позитивный ИГХ‑статус рецепторов в опухоли может являться показателем эффектив‑ ности лечения аналогами соматостатина. Однако проведение терапии пролонгированными АС пациентке с выявленной коэкспрессией SSTR2A и SSTR5 не увенчалось успехом: после двух введе‑ ний отмечено прогрессирование процесса.
На наш взгляд, определение экспрессии SSTR 2А и SSTR 5 в опухолевой ткани больных АКР, а также изучение возможности применения пролонгированных АС в лечении больных рас‑ пространенным АКР с позитивным (2+/3+) ИГХ статусом SSTR2A и SSTR5 в опухоли является перспективным направлением [10, 11]. Однако не‑ обходимы дальнейшие исследования на большей популяции больных, которые позволят определить место АС в терапии больных распространенным АКР и целесообразность определения экспрессии рецепторов соматостатина в опухоли всем без ис‑ ключения пациентам.
Список литературы Рецепторы соматостатина как потенциальная терапевтическая мишень в лечении распространенного адренокортикального рака. Клинический случай
- Berruti A., Baudin E., Gelderblom H., Haak H.R., Porpiglia F., Fassnacht M., Pentheroudakis G.; ESMO Guidelines Working Group. Adrenal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2012 Oct; 23 Suppl 7: vii131-8.
- Lughezzani G., Sun M., Perrotte P., Jeldres C., Alasker A., Isbarn H., Budäus L., Shariat S.F., Guazzoni G., Montorsi F., Karakiewicz P.I. The European Network for the Study of Adrenal Tumors staging system is prognostically superior to the international union against cancer-staging system: a North American validation. Eur J Cancer. 2010 Mar; 46 (4): 713-9. DOI: 10.1016/j.ejca.2009.12.007
- De Francia S., Ardito A., Daffara F., Zaggia B., Germano A., Berruti A., Di Carlo F. Mitotane treatment for adrenocortical carcinoma: an overview. Minerva Endocrinol. 2012 Mar; 37 (1): 9-23.
- Fassnacht M., Terzolo M., Allolio B., Baudin E., Haak H., Berruti A., Welin S., Schade-Brittinger C., Lacroix A., Jarzab B., Sorbye H., Torpy D.J., Stepan V., Schteingart D.E., Arlt W., Kroiss M., Leboulleux S., Sperone P., Sundin A., Hermsen I., Hahner S., Willenberg H.S., Tabarin A., Quinkler M., de la Fouchardière C., Schlumberger M., Mantero F., Weismann D., Beuschlein F., Gelderblom H., Wilmink H., Sender M., Edgerly M., Kenn W., Fojo T, Müller H.H., Skogseid B.; FIRM-ACT Study Group. Combination chemotherapy in advanced adrenocortical carcinoma. N Engl J Med. 2012 Jun 7; 366 (23): 2189-97. DOI: 10.1056/NEJMoa1200966
- Коломейцева А.А., Емельянова Г.С., Горбунова В.А., Орел Н.Ф., Переводчикова Н.И., Бохян В.Ю., Феденко А.А. Опыт применения схемы химиотерапии EDP-M (этопозид + доксорубицин + цисплатин + + митотан) в 1-й линии лечения пациентов с распространенным адренокортикальным раком в Российской Федерации. Современная онкология. 2017; 19 (3): 42-45.


