Редкая морфологическая находка после панкреатодуоденальной резекции
Автор: Райн Василиса Юрьевна, Персидский Михаил Александрович, Ионин Владимир Петрович, Хадиева Елена Дмитриевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 2 т.20, 2021 года.
Бесплатный доступ
Представлен случай успешного хирургического лечения редкого сочетания трех злокачественных опухолей большого соска двенадцатиперстной кишки у пациентки 59 лет. Клиническая картина при поступлении включала боли в животе, тошноту и рвоту, потерю веса, повышение температуры тела, признаки механической желтухи. После обследования заподозрен рак большого дуоденального сосочка, в связи с чем выполнена пилоросохраняющая панкреатодуоденальная резекция. Послеоперационный период протекал без осложнений, больная выписана из стационара на 17-e сут. По данным гистологического и иммуногистохимического исследования операционного материала в опухоли выявлено одновременное присутствие клеток умереннодифференцированной аденокарциномы (30 %) с участками мелкоклеточной нейроэндокринной карциномы grade 3 (50 %) и плоскоклеточным ороговевающим раком grade 2 (не более 20 % от объема опухоли) с ростом от слизистой оболочки двенадцатиперстной кишки в головку поджелудочной железы без инвазии её капсулы, края резекции - интактны. Обнаружена экспрессия синаптофизина, хромогранина А и цитокератина 5/6. Размеры опухоли (диаметр - 2 см) и отсутствие признаков локорегионарного распространения позволили стадировать процесс как T2N0M0 стадия II, в связи с чем адъювантное лечение не проводилось. Через 6 мес при КТ-контроле выявлены 2 очага в печени. При биопсии одного из них гистологически и иммуногистохимически верифицирован метастаз нейроэндокринного рака. Проводится химиотерапия первой линии по схеме этопозид + цисплатин.
Нейроэндокринный рак, плоскоклеточный рак большого дуоденального сосочка, аденокарцинома бдс, пилоросохраняющая панкреатодуоденальная резекция, фатерова ампула
Короткий адрес: https://sciup.org/140254424
IDR: 140254424 | УДК: 616.342-089-076 | DOI: 10.21294/1814-4861-2021-20-2-136-140
Текст научной статьи Редкая морфологическая находка после панкреатодуоденальной резекции
При гистологическом исследовании операционного материала, полученного после панкреатодуоденальных резекций, выполненных по поводу злокачественных новообразований (ЗНО) билиопанкреатодуоденальной зоны, наиболее частым гистологическим вариантом опухолей является аденокарцинома. При данных ЗНО 40–60 % приходятся на головку поджелудочной железы, 10–20 % обнаруживаются в фатеровой ампуле, 10 % составляет железистый рак дистального отдела холедоха и 5–10 % – рак двенадцатиперстной кишки [1]. Подавляющее большинство ЗНО в большом дуоденальном сосочке (БДС) представлено аденокарциномой, затем по частоте следует адено-плоскоклеточный рак [2, 3], плоскоклеточный рак встречается крайне редко [1, 4]. Нейроэндокринный рак с локализацией в БДС составляет не более 2–5 % [4–7]. Анализ литературы по базам данных MEDLINE и PubMed позволил обнаружить лишь одно описание сочетания нейроэндокринного и плоскоклеточного рака с локализацией в фатеровой ампуле [8]. В связи с редкостью патологии приводим данное клиническое наблюдение.
Больная, 59 лет, поступила в хирургическое отделение с жалобами на боли в верхних отделах живота, периодическое повышение температуры тела, тошноту и рвоту, снижение массы тела, пожелтение склер и кожи и обесцвечивание кала. При лабораторном исследовании выявлена прямая гипербилирубинемия: общий и прямой билирубин – 101 и 63 мкмоль/л соответственно. Уровень СА 19–9 при поступлении был в пределах референтных значений – 16,4 U/ml. По данным КТ брюшной по-лотсти и фиброэзофагогастроскопии заподозрен рак большого дуоденального сосочка, в связи с чем была выполнена панкреатодуоденальная резекция с сохранением привратника. Послеоперационный период протекал без осложнений, больная выписана из стационара на 17-е сут после операции под наблюдение онколога по месту жительства.
По данным гистологического и иммуногистохимического исследования операционного материала морфологическая природа опухоли описывается следующим образом: злокачественное новообразование большого дуоденального соска – аденокарцинома умеренной степени дифференцировки grade 2 (30 %) с участками мелкоклеточной нейроэндокринной карциномы grade 3 (50 %) и плоскоклеточным ороговевающим раком grade 2 (не более 20 % от объема опухоли) с ростом от слизистой оболочки двенадцатиперстной кишки в головку поджелудочной железы без инвазии её капсулы (рис. 1, 2).
Проведено иммуногистохимическое исследование панелью антител: CK 5/6 (D5/16B4), CK 8/18 (B22.1, B23.1), Chromogranin A (LK2H10), Synaptophysin (MRQ-40). Мелкоклеточный компонент опухоли экспрессирует в цитоплазме синаптофизин – слабо/умеренная цитоплазматическая реакция в виде зернистости при полном отсутствии экспрессии данного маркера в крупных клетках плоскоклеточного компонента опухоли (рис. 3). Отмечается выраженная диффузная мембранно-цитоплазматическая экспрессия CD56 в клетках нейроэндокринного компонента (рис. 4). Диффузная слабовыраженная экспрессия хромогранина А наблюдается только в островках Лангерганса поджелудочной железы. При оценке индекса пролиферативной активности экспрессия Ki67 определялась в 95–98 % опухолевых клеток нейроэндокринной части (рис. 5). Атипичный плоскоклеточный компонент обладает яркой мембранно-цитоплазматической экспрессией ци-токератина 5/6 в отличие от нейроэндокринного компонента опухоли (рис. 6).
В разных микропрепаратах оценка процентного содержания компонентов опухоли была различна, в окончательном морфологическом заключении был представлен усредненный, полуколичественный анализ долевого составляющего 3 видов карцином в одном макроскопическом узле.
Хирургические края резекции – интактны. Диаметр опухолевого узла 2 см и отсутствие признаков локорегионарного распространения позволили стадировать процесс как T2N0M0 (II стадия). Адъювантного лечения пациентка не получала. При контрольном обследовании через 6 мес по данным
КТ выявлено 2 очага в печени. При биопсии одного из них гистологически и иммуногистохимически верифицирован метастаз нейроэндокринного рака большого дуоденального соска. В качестве первой линии химиотерапии рекомендован платиносодержащий режим.
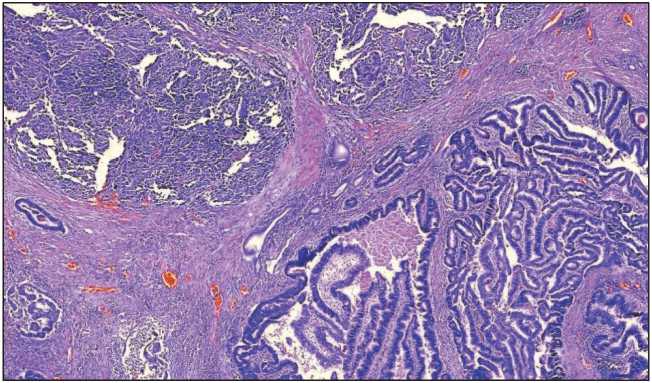
Рис. 1. Микрофото. Аденокарцинома в сочетании с мелкоклеточным нейроэндокринным раком и мелкими островками плоскоклеточной дифференцировки. Окраска гематоксилином и эозином, ×50
Fig. 1. Microphotograph. Tumor of the major duodenal papilla consisting of foci of adenocarcinoma and poorly differentiated neuroendocrine cancer. Routine hematoxylin and eosin staining, ×50
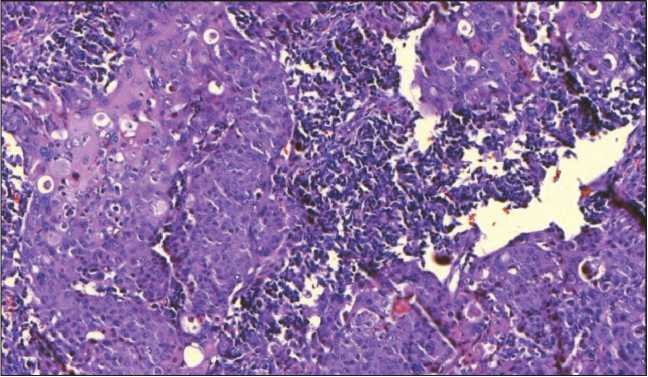
Рис. 2. Микрофото. Островки плоскоклеточной дифференцировки среди мелкоклеточного нейроэндокринного рака. Окраска гематоксилином и эозином, ×200
Fig. 2. Microphotograph. Foci of squamous cell carcinoma among neuroendocrine cancer cells. Routine hematoxylin and eosin staining, ×200
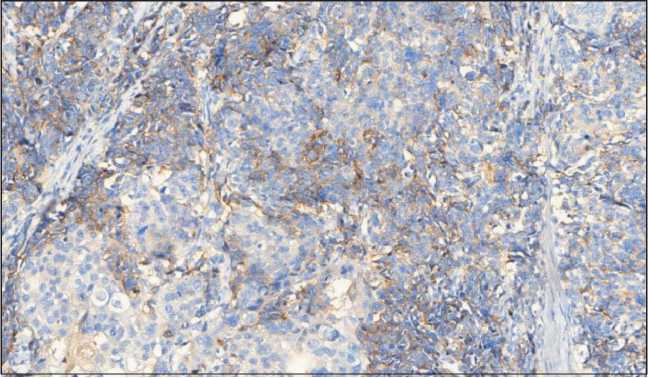
Рис. 3. Микрофото. ИГХ-исследование с синаптофизином, ×200
Fig. 3. Microphotograph. IHС with synaptophysin, ×200
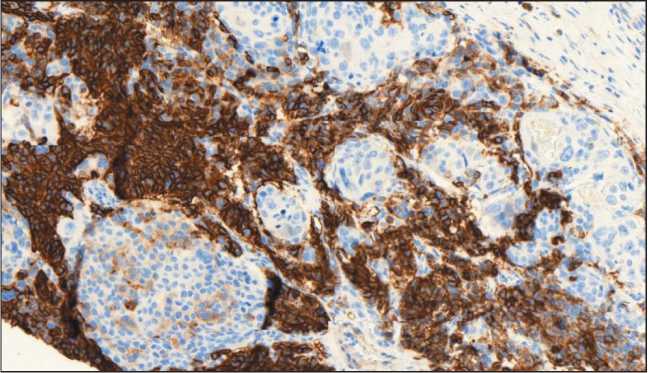
Рис. 4. Микрофото. ИГХ-исследование с CD56 (выраженная мембранно-цитоплазматическая экспрессия в нейроэндокринном компоненте), ×200
Fig. 4. Microphotograph. IHС with CD56, ×200
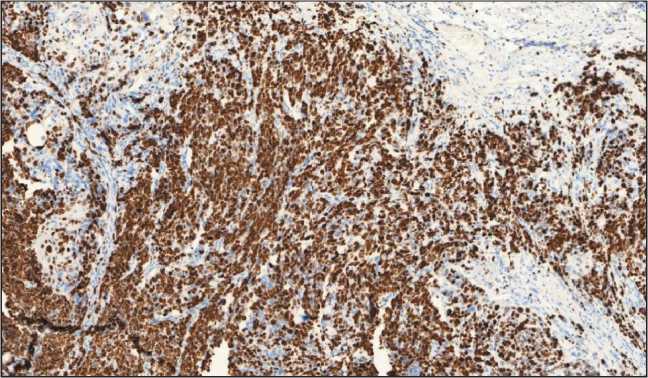
Рис. 5. Микрофото. ИГХ-исследование с Ki67: 95–98 % в клетках нейроэндокринной карциномы), ×200
Fig. 5. Microphotograph. IGH with Ki67, ×200
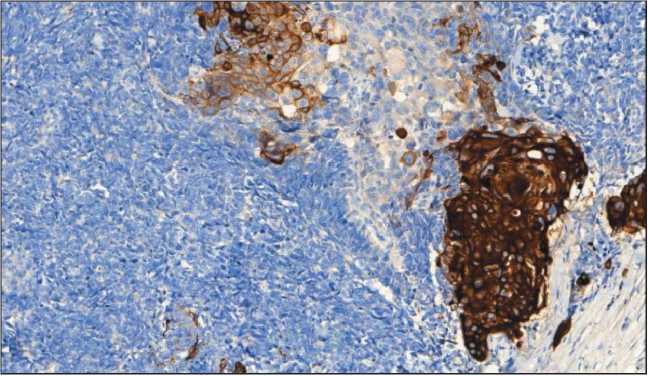
Рис. 6. Микрофото. ИГХ-исследование с цитокератином 5/6, ×200
Fig. 6. Microphotograph. IGH with cytokeratin 5/6, ×200
Обсуждение
Плоскоклеточный и низкодифференцированный нейроэндокринный рак периампулярной локализации обнаруживают различия в биологических свойствах по сравнению с аденокарциномой этой же зоны. Отмечена сильная корреляция показателей общей выживаемости больных и медианы без прогрессирования с гистологическим вариантом, гормональной активностью и локализацией первичной опухоли [9, 10]. Большинство авторов наряду с редкостью патологии отмечают более агрессивное течение заболевания при наличии плоскоклеточного компонента и нейроэндокрин- ных опухолей низкой дифференцировки в ЗНО периампулярной зоны [1, 2, 4, 8, 9, 11–14]. По данным литературы, в качестве лечения выполняется стандартное хирургическое вмешательство в объеме панкреатодуоденальной резекции в различных модификациях независимо от локализации опухоли, а также ее морфологического и иммуногистохимического варианта [2, 11, 12, 14–16], Необходимы накопление клинического материала и эпидемиологических данных, а также исследования онкогенеза с целью получения представлений о течении микст-неоплазий БДС и определения оптимальной тактики лечения.
Список литературы Редкая морфологическая находка после панкреатодуоденальной резекции
- Balci B., Calik B., Karadeniz T., Sahin H., Ugurlu L., Aydin C. Primary squamous cell carcinoma of the ampulla of Vater: a case report. Surg Case Rep. 2016 Dec; 2(1): 2. https://doi.org/10.1186/s40792-016-0130-0.
- Hoshimoto S., Aiura K., Shito M., Kakefuda T., Sugiura H. Adenosquamous carcinoma of the ampulla of Vater: a case report and literature review. World J Surg Oncol. 2015 Sep 29; 13: 287. https://doi.org/10.1186/s12957-015-0709-0.
- Arita K., Masuda T., Tanaka H., Kubochi M., Moriya Y., Fukumoto K., Shinobi T., Yoshino H., Ishizu H. An autopsy case report of adenosquamous cell carcinoma of the duodenal papilla with multiple liver and lung metastases. Nihon Shokakibyo Gakkai Zasshi. 2013 Sep; 110(9): 1649-56.
- Sunose Y., Ogawa T., Itoh H., Andoh T., Tomizawa N., Tanaka T., Sakamoto I., Arakawa K., Ikeya T., Takeyoshi I. Large cell neuroendocrine carcinoma of the ampulla of vater with adenocarcinoma and squamous cell carcinoma components. Jpn J Clin Oncol. 2011; 41(3): 434-9. https://doi.org/10.1093/jjco/hyq186.
- Albores-Saavedra J., Hart A., Chablé-Montero F., Henson D.E. Carcinoids and high-grade neuroendocrine carcinomas of the ampulla of vater: a comparative analysis of 139 cases from the surveillance, epidemiology, and end results program-a population based study. Arch Pathol Lab Med. 2010 Nov; 134(11): 1692-6. https://doi.org/10.1043/2009-0697-OAR.1.
- Albores-Saavedra J., Henson D.E., Klimstra D. Malignant epithelial tumors of the ampulla. Tumors of the gallbladder, extrahepatic bile ducts, and ampulla of Vater. Atlas of Tumor Pathology. Armed Forces Institute of Pathology. Washington DC. 2000; 290-293 p.
- Karpov O.E., Maady A.S., Alekseev K.I., Levchuk A.L., Stepanyuk I.V., Plotnitskii A.V., Sudilovskaya V.V. Neiroendokrinnaya opukhol' bol'shogo duodenal'nogo sosochka. Vestnik Natsional'nogo mediko-khirurgicheskogo Tsentra im. N.I. Pirogova. 2014; 9(4): 125-127.
- Sugawara G., Yamaguchi A., Isogai M., Watanabe Y., Kaneoka Y., Suzuki M. Small cell neuroendocrine carcinoma of the ampulla of Vater with foci of squamous differentiation: a case report. J Hepatobiliary Pancreat Surg. 2004; 11(1): 56-60. https://doi.org/10.1007/s00534-002-0840-5.
- Poddubnaya I.V., Kaprin A.D., Lyadov V.K. Klassifikatsiya opukholei TNM. 8-ya redaktsiya. Rukovodstvo i atlas. Tom I: Opukholi torako-abdominal'noi lokalizatsii. M., 2019. 424 s.
- Orel N.F., Artamonova E.V., Gorbunova V.A., Delektorskaya V.V., Emel'yanova G.S., Lyubimova N.V., Markovich A.A., Orlova K.V., Orlova R.V., Trifanov V.S. Prakticheskie rekomendatsii po lekarstvennomu lecheniyu neiroendokrinnykh opukholei zheludochnokishechnogo trakta, podzheludochnoi zhelezy i drugikh lokalizatsii. Zlokachestvennye opukholi. Prakticheskie rekomendatsii RUSSCO. 2019; #3s2 (9): 486-497.
- Bolanaki H., Giatromanolaki A., Sivridis E., Karayiannakis A.J. Primary squamous cell carcinoma of the ampulla of Vater. JOP. 2014 Jan; 15(1): 42-5. https://doi.org/10.6092/1590-8577/1649. PMID:24413783.
- Selvakumar E., Rajendran S., Balachandar T.G., Kannan D.G., Jeswanth S., Ravichandran P., Surendran R. Neuroendocrine carcinoma of the ampulla of Vater: a clinicopathologic evaluation. Hepatobiliary Pancreat Dis Int. 2008 Aug; 7(4): 422-5.
- Suzuki S., Tanaka S., Hayashi T., Harada N., Suzuki M., Hanyu F., Ban S. Small-cell neuroendocrine carcinoma of the ampulla of Vater. J Hepatobiliary Pancreat Surg. 2006; 13(5): 450-3. https://doi.org/10.1007/s00534-005-1093-x.
- Liu S.H., Tsay S.H. Coexistence of large cell neuroendocrine carcinoma and adenocarcinoma of the ampulla of vater. J Chin Med Assoc. 2008 Oct; 71(10): 536-40. https://doi.org/10.1016/S1726-4901(08)70164-3.
- Sato T., Yamamoto K., Ouchi A., Imaoka Y., Tokumura H., Matsushiro T. Undifferentiated carcinoma of the duodenal ampulla. J Gastroenterol. 1995 Aug; 30(4): 517-9. https://doi.org/10.1007/BF02347570.
- Yamamoto Y., Watanabe Y., Horiuchi A., Yoshida M., Yukumi S., Sato K., Nakagawa H., Sugishita H., Ishida N., Ishikawa M., Ishikawa K., Kawachi K. Adenoendocrine carcinoma of the accessory papilla of the duodenum: report of a case. Surg Today. 2009; 39(5): 425-9. https://doi.org/10.1007/s00595-008-3874-8.


