Редкая опухоль - метастатическая дигитальная папиллярная аденокарцинома. Обзор литературы, клинический случай успешной терапии
Автор: Макарова М.И., Давыдова Д.А., Богуш-вишневская Е.Н., Щербакова А.А., Гамаюнов С.В., Ермолаева А.М., Гришаков В.В., Шумская И.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.23, 2024 года.
Бесплатный доступ
Дигитальная папиллярная аденокарцинома (ДПА) - редкое злокачественное новообразование потовых желез, которое впервые было описано Хельвигом в 1979 г., а затем классифицировано Као в 1987 г. Чаще всего ДПА возникает у мужчин 50-70 лет и характеризуется относительно благоприятным течением. В большинстве случаев радикальное иссечение опухоли приводит к излечению. Однако у 14-47 % больных возникают отдаленные метастазы с преимущественным поражением легких (70 %). Наиболее интересным представляется изучение этиологии и патогенеза этого редкого онкологического заболевания, особенностей его молекулярно-генетического профиля. В настоящее время нет однозначного подхода к лечению метастатической ДПА, описаны единичные случаи использования химиотерапии. Цель исследования - проанализировать современные данные о патогенезе ДПА, особенностях диагностики и используемых методах лечения, а также представить первый описанный в научной литературе клинический случай лечения диссеминированной дигитальной карциномы ингибиторами контрольных точек иммунного ответа. материал и методы. Проведен поиск доступных литературных источников, опубликованных в базе данных Medline, Pubmed и др. с 1984 по 2023 г., 21 источник был включен в данный обзор. Описание клинического случая. Представлен редкий случай метастатической дигитальной папиллярной карциномы у мужчины (23 года) с манифестацией заболевания в возрасте 14 лет. Недостаточная настороженность и осведомленность онкологов и морфологов не позволили своевременно диагностировать злокачественную опухоль, даже в случае 3 местных рецидивов болезни. Только биопсия метастатического узла в легких с гистологическим и иммуногистохимическим исследованием архивного и нового материала позволила поставить правильный диагноз. При этом выявлены 2 потенциальные мишени, которые можно использовать для контроля заболевания: позитивная экспрессия андрогеновых рецепторов и экспрессия PD-L1 с CPS=20. Использование ингибиторов контрольных точек иммунного ответа (ипилимумаба и ниволумаба) позволило получить частичный ответ с последующей стойкой стабилизацией.
Дигитальная папиллярная аденокарцинома, редкая опухоль, опухоль кисти, иммунотерапия
Короткий адрес: https://sciup.org/140305923
IDR: 140305923 | УДК: 616-006.66-08 | DOI: 10.21294/1814-4861-2024-23-3-168-177
Текст научной статьи Редкая опухоль - метастатическая дигитальная папиллярная аденокарцинома. Обзор литературы, клинический случай успешной терапии
Дигитальная папиллярная аденокарцинома (ДПА) – редкое злокачественное новообразование потовых желез, которое впервые было описано Хельвигом в 1979 г. [1], а затем классифицировано Као в 1987 г. [2]. Данная опухоль часто представляет собой одиночное медленно растущее, безболезненное образование. В 2004 г. термин «дигитальная папиллярная аденокарцинома» утвержден в «Международной классификации болезней» как злокачественная опухоль кожи, которая объединила 2 наиболее часто используемых названия: «агрессивная дигитальная папиллярная аденома» и «агрессивная папиллярная аденокарцинома» [3, 4].
Пальцы кистей являются доминирующей локализацией (более 80 % случаев), следующая наиболее частая локализация – пальцы стоп [2]. Случаи появления ДПК в неакральных локализациях ред- ки, в литературе есть описания ДПК в коже скальпа [5], области надколенника, мошонки [6].
Этиология данной опухоли неизвестна. Однако новые исследования показывают связь ее возникновения с инфицированием вирусом HPV42. HPV42 в настоящее время классифицируется как тип HPV «низкого риска» видов Alpha-1 (род Alphapapillomavirus), который не связан с онкогенной трансформацией. Подобно другим неонкогенным типам ВПЧ «низкого риска» (например, ВПЧ6 или 11), ВПЧ42 вызывает доброкачественные бородавки и лишь изредка встречается при раке. Чтобы облегчить онкогенную трансформацию, онкогенные ВПЧ используют свои онкобелки E6 и E7 для изменения хода клеточного цикла. Основной мишенью белка Е6 является р53, который подвергается протеасомальной деградации. При исследовании белок E6 вируса HPV42 не приводил к деградации р53 и таким образом не показал значимости в развитии злокачественной трансформации. А белок E7 HPV42 оказал влияние на увеличение пролиферативной активности клетки, что способствовало избеганию механизмов старения и в дальнейшем злокачественной трансформации клеток [7, 8].
В недавнем сообщении C.M. Bui et al. [9] описано 8 случаев ДПА, развившихся, по мнению исследователей, с участием 2 различных патогенетических механизмов: мутации BRAF и инфекции ВПЧ низкого риска. При этом ДПА с ВПЧ-инфекцией низкого риска демонстрируют агрессивное течение, высокую степень злокачественности, выраженную плоскоклеточную дифференцировку и BRAF дикого типа. ДПА с мутацией BRAF V600E имеют менее агрессивные клинические признаки, low grade дифференцировку, слабо выраженную или отсутствующую плоскоклеточную дифференцировку и отрицательную инфекцию ВПЧ.
Возрастной диапазон появления опухоли широк – от 14 до 83 лет [10], но чаще она развивается у мужчин в возрасте 50–70 лет, средний возраст – 52 года [2]. ДПА вызывает трудности при диагностике, так как существует довольно много патологий, которые являются доброкачественными и имеют морфологическую схожесть с ДПА, например гидраденома, папиллярная эккринная аденома, цистаденома. Кроме того, микроскопически опухоль может быть ошибочно диагностирована как аденокарцинома молочной железы, легких и щитовидной железы.
ДПА обычно представляет собой многоузловое образование, развивающееся в дерме или подкожной клетчатке, с эпидермисом не связана. Границы опухоли варьируют от четких до размытых. В структуре опухоли сочетаются участки солидного, кистозного и папиллярного строения, последние могут иметь или нет фиброваскулярную основу. Типичным паттерном являются тесно расположенные железы, образованные кубическим или низким столбчатым эпителием с нередкой апокринизацией и возможным наличием слоя миоэпителиальных клеток. Цитологическая атипия обычно не выражена, поражения с высокой степенью атипии редки. Митотическая активность крайне вариабельна [11, 12]. В части случаев в опухоли доминируют солидные участки, в солидных опухолях могут встречаться некрозы. Иногда можно видеть фокусы плоскоклеточной метаплазии и светлоклеточные изменения. Строма опухоли гипоклеточная, гиа-линизированная, реже – с явлениями миксоматоза. Лимфоваскулярная инвазия встречается редко. В случае четко очерченной опухоли с мягкой цитологической атипией и низкой митотической активностью при первичной диагностике она может быть ошибочно интерпретирована как доброкачественный очаг. По этой причине ранее выделяли агрессивную дигитальную папиллярную аденому.
Однако было показано, что впоследствии такие опухоли могут метастазировать [2], поэтому в настоящее время все такие опухоли классифицируют как дигитальные папиллярные аденокарциномы.
При иммуногистохимическом исследовании (ИГХ) клетки ДПА диффузно позитивны к панци-токератину и СК7. Эпителий желез и люминальный край сосочков демонстрируют яркую окраску с антителами к EMA и CEA. Миоэпителиальный слой окрашивается SMA, calponin, p63, и podoplanin (очагово). S100 вариабелен как в люминальных, так и в миоэпителиальных клетках. Индекс пролиферации Ki67 ДПА находится в интервале от 2 до 30 % [12]. В 50 % случаев в опухоли могут выявляться рецепторы эстрогенов, прогестерона и андрогенов [13, 14].
Дифференциальная диагностика проводится как с доброкачественными опухолями (гидраденома, папиллярная эккринная аденома, апокриновая ци-стаденома), так и злокачественными (микрокистоз-ная аднексальная карцинома, гидраденокарцинома, миоэпителиальная карцинома, метастатические карциномы кожи). В сложных диагностических случаях, особенно при неакральных локализациях, полезно уточнение HPV42-статуса с помощью FISH [15].
Изучение молекулярно-генетического профиля ДПА является актуальным и помогает установить биологию этой опухоли. Описаны случаи выявления мутаций в гене BRAF V600E [16], гиперэкспрессии FGFR2 [17]. При других типах злокачественных новообразований, таких как рак толстой кишки, меланома, холангиоцелюллярная карцинома, мутации в гене BRAF и гиперэкспрессия FGFR2 ассоциируются с худшим прогнозом. В настоящее время в арсенале онкологов имеются лекарственные препараты, направленные на данные изменения в генотипе опухоли. Ввиду небольшого количества пациентов, а также в связи с выполнением молекулярно-генетического исследования ретроспективно об успехах данной терапии у пациентов с ДПА пока говорить невозможно.
Широкое иссечение с контролем границы резекции рекомендуется в качестве хирургического метода в первой линии лечения местнораспространенной ДПА [11]. По данным литературы, биопсия сигнального лимфатического узла (БСЛУ) помогает в раннем выявлении и профилактике регионарных метастазов [6]. В серии из 18 пациентов, которым была проведена БСЛУ, в 3 (17 %) случаях обнаружены позитивные СЛУ, из них у 2 больных в последующем появились отдаленные метастазы. У пациентов с негативными СЛУ отдаленные метастазы не отмечены [6]. Из-за редкости этой опухоли нет единого мнения о долгосрочной пользе БСЛУ, и данная опция не применяется в рутинной практике.
В настоящее время нет данных, подтверждающих необходимость применения адъювантной хи- миотерапии или облучения. Мы обнаружили только одно описание предоперационной лучевой терапии у 36-летнего мужчины с ДПА, проводившейся с целью уменьшения опухоли. Авторы сообщили о полном патоморфологическом ответе [18].
ДПА – опухоль низкой степени злокачественности, и, если ее диагностировать на ранней стадии и выполнить радикальное лечение, у пациентов будет очень хороший прогноз. После первичного лечения рекомендуется регулярное наблюдение с участием дерматологов и онкологов. Частота метастазирования составляет 14–41 %. Отмечается поражение регионарных лимфатических узлов и легких [2, 10–13].
ДПА имеет затяжное течение и отсроченное появление отдаленных метастазов (описаны случаи возникновения отдаленных метастазов через 6–14–20 лет после возникновения опухоли) [12]. Чаще всего ДПА метастазирует в лимфатические узлы и легкие, а также в мозг, кожу, кости и почки [19]. Даже в случае развития отдаленных метастазов заболевание характеризуется относительно индолентным течением. R. Suchak et al. описывают 3 случая прогрессирующей ДПА с метастазами в легкие, когда пациенты были живы через 24 мес после диссеминации [12]. Поэтому зачастую динамическое наблюдение является приоритетом даже при развитии метастазов. Некоторые авторы предлагают агрессивную хирургическую тактику в случае операбельных метастазов [11]. При метастатической ДПА выбором метода лечения является лекарственная терапия. В литературе описаны случаи применения только цитостатической терапии. T. Kobayashi et al. представили случай применения химиотерапии доцетакселом в дозе 25 мг/м2 в еженедельном режиме [14]. Другому пациенту проводилась химиотерапия паклитакселом и карбоплатином, на фоне которой отмечалась положительная динамика, однако при возникновении нежелательного явления в виде нейропатии курсы терапии были отменены, с течением времени выявлено прогрессирование заболевания, предприняты попытки химиотерапии доцетакселом, затем комбинацией карбоплатина и фторурацила, на фоне которых отмечалось дальнейшее прогрессирование [20]. Также в литературе описаны отдельные случаи применения комбинации этопозида и цисплатина, VP16 без существенного ответа [11]. В 2 других случаях сообщается о лечении комбинацией доксорубицина, интерферона и препаратов платины с умеренной эффективностью [21].
Мы представляем опыт применения иммунотерапии у пациента с метастатической дигитальной папиллярной аденокарциномой пальца кисти.
Больной, мужчина 23 лет. Образование в области IV пальца правой кисти выявлено в 2013 г., в возрасте 14 лет, тогда же впервые выполнено иссечение опухоли сухожилия сгибателя IV пальца (гистологическое заключение не сохранилось, со слов родственников, данных о злокачественной опухоли не было). Через год, в 2014 г., а затем еще дважды, в 2015 и 2016 гг., выполнялись иссечения рецидивов данного образования. Заключение о наличии злокачественной опухоли по результатам ИГХ сделано только в 2020 г. (гистологический материал 2015 г.): папиллярная пальцевая аденокарцинома кожи пальца кисти (рис. 1–5).
В 2018 г., в возрасте 19 лет, через 5 лет от момента появления опухоли, по данным КТ органов грудной клетки выявлены очаговые образования в обоих легких. Выполнено оперативное лечебнодиагностическое вмешательство в объеме торакоскопической атипичной резекции верхней и нижней долей левого легкого.
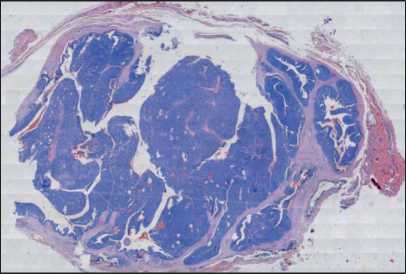
Рис. 1. Микрофото. Общий вид опухоли. Опухоль дольчатого (многоузлового) вида, с четкими контурами, преимущественно солидного строения. Окраска гематоксилином и эозином.
Общий вид сканированного изображения. Примечание: микрофото выполнено авторами
Fig. 1. Microphoto. Lobulated and multinodular tumor display solid, cystic and papillary areas with fairly clear contours (overall view). Hematoxylin and eosin staining. Scanning view. Note: created by the authors
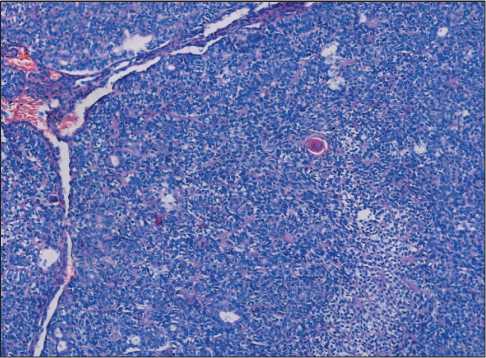
Рис. 2. Участки солидного вида: фокусы плоскоклеточной метаплазии, цитологическая атипия не выражена, митозов нет. Окраска гематоксилином и эозином, ×10. Примечание: микрофото выполнено авторами
Fig. 2. Microphoto. Solid areas: small foci of squamous metaplasia, mild cytological atypia, no mitosis. Hematoxylin and eosin staining, ×10. Note: created by the authors
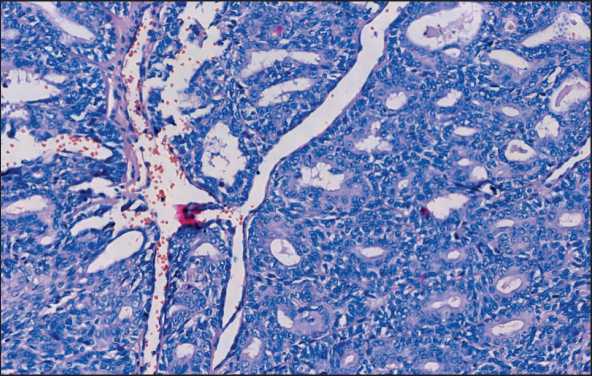
Рис. 3. Микрофото. Многочисленные близко расположенные и сливающиеся железистые структуры из низкого призматического эпителия. Окраска гематоксилином и эозином, ×20.
Примечание: микрофото выполнено авторами
Fig. 3. Microphoto. Numerous closely spaced and confluent glandular structures from low prismatic epithelium. Hematoxylin and eosin staining, ×20. Note: created by the authors
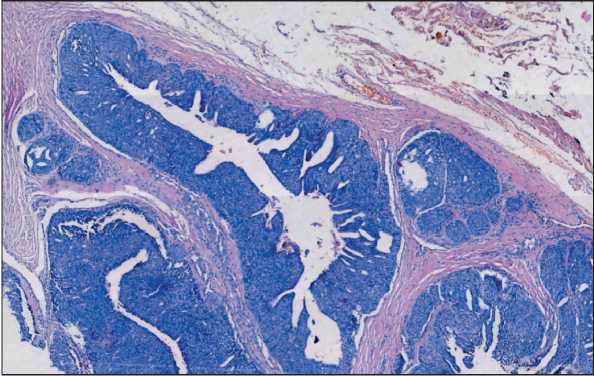
Рис. 4. Микрофото. Участки опухоли с кистозной трансформацией, наличием истинных папиллярных и псевдопапил-лярных структур. Окраска гематоксилином и эозином, ×5.
Примечание: микрофото выполнено авторами
Fig. 4. Microphoto. Tumor areas with cystic transformation and true papillary and pseudopapillary structures. Hematoxylin and eosin staining, ×5. Note: created by the authors
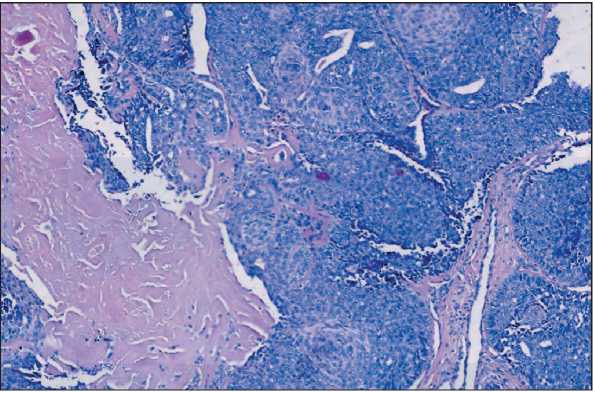
Рис. 5. Микрофото. Гиалинизированная строма. Окраска гематоксилином и эозином, ×10. Примечание: микрофото выполнено авторами
Fig. 5. Microphoto. Hyalinized tumoral stroma. Hematoxylin and eosin staining, ×10. Note: created by the authors
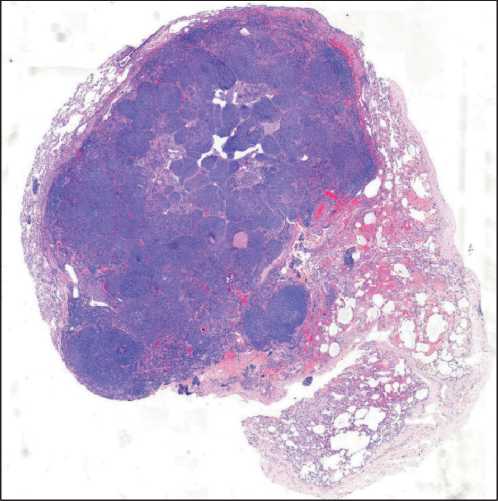
Рис. 6. Микрофото. Общий вид метастатического очага в легком. Окраска гематоксилином и эозином. Общий вид сканированного изображения.
Примечание: микрофото выполнено авторами Fig. 6. Microphoto. Metastatic focus in the lung (overall view). Hematoxylin and eosin staining. Scanning view.
Note: created by the authors
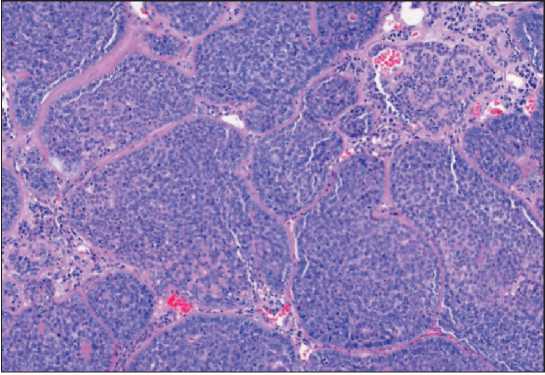
Рис. 7. Микрофото. Опухоль представлена дольками солидного вида с редким формированием люминальных структур. Строма гиалинизирована. Клеточная атипия выражена умеренно. Митотическая активность высокая. Окраска гематоксилином и эозином. Увеличение, ×10.
Примечание: микрофото выполнено авторами
Fig. 7. Microphoto. The tumor display solid lobules, rare glandular structure with mild cellular atypia and numerous mitotic figures. Stroma hyalinized. Hematoxylin and eosin staining, ×10.
Note: created by the authors
По данным гистологического исследования с последующим ИГХ, а также по результатам пересмотра гистологических препаратов первичной опухоли (2013), полученных при иссечении образования IV пальца правой кисти и рецидивов, верифицирован диагноз: папиллярная аденокарцинома кожи пальца кисти с метастазами в легких (рис. 6, 7).
В послеоперационном периоде лекарственная и лучевая терапии не проводились. Рекомендовано динамическое наблюдение.
Пациент регулярно проходил контрольные обследования в течение года, наблюдался небольшой рост очагов в легких в рамках стабилизации. Через год после операции на легком (через 7 лет после вы-
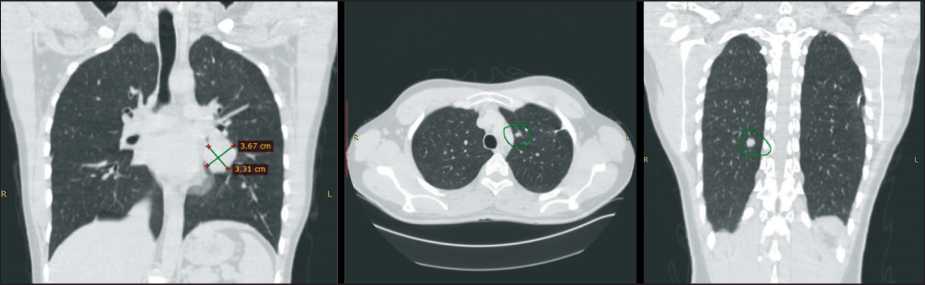
Рис. 8. КТ органов грудной клетки в начале лечения (декабрь 2020 г.). Очаги в легких с обеих сторон, отрицательная динамика по критериям RECIST 1.1 (по сравнению с сентябрем 2020 г. – за 3 мес наблюдения) в виде увеличения размеров крупного очага слева и части мелких очагов с обеих сторон. Количество очагов не увеличилось. Примечание: снимки выполнены авторами
Fig. 8. CT scan of the chest at the start of treatment (December 2020). Lung lesions on both sides, negative dynamics according to RECIST 1.1 criteria (compared to September 2020 – for 3 months of follow-up) in the form of an increase in the size of a large lesion on the left and some small foci at both sides. The number of foci did not increase. Note: created by the authors
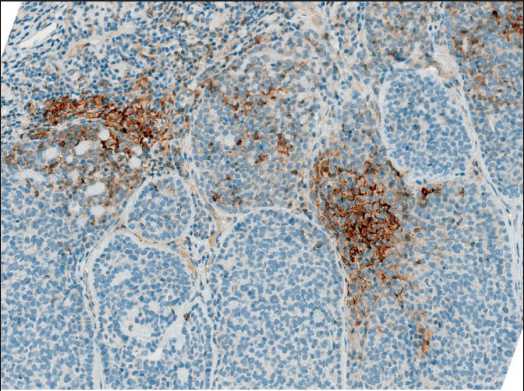
Рис. 9. Микрофото. Реакция с PD-L1 – антиген экспрессируется на мембранах как опухолевых клеток, так и клеток воспалительного инфильтрата. ИГХ, реакция с PDL1 (sp263), ×10. Примечание: микрофото выполнено авторами Fig. 9. Microphoto. Immunohistochemical staining of PDL1 – the antigen is expressed both on the membranes of tumor cells and cells of the inflammatory infiltrate. IHC, PDL1(sp263) , ×10. Note: created by the authors явления первичной опухоли) по данным КТ органов грудной клетки выявлено прогрессирование заболевания – продолженный рост метастатических очагов в обоих легких. Радикальное оперативное лечение не представлялось возможным, рассматривались варианты повторной паллиативной операции на левом легком в объеме резекции нижней доли, вплоть до нижней лобэктомии слева (с учетом расположения метастатической опухолевого узла в корне нижней доли и потенциальной опасности сдавления бронха и инвазии нижней легочной вены данным опухолевым узлом) (рис. 8).
Для подбора оптимальной схемы лекарственного лечения гистологический материал пациента был направлен на дополнительные ИГХ и молекулярно-генетические исследования. Получены следующие результаты: опухоль с отрица- тельным статусом по рецепторам эстрогена и прогестерона, Her2/neu; выявлена позитивная экспрессия рецепторов андрогенов; ИГХ-признаков микросателлитной нестабильности не выявлено; при ИГХ выявлена яркая цитоплазматическая реакция в 25 % опухолевых клеток на ALK (с использованием антител анти – ALK (D5F3), при FISH-исследовании транслокация ALK не подтвердилась; опухоль позитивна по экспрессии PD-L1 (CPS=20) (с использованием моноклональных антител sp263 и внешних позитивных контролей): TPS – 10 %, TS – 10 %, CPS 20. Следует отметить, что критерии оценки статуса PDL для ДПА не разработаны, поэтому система оценки была выбрана патологом исходя из характера экспрессии (рис. 9); мутаций в гене BRAF не обнаружено; не выявлено перестройки NTRK.
Пациент информирован об ограниченности опций цитостатической терапии. Учитывая позитивный статус по экспрессии PD-L1, принято решение о лекарственной терапии по схеме: Ниволумаб 360 мг в 1-й и 22-й день + ипилимумаб 1 мг/кг в 1-й день; цикл 42 дня. Всего выполнено 7 введений ниволумаба и 4 введения ипилимумаба. На фоне проводимого лечения отмечалась положительная динамика, проявляющаяся уменьшением размеров всех очагов, нивелированием очага в S1–2 слева (рис. 10).
По данным биохимического анализа крови после 7-го введения ниволумаба выявлено нежелательное явление – гепатотоксичность IV степени. Иммунотерапия была приостановлена. Согласно рекомендациям по лечению иммуноопосредован-ных нежелательных явлений, назначена терапия преднизолоном в дозе 1 мг/кг в сут, затем в связи с нарастанием токсичности доза преднизолона увеличена до 2 мг/кг, с последующим постепенным снижением дозы. На фоне терапии глюкокортикостероидами явления гепатотоксичности купированы. Учитывая развитие иммуноопосредованного гепатита IV степени, дальнейшее проведение
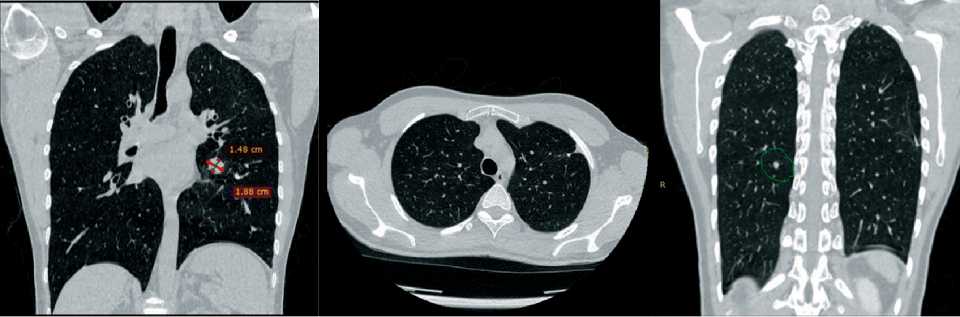
Рис. 10. КТ органов грудной клетки в процессе иммунотерапии: картина метастатического поражения паренхимы легких в стадии лечебного патоморфоза. В сравнении с исследованием от декабря 2020 г. (через 6 мес от начала терапии) отмечается уменьшение размеров всех очагов, нивелирование очага в S1–2 слева. Примечание: снимки выполнены авторами Fig. 10. CT scan of the chest during immunotherapy: a picture of a metastatic lesion of the lung parenchyma in the stage of therapeutic pathomorphosis. Compared to a study from December 2020 (6 months after the start of therapy), there is a decrease in the size of all foci, leveling of the lesion in S1–2 on the left. Note: created by the authors
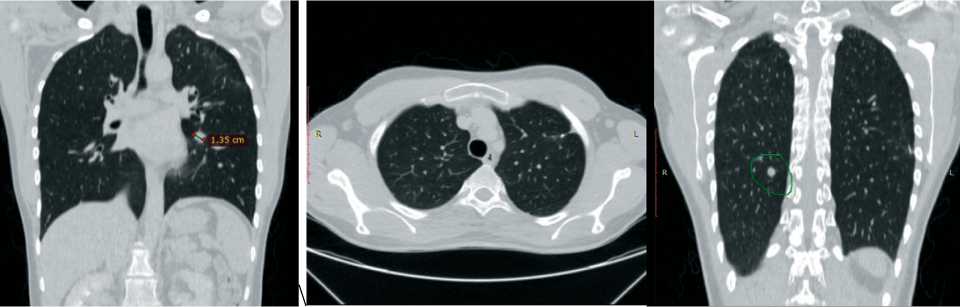
Рис. 11. КТ органов грудной клетки через год после окончания иммунотерапии. Дополнительные образования в легких с обеих сторон без изменения количества. Слева без динамики, по сравнению с исследованиями от 18.03.22 и 24.06.22. Справа размеры образования в S6 не изменились, снизилась активность накопления контраста, по сравнению с исследованием от 24.06.22 – положительная динамика. Примечание: снимки выполнены авторами
Fig. 11. CT scan of the chest one year after the end of immunotherapy. Additional lesions in the lungs on both sides without changing the number. On the left, no dynamics compared to 03/18/2022 and 06/24/2022. On the right, the size of the formation in S6 did not change, the activity of contrast accumulation decreased compared to the study on June 24, 2022 – positive dynamics. Note: created by the authors
иммунотерапии сопряжено с высоким риском осложнений, и она была отменена.
На момент окончания терапии по данным КТ новых очаговых образований в легких не выявлено. Сохранялись солидные образования левого и правого легких, аксиллярная лимфаденопатия (стабилизация процесса). Пациент регулярно проходит контрольное обследование, и до настоящего времени отмечается стабилизация с некоторым уменьшением накопления контраста в некоторых метастатических очагах в легких. Период наблюдения составил 37 мес от момента начала иммунотерапии, пациент жив без признаков прогрессирования заболевания, с сохраняющейся положительной динамикой по данным контрольной КТ в феврале 2024 г.
Обсуждение
Дигитальная папиллярная карцинома является редким злокачественным новообразованием. Мы представили редкий случай дигитальной папиллярной карциномы с манифестацией заболевания в возрасте 14 лет. Недостаточные настороженность и осведомленность онкологов и морфологов не позволили своевременно диагностировать злокачественную опухоль даже в случае 3 местных рецидивов болезни. Только биопсия метастатического узла в легких с гистологическим и ИГХ исследованием (архивного и нового материала) позволила поставить правильный диагноз.
При местнораспространенном процессе возможно было проведение оперативного лечения в радикальном варианте, наиболее эффективной в этой ситуации является ампутация пальца кисти. Безусловно, каждый случай ДПА должен быть обсужден мультидисциплинарной командой, так как даже в случае метастатического поражения агрессивная хирургическая тактика, лучевая терапия, стереотаксическая лучевая терапия могут быть полезны. При распространенном метастатическом процессе наши возможности ограничены проведением цитостатической лекарственной терапии на основе весьма скудных публикаций по этому вопросу. Результаты применения ци- тостатиков, таких как цисплатин, карбоплатин этопозид, митомицин, доксорубицин, не являются обнадеживающими. Учитывая орфанность данной болезни, важным представляется проведение исследований (иммуногистохимических, а оптимально и генетических (NGS)), направленных на выяснение характеристик опухоли, а также ее микроокружения, особенно у молодых пациентов. Полученные результаты, возможно, позволят не только определить драйверы этиологии и патогенеза заболевания, но и подобрать варианты лекарственной терапии. Недавние публикации показали ключевую роль двух патогенетических факторов в развитии ДПА: мутации в гене BRAF и вируса папилломы человека. В представленном случае мы выявили 2 потенциальные мишени, которые можно было использовать для контроля заболевания: по- зитивную экспрессию андрогеновых рецепторов и экспрессию PD-L1 с CPS=20. В доступных литературных источниках мы не обнаружили опыта использования антиандрогенной терапии, а также данных об эффективности иммунотерапии. Попытка проведения иммунотерапии на основании только одного, возможно, предиктивного маркера оказалась успешной. Это открывает нам перспективы для дальнейшего изучения данной опухоли, ее морфологических и генетических характеристик с целью подбора оптимальной схемы лечения. Подход, основанный на поиске потенциальных мишеней, может облегчить онкологу принятие решения о лечебной тактике и продлить жизнь пациента с метастатической дигитальной папиллярной аденокарциномой.
Список литературы Редкая опухоль - метастатическая дигитальная папиллярная аденокарцинома. Обзор литературы, клинический случай успешной терапии
- Helwig E.B. Eccrine acrospiroma. J Cutan Pathol. 1984; 11(5): 415-20. https://doi.org/10.1111/j.1600-0560.1984.tb00398.x.
- Kao G.F., Helwig E.B., Graham J.H. Aggressive digital papillary adenoma and adenocarcinoma. A clinicopathological study of 57 patients, with histochemical, immunopathological, and ultrastructural observations. J Cutan Pathol. 1987; 14(3): 129-46. https://doi.org/10.1111/j.1600-0560.1987.tb00488.x.
- Pathology and Genetics of Skin Tumours. WHO Classification of Tumours. Lyon: IARC Press, 2006.
- Digital papillary adenocarcinoma. WHO Classification of Skin Tumours. Lyon: IARC Press, 2018.
- Balci M.G., Tayfur M., Deger A.N., Cimen O., Eken H. Aggressive papillary adenocarcinoma on atypical localization: A unique case report. Medicine (Baltimore). 2016; 95(28). https://doi.org/10.1097/MD.0000000000004110.
- Bartelstein M.K., Schwarzkopf E., Busam K.J., Brady M.S., Athanasian E.A. Sentinel lymph node biopsy predicts systemic recurrence in digital papillary adenocarcinoma. J Surg Oncol. 2020; 122(7): 1323-7. https://doi.org/10.1002/jso.26170.
- Cascardo C.A., Cornell G., Moesch J.R. Human papillomavirus 42-associated digital papillary adenocarcinoma. JAAD Case Rep. 2022; 32: 52-4. https://doi.org/10.1016/j.jdcr.2022.10.038.
- Leiendecker L., Neumann T., Jung P.S., Cronin S.M., Steinacker T.L., Schleiffer A., Schutzbier M., Mechtler K., Kervarrec T., Laurent E., Bachiri K., Coyaud E., Murali R., Busam K.J., Itzinger-Monshi B., Kirnbauer R., Cerroni L., Calonje E., Rütten A., Stubenrauch F., Griewank K.G., Wiesner T., Obenauf A.C. Human Papillomavirus 42 Drives Digital Papillary Adenocarcinoma and Elicits a Germ Cell-like Program Conserved in HPVPositive Cancers. Cancer Discov. 2023; 13(1): 70-84. https://doi.org/10.1158/2159-8290.CD-22-0489.
- Bui C.M., Pukhalskaya T., Smoller B.R., Zengin H.B., Heneidi S., Vail E., Makhoul E., Balzer B. Two distinct pathogenic pathways of digital papillary adenocarcinoma - BRAF mutation or low-risk HPV infection. J Cutan Pathol. 2023; 50(6): 568-76. https://doi.org/10.1111/cup.14386.
- Rismiller K., Knackstedt T.J. Aggressive Digital Papillary Adenocarcinoma: Population-Based Analysis of Incidence, Demographics, Treatment, and Outcomes. Dermatol Surg. 2018; 44(7): 911-7. https://doi.org/10.1097/DSS.0000000000001483.
- Duke W.H., Sherrod T.T., Lupton G.P. Aggressive digital papillary adenocarcinoma (aggressive digital papillary adenoma and adenocarcinoma revisited). Am J Surg Pathol. 2000; 24(6): 775-84. https://doi.org/10.1097/00000478-200006000-00002.
- Suchak R., Wang W.L., Prieto V.G., Ivan D., Lazar A.J., Brenn T., Calonje E. Cutaneous digital papillary adenocarcinoma: a clinicopathologic study of 31 cases of a rare neoplasm with new observations. Am J Surg Pathol. 2012; 36(12): 1883-91. https://doi.org/10.1097/PAS.0b013e31826320ec.
- Weingertner N., Gressel A., Battistella M., Cribier B. Aggressive digital papillary adenocarcinoma: A clinicopathological study of 19 cases. J Am Acad Dermatol. 2017; 77(3): 549-58. https://doi.org/10.1016/j.jaad.2017.02.028.
- Kobayashi T., Hiura A., Oishi K., Maeda S., Le Pavoux A.J., Ohara K., Uruga H. Aggressive Digital Papillary Adenocarcinoma With Multiple Organ Metastases: A Case Report and Review of the Literature. Am J Dermatopathol. 2016; 38(12): 910-4. https://doi.org/10.1097/DAD.0000000000000703.
- Vanderbilt C., Brenn T., Moy A.P., Harloe G., Ariyan C., Athanasian E., Busam K.J. Association of HPV42 with digital papillary adenocarcinoma and the use of in situ hybridization for its distinction from acral hidradenoma and diagnosis at non-acral sites. Mod Pathol. 2022; 35(10): 1405-10. https://doi.org/10.1038/s41379-022-01094-8.
- Trager M.H., Jurkiewicz M., Khan S., Niedt G.W., Geskin L.J., Carvajal R.D. A Case Report of Papillary Digital Adenocarcinoma With BRAFV600E Mutation and Quantified Mutational Burden. Am J Dermatopathol. 2021; 43(1): 57-9. https://doi.org/10.1097/DAD.0000000000001694.
- Surowy H.M., Giesen A.K., Otte J., Büttner R., Falkenstein D., Friedl H., Meier F., Petzsch P., Wachtmeister T., Westphal D., Wieczorek D., Wruck W., Adjaye J., Rütten A., Redler S. Gene expression profiling in aggressive digital papillary adenocarcinoma sheds light on the architecture of a rare sweat gland carcinoma. Br J Dermatol. 2019; 180(5): 1150-60. https://doi.org/10.1111/bjd.17446.
- Feldmeyer L., Prieto V.G., Ivan D., Nagarajan P., Tetzlaff M.T., Curry J.L., Bell1 D., Moon B.S., Torres-Cabala C.A., Aung P.P. Role of radiotherapy in aggressive digital papillary adenocarcinoma. Annals of Clinical and Laboratory Science. 2016; 46(2): 222-4.
- Gorva A.D., Mohil R., Srinivasan M.S.Aggressive digital papillary adenocarcinoma presenting as a paronychia of the finger. J Hand Surg Br. 2005; 30(5): 534. https://doi.org/10.1016/j.jhsb.2005.01.011.
- Frey J., Shimek C., Woodmansee C., Myers E., Greer S., Liman A., Adelman C., Rasberry R. Aggressive digital papillary adenocarcinoma: a report of two diseases and review of the literature. J Am Acad Dermatol. 2009; 60(2): 331-9. https://doi.org/10.1016/j.jaad.2008.07.038.
- Bakotic B., Antonescu C.R. Aggressive digital papillary adenocarcinoma of the foot: the clinicopathologic features of two cases. J Foot Ankle Surg. 2000; 39(6): 402-5.


