Редкий случай интракраниальной болезни Кастлемана
Автор: Сулин К.А., Чижова К.А., Самочерных Н.К., Белов И.Ю., Макаров И.А., Митрофанова Л.Б., Гуляев Д.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.22, 2023 года.
Бесплатный доступ
Введение. Болезнь Кастлемана (БК) - редкое лимфопролиферативное заболевание, также известное как ангиофолликулярная гиперплазия лимфатических узлов или гигантская лимфоидная гиперплазия. При наличии одного очага БК считается уницентрической, если клиническая картина представлена множественной лимфаденопатией и сопутствующими системными проявлениями - мультицентрической. Манифестация заболевания возникновением очага, мимикрирующего под опухоль мозговых оболочек или головного мозга, является исключительно редким явлением - известно всего 20 случаев, включая представленный в нашей статье. Основной метод лечения локализованных форм - хирургическая резекция. Наше наблюдение посвящено редкому варианту интракраниальной БК. Описание клинического случая. Больная, 35 лет, поступила в клинику с жалобами на периодическую головную боль умеренной интенсивности диффузного характера, а также затруднение при счете и письме. За месяц до госпитализации возник однократный генерализованный эпилептический приступ. В клинической картине на момент поступления отмечался синдром Герстмана-Шильдера, что топически соответствовало поражению правой теменной доли. На МРТ головного мозга с контрастным усилением отмечалась патологическая инфильтрация в структуре правой теменной кости с наличием массивного параоссального компонента, распространяющегося интракраниально, с компрессией вещества правой теменной доли и умеренно выраженным перифокальным отеком вещества мозга. Новообразование удалено тотально вместе с фрагментом твердой мозговой оболочки (ТМО). Выполнены пластика ТМО васкуляризированным лоскутом надкостницы и одномоментная пластика дефекта черепа титановым имплантатом. По данным гистологического и иммунохимического исследований, а также дополнительных обследований установлен диагноз уницентрической формы БК. По результатам контрольной МРТ головного мозга с контрастным усилением через 3, 6 и 12 мес данных за рецидив не выявлено. Пациентка в настоящий момент не отмечает никаких симптомов заболевания. Заключение. Интракраниальная уницентрическая БК является доброкачественным заболеванием, поддающимся радикальному хирургическому лечению и не требующим дальнейшей адъювантной терапии. Несмотря на сложность дифференциальной диагностики между БК и менингиомами, первичная тактика лечения остается единой во всех случаях: тотальное хирургическое удаление.
Болезнь кастлемана, гамартома, интракраниальная опухоль, менингиома
Короткий адрес: https://sciup.org/140300187
IDR: 140300187 | УДК: 616.428-007.61 | DOI: 10.21294/1814-4861-2023-22-3-144-152
Текст научной статьи Редкий случай интракраниальной болезни Кастлемана
Болезнь Кастлемана (БК) – редкое лимфопролиферативное заболевание, также известное как ангиофолликулярная гиперплазия лимфатических узлов или гигантская лимфоидная гиперплазия [1]. Впервые эта патология была описана в 1954 г. B. Castleman в серии из 13 наблюдений как локальная гиперплазия лимфатических узлов средостения, напоминающая тимому [2].
БК включает в себя несколько гетерогенных структурных подтипов, предположительно различной этиологии. При наличии одного очага БК считается уницентрической, а если клиническая картина представлена множественной лимфаденопатией и сопутствующими системными проявлениями – мультицентрической. В свою очередь, множественные формы подразделяют на HHV-8-ассоциированные, POEMS-ассоциированные и идиопатические. Гистологически среди вариантов БК выделяют гиалиново-сосудистый, плазмоклеточный и промежуточный [3]. Каждый год в США выявляют около 4300–5200 новых случаев БК. При этом около 23 % пациентов имеют уни- центрическую форму (от 1001 до 1192 случаев), у 77 % больных отмечается клиническая картина множественных форм [4]. В РФ на данный момент не существует статистических сведений об этом заболевании.
Манифестация заболевания возникновением очага, мимикрирующего под опухоль мозговых оболочек или головного мозга, является исключительно редким явлением – известно всего 20 случаев, включая представленный в нашей статье [5, 6]. Первыми данное лимфопролиферативное заболевание интракраниальной локализации описали M.J. Lacombe et al. в 1983 г. [7]. При этом все описанные ранее интракраниальные очаги представляли собой уницентрическую форму БК. Основной метод лечения локализованных форм – хирургическая резекция, которая в 93–95 % позволяет достичь полного излечения [3, 8]. В доступной отечественной литературе нам не удалось найти описанных случаев интракраниальных очагов ангиофолликулярной гиперплазии. Наше наблюдение посвящено редкому варианту интракраниальной БК.
Клинический случай
Больная, 35 лет, поступила в клинику с жалобами на периодическую головную боль умеренной интенсивности диффузного характера, а также затруднение при счете и письме. Из анамнеза известно, что за месяц до госпитализации возник однократный генерализованный эпилептический приступ. В клинической картине на момент поступления отмечался синдром Герстмана–Шильдера, что топически соответствовало поражению правой теменной доли. На МРТ головного мозга с контрастным усилением (рис. 1–3) отмечалась патологическая инфильтрация в структуре правой теменной кости с признаками «вздутия» костной ткани, с деструкцией внутренней и наружной кортикальных костных пластинок, наличием массивного параоссального компонента, распространяющегося интракраниально, с нечеткими неровными контурами, размерами 2,2×5,0×3,8 см, с компрессией вещества правой теменной доли и умеренно выраженным перифокальным отеком вещества мозга. Образование диффузно накапливало контрастное вещество, общие размеры контрастируемого интракраниального и внутрикостного компонента составляли 3,0×3,8×5,0 см. Отмечалось постконтрастное усиление сигнала от прилежащей твердой мозговой оболочки (ТМО) в правой теменной области.
Принимая во внимание клиническую картину поражения правой теменной доли в виде синдрома Герстмана–Шильдера и наличие структурной эпилепсии, с целью устранения компрессии головного мозга и гистологической верификации опухоли принято решение о хирургической резекции новообразования. Интраоперационно отмечалась аррозия костного лоскута, участок ТМО в ее проекции уплотнен и изменен, опухоль желто-серого цвета, плотно-эластической консистенции, обиль-
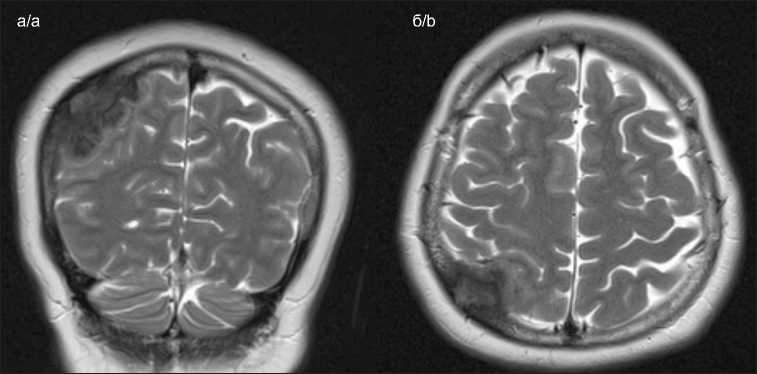
Рис. 1. МРТ головного мозга в режиме T2. Визуализируется экстрацеребральное гипоинтенсивное образование в области теменной доли справа без выраженного перифокального отека: а – коронарная плоскость; б – аксиальная плоскость
Fig. 1. MRI of the brain, T2-weighted image. An extracerebral hypointense formation is visualized in the region of the parietal lobe without expressed perifocal edema: a – coronal plane; b – axial plane
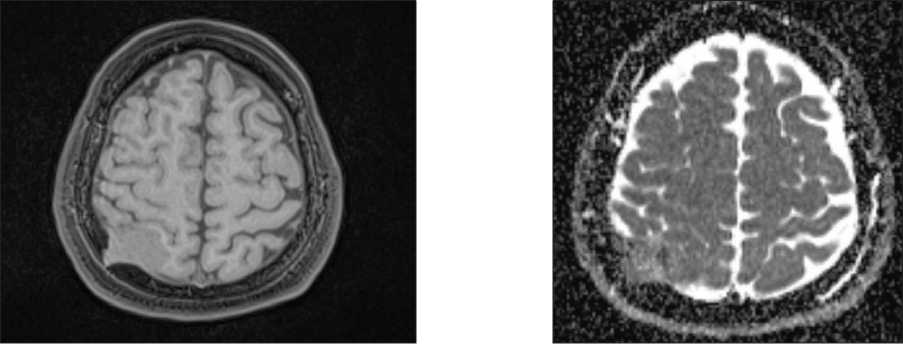
Рис. 2. МРТ головного мозга в режиме Т1, коронарная плоскость. Складывается впечатление об инвазии кости Fig. 2. MRI of the brain, T1-weighted image, coronal plane. Impression of bone invasion
Рис. 3. МРТ головного мозга в DWI-режиме, коронарная плоскость
Fig. 3. MRI of the brain, DWI image, coronal plane но васкуляризирована. Новообразование удалено тотально вместе с фрагментом ТМО. Выполнены пластика ТМО васкуляризированным лоскутом надкостницы и одномоментная пластика дефекта черепа титановым имплантатом.
Макроскопически удаленные ткани представляли собой образование размерами 2,0×1,5×1,5 см с фрагментом ТМО, которое имело желтосерый цвет, бугристую поверхность, плотную консистенцию, макроскопически не прорастало оболочки мозга и не имело инвазивного роста в ткани мозга.
При гистологическом исследовании подтвердилось отсутствие инвазивного роста образования в ткани оболочек и головного мозга. Образование представляло собой фиброзную ткань с обширными зонами гиалиноза с выраженной очаговой, интерстициальной и периваскулярной муфтообразной лимфоцитарно-плазмоцитарной инфильтрацией. Лимфоидный компонент представлен малыми лимфоцитами со «зрелой» морфологией ядер, среди которых определяются малочисленные рассеянные крупные клетки с высоким ядерно-цитоплазматическим соотношением, с округло-овальными везикулярными ядрами, содер- жащими преимущественно по одному центральному эозинофильному ядрышку. Плазмоклеточной компонент представлен зрелыми плазмоцитами, среди которых встречаются двуядерные формы и клетки с тельцами Русселя. Помимо этого в образовании определялись единичные фолликулы с гиперплазией зоны мантии, фолликулы с удвоением герминативных центров и с врастанием сосудов с гиалинизированной стенкой в последние, вторичные фолликулы. Также вне фолликулов определялись обширная васкуляризация за счет гиалинизированных сосудов и пролиферация сосудов (рис. 4). Данная гистологическая картина требовала дифференциальной диагностики с лимфопролиферативными заболеваниями, ВИЧ-ассоциированной лимфаденопатией, реактивной лимфаденопатией, поражением лимфатических узлов при ревматологических заболеваниях, IgG4-ассоциированным поражением ткани мозговой оболочки, болезнью Кастлемана, фолликулярной дендритно-клеточной саркомой.
Учитывая анамнез заболевания и данные лабораторно-инструментального обследования пациентки, мы исключили из дифференциального диагноза ВИЧ-ассоциированное поражение,
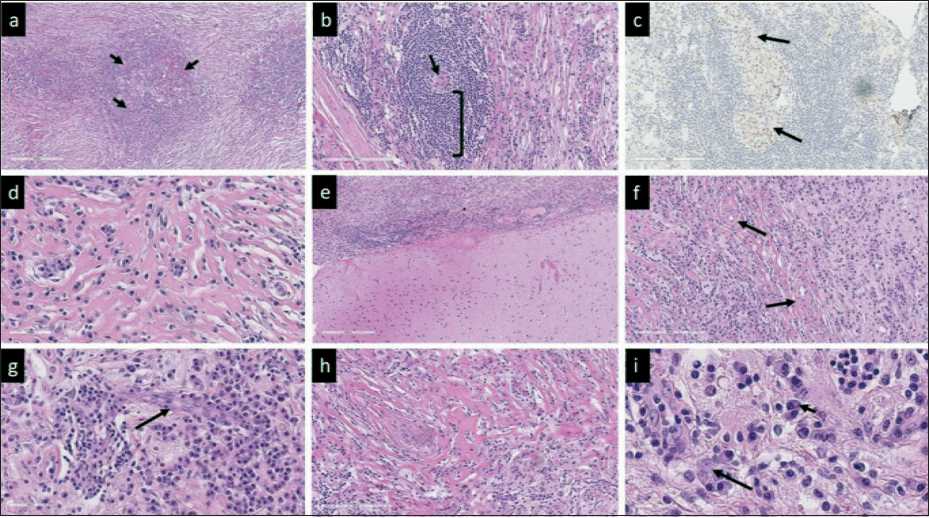
Рис. 4. Микрофото. Гистологическое исследование: a – фолликулы с герминативными центрами, с пенетрацией сосудов (указаны стрелками), ×100; b – фолликулы с гиперплазией зоны мантии (показаны скобкой) и сосудом с гиалинизированной стенкой в центре (указан стрелкой), ×200; c – фолликул с двумя герминативными центрами (указаны стрелками), ×200; d – инфильтрат из плазмоцитов в гиалинизированной строме, ×400;
e – граница образования с тканью мозга, ×100; f – гиалинизированные сосуды с фиброзом по типу «луковой шелухи» по периферии, ×200; g – сосуд с пролиферацией эндотелия (указан стрелкой), ×400; h – гиалиновая строма с обилием сосудов, ×400; i – основной инфильтрат вне фолликулов, представленный плазмоцитами (указаны короткой стрелкой) и крупными клетками (указаны длинной стрелкой); a, b, e – i – окраска гематоксилином и эозином; с – иммуноокрашивание с bcl6
Fig. 4. Microphoto. Histological examination: a – follicles with germinal centers, with vascular penetration (indicated by arrows), ×100; b – follicles with hyperplasia of the mantle zone (shown in brackets) and a vessel with a hyalinized wall in the center (indicated by an arrow), ×200; c – follicle with two germinal centers (indicated by arrows), ×200; d – plasma cell infiltrate in hyalinized stroma, ×400; e – a border between brain tissue and lesson, ×100; f – hyalinized vessels with fibrosis of the «onion peel» type along the periphery, ×200; g – vessel with endothelial proliferation (indicated by arrow), ×400; h – hyaline stroma with an abundance of blood vessels, ×400; i – the main infiltrate outside the follicles is represented by plasma cells (indicated by a short arrow) and large cells (indicated by a long arrow); a, b, e – i – Hematoxylin and eosin; с – immunostaining with bcl6
поражение лимфатических узлов при ревматологической патологии. Также нормальный сывороточный уровень IgG сильно снижал вероятность IgG4-ассоциированного поражения.
По результатам иммуногистохимического исследования мы обнаружили, что среди ранее выявленного инфильтрата, представленного малыми лимфоцитами, несколько преобладают B-клетки с мембранной экспрессией CD45, CD20, ядерной экспрессией Pax5, которые негативны к CyclinD1, CD5, CD10, CD23, MUM1, Bcl6, Bcl2. Т-клетки в несколько меньшем объеме, с мембранной экспрессией CD5 и CD3. Индекс пролиферативной активности по Ki67 низкий ~ 2 %. Вторичные фолликулы, окруженные CD20- и Bcl2-позитивными, CyclinD1-негативными клетками зоны мантии. Герминативные центры этих фолликулов Bcl6- и CD10-позитивны и негативны к Bcl2. CD23 маркирует сети фолликулярных дендритных клеток. На выявленном избытке плазматических клеток определялась мембранная экспрессия CD38, CD138, EMA, ядерная экспрессия MUM1, на подавляющем большинстве клеток цитоплазматическая экспрессия IgG и на части IgG4, политипическая экспрессия легких цепей Ig (Ig-lambda:Ig-kappa ~ 1:1). При ×400 определяется >50 IgG4-позитивных плазматических клеток на 1 поле зрения. Соотношение IgG4+ плазматических клеток к IgG+ плазматическим клеткам составляет менее 40 %. На выявленных ранее крупных рассеянных клетках выявлена ядерная экспрессия CyclinD1, цитоплазматическая экспрессия S100. Эти клетки негативны к Pax5, CD20, CD3, CD30, CD1a, CD68. Достоверно оценить экспрессию CD45 на крупных клетках затруднительно в связи с большим количеством прилежащих CD45-позитивных лимфоцитов. Полученный иммунофенотип крупных клеток в наибольшей степени соответствует реактивному менинготелию. Визуализируется неспецифическое окрашивание STAT6. Также клетки инфильтрата негативны к HHV8 и IgM (рис. 5).
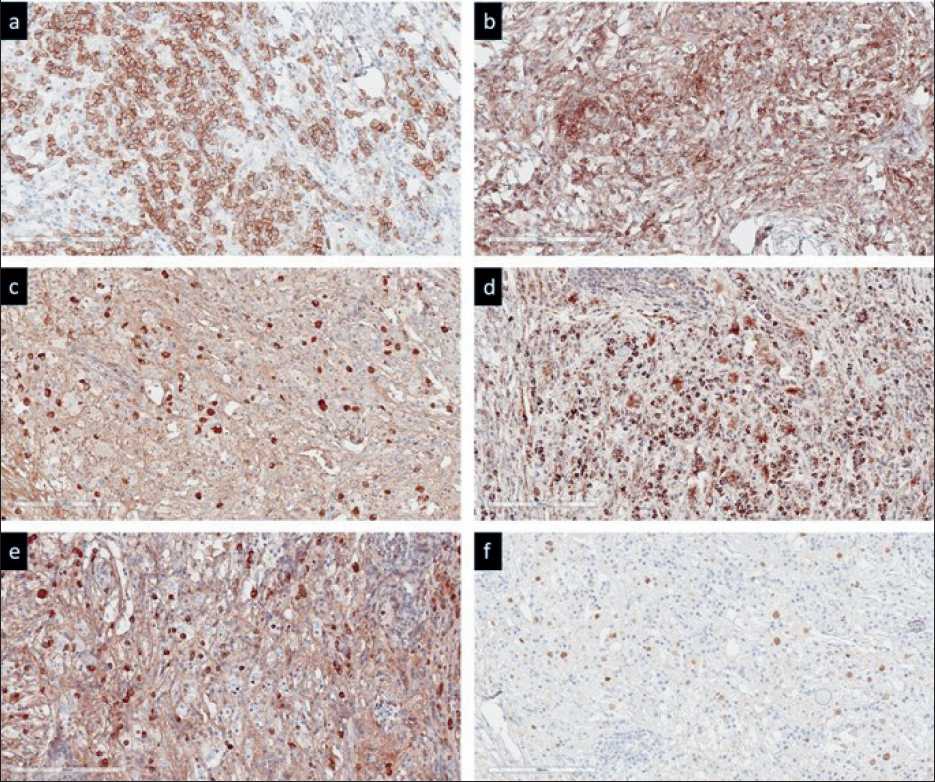
Рис. 5. Микрофото. Иммуногистохимическое исследование, ×200:
a – иммуноокрашивание с антителом к CD38; b – иммуноокрашивание с антителом к CD45; c – иммуноокрашивание с антителом к IgG4;
d – иммуноокрашивание с антителом к STAT6; e – иммуноокрашивание с антителом к IgG; f – иммуноокрашивание с антителом к cyclinD1
Fig. 5. Microphoto. Immunohistochemistry, ×200:
a – immunostaining with anti-CD38 antibody; b – immunostaining with anti-CD45 antibody; c – immunostaining with anti-IgG4 antibody;
d – immunostaining with anti-STAT6 antibody; e – immunostaining with anti-IgG antibody; f – immunostaining with anti-cyclinD1 antibody
Таким образом, данный иммунофенотип образования не характерен для лимфопролиферативных заболеваний, IgG4-ассоциированного поражения, фолликулярной дендритно-клеточной саркомы. Учитывая данные литературы о возможном поражении мозговых оболочек болезнью Кастлемана, данные клинико-лабораторного обследования, мы приняли решение, что наиболее приемлемым диагнозом в данном случае являлась HHV8 не ассоциированная уницентрическая болезнь Кастлемана с поражением мозговых оболочек, смешанный вариант гиалиновых сосудов и плазматических клеток.
Пациентка выписана на 7-е сут в удовлетворительном состоянии. В неврологическом статусе отмечался регресс аграфии, акалькулии. Наблюдалась транзиторная гемиапраксия слева, регрессировавшая на фоне консервативной терапии.
Для оценки распространенности заболевания и исключения поражения костного мозга проводились: электрофорез белков сыворотки, трепанобиопсия с миелограммой и ПЭТ/КТ всего тела с 18F-фтордезоксиглюкозой. Данных за мульти-центрический характер заболевания не получено, очагов патологического гиперметаболизма не обнаружено.
Учитывая наличие у пациентки структурной эпилепсии, был рекомендован прием препарата Депакин Хроно 1000 мг в сут. После хирургического лечения больная принимала терапию в течение 10 мес с постепенным снижением дозы и последующей отменой. Эпилептических приступов за весь период наблюдения отмечено не было.
По данным дополнительных обследований установлен диагноз уницентрической формы болезни Кастлемана, отсутствовали показания к проведению специфической терапии. По результатам контрольной МРТ головного мозга с контрастным усилением через 3, 6 и 12 мес данных за рецидив не выявлено. Пациентка находится под амбулаторным наблюдением нейрохирурга и гематолога и в настоящий момент не отмечает никаких симптомов заболевания.
Обсуждение
Причины интракраниального развития БК, учитывая весьма малое известное число случаев, до сих пор остаются неясными. Принимая во внимание, что очаг развивается из лимфоидной ткани, предполагались различные варианты происхождения БК в полости черепа. Высказывалось предположение, что внутричерепная локализованная болезнь Кастлемана может быть связана с гамартомной природой, поскольку считалось, что как таковой лимфоидной ткани в полости черепа нет [9]. Однако этот вариант не нашел своего подтверждения, так как был установлен поликлональный характер клеточного состава в образованиях, исключающий опухолевую, в том числе и доброкачественную, природу данного заболевания [10]. Хотя происхождение лимфоидной ткани в оболочках мозга неизвестно, фолликулярные дендритные анти-генпрезентующие клетки (ФДК) были обнаружены в ткани головного мозга мышей при инфекции и аутоиммунном энцефалите, а также при первичных воспалительных заболеваниях центральной нервной системы [11]. В норме ФДК расположены в герминативном центре вторичных фолликулов и взаимодействуют с В-лимфоцитами посредством презентации антигена, а также секреции хемо-кинов и цитокинов. Атрофичные зародышевые центры со снижением количества B-лимфоцитов могут отражать дисфункцию ФДК при БК [3]. Предположительно, в случае интракраниальной БК ФДК развиваются из клеток, находящихся в оболочках изначально, или мигрируют через кровь опосредованно через сигнальные молекулы [12, 13]. Исследования транскриптома при уницентри-ческой БК выявили гиперэкспрессию и активацию маркеров ФДС, факторов ангиогенеза, факторов ремоделирования внеклеточного матрикса, компонентов комплемента и маркеров активации зародышевого центра [10]. В настоящее время одно из ключевых мест в теории патогенеза БК занимает представление о нарушении регуляции экспрессии гена ИЛ-6 и, как следствие, селективной гиперэкспрессии данного цитокина. Таким образом, клинические и лабораторные проявления заболевания предположительно являются результатом гиперпродукции ИЛ-6, который взаимодействует с пролиферирующими сосудами и активирует мигрировавшие В-лимфоциты. Это также объясняет поликлональный характер изменений клеточного состава при БК [14].
Одной из основных проблем диагностики поражения твердой мозговой оболочки при болезни Кастлемана является отсутствие патогномоничных признаков. В большинстве описанных ранее случаев, в том числе и нашем, лимфопролиферативный узел изначально расценивался как менингиома вследствие ряда признаков, делающих эти заболевания весьма схожими [15]. В связи с этим закономерна необходимость установить, какая совокупность критериев может позволить предположить наличие данного заболевания на этапе дооперационного обследования. J.B. Paredes et al., проанализировав ранее описанные случаи, отмечают диспропорциональный массивный отек, не соответствующий размеру образования, в 12 из 18 известных на момент описания наблюдений и предполагают, что данную особенность стоит считать ключевой в проведении дифференциальной диагностики между менингиомой и БК [5]. В одном из представленных ранее наблюдений интракраниального случая БК авторы отметили заметный отек мозга на Т2-взвешенных изображениях, превышающий в несколько раз размеры новообразования, и высказали предположение, что отек головного мозга при БК может быть связан не с масс-эффектом, а с иммуноопосредованными эффектами лимфоидной гиперплазии [9]. В нашем наблюдении выраженного перифокального отека не отмечалось. Эта гипотеза требует дальнейшего изучения.
Еще одной особенностью в дифференциальной диагностике между менингиомами и интракраниальной БК является возможное нетипичное расположение очага лимфоидной гиперплазии. Так, по данным литературы, среди выявленных случаев встречается обширное бифронтальное межполушарное экстрацеребральное поражение [16].
Так как дифференцировать менингиому и интракраниальную форму БК весьма затруднительно, учитывая схожесть клинической картины и данных нейровизуализации, R.V. Pawar et al. предлагают использовать для этого МР-перфузию с динамическим контрастным усилением. Гиперваскуляризация в сочетании с отсутствием гематоэнцефалического барьера в случае обоих заболеваний приводят к повышению значений кинетических параметров накопления, плато и выведения контрастного препарата, что дает информацию о свойствах ткани на микрососудистом уровне, а также
Список литературы Редкий случай интракраниальной болезни Кастлемана
- Pribyl K., Vakayil V., Farooqi N., Arora N., Kreitz B., Ikramuddin S., Linden M. A., Harmon J. Castleman disease: A single-center case series. Int J Surg Case Rep. 2021; 80. https://doi.org/10.1016/j.ijscr.2021.105650.
- Castleman B., Iverson L., Menendez V.P. Localized mediastinal lymphnode hyperplasia resembling thymoma. Cancer. 1956; 9(4): 822-30. https://doi.org/10.1002/1097-0142(195607/08)9:4<822::aid-cncr2820090430-3.0.co;2-4.
- van Rhee F., Oksenhendler E., Srkalovic G., Voorhees P., Lim M., Dispenzieri A., Ide M., Parente S., Schey S., Streetly M., Wong R., Wu D., Maillard I., Brandstadter J., Munshi N., Bowne W., Elenitoba-Johnson K.S., Fossa A., LechowiczM.J., Chandrakasan S., Pierson S.K., Greenway A., Nasta S., Yoshizaki K., Kurzrock R., Uldrick T.S., Casper C., Chadburn A., Fajgenbaum D.C. International evidence-based consensus diagnostic and treatment guidelines for unicentric Castleman disease. Blood Adv. 2020; 4(23): 6039-50. https://doi.org/10.1182/bloodadvances.2020003334.
- Simpson D. Epidemiology of Castleman Disease. Hematol Oncol Clin North Am. 2018; 32(1): 1-10. https://doi.org/10.1016/j.hoc.2017.09.001.
- Escribano Paredes J.B., Carrasco Moro R., Lopez Gutierrez M., Arias H.P., Garcia-CosioM., GarGa Madrona S., Nedkova Hristova V., Martinez Poles J., Francisco J.B.C. Radiologic and Histopathologic Features in an Intracranial Localized Castleman Disease: A Case Report and Review of Literature. Neurologist. 2019; 24(1): 33-6. https://doi.org/10.1097/NRL.0000000000000203.
- Wang Y., Zhou L., Wang W., Cheng H. Intracranial Castleman Disease Presenting as a Meningioma. World Neurosurg. 2020; 142: 420-2. https://doi.org/10.1016/j.wneu.2020.07.043.
- Lacombe M.J., Poirier J., Caron J.P. Intracranial lesion resembling giant lymph node hyperplasia. Am J Clin Pathol. 1983; 80(5): 721-3. https://doi.org/10.1093/ajcp/80.5.721.
- Liu W., Cai Q., Yu T., Strati P., Hagemeister F.B., Zhai Q., Zhang M., Li L., Fang X., Li J., Sun R., Zhang S., Yang H., Wang Z., Qian W., Iwaki N., Sato Y., Oksenhendler E., Xu-Monette Z.Y., Young K.H., Yu L. Clinical characteristics and outcomes of Castleman disease: a multicenter Consortium study of 428 patients with 15-year follow-up. Am J Cancer Res. 2022; 12(9): 4227-40.
- Hashimoto H., Iida J., Hironaka Y., Sakaki T. Intracranial Castleman's disease of solitary form. Case report. J Neurosurg. 1999; 90(3): 563-6. https://doi.org/10.3171/jns.1999.90.3.0563.
- Hoffmann C., Hentrich M., Tiemann M., Rosenwald A., Weber F., Willenbacher W., HubelK. Recent Advances in Castleman Disease. Oncol Res Treat. 2022; 45(11): 693-704. https://doi.org/10.1159/000526640.
- McMenamin P.G. Distribution and phenotype of dendritic cells and resident tissue macrophages in the dura mater, leptomeninges, and choroid plexus of the rat brain as demonstrated in wholemount preparations. J Comp Neurol. 1999; 405(4): 553-62.
- Matsumura K., Nakasu S., Tanaka T., Nioka H., Matsuda M. Intracranial localized Castleman's disease. Case report. Neurol Med Chir (Tokyo). 2005; 45(1): 59-65. https://doi.org/10.2176/nmc.45.59.
- Cokelaere K., Debiec-Rychter M., De Wolf-Peeters C., Hage-meijer A., Sciot R. Hyaline vascular Castleman's disease with HMGIC rearrangement in follicular dendritic cells: molecular evidence of mesenchymal tumorigenesis. Am J Surg Pathol. 2002; 26(5): 662-9. https://doi.org/10.1097/00000478-200205000-00013.
- Melikyan A.L., Egorova E.K. Bolezn' Kastlemana (obzor literatury). Onkogematologiya. 2016; 11(2): 8-20. https://doi.org/10.17650/1818-8346-2016-11-2-8-20.
- Johnson M.D., Powell S.Z., Boyer P.J., Weil R.J., Moots P.L. Dural lesions mimicking meningiomas. Human Pathol. 2002; 33(12): 1211-26. https://doi.org/10.1053/hupa.2002.129200.
- Pawar R.V., Fatterpekar G.M., Zagzag D., Parker E.C., Naray-ana A. Multicentric Castleman's disease of the central nervous system: evaluation with dynamic susceptibility contrast perfusion magnetic resonance imaging. Clin Neuroradiol. 2012; 22(3): 245-51. https://doi.org/10.1007/s00062-011-0090-5.
- Rebrikova V.A., Sergeev N.I., PaDalko B.B., Kotlyarov P.M., Solodkii V.A. Vozmozhnosti MR-perfuzii v otsenke effektivnosti lecheniya zlokachestvennykh opukholei golovnogo mozga. Voprosy neirokhirurgii im. N.N. Burdenko. 2019; 83(4): 113-20. https://doi.org/10.17116/neiro201983041113.
- Carbone A., Borok M., Damania B., Gloghini A., Polizzotto M.N., Jayanthan R.K., Fajgenbaum D.C., Bower M. Castleman disease. Nat Rev Dis Primers. 2021; 7(1): 84. https://doi.org/10.1038/s41572-021-00317-7.


