Редкий случай первично-множественной опухоли у носительницы мутации в гене BRCA1: BRCA-ассоциированный рак яичников и карциноид лёгкого
Автор: Иванцов Александр Олегович, Клещв Максим Александрович, Городнова Татьяна Васильевна, Соколенко Анна Петровна, Котив Христина Богдановна, Амелина Инна Дмитриевна, Михнин Александр Евгеньевич, Урманчеева Аделия Федоровна, Берлев Игорь Викторович, Имянитов Евгений Наумович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 1 т.17, 2018 года.
Бесплатный доступ
Наследственные мутации в генах BRCA1 и BRCA2 чаще провоцируют развитие метахронных опухолей по сравнению с общей популяцией. У носительниц в гене BRCA1 фатально повышен риск развития рака молочной железы и яичников, а также других неоплазий: рака шейки матки, эндометрия, маточной трубы, поджелудочной железы, яичек, предстательной железы, слюнных желез. Общепринятые представления о патогенезе наследственных раков подразумевают, что развитию опухоли всегда предшествует утрата оставшегося (нормального) аллеля вовлечённого гена. Тем не менее существуют достоверные сведения о том, что некоторые BRCA1-ассоциированные РЯ демонстрируют сохранность второй копии BRCA1. В работе впервые описан клинический случай развития нейроэндокринной опухоли - метахронного рака яичника и карциноида лёгкого у больной, носительницы мутации в гене BRCA1. Кроме того, в опухоли продемонстрирован феномен потери гетерозиготности в локусе гена BRCA1 (утрата аллеля дикого типа).
Рак яичников, наследственные мутации, ген brca1, карциноид легкого
Короткий адрес: https://sciup.org/140254012
IDR: 140254012 | УДК: 618.11-006.6-056.7:616.24-006.86:575.224 | DOI: 10.21294/1814-4861-2018-17-1-99-103
Текст научной статьи Редкий случай первично-множественной опухоли у носительницы мутации в гене BRCA1: BRCA-ассоциированный рак яичников и карциноид лёгкого
Больная Л., 64 лет, обратилась в НИИ онкологии им. Н.Н. Петрова в октябре 2015 г., когда был установлен диагноз рак яичника IIIC стадии (FIGO), сT3сNхM0. У пациентки отягощённый семейный анамнез (у матери – рак яичника в 76 лет; у сестры – рак яичника в 60 лет). При молекулярногенетическом тестировании выявлена мутация в гене BRCA1 5382insC (рис. 1).
На первом этапе комбинированного лечения пациентка согласилась принять участие в клиническом многоцентровом проспективном нерандомизированном исследования НИИ онкологии им. Н.Н. Петрова по изучению эффективности
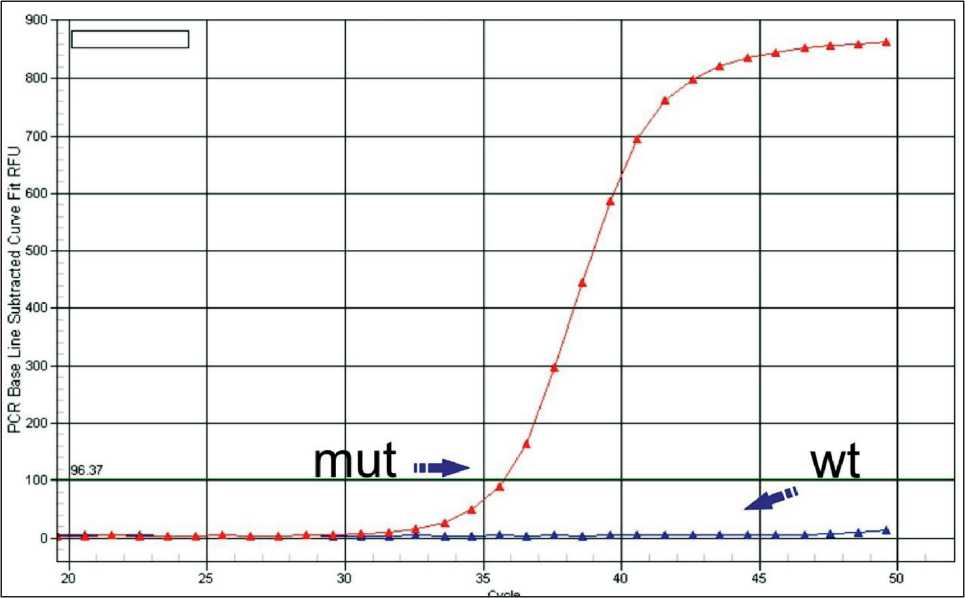
Рис. 1. Кривые амплификации аллель-специфической полимеразно-цепной реакции в реальном времени с образцом, содержащим мутантный аллель BRCA1 и потерю аллеля дикого типа
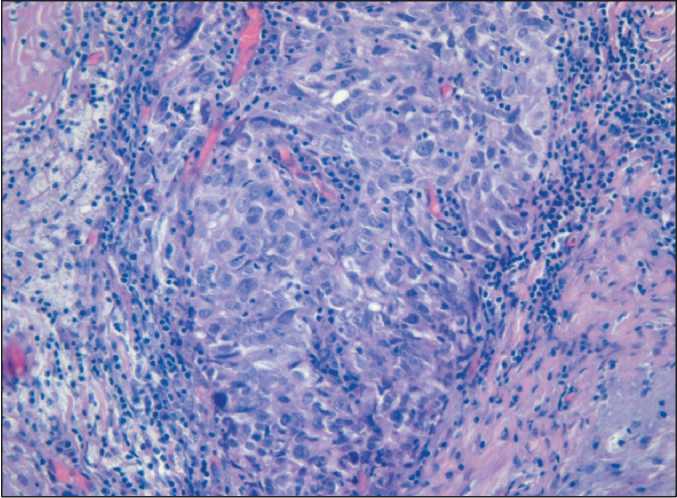
Рис. 2. Микрофото. Серозная карцинома яичника высокой степени злокачественности, окраска гематоксилином и эозином, ×200
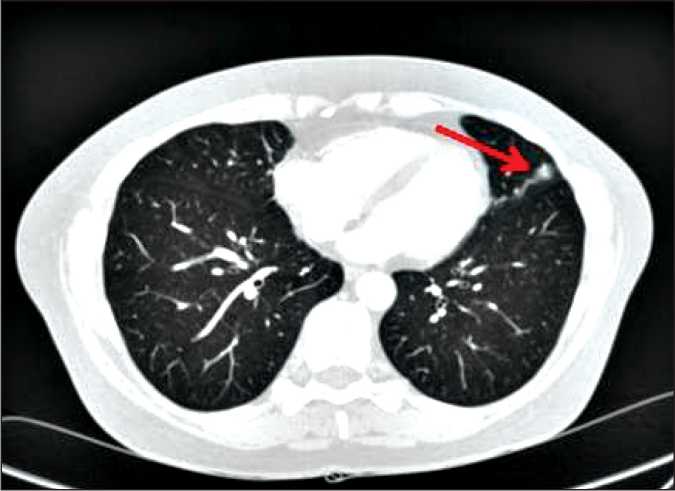
Рис. 4. Компьютерная томограмма грудной клетки с внутривенным контрастированием. Полусферическое утолщение медиастинальной плевры слева на уровне С3 левого лёгкого, январь 2017 г.
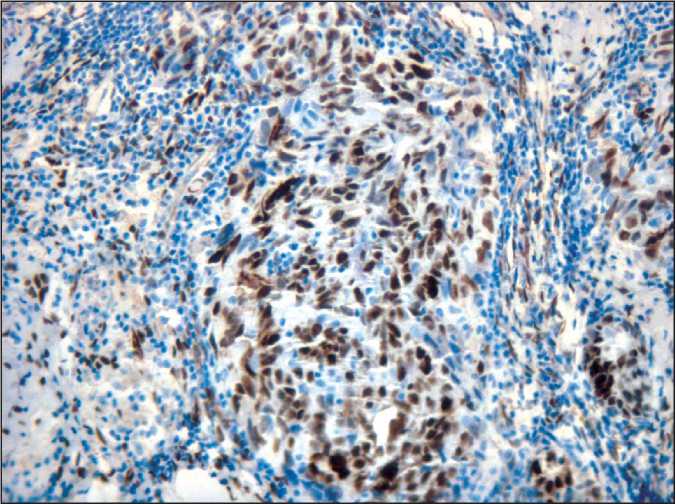
Рис. 3. Микрофото. Серозная карцинома яичника высокой степени злокачественности, положительная ядерная экспрессия WT-1, ×200
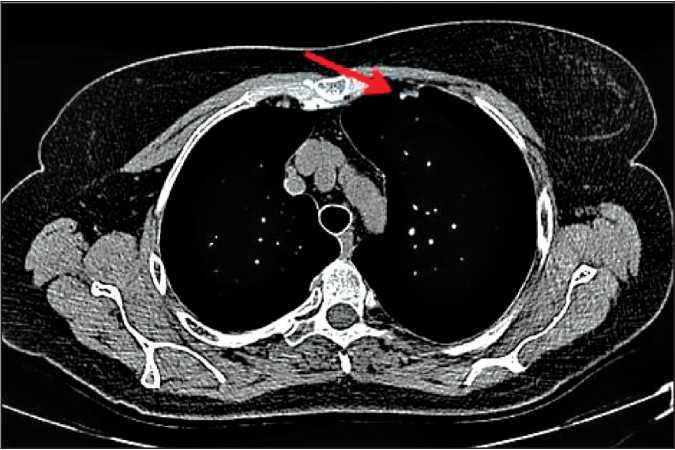
Рис. 5. Компьютерная томограмма грудной клетки с в/в контрастированием. Полусферическое утолщение медиастинальной плевры слева на уровне С3 левого лёгкого, февраль 2017 г.
неоадъювантной ХТ по схеме цисплатин + митомицин С у больных РЯ носительниц мутаций в гене BRCA1. Протокол был одобрен местным комитетом по этике. Пациентка получила 3 цикла комбинированной ХТ по схеме цисплатин 100 мг/м2 и митомицин С 10 мг/м2 каждые 3 нед с достижением полного клинического регресса опухоли (по шкале RECIST 1.1), после чего 12.12.16 выполнена оптимальная циторедуктивная операция в объеме экстирпации матки с придатками, оментэкто-мии. При патоморфологическом исследовании удалённого препарата установлен гистологический тип опухоли: серозная карцинома высокой степени злокачественности левого яичника (рис. 2, 3) (иммуногистохимическое исследование опухолевых клеток: ER, p16, PAX8, WT1 позитивные, p53, PR негативные, Ki67 – 15 %), метастазы в 5 фрагментах большого сальника, 1,8 см в наибольшем измерении, степень регресса опухоли в яичнике – 2, в большом сальнике – 2 (по Bohm, 2015 г.) [9], pT3b. Белые тела, стромальная гиперплазия правого яичника. Затем в адъювантном режиме выполнено 4 цикла полихимиотерапии по той же схеме (последний курс химиотерапии 25.07.16).
Несмотря на то, что определение гистопатологического ответа опухоли на НАХТ широко используется в клинической практике для рака молочной железы, рака толстой кишки, для рака яичника пока нет общепринятой системы [10]. Это связано с тем, что в повседневной клинической практике систематическое назначение неоадъювантной терапии при РЯ стало использоваться не так давно, поэтому критериев оценки гистопатологического регресса, которые были бы рекомендованы для рутинного использования врачами-патоморфологами, в настоящее время не существует. Для оценки гистопатологического регресса в сальнике мы использовали классификацию степеней патоморфоза, предложенную Böhm. Она отличается высокой межнаблюдательной воспроизводимостью, ассоциацией с прогнозом заболевания. Основным критерием оценки по Böhm является общий размер опухолевой массы, которая при выраженном регрессе не должна превышать 2 мм.
При контрольном обследовании в марте 2017 г. на фоне клинической ремиссии по основному заболеванию была проведена компьютерная томография грудной клетки с внутривенным контрастированием, при которой отмечено появление полусферического утолщения медиастинальной плевры слева на уровне S3 левого лёгкого, размерами 13×8 мм (рис. 4, 5).
Пациентке 30.03.17 выполнена диагностическая видеоторакоскопия слева, миниторакотомия слева, резекция язычковых сегментов левого лёгкого. При патоморфологическом исследовании удалённого препарата установлен следующий гистологический тип опухоли: типичный карциноид
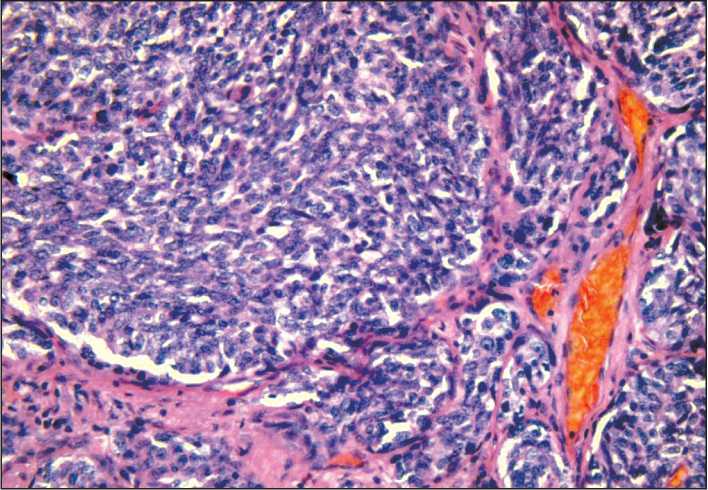
Рис. 6. Микрофото. Типичный карциноид лёгкого, окраска гематоксилином и эозином, ×200
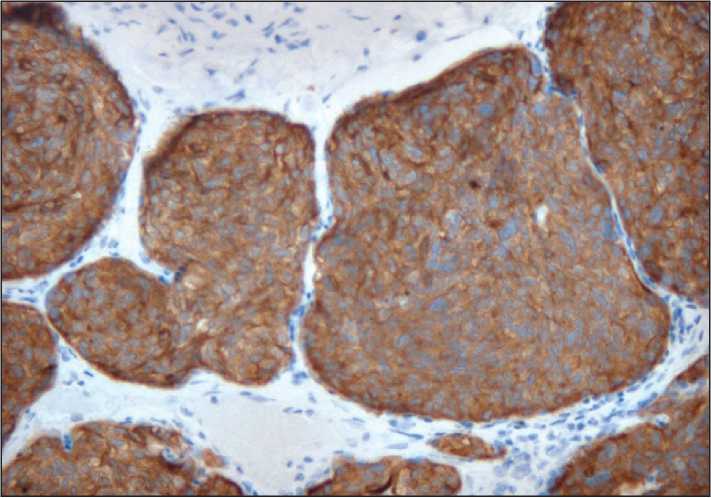
Рис. 7. Микрофото. Типичный карциноид лёгкого, положительная цитоплазматическая экспрессия synaptophysin, ×200
(опухолька/tumorlet) левого легкого (рис. 6, 7) размером 3 мм (иммуногистохимическое исследование опухолевых клеток: CK8, синаптофизин, TTF-1 позитивные, p16, p53 негативные, Ki67 – 2 %). Молекулярный анализ опухолевых клеток карциноида лёгкого выявил потерю гетерозиготности в локусе гена BRCA1 (утрата аллеля дикого типа).
Заключение
BRCA-ассоциированные опухоли характеризуются особенностями клинического течения терапии и занимают особое место среди злокачественных заболеваний. Спектр первично-множественных опухолей у носителей мутации в гене BRCA1 в основном представлен раком молочной железы, раком яичника, раком маточной трубы, тела матки, раком щитовидной железы. Согласно данным литературы и нашим исследованиям, у носительниц мутации развиваются «вторые» опухоли в среднем с интервалом в 7 лет. В клинической практике нашего института мы впервые описываем карциноид лёгкого у носительницы мутации в гене BRCA1, который возник через 8 мес после окончания цитостатической терапии.
Работа поддержана грантом РНФ 14-25-00111.
Список литературы Редкий случай первично-множественной опухоли у носительницы мутации в гене BRCA1: BRCA-ассоциированный рак яичников и карциноид лёгкого
- Brose M.S., Rebbeck T.R., Calzone K.A., Stopfer J.E., Nathanson K.L., Weber B.L. Cancer risk estimates for BRCA1 mutation carriers identified in a risk evaluation program. J Natl Cancer Inst. 2002 Sep 18; 94 (18): 1365-72.
- Kadouri L., Hubert A., Rotenberg Y., Hamburger T., Sagi M., Nechushtan C., Abeliovich D., Peretz T. Cancer risks in carriers of the BRCA1/2 Ashkenazi founder mutations. J Med Genet. 2007 Jul; 44 (7): 467-71. DOI: 10.1136/jmg.2006.048173
- Thompson D., Easton D., Breast Cancer Linkage Consortium. Cancer Incidence in BRCA1 mutation carriers. J Natl Cancer Inst. 2002; 18 (94): 1358-65.
- Antoniou A., Pharoah P.D., Narod S., Risch H.A., Eyfjord J.E., Hopper J.L., Pasini B. Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case Series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet. 2003; 5 (72): 1117-1130.
- Ferrone C.R., Levine D.A., Tang L.H., Allen P.J., Jarnagin W., Brennan M.F., Offit K., Robson M.E. BRCA Germline Mutations in Jewish Patients With Pancreatic Adenocarcinoma. J Clin Oncol. 2009 Jan 20; 27 (3): 433-8. DOI: 10.1200/JCO.2008.18.5546
- Friedenson B. BRCA1 and BRCA2 pathways and the risk of cancers other than breast or ovarian. MedGenMed. 2005 Jun 29; 7 (2): 60.
- Howlett N.G., Taniguchi T., Olson S., Cox B., Waisfisz Q., De Die-Smulders C., Persky N., Grompe M., Joenje H., Pals G., Ikeda H., Fox E.A., D'Andrea A.D. Biallelic inactivation of BRCA2 in Fanconi anemia. Science. 2002 Jul 26; 297 (5581): 606-9. DOI: 10.1126/science.1073834
- O'Donovan P., Livingston D. BRCA1 and BRCA2: breast/ovarian cancer susceptibility gene products and participants in DNA double-strand break repair. Carcinogenesis. 2010 Jun; 31 (6): 961-7. DOI: 10.1093/carcin/bgq069
- Böhm S., Faruqi A., Said I., Lockley M., Brockbank E., Jeyarajah A., Fitzpatrick A., Ennis D., Dowe T., Santos J.L., Cook L.S., Tinker A.V., Le N.D., Gilks C.B., Singh N. Chemotherapy response score: development and validation of a system to quantify histopathologic response to neoadjuvant chemotherapy in tubo-ovarian high-grade serous carcinoma. J Clin Oncol. 2015 Aug 1; 33 (22): 2457-63. DOI: 10.1200/JCO.2014.60.5212
- Said I., Böhm S., Beasley J., Ellery P., Faruqi A.Z., Ganesan R., Hirschowitz L., Jeetle S., Leen S.L., McCluggage W.G., McDermott J., Merard R., Millner T.O., Trevisan G., Vella J., Gilks C.B., Singh N. The Chemotherapy Response Score (CRS): Interobserver Reproducibility in a Simple and Prognostically Relevant System for Reporting the Histologic Response to Neoadjuvant Chemotherapy in Tuboovarian High-grade Serous Carcinoma. Int J Gynecol Pathol. 2017 Mar; 36 (2): 172-79. DOI: 10.1097/PGP.0000000000000307


