Редкое клиническое наблюдение пациента со смешанной нейроэндокринной-не-нейроэндокринной опухолью большого дуоденального соска
Автор: Дроздов Е.С., Грищенко М.Ю., Харитонкин В.И., Лян Н.И., Бородин О.Ю., Фесик Е.А., Короткевич А.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 2 т.22, 2023 года.
Бесплатный доступ
Актуальность. Нейроэндокринные опухоли являются редкими неоплазиями, которые встречаются в 1 % среди всех опухолевых поражений органов пищеварения. В 2010 г. в классификацию нейро-эндокринных опухолей ВОЗ включены смешанные нейроэндокринно-не-нейроэндокринные опухоли (СННО). Данный вид опухоли является чрезвычайно редким и чаще всего встречается в червеобразном отростке, ободочной и прямой кишке. В доступной мировой литературе описано 30 клинических случаев СННО большого дуоденального соска (БДС), в отечественной литературе данная патология не описана. Описание клинического случая. Первым клиническим проявлением заболевания была механическая желтуха. Госпитализирован в дежурный хирургический стационар, проведена эзофагогастродуоденоскопия, выявлено объемное образование БДС. Для купирования желтухи выполнена папиллосфинктеротомия, транспапиллярное стентированиие холедоха пластиковым стентом. На фоне лечения желтуха купирована, получено гистологическое заключение - опухоль БДС верифицирована как аденокарцинома. Пациенту проведено оперативное лечение в объеме гастропанкреатодуоденальной резекции. По результатам послеоперационного иммуногистохимического исследования экспрессия в опухолевых клетках антител: Synaptophysin (клон 27G12) +++, Chromogranin A (5H7) +, CD 57 (NK-1) ++, Ki 67 (Mib 1) 80 %. Заключение: смешанная нейроэндокринная (G3) не-нейроэндокринная карцинома (G2) большого дуоденального соска с ростом в пределах стенки двенадцатиперстной кишки. Метастазы нейроэндокринного компонента в 3 лимфоузлах, метастаз аденокарциномы в 1 из 15 исследованных лимфоузлов; pT2N2M0, СННО high grade (по классификации S. La Rosa). заключение. Смешанные нейроэндокринно-не-нейроэндокринные опухоли БДС являются крайне редкой патологией. Информативность предоперационной морфологической диагностики невысока. При морфологическом исследовании злокачественных опухолей БДС должна учитываться возможность сочетания нейроэндокринной опухоли с аденокарциномой.
Аденокарцинома, большой дуоденальный сосок, нейроэндокринная опухоль, иммуногистохимия
Короткий адрес: https://sciup.org/140298591
IDR: 140298591 | УДК: 616.368-006 | DOI: 10.21294/1814-4861-2023-22-2-168-174
Текст научной статьи Редкое клиническое наблюдение пациента со смешанной нейроэндокринной-не-нейроэндокринной опухолью большого дуоденального соска
Нейроэндокринные опухоли (НЭО) представляют собой гетерогенную группу редких новообразований, которые составляют 1 % всех злокачественных новообразований органов пищеварения [1]. С 2010 г. в гистологическую классификацию НЭО Всемирной организации здравоохранения включены смешанные адено-нейроэндокринные карциномы (MANEC, mixed adenoneuroendocrine carcinoma), которые начиная с 2017 г. переименованы в смешанные нейроэндокринно-не-нейроэндокринные опухоли
(СННО; MiNEN – mixed neuroendocrine-non-neuroendocrine neoplasms), которые характеризуются как смешанные опухоли, состоящие, как минимум, из двух морфологически различных неопластических компонентов, в том числе одного нейроэндокринного, каждый из компонентов составляет не менее 30 % опухолевой массы [2, 3]. Следует отметить, что 30 % отсечка выбрана произвольно и не основывалась на доказанных клинических данных, и к настоящему времени имеются работы, показывающие, что к категории СННО можно относить опухоли, в которых содержание одного из компонентов составляет менее 30 %, поскольку это может быть оправдано с клинической точки зрения, особенно когда один из двух компонентов представлен агрессивным раком, который влияет на прогноз независимо от его количества [4].
СННО – чрезвычайно редкая патология, при которой могут возникать сложности как при диагностике, так и при выборе методики лечения. Основываясь на статистических данных Европейского регистра, заболеваемость СННО составляет менее 0,01/100 000 случаев в год, наиболее частыми локализациями СННО являются червеобразный отросток (60,3 %), ободочная и прямая кишка (14,5 %) и редко гепатопанкреатобилиарная область (1,6 %) [5, 6]. Нейроэндокринный компонент обычно располагается в самых глубоких слоях опухоли, как следствие при проведении эндоскопической биопсии большинство образований до хирургического лечения ошибочно диагностируют как аденокарциному [7].
К настоящему времени в мировой литературе описано около 30 случаев СННО БДС, в отечественной литературе описания случаев данной патологии нами не обнаружено. Согласно ранее опубликованным работам, средний возраст пациентов с данной патологией составляет 77,5 года (от 27 до 89 дет), одинаково часто встречается у мужчин и женщин (1:1,14), возможно ее сочетание с болезнью Реклингхаузена (нейрофиброматоз 1-го типа). Наиболее частыми симптомами СННО БДС, как и других опухолей ампулярной области, являются желтуха (69,2 %), боль (53,8 %), потеря веса (38,5 %) с редкими или малозаметными эндокринными симптомами, несмотря на то, что некоторые из этих опухолей гормонпродуцирующие [7].
Основным методом лечения локализованных СННО является хирургическое вмешательство. Несмотря на свою гетерогенность, часть СННО являются высокоагрессивными новообразованиями с плохим прогнозом, которые следует лечить как ненейроэндокринные виды рака, а не как «классические» НЭО. При местнораспространенных СННО проводится комбинированное лечение (пе-риоперационное или адъювантное). При наличии экспрессии рецепторов соматостатина (SSTR2) дополнительно назначают пролонгированные аналоги соматостатина. Логично, что лечение метастатического СННО должно быть ориентировано на опухолевый компонент, который определяется в метастатическом очаге, поскольку нейроэндокринные и ненейроэндокринные компоненты могут метастазировать как вместе, так и по отдельности [9, 10].
В данной статье описывается редкий случай СННО БДС, которая на дооперационном этапе была верифицирована как аденокарцинома.
Пациент К., 64 лет, в мае 2022 г. отметил появление болей в брюшной полости, желтушность кожных покровов. В порядке скорой медицинской помощи госпитализирован в хирургическое отделение ОГАУЗ «Томская областная клиническая больница». При биохимическом анализе крови отмечалось повышение уровня общего билирубина до 240,3 мкмоль/л, прямого билирубина – до 139 мкмоль/л. Назначена консервативная терапия, проведено дообследование. При ЭГДС визуализировано объемное образование в области большого дуоденального соска. Взята биопсия. Выполнена эндоскопическая папиллосфинктеротомия, транспапиллярное стентированиие холедоха пластиковым стентом. По результатам цитологического исследования данные за аденокарциному большого дуоденального соска. На фоне лечения отмечено снижение уровня билирубина до 86,8 мкмоль/л.
После выписки обратился в ОГАУЗ «Томский областной онкологический диспансер», где 24.06.22 выполнена МРТ органов брюшной полости: печень расположена обычно, но несколько увеличена в размерах, структура однородная, контрастное соединение накапливает равномерно. Внутрипеченочные желчные протоки расширены. Холедох расширен до 9 мм. Воротная вена – 12 мм. Желчный пузырь не увеличен, стенка до 2 мм, равномерно накапливает контраст, конкрементов не определяется. Поджелудочная железа с четкими, мелкобугристыми контурами, структура диффузно-неоднородная, размеры: головка – 30 мм, тело – 16 мм, хвост – 20 мм. Парапанкреатическая клетчатка без изменений. Вирсунгов проток не расширен. В области БДС – объемное образование размером до 4 см, с равномерным накоплением парамагнетика (рис. 1).
23.07.22 пациент госпитализирован в онкологическое отделение «Томский областной онкологический диспансер». При поступлении общее состояние удовлетворительное. Биохимический анализ крови: щелочная фосфатаза – 306,00 Е/л, альбумин – 41,1 г/л, билирубин прямой – 32,3 мкМ/л, билирубин общий –75,4 мкМ/л, АСТ – 46,0 Е/л,
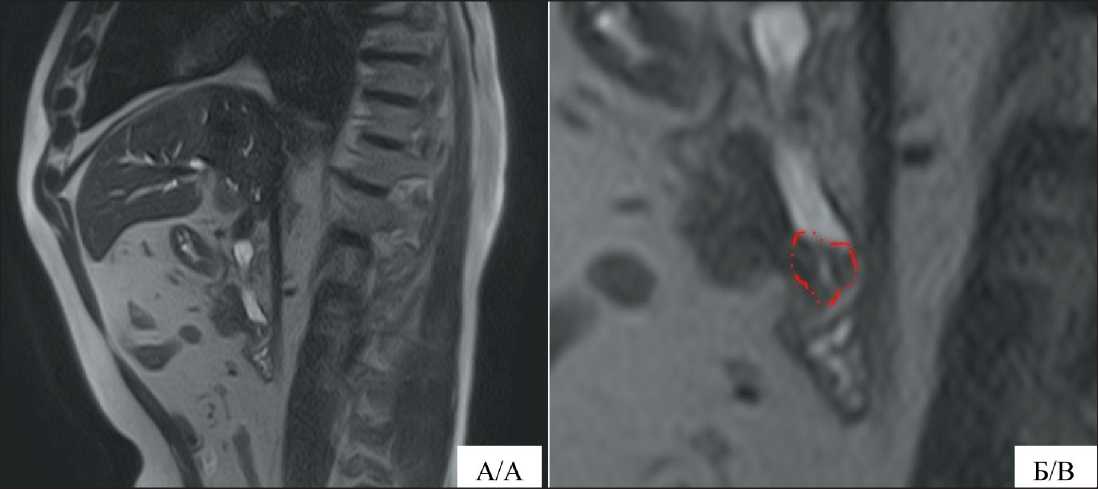
Рис. 1. МРТ брюшной полости: А) Т2-взвешенное изображение в сагиттальной проекции вдоль холедоха; Б) это же увеличенное изображение, красным пунктиром указана область дуоденального соска с карциномой
Fig. 1. MRI of the abdominal cavity: A) T2-weighted image in the sagittal projection along the choledochus; B) the same enlarged image, where the red dotted line indicates the area of the duodenal papilla with carcinoma
АЛТ – 71 Е/л. Онкомаркеры: СА 19–9 –145,7 Ед/мл (норма 0,0–37,0), РЭА – 1,23 нг/мл (норма 0,0–4,0). С учетом данных предоперационного обследования диагноз: рак большого дуоденального соска, стадия IВ сT2N0M0. Показано оперативное лечение.
26.07.22 выполнена гастропанкреатодуоде-нальная резекция. После резекционного этапа сформирован термино-терминальный инвагинаци- онный панкреатоэнтероанастомоз на потерянном стенте, на этой же петле тонкой кишки сформирован однорядный гепатикоэнтероанастомоз, на второй петле – позадиободочный гастроэнтероанастомоз, межкишечное соустье по Ру.
Макропрепарат: после продольного рассечения двенадцатиперстной кишки в области БДС определяется ранее установленный транспапиллярный
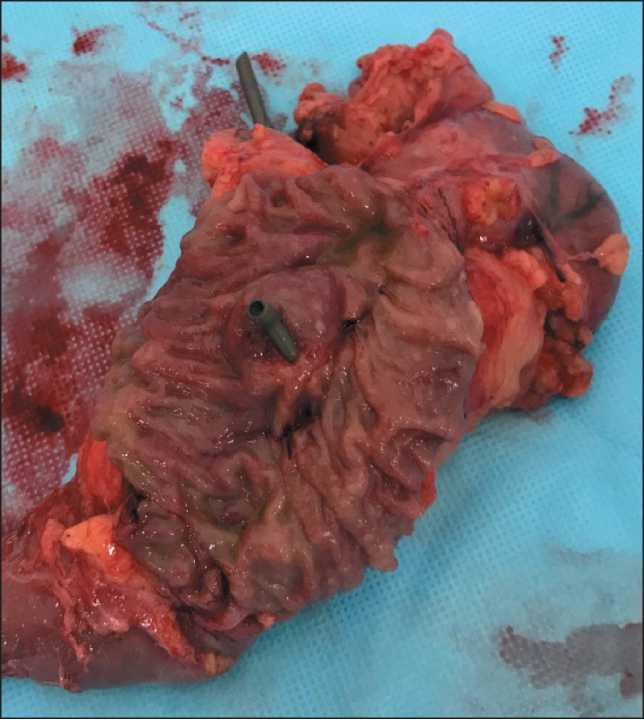
Рис. 2. Макропрепарат. Удаленный гастропанкреатодуо-денальный комплекс. Двенадцатиперстная кишка вскрыта вдоль. В области большого дуоденального соска объемное образование размерами до 4 см, определяется ранее установленный транспапиллярный пластиковый стент Fig. 2. Macrospecimen. The duodenum was opened lengthwise. In the region of the large duodenal papilla, a tumor up to 4 cm in size, a previously installed transpapillary plastic stent is seen
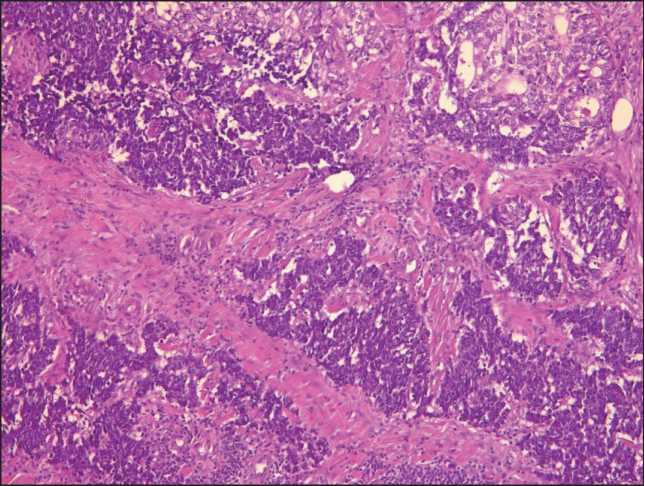
Рис. 3. Микрофото. Солидные поля нейроэндокринной карциномы, состоящей из мелких полиморфных округло-овоидной формы клеток со скудной цитоплазмой, вытянутыми ги-перхромными ядрами. Опухолевые клетки в виде солидных полей, гнезд и ячеек. Среди опухолевых структур отмечаются железисто-криброзные структуры, построенные умереннополиморфными клетками цилиндрической формы с обильной светлой цитоплазмой, округлыми нормо-гипохромными ядрами. Окраска гематоксилином и эозином, ×10
Fig. 3. Microphoto. Solid fields of neuroendocrine carcinoma are visible, consisting of small polymorphic round-ovoid cells with poor cytoplasm, elongated hyperchromic nuclei. Tumor cells in the form of solid fields, nests and cells. Among the described tumor structures, glandular-cribriform structures are noted, built by moderately polymorphic cylindrical cells with abundant light cytoplasm, rounded normo-hypochromic nuclei. Hematoxylin and eosin staining, ×10
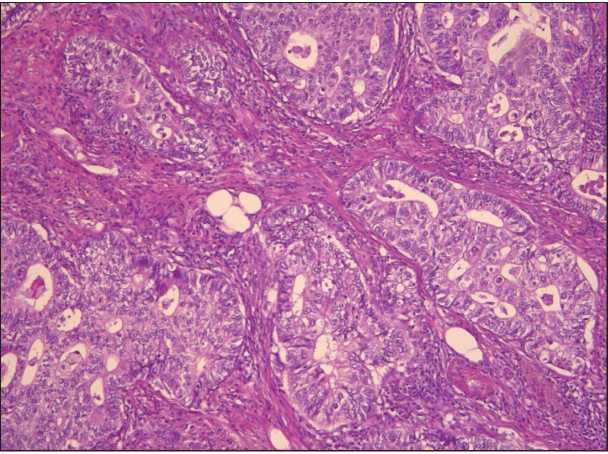
Рис. 4. Микрофото. Железисто-криброзные структуры аденокарциномы, построенные умереннополиморфными циллиндрической формы клетками с обильной светлой цитоплазмой, округлыми нормо-гипохромными ядрами. Окраска гематоксилином и эозином, ×20
Fig. 4. Microphoto. Glandular-cribriform structures of adenocarcinoma, built by moderately polymorphic cylindrical cells with abundant light cytoplasm, rounded normo-hypochromic nuclei.
Hematoxylin and eosin staining, ×20
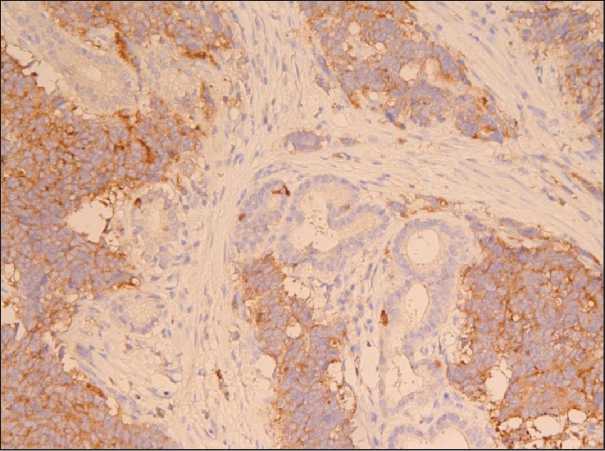
Рис. 5. Иммуногистохимическое исследование. Synaptophysin (клон 27G12). Позитивная цитоплазматическая экспрессия синаптофизина в клетках нейроэндокринной карциномы, в железистых структурах аденокарциномы отсутствует экспрессия синаптофизина. ×10
Fig. 5. Immunohistochemistry. Synaptophysin (clone 27G12). Positive cytoplasmic expression of synaptophysin in the cells of neuroendocrine carcinoma, no expression of synaptophysin in the glandular structures of adenocarcinoma. ×10
пластиковый стент. Большой дуоденальный сосок в виде опухолевого образования размером до 4 см. При рассечении новобразования определяется белесоватая плотная опухолевая ткань, которая прорастает на всю толщу двенадцатиперстной кишки (рис. 2).
Гистологическое исследование: опухоль большого дуоденального соска представлена двумя компонентами, один из которых представлен железисто-криброзными структурами из умеренно полиморфных цилиндрической формы кле- ток. Второй компонент опухоли представлен солидными полями, гнездами и ячейками из мелких, умеренно полиморфных округло-вытянутой формы клеток с гиперхромными ядрами, скудной цитоплазмой (рис. 3, 4). В трех лимфатических узлах метастазы опухоли, построенные мелкими клетками округло-овальной формы, в одном лимфоузле – железисто-криброзного строения
Иммуногистохимическое исследование проводилось автоматизированным методом с использованием иммуногистостейнера Bond-Max.
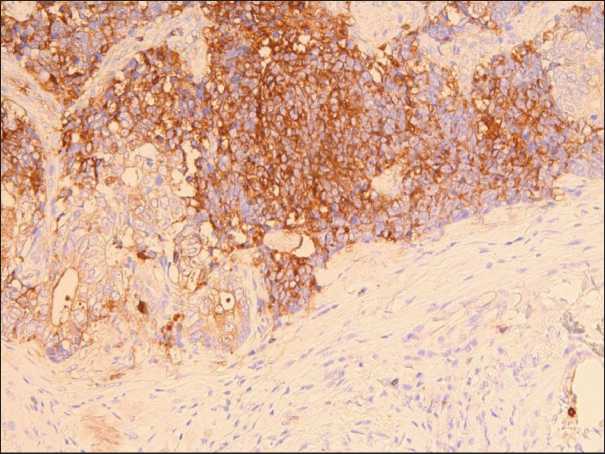
Рис. 6. Иммуногистохимическое исследование. CD57 (клон NK1). Яркая цитоплазматическая экспрессия CD57 в опухолевых клетках нейроэндокринной карциномы и отсутствует экспрессия в железистых структурах аденокарциномы. ×10 Fig. 6. Immunohistochemistry. CD57 (clone NK1). There is a bright cytoplasmic expression of CD57 in tumor cells of neuroendocrine carcinoma and no expression in the glandular structures of adenocarcinoma. ×10
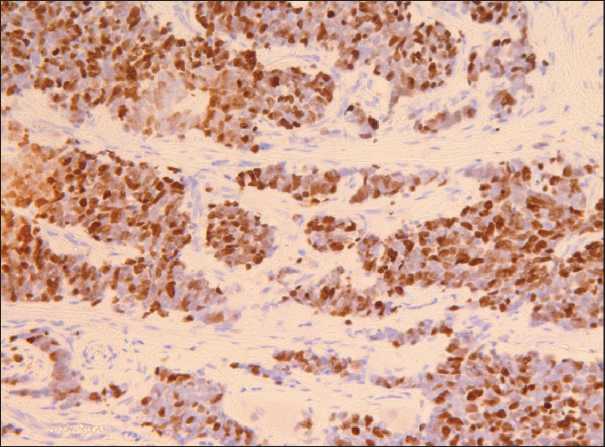
Рис. 7. Иммуногистохимическое исследование. Индекс пролиферативной активности опухоли. Ki67 (клон MIB1). Высокая пролиферативная активность в нейроэндокринной карциноме. Ki67 – 80 %. ×20
Fig. 7. Immunohistochemistry. Tumor proliferative activity index. Ki67 (MIB1 clone). High proliferative activity in neuroendocrine carcinoma. Ki67 – 80 %. ×20
Использованы моноклональные антитела RTU (готовые к применению) и полимерная система визуализации. Для верификации опухоли использовались антитела: Synaptophysin (клон 27G12), произвоидитель Leica Bond, CD57 (клон NK1), производитель Leica Bond, и Ki 67 (клон MIB1) производитель фирмы DAKO. Экспрессия в опухолевых клетках антител: Synaptophysin (клон 27G12) +++, Chromogranin A (5H7) +, CD 57 (NK-1) ++, Ki 67 (Mib 1) 80 % (рис. 5–7). Заключение: смешанная нейроэндокринная (G3) ненейроэндокринная карцинома (G2) большого дуоденального соска с ростом в пределах стенки двенадцатиперстной кишки. Метастазы нейроэндокринного компонента в трех лимфоузлах, метастаз аденокарциномы в 1 из 15 исследованных лимфоузлов. pT2N2M0, СННО high grade (по классификации S. La Rosa).
Послеоперационный период протекал без осложнений, отмечалась эугликемия без дополнительной терапии. Дренажи удалены на 8-е сут. Выписан на 10-е сут после операции. В последующем проведен онкологический консилиум, назначена адъювантная химиотерапия по схеме EP (этопозид, цисплатин).
Заключение
Смешанная нейроэндокринная-не-нейроэндо-кринная опухолю БДС является крайне редкой патологией. Информативность предоперационной морфологической верификации невысока. При морфологическом исследовании злокачественных опухолей БДС должна учитываться возможность сочетания нейроэндокринной опухоли с аденокарциномой.
Список литературы Редкое клиническое наблюдение пациента со смешанной нейроэндокринной-не-нейроэндокринной опухолью большого дуоденального соска
- Lepage C., Bouvier A.M., Faivre J. Endocrine tumours: epidemiology of malignant digestive neuroendocrine tumours. Eur J Endocrinol. 2013; 168(4): 77-83.
- Kim J.Y., Hong S.M., Ro J.Y. Recent updates on grading and classification of neuroendocrine tumors. Ann Diagn Pathol. 2017; 29: 11-6.
- Holmager P., Langer S.W., Kjaer A., Ringholm L., Garbyal R.S., Pommergaard H.C., Hansen C.P., Federspiel B., Andreassen M., Knigge U. Surgery in Patients with Gastro-Entero-Pancreatic Neuroendocrine Carcinomas, Neuroendocrine Tumors G3 and High Grade Mixed Neuroendo-crine-Non-Neuroendocrine Neoplasms. Curr Treat Options Oncol. 2022; 23(6): 806-17.
- La Rosa S. Challenges in High-grade Neuroendocrine Neoplasms and Mixed Neuroendocrine/Non-neuroendocrine Neoplasms. Endocr Pathol. 2021; 32(2): 245-57.
- Ren X., Jiang H., Sun K., Qin X., Qu Y., Xia T., Chen Y. Mixed neuroendocrine-non-neuroendocrine neoplasm of the gallbladder: case report and literature review. Diagn Pathol. 2022; 17(1): 51. 10.1186/ s13000-022-01231-6.
- Добродеев А.Ю., Гороховская В.И., Костромицкий Д.Н., Афанасьев С.Г., Бондарь Л.Н., Авдеенко Т.В., Тарасова А.С., Августинович А.В. Смешанная нейроэндокринная-не-нейроэндокринная опухоль толстой кишки: Редкое клиническое наблюдение. Экспериментальная и клиническая гастроэнтерология. 2021; 11(195): 97-99.
- Zhang L., DeMay R.M. Cytological features of mixed adenoneuroendocrine carcinoma of the ampulla: two case reports with review of literature. Diagn Cytopathol. 2014; 42(12): 1075-84. 10.1002/ dc.23107.
- de Mestier L., Cros J., Neuzillet C., Hentic O., Egal A., Muller N., Bouché O., Cadiot G., Ruszniewski P., Couvelard A., Hammel P. Digestive System Mixed Neuroendocrine-Non-Neuroendocrine Neoplasms. Neuroendocrinology. 2017; 105(4): 412-25.
- Minaya-Bravo A.M., Garcia Mahillo J.C., Mendoza Moreno F., Noguelares Fraguas F., Granell J. Large cell neuroendocrine - Adenocar-cinona mixed tumour of colon: Collision tumour with peculiar behaviour. What do we know about these tumours? Ann Med Surg (Lond). 2015; 4(4): 399-403.
- Frizziero M., Chakrabarty B., Nagy B., Lamarca A., Hubner R.A., Valle J.W., McNamara M.G. Mixed Neuroendocrine Non-Neuroendocrine Neoplasms: A Systematic Review of a Controversial and Underestimated Diagnosis. J Clin Med. 2020; 9(1): 273.


