Редкое наблюдение первичной гепатоидной аденокарциномы легкого
Автор: Тонеев Е.А., Мартынов А.А., Лазаревский М.М., Пикин О.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 2 т.21, 2022 года.
Бесплатный доступ
Актуальность. Гепатоидная аденокарцинома представляет собой карциному с железистой и гепатоцеллюлярной дифференцировкой. Данная разновидность опухоли легкого встречается крайне редко. По данным базы редких клинических наблюдений, опухоль обладает склонностью к раннему метастазированию, агрессивному течению заболевания. Лечебная тактика по ведению данной группы пациентов в настоящее время не выработана ввиду малого количества наблюдений. Наиболее эффективным способом является хирургический метод. В литературе описано всего 51 наблюдение данной патологии. В отечественной литературе настоящее наблюдение является вторым. Описание. Представлен клинический случай гепатоидной аденокарциномы легкого у мужчины 54 лет, у которого при обследовании по поводу новообразования легкого выявлена гепатоидная аденокарцинома. Описаны сложности морфологической диагностики данного гистотипа опухоли, т.к. морфологическое сходство гепатоидной аденокарциномы и гепатоцеллюлярного рака требует комплексного подхода в дифференциальной диагностике данных патологий c целью постановки точного диагноза. Представлена тактика ведения пациента. Заключение. Гепатоидная аденокарцинома легкого представляет собой редкое по гистологической структуре злокачественное новообразование легкого, с неблагоприятным прогнозом, что продемонстировано в нашем наблюдении.
Гепатоидная аденокарцинома легкого, рак легкого
Короткий адрес: https://sciup.org/140293895
IDR: 140293895 | УДК: 616.24-006.66
Текст научной статьи Редкое наблюдение первичной гепатоидной аденокарциномы легкого
В настоящее время алгоритмы лечения данной патологии не разработаны ввиду ее редкой встречаемости, в отечественной литературе описан только один клинический случай гепатоидной аденокарциномы легкого [4]. Поэтому мы хотим представить наше клиническое наблюдение.
Клиническое наблюдение
Пациент Ш., 54 года, обратился в ГУЗ «Областной клинический онкологический диспансер» в ноябре 2020 г. с жалобами на одышку при незначительной физической нагрузке, эпизодическое повышение температуры тела до 37,5 °C. Объективное состояние: индекс Карновского – 60 %, ECOG 2–3 балла. Индекс курящего человека: 30 пачка/лет. При обследовании по месту жительства данных за вирусный гепатит и цирроз печени не получено. Первые симптомы возникли в октябре 2020 г., проходил лечение с подозрением на COVID-19, который не подтвержден. При обследовании грудной клетки выявлено образование корня левого легкого.
Пациенту проведено комплексное обследование в ГУЗ «Областной клинический онкологический диспансер», при котором общеклинические данные не содержали отклонений от нормы, показатели онкомаркеров: АФП в норме. При ФГДС и ФБС органической патологии не выявлено. Мультиспи-ральная компьютерная томография (МСКТ) органов грудной клетки и брюшной полости (19.11.20): в S6 левого легкого образование, размерами 76×92 мм, просвет бронхов сужен. Периферические и внутригрудные лимфатические узлы: надключичные слева, размерами до 19 мм, справа – 21 мм, паратрахеальные – до 23×21 мм, нижние паратрахеальные – 39×23 мм, бифуркационные – до 41 мм, лимфоузлы корня левого легкого в конгломерате 50×49 мм (рис. 1, 2). Печень гомогенной структуры, внутрипеченочные желчные протоки, воротная вена не расширены. Лимфоузлы верхнего этажа брюшной полости не изменены.
С диагностической целью 26.11.20 выполнена биопсия надключичного лимфатического узла слева. Гистологическое заключение: в лимфатическом узле метастаз рака солидного строения, состоящий из крупных клеток с обильной зернистой эозинофильной и амфифильной цитоплазмой, с очаговыми признаками железистой дифференцировки. Подозрение на метастаз гепатоидной аденокарциномы, с учетом анамнеза – из легкого.
Иммуногистохимическое исследование (автоматизированное, иммуногистостейнер Autostainer 360): опухолевые клетки экспрессируют Cytok-eratin pan (клон AE1/AE3), Cytokeratin 7 (клон OVTL12/30), TTF-1 (клон 8G7G3/1) – (цитоплазматическая экспрессия), Anti-Hep-Par-1 (клон OCH1E5), Alpha Fetoprotein (Polyclonal), Cytok-eratin HMW (клон 34BetaE12); не экспрессируют: р63 (клон 7JUL), Synaptophysin (клон 9P11), S100 (клон 4C4.9). Заключение: в лимфоузле метастаз гепатоидной аденокарциномы.
Мультидисциплинарный консилиум врачей в составе торакального хирурга, радиотерапевта и химиотерапевта выставил диагноз: Рак нижней доли левого легкого cT4N3M0 IIIC стадии (TNM8) с метастазами в лимфатические узлы средостения, надключичные лимфатические узлы справа и слева. Назначено: пересмотр гистологических препаратов в UNIM (технопарк Сколково); молекулярно-генетическое исследование мутаций: BRAF, EGFR, ALK, ROS1, PD-L1; химиотерапия + иммунотерапия по схеме паклитаксел + карбоплатин + пембролизумаб.
Заключение UNIM (технопарк Сколково), патологоанатомическое заключение: в лимфатических узлах метастазы низкодифференцированной гепатоидной аденокарциномы без ИГХ-признаков органной специфичности. ALK-статус опухоли – отрицательный, PD-L1 статус – позитивный (TPS 1–49 %). EGFR-статус – отрицательный (1+). ROS1-статус – неопределенный (2+). Дифференциальная диагностика. Реакции АТ: Pax-8 (Polyclonal) – отрицательная, Alpha-Fetoprotein – отрицательная, TTF-1 – отрицательная, СК7- – положительная (+) диффузная, Arginase-1 – положительная (+) очаговая, PD-L1 – (TPS 2 %), ALK – отрицательная, PSA – отрицательная, GATA-3 – отрицательная, CDX2 – отрицательная, CK20 – отрицательная, Napsin A (poly) – отрица- тельная. Микроскопическое описание: в готовых гистологических препаратах фрагменты лимфатических узлов со стертым гистологическим рисунком за счет роста опухоли преимущественно солидного строения из крупных эпителиальных клеток с развитой амфофильной зернистой и мелковаскуолизированной цитоплазмой, с полиморфными округло-овальными ядрами с крупными ядрышками.
Таким образом, при гистологическом исследовании лимфатических узлов выявлены метастазы солидного рака, клетки которого по морфологии (обильная амфифильная зернистая цитоплазма, четкие межклеточные границы) напоминали гепатоциты – имели гепатоидный вид (рис. 3–5).
Иммунофенотип (экспрессия опухолевыми клетками HepPar-1, CK7, необычная цитоплазматическая экспрессия TTF-1) подтверждал
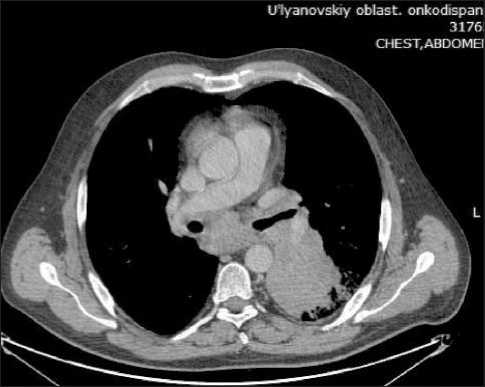
Рис. 1. Опухоль нижней доли левого легкого, метастазы в лимфатические узлы корня легкого, средостения
Fig. 1. Tumor of the lower lobe of the left lung, metastases in lymph nodes of the root of the lung and mediastinum
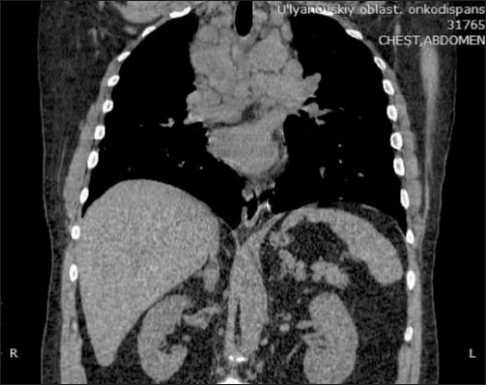
Рис. 2. Метастазы в лимфатические узлы средостения. Печень гомогенной структуры
Fig. 2. Metastases in lymph nodes of the mediastinum. Liver echogenicity is homogeneous
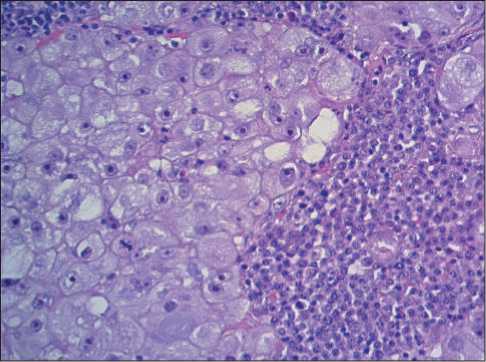
Рис. 3. Микрофото. В лимфатическом узле метастаз солидного рака с гепатоидными чертами клеток. Окраска гематоксилином и эозином, ×20
Fig. 3. Microphoto. Lymph node metastasis of hepatoid carcinoma. Hematoxylin and eosin staining, ×20
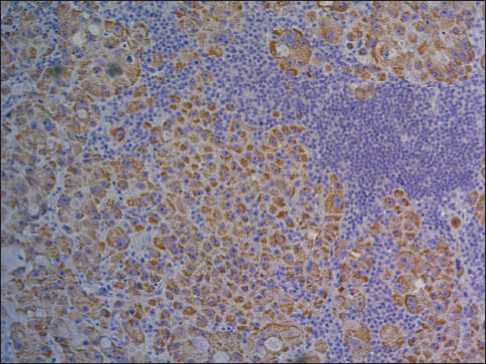
Рис. 4. Микрофото. Иммуногистохимическое окрашивание с антителом к HepPar-1, ×10. Цитоплазматическая экспрессия в опухолевых клетках
Fig. 4. Microphoto. Immunohistochemical staining with antibody to HepPar-1, ×10. Cytoplasmic expression in tumor cells
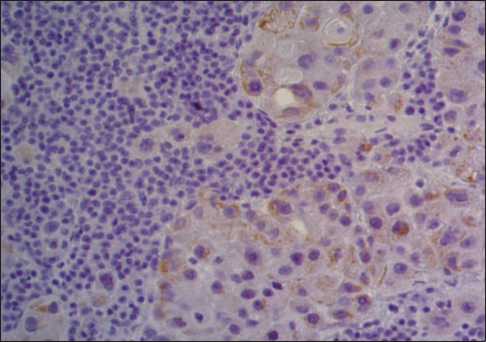
Рис. 5. Микрофото. Иммуногистохимическое окрашивание с антителом к TTF-1, ×20. Необычная цитоплазматическая экспрессия опухолевыми клетками
Fig. 5. Microphoto. Immunohistochemical staining with anti-TTF-1 antibody, ×20. Unusual cytoplasmic expression by tumor cells
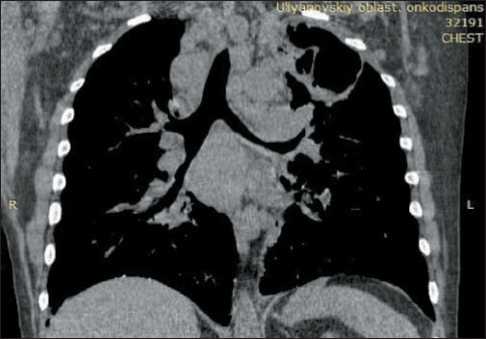
Рис. 6. Полость деструкции легочной ткани в верхней доле левого легкого. Лимфаденопатия средостения
Fig. 6. Cavity of lung tissue destruction in the upper lobe of the left lung. Mediastinal lymphadenopathy
метастаз гепатоидной аденокарциномы и исключал метастаз морфологически сходного гепатоцеллюлярного рака. При проведении дальнейшего ИГХ-исследования в другой лаборатории иммуногистохимические маркеры органной специфичности в опухоли обнаружены не были (отсутствие экспрессии PAX8, GATA3, PSA, CDX2, Napsin A poly).
Пациент получил 1 курс лекарственной терапии, которую перенес удовлетворительно. Выписан в состоянии средней степени тяжести. При повторном обращении состояние пациента расценивалось как тяжелое, ECOG 3–4 балла, индекс Карновского – 30 %, жалобы на выраженную одышку в покое, повышение температуры тела до 38 °С. МСКТ-контроль органов грудной клетки и брюшной полости (23.12.20): прогрессирование процесса в виде увеличения размеров лимфатических узлов, формирование полости деструкции в верхней доле левого легкого (рис. 6). С учетом тяжести состояния рекомендовано симптоматическое лечение. Пациент умер через 2 нед.
Обсуждение
При анализе баз данных PubMed, Google и Google Scholar, eLibrary.Ru установлено, что в настоящий момент в литературе описан 51 случай гепатоидной аденокарциномы легкого. По данным описанных клинических наблюдений, наиболее часто данная патология встречается у мужчин, с длительным анамнезом курения [5]. Наш случай не является исключением, у пациента – длительный анамнез табакокурения. Первичная гепатоидная аденокарцинома является крайне агрессивной опухолью с ранним метастазированием и плохим прогнозом [6]. Эффективным способом лечения ГА является радикальное хирургическое вмешательство. Наиболее длительный период наблюдения после операции – 9 лет – имеется у женщины с ГА легкого IA стадии [7].
H. Ishikura et al. впервые сообщили о гепато-идной аденокарциноме легкого и предложили следующие два диагностических критерия: наличие типичной ацинарной или папиллярной аденокарциномы и наличие компонента карциномы, который напоминает гепатоцеллюлярную карциному и продуцирует АФП [3]. Однако только в 17 из 51 (33,3 %) ранее описанных случаев наблюдались высокие уровни сывороточного АФП (>10 нг/мл) [8]. В 1 (2,7 %) случае уровень АФП в сыворотке был нормальным, а в 13 (50 %) наблюдениях АФП в сыворотке не определялся [9]. Иммуногистохимическое исследование опухоли показало положительную реакцию на АФП в 31 (60,8 %) из 51 случая, а 21 (41,1 %) из 51 случая были отрицательными на АФП. В нашем случае мы не выявили продукцию АФП опухолевыми клетками, что подтверждено дважды [10].
При первичной аденокарциноме легкого частота соматических мутаций составляет около 50 %, в нашем случае соматических мутаций BRAF, EGFR, ALK, ROS1 не выявлено, таким образом, провести эффективную терапию таргетными препаратами не представлялось возможным. Статус PD-L1 был положительным, мы использовали при лечении комбинацию химиотерапия + пембро-лизумаб, использование данной комбинации возможно без определения PD-L1-статуса, согласно рекомендациям АОР и NCCN [11–13]. V. Basse et al. сообщили, что при лечении ГА легкого возможно использование ингибиторов PD-L1, несмотря на отсутствие экспрессии PD-L1 [14]. К сожалению, в нашем случае необходимого эффекта при назначении комбинации цитостатиков и пембролизумаба мы не получили.
Таким образом, морфологическое сходство ге-патоидной аденокарциномы и гепатоцеллюлярного рака требует комплексного подхода в дифференциальной диагностике данных патологий [15, 16].
Однако ввиду редкости данного новообразования единого протокола лечения не существует, и, как правило, при распространенных формах опухоли прогноз неблагоприятный [17, 18].
Список литературы Редкое наблюдение первичной гепатоидной аденокарциномы легкого
- NargundA., AgrawalM., Dharmalingam P., Amirtham U., PaiM. Primary hepatoid adenocarcinoma of the lung: A study of two cases with review of literature. Indian J Med Paediatr Oncol. 2020; 41(4): 591-5 doi: 10.4103/ijmpo.ijmpo_245_19.
- Pasricha S., Grover S., KambojM., BansalD., Batra U., Gupta G., Sharma A., Durga G., JajodiaA., BKoyyala V.P., Mehta A. Hepatoid adenocarcinoma of lung: A diagnostic challenge - Series of six cases with histo-pathological, predictive molecular and PD.L1 assessment. Indian J Pathol Microbiol. 2021; 64(1): 128-31. doi: 10.4103/IJPM.LJPM_334_20.
- Ishikura H., Kanda M., Ito M., Nosaka K., Mizuno K. Hepatoid adenocarcinoma: a distinctive histological subtype of alpha-fetoprotein-producing lung carcinoma. Virchows Arch A Pathol Anat Histopathol. 1990; 417(1): 73-80. doi: 10.1007/BF01600112.
- Паклина О.В., Сетдикова Г.Р., Гордиенко Е.Н., Никитин П.Н. Гепатоидная аденокарцинома легкого с множественными местастаза-ми в тонкую кишку. Архив патологии. 2011; 73(2): 40-2. [Paklina O. V., Setdikova G.R., GordienkoE.N., NikitinP.N. Hepatoid adenocarcinoma of the lung with multiple metastases to the small intestine. Pathology Archive. 2011; 73(2): 40-2. (in Russian)].
- Carlinfante G., FoschiniM.P., Pasquinelli G., ScottiR., CavazzaA. Hepatoid carcinoma of the lung: a case report with immunohistochemical, ultrastructural and in-situ hybridization findings. Histopathology. 2000; 37(1): 88-9. doi: 10.1046/j.1365-2559.2000.00955-5.x.
- Haninger D.M., Kloecker G.H., Bousamra Ii.M., Nowacki M.R., Slone S.P. Hepatoid adenocarcinoma of the lung: report of five cases and review of the literature. Mod Pathol. 2014; 27(4): 535-42. doi: 10.1038/ modpathol.2013.170.
- Motooka Y., Yoshimoto K., Semba T, Ikeda K., Mori T., Honda Y., IyamaK., SuzukiM. Pulmonary hepatoid adenocarcinoma: report of a case. Surg Case Rep. 2016; 2(1). doi.org/10.1186/s40792-016-0129-6.
- Nasu M., Soma T., Fukushima H., Kudo K., Matsubara O. He-patoid carcinoma of the lung with production of alpha-fetoprotein and abnormal prothrombin: an autopsy case report. Mod Pathol. 1997; 10(10): 1054-8.
- Su J.S., Chen Y.T., Wang R.C., Wu C.Y., Lee S.W., Lee T.Y. Clini-copathological characteristics in the differential diagnosis of hepatoid adenocarcinoma: a literature review. World J Gastroenterol. 2013; 19(3): 321-7. doi: 10.3748/wjg.v19.i3.321.
- Miyama Y., Fujii T., Murase K., Takaya H., Kondo F. Hepatoid adenocarcinoma of the lung mimicking metastatic hepatocellular carcinoma. Autops Case Rep. 2020; 10(2). e2020162. doi.org/10.4322/ acr.2020.162.
- КазанцеваМ.А., Бредер В.В., Лактионов K.K. Иммунотерапия гепатоцеллюлярного рака: начало и перспективы. Медицинский Совет. 2019; (10): 15-21. [KazantsevaM.A., Breder V.V., LaktionovK.K. Immu-notherapy for hepatocellular cancer: beginning and future perspectives. Medical Council. 2019; (10): 15-21. (in Russian)]. doi: 10.21518/2079-701X-2019-10-15-21.
- Paz-AresL., Luft A., VicenteD., TafreshiA., Gümü¡M., Mazières J., Hermes B., Çay í¡¡enler F., Csöszi T., Fülöp A., Rodríguez-Cid J., Wilson J., Sugawara S., Kato T., Lee K.H., Cheng Y., Novello S., Halmos B., Li X., Lubiniecki G.M., Piperdi B., Kowalski D.M.; KEYNOTE-407 Investigators. Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer. N Engl J Med. 2018; 379(21): 2040-51. doi: 10.1056/ NEJMoa1810865.
- GandhiL., Rodríguez-AbreuD., Gadgeel S., EstebanE., FelipE., De Angelis F., Domine M., Clingan P., Hochmair M.J., Powell S.F., Cheng S.Y., Bischoff H.G., Peled N., Grossi F., Jennens R.R., Reck M., Hui R., Garon E.B., Boyer M., Rubio-Viqueira B., Novello S., Kurata T., Gray J.E., Vida J., Wei Z., Yang J., Raftopoulos H., Pietanza M.C., Ga-rassinoM.C.; KEYNOTE-lS9Investigators. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med. 2018; 378(22): 2078-92. doi: 10.1056/NEJMoa1801005.
- Basse V., Schick U., Guéguen P., Le Maréchal C., Quintin-Roué I., Descourt R., Simon H., Uguen A., Quéré G. A Mismatch Repair-Deficient Hepatoid Adenocarcinoma of the Lung Responding to Anti-PD-L1 Dur-valumab Therapy Despite no PD-L1 Expression. J Thorac Oncol. 2018; 13(7). doi: 10.1016/j.jtho.2018.03.004.
- Shao Y., Zhong D.S., Wang D., Ma L. Hepatoid adenocarcinoma of the lung: A case report. Int J Clin Exp Pathol 2016; 9: 4067-72.
- Ayub A., Nunez Lopez O., BoothA., Okereke I. Pulmonary hepatoid adenocarcinoma. J Thorac Cardiovasc Surg. 2019; 158(4): 139-40. doi: 10.1016/j.jtcvs.2019.06.023.
- Kuan K., Khader S.N., El Hussein S. Hepatoid adenocarcinoma of the lung. Diagn Cytopathol. 2019; 47(8): 831-3.
- Tonyali O., Gonullu O., OzturkM.A., KosifA., Civi O.G. Hepatoid adenocarcinoma of the lung and the review of the literature. J Oncol Pharm Pract. 2020; 26(6): 1505-10. doi: 10.1177/1078155220903360.


