Редкоземельные элементы в ядерной медицине
Автор: Кодина Г.Е., Кулаков В.Н., Шейно И.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Радиационная медицина
Статья в выпуске: 4 т.10, 2014 года.
Бесплатный доступ
В обзоре рассмотрены основные направления применения стабильных и радиоактивных изотопов редкоземельных элементов в технологиях ядерной медицины — радионуклидной диагностике и терапии, а также магнитно-резонансной томографии и бинарных технологиях лучевой терапии.
Лучевая артерия, радионуклидная диагностика
Короткий адрес: https://sciup.org/14918065
IDR: 14918065
Текст научной статьи Редкоземельные элементы в ядерной медицине
Реально применение в радионуклидной диагностике нашли только 169Yb и 167Tm. 169Yb в течение нескольких лет (1970–1980-е годы) использовали, в том числе и в СССР, в виде комплекса 169Yb-ДТПА (диэтилентриаминпентатацетат) для определения скорости клубочковой фильтрации почек при различных заболеваниях, а также для диагностики опухолей головного мозга методом сцинтиграфии. Однако к недостаткам препарата можно отнести достаточно большой период полураспада (31,8 сут) радионуклида и наличие в спектре γ-излучения относительно «жестких» линий — 0,177 МэВ (22%), 0,198 МэВ (35%), 0,308 МэВ (10%). Это явилось причиной отказа от использования препарата с появлением дешевого, доступного и оптимального по своим характеристикам аналога — комплекса 99mТс (отечественный РФП «Пентатех, 99mТс» широко применяется в течение более 30 лет).
Поисковые исследования по препаратам тулия-167 в течение длительного периода (1970– 1990-е годы) проводились во многих странах. В ФГБУ ГНЦ ФМБЦ им. А. И. Бурназяна ФМБА России (до 2007 г. — ГНЦ-Институт биофизики) были разработаны остеотропные РФП «Тулинитат,167Tm» (комплекс с нитрилотриацетатом) и «Тулинифор,167Tm» (комплекс с нитрилотриметиленфосфоновой кислотой) [2]. По результатам клинических испытаний препараты были рекомендованы к клиническому применению, однако оказались значительно дороже (радионуклид получают на циклотроне) аналогичных РФП 99mТс и поэтому не были приняты к выпуску производством.
-
2. Радионуклиды РЗЭ в лучевой терапии.
-
2.1. Лечение с применением закрытых источников ионизирующих излучений
-
В течение многолетней истории применения закрытых источников в медицине использовали более 20 радионуклидов, среди которых в давно уже ставших классическими пособиях [3, 4] упоминаются 147Pm, 148Pm, 177Lu, хотя их применяли не так широко, как, например, 60Co или 192Ir.
В последнее десятилетие активно публикуются сведения о высокодозной брахитерапии (ВДБ) с закрытыми источниками иттербия-169 [5–8], которые извлекают из облучаемого очага по окончании курса лечения. 169Yb обладает некоторыми преимуществами в части ядерно-физических свойств в сравнении с рутинными для ВДБ радионуклидами 192Ir и 60Сo. К
основным преимуществам ВДБ на основе 169Yb можно отнести:
— более мягкий спектр излучения, по сравнению с аналогичным по возможности набора активности Ir-192 источником, на порядок снижающий требования к защите медицинского персонала (к тому же не требуется строительство каньонов);
— более жесткий спектр, чем у 125I и 103Pd, что является наиболее подходящим для лечения рака молочной железы, где требуется большая глубина проникновения излучения;
— возможность применения микроисточников для лечения поверхностных раков (рак кожи, меланомы и др.), а также терапии раковых заболеваний области «голова — шея» (рак слюнной железы, гортани и пр.).
Особую ценность ВДБ с 169Yb приобретает благодаря возможности органосохранной терапии (в первую очередь рака молочной железы и рака простаты). В настоящее время в российской практике наиболее широко распространенной методикой терапии рака являются: хирургическое удаление опухоли и близлежащих тканей с последующим курсом (радио) химиотерапии. Применение ВДБ позволит сохранять органы, что является критически важным для пациентов.
Приоритетные направления применения 169Yb при комплексном лечении онкологических заболеваний: меланома любой локализации, внутриэпителиальные неоплазии яичка, саркомы, плоскоклеточный рак головы и шеи, рак шейки матки, рак эндометрия, рак прямой кишки, рак мочевого пузыря, рак предстательной железы, рак молочной железы, немелкоклеточный рак легкого и другие. В настоящее время метод находится в стадии развития.
-
2.2. Лечение с применением радиофармацевтических препаратов (РФП). В последние годы интенсивно развивается лучевая терапия открытыми источниками радионуклидов, которая является эффективным средством как самостоятельного, так и комбинированного лечения больных. В английской аббревиатуре метод называется OST (Open Sources Therapy) или ERT (EndoRadionuclide Therapy). В русскоязычной литературе принят термин «радионуклидная терапия» (РНТ). Эти методы особенно эффективны в лучевой терапии злокачественных лимфом, рака щитовидной железы, гормонозависимых опухолей, при метастатическом поражении скелета и лимфатической системы, ревматоидных артритах и др.
В РФП терапевтического назначения радионуклид является основным лечебным началом, позволяющим локализовать лечебную дозу излучения непосредственно в органе-мишени или, иногда, в пораженных клетках и, соответственно, обеспечить минимальное облучение окружающих здоровых клеток органов и тканей. В зависимости от характера и локализации патологического процесса для радиотерапии используют [1]:
β — -излучатели с энергиями β-частиц в области 200–2000 кэВ;
α-излучатели с высокой линейной передачей энергии (ЛПЭ~100 кэВ/мкм) и коротким пробегом частиц (50–100 мкм);
радионуклиды, распадающиеся электронным захватом (ЭЗ) или внутренней электронной конверсией (ВЭК).
В отличие от диагностических процедур радионуклиды РЗЭ оказались весьма эффективными для
До лечения
Через 1 год
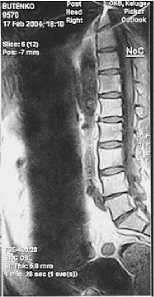
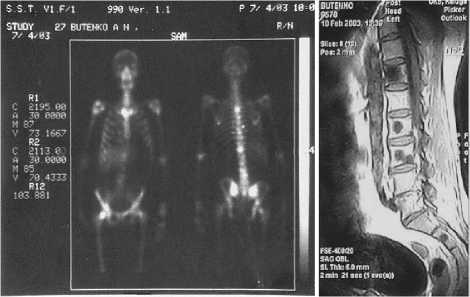
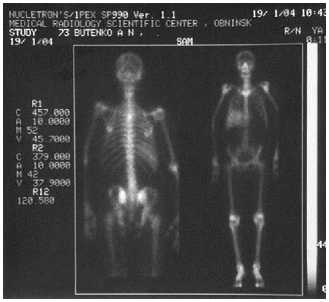
Рис. 1. Результаты радионуклидной терапии метастатических очагов у больного после двух введений (90 МКи с интервалом через 6 мес) самария-оксабифора, 153Sm применения в различных схемах терапии открытыми источниками. В табл. 1 перечислены наиболее полезные из них.
В основном в настоящее время используют 153Sm, 166Ho и 177Lu. При этом наличие в спектре излучения каждого из этих радионуклидов γ-линий обеспечивает возможность визуализации очагов накопления соответствующего РФП в организме и мониторинга лечения.
153Sm используют для лечения метастатических поражений скелета с конца 1990-х годов. Следует отметить, что практически первым препаратом 153Sm, примененным для РНТ, был отечественный РФП «Самарий оксабифор,153Sm» (комплекс с тетраме-тиленфосфонатом-оксабифором), разработанный в ГНЦ ФМБЦ им. А. И. Бурназяна и защищенный патентом РФ [9, 10]. К настоящему времени РНТ с этим препаратом проведена более тысячи пациентам. На рис. 1 представлены результаты лечения одного из пациентов.
С 2002 г. на международном рынке появился и успешно применяется аналогичный РФП «Quadramet,153Sm» (фирма IВА, Бельгия — Франция).
В результате исследований нескольких РФП на основе гольмия-166 коммерчески доступные препараты на международном рынке не появились, хотя в нескольких странах были предложены и успешно испытаны такие препараты, как 166Ho-DOTMP (тетрафосфонат, множественнная миелома), 166Ho-FHMA (макроагрегаты гидроксида железа, радиосиновек-томия) [11], описаны препараты на основе антител и пептидов, меченных 166Ho. Одним из негативных моментов, предположительно обусловивших сни- жение интереса исследователей к 166Ho, можно считать трудность его получения на реакторе без примеси долгоживущего метастабильного изотопа 166mHo (T1/2=1200 лет), имеющего жесткое (>1000 кэВ) γ-излучение [12].
Наибольший интерес среди терапевтических радионуклидов РЗЭ исследователи проявляют к лютецию-177, которому посвящено большинство современных публикаций в области радионуклидной терапии. Этот радионуклид имеет достаточно «выгодные» с точки зрения РНТ ядерно-физические и химические свойства. Так, относительно низкая энергия βˉ-излучения (см. табл. 2) обусловливает его невысокую проникающую способность в биологических тканях (пробег ˂1мм), что позволяет использовать 177Lu в терапии опухолей небольшого размера. Значимый выход γ-квантов с энергией около 208 кэВ дает возможность визуализировать биологическое распределение радионуклида и выполнить корректный расчет требуемых и полученных доз облучения органов и тканей. Период полураспада 177Lu (6,7 сут) позволяет осуществлять доставку РФП на достаточно большие расстояния от места их производства [13].
Химические свойства лютеция (Lu3+) хорошо изучены, высокая устойчивость его комплексных соединений с бифункциональными хелатирующими агентами (ДТПА, ДОТА [14] и др.), химическое и биологическое поведение, аналогичное в некоторых случаях таковому для соединений галлия и иттрия, дает возможность применять разработанные ранее методики синтеза меченых соединений, входящих в состав РФП 68Ga и 90Y.
Радионуклиды для терапии открытыми источниками [1]
Таблица 1
|
Радионуклид |
T 1/2 |
Тип распада |
Средняя энергия β-излучения и энергии наиболее интенсивных α- и γ-излучений, кэВ |
|
149 Tb |
4,1 ч |
ЭЗ; β+; α |
α 3967; γ 165, 362,3 |
|
153Sm |
46,7 ч |
β — |
223,2; γ 103,2 |
|
159 Gd |
18,6 ч |
β — |
254; γ 363,3 |
|
166Ho |
26,8 ч |
β — |
668; γ 80,6 |
|
169 Er |
9,4 сут |
β — |
99,1 |
|
170Tm |
128,6 сут |
β — |
315,5; γ 84,3 |
|
175 Yb |
4,2 сут |
β — |
142; γ 396,3 |
|
177Lu |
6,7 сут |
β — |
136,8; γ 208,4 |
Таблица 2
|
Электронная эмиссия |
Фотонная эмиссия |
||||||
|
Радионуклид |
Период полураспада |
Тип |
Энергия (MeV) |
Вероятность (на 100 распадов) |
Тип |
Энергия (MeV) |
Вероятность (на 100 распадов) |
|
|||||||
|
Самарий-153 (153Sm) |
46,3 часа |
β- ce |
0,200 (макс: 0.635) 0,226 (макс: 0,705) 0,265 (макс: 0,808) 0,021 0,055 0,095 |
32,2 49,6 17,5 21,7 43,2 6,44 |
X γ |
0,006 0,041 0,042 0,047 0,070 0,103 |
12,0 17,5 31,7 12,4 4,85 29,8 |
|
Гольмий-166 (166Ho) |
26,8 час |
β- e A ce |
0,651 (макс: 1,773) 0,694 (макс: 1,854) 0,006 0,023 0,071 0.078 |
48,7 50,0 27,8 11,5 26,5 6.44 |
X γ |
0,007 0,048 0,049 0,081 |
8,3 3,1 5,5 6,71 |
|
Лютеций-177 (177Lu) |
6,65 сут |
β- e A ce e A ce |
0,048 (макс: 0,177) 0,110 (макс: 0.385) 0,149 (макс: 0.498) 0,044 0,112 0,143 5,540 5,607 5,716 5,747 0,009 0,024 0,046 0,056 0,171 |
11,61 9,1 79,4 0,27 0,48 0,57 9,0 25,2 51,6 9,0 28 7,5 12,7 18,5 9,3 |
γ γ |
0,208 0,081 0,084 0,095 0,154 0,269 |
10,36 15,3 25,4 11,5 5,7 13,9 |
Примечание:eA – электроны Оже; ce – электроны конверсии; β- – электроны; γ – гамма-излучение; X – рентгеновское излучение.
Основные физические характеристики 153Sm, 166Ho, 177Lu [13]
Открытие в опухолевых клетках рецепторов, способных взаимодействовать с природными пептидами, а также развитие химии и технологии синтетических пептидов обусловили появление нового класса РФП ‒ меченых пептидов. Развитие этого направления было связано с появлением в первую очередь диагностических РФП на основе производных октреотида с 111In (ОФЭКТ) и 68Ga (ПЭТ) для визуализации нейроэндокринных опухолей (НЭО). Еще в 1998 г. было показано [15], что высокодифференцирован- ные НЭО характеризуются низкой скоростью метаболизма и соответственно низким потреблением глюкозы, делающим 18F-ФДГ неподходящей для оценки высокодифференцированных форм этих опухолей. Позже Антунес с соавт. [16] сообщил о том, что мечение 68Ga имеет преимущества по сравнению с другими изотопами.
Практически параллельно с созданием новых диагностических технологий для НЭО были предложе- ны методы РНТ с использованием аналогичных препаратов, содержащих пептиды, меченные 90Y и 177Lu.
Для этой группы радионуклидов возникли проблемы получения собственно радионуклида с требуемыми характеристиками. Речь идет в первую очередь о необходимой величине удельной активности получаемого радионуклида и объемной активности растворов, используемых для приготовления РФП. Препараты нового поколения представляют собой в большинстве случаев меченые антитела или пептиды. Реакции мечения, как правило, реализуется посредством бифункциональных хелатирующих агентов (БХА), которые могут присоединяться к молекулам биологически активного соединения, с одной стороны, и, с другой стороны, имеют хелатирующие группировки, способные связывать катионы металлов. Концентрации биоконъюгатов в составе РФП крайне малы и составляют несколько микрограммов. Поэтому для получения высокого выхода в реакции мечения исходные растворы радионуклидов в идеальном случае не должны содержать примесей других элементов и стабильных изотопов целевого радионуклида, а требуемое количество активности должно находиться в малом объеме раствора. Достаточно часто минимальные дозировки составляют 500–2000 МБк в объеме 50–100 мкл при удельной активности не менее 1000 МБк/мкг. При этом термин «удельная активность» в современной литературе трактуется как отношение активности радионуклида к общему весовому количеству любых веществ, присутствующих в растворе. Часто в спецификациях на раствор радионуклида нормативы по примесям показывают в мкг/МБк (ГБк) на установленную дату поставки радионуклида. В таком случае допустимым уровнем считают не более 1–2 мкг/ГБк. Крайне жесткие требования предъявляются также к радионуклидной чистоте исходных растворов радионуклидов.
Для получения радионуклида 177Lu могут быть использованы следующие способы:
«прямой» — облучение нейтронами ядерного реактора стартового материала, содержащего 176Lu;
«непрямой» — облучение нейтронами ядерного реактора стартового материала, содержащего 176Yb.
Помимо удельной активности, важным параметром качества 177Lu является относительное содержание долгоживущего изомера 177mLu (T1/2=160,4 сут). Оптимальные характеристики целевого радионуклида (максимальная удельная активность и радионуклидная чистота) достигаются при использовании «прямого» способа только в высокопоточных реакторах (Ф=2·1015 н·см-2с-1 (только два в мире: HFIR, США, Оак-Ридж и СМ 3, Россия, Димитровград). Удельная активность 177Lu, полученного нейтронным облучением 176Yb, не зависит от плотности потока тепловых нейтронов, а расчетное соотношение активностей 177mLu/177Lu не превышает величину 1·10–5 в широком интервале изменения условий облучения. Однако для реализации «непрямого» способа необходимо использовать стартовый материал, не содержащий примесей природных изотопов лютеция. Работы по созданию промышленных технологий получения 177Lu с требуемыми для медицины характеристиками проводятся в нескольких странах, в том числе достаточно успешно в России (НИИАР, Димитровград). Поставки сырьевого радионуклида выполняются в течение последних трех лет, начаты пробные поставки особо чистого 177Lu хлорида.
По химическому составу наиболее приемлемыми вариантами для исходных растворов радионуклидов являются слабокислые растворы HCl (0,1–0,01 Моль/л). К настоящему времени перечисленные проблемы решаются с помощью специальных устройств — модулей синтеза РФП, в которых одновременно проводят ионообменную очистку от примесей и концентрирование раствора радионуклида, а также собственно синтез препарата. При этом общее время процесса занимает не более 30 мин. Конструкционно модули позволяют выполнять процедуры очистки и синтеза аналогичных по химическому составу как диагностических, так и терапевтических РФП.
Именно в публикациях последних лет в области ядерной медицины появился термин «тераностика» ( Theranostics ) [17], образованый от слияния слов « тера пия» и «диаг ностика » и применяемый для технологий диагностики и лечения заболевания индивидуального пациента (персонализированная медицина), когда на основе визуализации патологического очага определяются тактика лечения и дозировки. Этот термин имеет и более широкое значение при использовании не только радионуклидных, но и других технологий, например МРТ-визуализация и бинарные лучевые технологии с препаратами гадолиния (см. следующий раздел), а также комбинированных схем визуализации (ОФЭКТ/КТ, ПЭТ/КТ, ПЭТ/ МРТ) и терапии. В радионуклидных тераностических схемах наиболее часто предлагается на основе ПЭТ/ КТ-исследований, выполненных с 68Ga, проводить РНТ с 177Lu и/или 90Y, что уже успешно использовано в лечении целого ряда онкологических заболеваний [17, 18].
-
3. Соединения стабильного гадолиния в магнитно-резонансной томографии и бинарных технологиях радиационной терапии злокачественных опухолей. На сегодняшний день в мировой клинической практике использование контрастных средств для получения изображения с помощью магнитно-резонансной томографии (МРТ) стало обязательным условием исследований больных любого клинического профиля.
При проведении МРТ с контрастом практическое значение имеют только гадолинийсодержащие препараты. Гадолиний является парамагнетиком и образует прочные комплексы с различными полиден-тантными лигандами. В табл. 3 приведены основные
Таблица 3
Контрастные вещества, содержащие гадолиний (Gd3+) [19]
|
Название МРКС |
Химическое соединение |
Сокращенное обозначение |
Производитель |
|
Омнискан |
Гадодиамид |
Gd-DTPA-BMA |
Nycomed Австрия |
|
Магневист |
Гадопентетата димеглумин |
Gd-DTPA |
Schering Германия |
|
Мультиханс |
Гадобената димеглумин |
Gd-BOPTA |
Braeco Италия |
|
Примовист |
Гадоксетовой кислоты динатриевая соль |
Gd-EOB-DPTA |
Байер Шеринг АГ (Германия) |
Окончание табл. 3
До 2012 г. в России зарегистрированы и разрешены к клиническому использованию контрастные средства, состоящие из хелатных комплексов иона гадолиния. К ним относятся гадовист, дотарем, при-мовист, магневист, омнискан [19]. Насущной проблемой практической МРТ-диагностики является создание массовых, относительно дешевых и эффективных контрастных препаратов на основе стойких комплексов хелатов.
В настоящее время интенсивно развиваются два вида бинарных технологий лучевой терапии: ней-трон-захватная терапия (НЗТ) и фотон-захватная терапия (ФЗТ).
Сущность этих технологий заключается в локализации вторичного излучения, возникающего в реакциях взаимодействия первичного излучения с введенными в опухоль специальными элементами. Для НЗТ первичное излучение — поток тепловых нейтронов и поглощающие элементы — бор и гадолиний. Для ФЗТ первичное излучение — фотоны рентгеновского спектра и поглощающие элементы с атомным номером более 53.
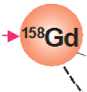
Нуклид 157Gd (содержание в естественной смеси ~16%) обладает наибольшим сечением захвата нейтронов из всех существующих в природе стабильных нуклидов (≈254 кбарн). В результате реакции захвата нейтрона ядром 157Gd образуется ядро 158Gd в возбужденном состоянии. Энергия возбуждения (Qvalue=7.94 MeV), полученная за счет энергии связи захваченного нейтрона, снимается испусканием гамма- и рентгеновского излучения, конверсионных электронов и электронов Оже (рис. 2).
Таким образом, ядерная реакция, которая происходит при облучении потоком тепловых нейтронов биологической ткани с гадолинием, сопровождается существенным выделением энергии, и примерно 1 % этой энергии локализуется вблизи атома гадолиния. Этот эффект используется в технологии нейтрон-за-хватной терапии с использованием гадолинийсодержащих препаратов (т.н. Gd-НЗТ).
В общем виде технология НЗТ заключается в предварительном насыщении опухоли нуклидами, обладающими высоким сечением захвата (10В и гадолиний), и последующем облучении ее потоком тепловых нейтронов
В 1995 г. на ядерном реакторе МИФИ были проведены эксперименты по оценке эффективности Gd-содержащего препарата Магневист ® на крысах с саркомой Йенсена в технологии нейтрон-захватной терапии. Показано, что при непосредственном введении препарата в опухоль в концентрации порядка 13 мг/г опухолевой ткани в 80% случаев наблюдалась полная регрессия опухоли (рис. 3).
В дальнейшем в исследованиях использовался отечественный гадолинийсодержащий препарат Ди-пентаст. Препарат Дипентаст представляет собой лекарственную форму комплекса гадолиния с диэти-лентриаминопентауксусной кислотой (рис. 4).
Лекарственная форма комплекса Gd c ДТПА представляет собой водный раствор комплекса и
@-^57Gd
Оже электроны "^ е- 5.9 keV

*7.88 MeV
Q , = 7.94 MeV lvalue <.v-riviev
M Электроны внутренней e конверсии
45-66 keV
Рис. 2. Схема реакции захвата нейтрона ядром 157Gd
Время после облучения, дни
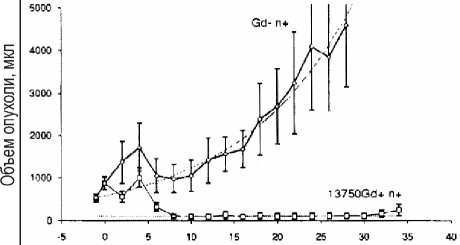
Рис. 3. Динамика роста опухолей крыс с Gd и без него после облучения нейтронами [20]
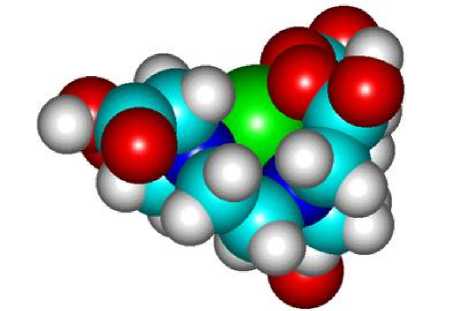
— углерод, — водород, — кислород, — азот, — гадолиний
Рис. 4. Структура комплекса Gd3+ c диэтилентриаминопента-уксусной кислотой
Таблица 4
Основные характеристики препарата Дипентаст
|
Параметр, единица измерения |
Значение параметра |
|
Молекулярная масса, дальтон |
938 |
|
Концентрация субстанции, мМоль/мл (мг/мл) |
0,5 (469) |
|
Содержание гадолиния, % от массы |
17 |
|
рН лекарственной формы |
6,5–8,0 |
|
Вязкость, сР: |
|
|
при 20 °С |
4,9 |
|
при 37 °С |
2,9 |
|
Плотность, г/см3 при 20 °С |
1,2 |
|
Константа устойчивости хелата, log K |
22,5 |
|
Летальная доза LD50, мМоль/кг: |
|
|
Внутривенно мышам |
5–8 |
|
Внутривенно крысам |
10 |
|
Характер выведения из организма |
полное |
|
Средняя эффективность спинрешеточной релаксации 1Н в буферном растворе (20 МГц, 30 °С, мМольхс) — 1 |
7,8±0,3 |
вспомогательного лекарственного полимера. На разработанную лекарственную форму комплексов Gd (III) c ДТПА был выдан патент Российской Федерации [21]. Важнейшие характеристики созданного препарата, названного Дипентаст, приведены в табл. 4.
Проведенные исследования технологии НЗТ с гадолинийсодержащим препаратом Дипентаст на животных с перевивными опухолями показали ее значительную эффективность (рис. 5).
С 1998 по 2008 г. на собаках со спонтанной меланомой в рамках предклинических исследований на ядерном реакторе ИРТ МИФИ были проведены эксперименты по оценке сравнительной эффективности препаратов с 10B (борфенилаланин, БФА) и природного гадолиния (Дипентаст) в технологиях лечения методами 10BНЗТ и GdНЗТ соответственно [23]. Меланома собак выбрана в качестве модели лечения аналогичной патологии у человека.
Для оценки эффективности НЗТ полученные данные сравнивались с результатами лечения хирургическими методами и облучением только пучком нейтронов. Оценивались как непосредственные результаты облучения, так и отдаленные результаты (процент и сроки рецидивирования, продолжительность жизни).
После проведения статистического анализа достоверности результатов выяснили, что облучение
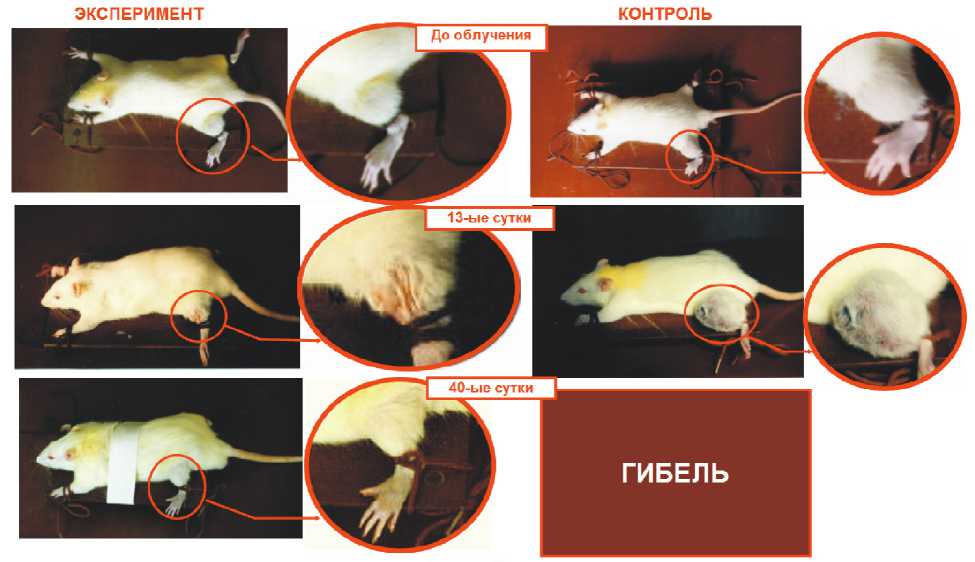
Рис. 5. Динамика регрессии опухоли у крысы с перевитой саркомой С-45 в радиобиологических экспериментах на реакторе ИРТ МИФИ [22]. Препарат Дипентаст. Интратуморальное введение
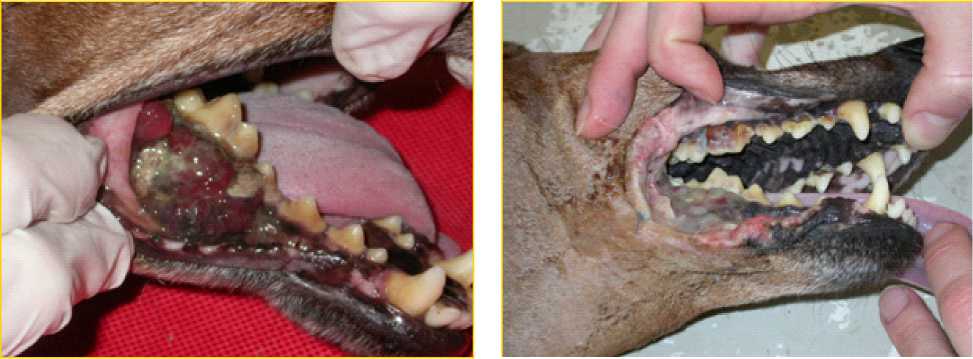
до облучения после облучения
Рис. 6. Пример лечения меланомы T3N0M0 — II b собаки методом Gd-НЗТ. Полная регрессия опухоли. Безрецидивный период — 8 месяцев
с предварительным введением препаратов бора, то есть BНЗТ, позволяет достигнуть полной регрессии опухоли в 78% случаев, а при облучении просто нейтронами — только в 20%. При 1oBH3T в случаях полной регрессии опухоли рецидивирование не наблюдалось, что доказывает факт полного уничтожения клеток меланомы в первичном очаге. В то же время при нейтронном облучении рецидивирование возникало через 101±28,8 дня после проведения НТ. При хирургическом лечении безрецидивный период составил в среднем 30±5,5 дня при 100% вероятности рецидивирования.
При проведении НЗТ с использованием Дипен-таста (GdНЗТ) регрессия опухоли происходила медленнее по сравнению с 10BНЗТ. Полная регрессия опухоли имела место у 46% животных, что составляет 59% от такового показателя при 10ВНЗТ. Через 106±7,5 дня после GdH3T у 66,7% животных мы констатировали рецидивирование опухоли. Тем не менее эффект облучения при GdНЗТ был достаточно высок (рис. 6).
Различие в результате при 10BНЗТ и GdНЗТ позволят объяснить различия в механизмах НЗТ в этих двух технологиях. 10BНЗТ предполагает избирательное накопление препаратов бора внутри именно опухолевых клеток. Пробег альфа-частиц, которые образуются при облучении, соизмерим с диаметром клетки, чем и достигается такой высокий эффект данной терапии. При GdНЗТ Дипентаст в основном находится в межклеточном пространстве, и накопление препарата в опухолевой ткани достигается только интратуморальным введением препарата. В GdНЗТ и 10BНЗТ в результате поглощения тепловых нейтронов реализуются различные поражающие опухолевые клетки радиационные факторы. Такое различие в механизме клинически выражается большим эффектом побочных воздействий на здоровые ткани при GdНЗТ. При GdНЗТ степень лучевых повреждений была несколько выше, чем при простом облучении нейтронами и при BНЗТ.
По нашему мнению, GdНЗТ нуждается в специальных программах, позволяющих оптимизировать все количественные параметры процесса интратумо-рального введения межклеточного препарата. Такая программа должна учитывать особенности микроциркуляции каждой индивидуальной облучаемой мишени. Разработка подобной программы может суще- ственно повысить эффективность GdНЗТ, приблизив ее к эффективности 10BНЗТ.
Поэтому, несмотря на преимущества метода 10BНЗТ над GdНЗТ, технология GdНЗТ является также перспективной для клинического применения.
Одно из преимуществ технологии GdНЗТ над 10BНЗТ у собак является экономический аспект такого вида лечения. Препараты бор-фенилаланина производятся за рубежом и являются достаточно дорогостоящими. Отечественный препарат Дипен-таст, имеет более низкую себестоимость. Кроме того, технология GdНЗТ не требует предварительного системного введения препарата за 1–2 часа до облучения. Дипентаст вводится непосредственно перед началом облучения.
НЗТ эффективнее традиционных методов лечения первичного опухолевого очага, но никак не влияет на процесс образования метастазов. На сегодняшний день, проводятся многие исследования в медицине по исследованию биологических методов, которые смогли повлиять на процесс метастазирования.
Таким образом, наш опыт применения гадолинийсодержащих препаратов показал, что повышение эффективности технологии GdНЗТ возможно лишь при наличии тропности препарата к опухолевой ткани. Исследования в этом направлении ведутся в настоящее время группой профессора В. М. Евдокимова в Институте молекулярной биологии РАН с использованием наночастиц Gd-ДНК [24].
Физический принцип фотон-захватной терапии (ФЗТ) [25] состоит в увеличении локального энерговыделения, вызванного электронами фотопоглощения и сопутствующего Оже-каскада (рис. 7) на ато-
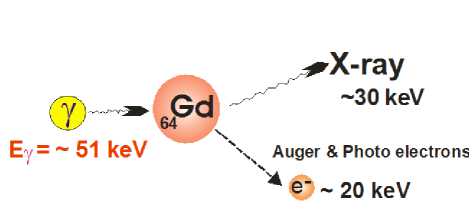
Рис. 7. Схема реакции захвата фотонов, используемая в GdФЗТ
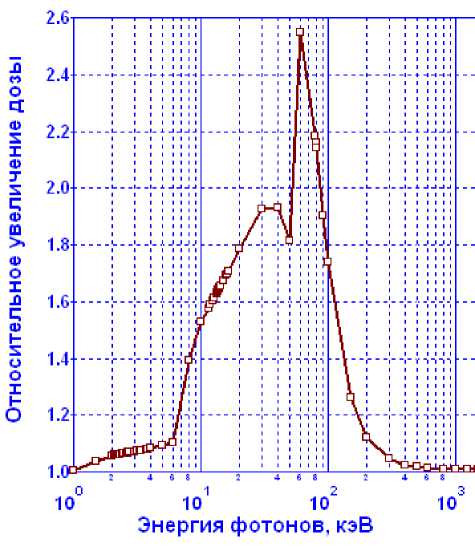
Рис. 8. Относительное увеличение поглощенной дозы в биологической ткани при введении в нее (1 % по массе) гадолиния [26]
мах «тяжелых» элементов (Gd, Pt и т.п.), входящих в состав специальных препаратов, при облучении опухоли фотонами рентгеновского спектра.
Как показали расчетные исследования [26], наличие в биологической ткани атомов гадолиния при облучении приводит к заметному возрастанию поглощенной дозы в диапазоне энергий фотонов от 10 до 100 кэВ (рис. 8).
За рубежом часто используются другие наименования технологии ФЗТ. Так, F. Verhaegen в 2005 г. ввел термин «контрастно-усиливающая радиационная терапия» (contrast-enhanced radiation therapyCERT), предложил использовать инструмент компьютерной томографии (КТ) для повышения дозы через фотоэлектрический эффект. Было предложено преобразовать диагностический КТ (140 кВ) в терапевтический рентгеновский аппарат, применяя гадолинийсодержащую контрастную среду.
Проведенная экспериментальная проверка технологии ФЗТ с препаратом Дипентаст на экспериментальных животных с перевивными опухолями (меланома B16F10) показала эффективность этого метода лечения [28, 29] (рис. 9).
Работы по созданию технологии фотон-захватной терапии начаты в последние годы. Интерес к этому новому виду лучевой терапии обусловлен необходимостью разработки новых и эффективных методов лучевой терапии со сравнительно низкой стоимостью облучательной аппаратуры, ее возможностью массового применения в медицинских учреждениях.
Список литературы Редкоземельные элементы в ядерной медицине
- Кодина Г E. Методы получения радиофармацевтических препаратов и радионуклидных генераторов для медицины. В кн.: Изотопы: свойства, получение и применение/под ред. В. Ю. Баранова. 2-е изд. М.: Физматлит, 2005. Т. 2, с. 389-411
- Левин В.И., Седов В.В., Кодина Г.Е. и др. Диагностическое средство костной системы: авт. свид. № 1086582 от 19.02.82, БИ № 29, 1985
- Линденбратен Л.Д., Лясс Ф.М. Медицинская радиология. М.: Медицина, 1979; с. 269
- Павлов А.С. Внутритканевая гамма-и бета-терапия злокачественных опухолей. М.: Медицина, 1967, с. 44.
- Patel NS, et al. Ytterbium-169: a promising new radio-nuclide for intravascular brachyterapy. Cardiovasc Radiat Med 2001; 2 (3): 73-80
- Держиев В.А., Дякин B.M., Илькаев P.И. и др. Квантовая электроника 2003; 33 (6): 553
- Patent US 6,183,409 В1. Feb.6. 2001
- Patent WO 2005/023367 A2. 17.03.2005
- Кодина Г.E., Громова Н.П., Тронова И.Н. и др. Радиофармацевтическая композиция: патент РФ № 2162714, приор. 20.06.2000 г., per 10.02.2001 г. Бюл. №4
- (Цыб А.Ф., Дроздовский Б.Я., Крылов В.В., Кодина Г.Е. Паллиативная терапия самарием-оксабифором, 153Sm при метастатических поражениях костей. Мед. радиол, рад. безопасность 2002; 47 (5): 61-69
- Наркевич Б.Я., Ширяев С.В. Методические основы радионуклидной терапии. Мед. радиол, рад. Безопасность 2003; 48 (5): 35-44
- Isotope Explorer Nuclear Structure and Decay Data. http://ie.lbl.gov/education/isotopes.htm
- Приложение к ОФС 42-0073-07 «Радиофармацевтические препараты». М.: ГФ изд. XII, 2008; с. 475
- Ларенков A.A., Брускин А.Б., Кодина Г.E. Радионуклиды галлия в ядерной медицине: радиофармацевтические препараты на основе изотопа 68Ga. Мед. радиол, рад. безопасность 2011; 56 (5): 56-73
- Adams S, Baum R, Rink T, et al. Limited value of flu-orine-18 fluorodeoxyglucose positron emission tomography for the imaging of neuroendocrine tumors. Eur J Nucl Med 1998; 25: 79-83
- Antunes P, Ginj M, Zhang H, et al. Are radiogallium-la-belled DOTA-conjugated somatostatin analogues superior to those labelled with other radiometals. Eur J Nucl Med Mol Imaging 2007; 34: 982-993
- Teranostics, Gallium-68 and Other Radionuclides. In: Baum RP, Rosch F, eds. A Pathway to Personalized Diagnosis and Treatment. Berlin: Heidelberg, Springer-Verlag, 2013; 576 p.
- Abstracts of 2nd World Congress on Ga-68 and Peptide Receptor Radionuclide Therapy (PRRNT). World J Nucl Med 2013; 12(1), Suppl. 1:7-102.
- Нам И.Ф., Яновский В.A., Шипунов Я.А. Современные тенденции создания контрастных средств для магнитно-резонансной томографии. Сибирский медицинский журнал (Томск) 2012; (3): 134-137
- Khokhlov VF, Yashkin PN, Silin Dl, Lawaczeck R. Neutron Capture Therapy with Gadopentate Dimeglumine: Experiments on Tumor-Bearing Rats. Academic Radiology 1995; 2: 392-398
- Patent RF № 2150961. Russian (Патент РФ № 2150961)
- Khokhlov VF, Korotkevich АО, Malyutina TS, et al. Biological evaluation of boron-and gadolinium-containing agents for NCT Eighth International Symposium on Neutron Capture Therapy for Cancer, 13-18 September 1998, La Jolla, California, USA. Report E-94
- Mitin VN, Kulakov VN, Khokhlov VF, et al. Comparison of BNCTand GdNCT efficacy in treatment of canine cancer. Applied Radiation and Isotopes 2009; 67: 299-301
- Yevdokimov YM, Salyanov VI, Akulinichev SV, et al. Novel Biomaterial for NCT-"Rigid" Particles of (DNA-Gadolinium) Liquid-Crystalline Dispersions. Journal of Biomaterials and Na-nobiotechnology 2011; 2: 281-292
- (Хохлов В.Ф., Шейно И.Н., Кулаков B.H., Митин В.Н. и др. Способ Фотон-Захватной Терапии злокачественных опухолей: патент РФ 2270045, 2006)
- Sheino IN/Dose-supplementary therapy of malignant tumors. Advances in Neutron Capture Therapy 2006. Nakagawa Y, Kobayashi T and Fukuda H? eds Proceedings of ICNCT-12. "From the Past to the Future", October 9-13, 2006; Takamatsu, Kagawa, Japan; p. 531-534
- Verhaegen F, Reniers B, Deblois F, et al. Dosimetric and microdosimetric study of contrast-enhanced radiotherapy with ki-lovolt x-rays. Phys Med Biol 2005; 50: 3555-3569
- Lipengolts AA, Khokhlov VF, Kulakov VN, et al. Photon Capture Therapy -Process Analog of Neutron Capture Therapy. First Experimental Results of Melanoma Treatment in Mice. New Challenges in Neutron Capture Therapy 2010. p. 105-106
- Черепанов А.А., Липенгольц А.А., Насонова Т.А. и др. Увеличение противоопухолевого эффекта рентгеновского облучения при помощи гадолиний содержащего препарата на примере мышей с трансплантированной меланомой B16F10. Медицинская физика 2014; 3 (63): 66-69.


