Регенерация ампутированой конечности тритона при воздействии ультразвука и CaCl2
Автор: Ганцгорн Алена Александровна, Донкова Наталья Владимировна
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 11, 2021 года.
Бесплатный доступ
Цель исследования - установить влияние сочетанного воздействия ультразвука и CaCl2 на макро- и микроструктуру регенерирующих тканей грудной конечности тритона после ампутации. Определено, что после ампутации грудной конечности у тритона происходит поэтапная посттравматическая регенерация. Конечность восстанавливается полностью к 85-м суткам и становится физиологически, макро- и микроструктурно равноценной исходной конечности. При стимуляции регенерации сочетанным воздействием ультразвука и CaСl2, добавленного в воду, процесс восстановление конечности протекает интенсивнее и завершается на 2-3 недели раньше, чем в контрольной группе. На 42-е сутки после ампутации длина регенерирующей культи в контрольной группе составляла 7,03±0,11 мм, а во второй группе, где применялся ультразвук, была длиннее, чем в контроле, на 13,3 % (Р ≤ 0,05) и достигала 7,97±0,11 мм. В третьей группе при сочетанном воздействие ультразвука и CaСl2 в течение 10 дней, экспозиция 30 с, длина культи превышала контрольное значение на 27,6 % (Р ≤ 0,05) и достигала 8,97±0,18 мм. На 42-е сутки на микроструктурном уровне сформированы кожа с ороговевающим эпителием и железами, поперечно полосатые мышцы и кости, представленные хрящевой тканью. При этом наиболее выраженные и завершенные процессы остеогенеза отмечались в группе, где применяли сочетанное воздействие ультразвука и CaCl2. Кости грудной конечности тритона после ампутации регенерируют за счет хрящевой ткани эпифизарных пластинок, сформировавшихся на месте мезенхимы. Хрящевая ткань представлена изогенными группами округлых хондроцитов, пространство между которыми заполнено безволокнистым матриксом - хондромукоидом. Стимуляция регенерации сочетанным воздействием ультразвуком и CaСl2 ускоряет лишь процесс регенерации, но сохраняет закономерности развития хрящевой кости в зоне эпифизарных пластинок из мезенхимы.
Тритон, регенерация, микроструктура грудной конечности, ультразвук, cacl2
Короткий адрес: https://sciup.org/140290041
IDR: 140290041 | УДК: 48:597.94 | DOI: 10.36718/1819-4036-2021-11-167-173
Текст научной статьи Регенерация ампутированой конечности тритона при воздействии ультразвука и CaCl2
Введение. Поскольку механизм восстановления кости изучен недостаточно, в настоящее время проблема репаративной регенерации костной ткани является актуальной. Некоторые аспекты биохимических и морфологических механизмов и процессов рассмотрены в работах А.А. Корж, Г.В. Сорокина [2, 3]. Важно понять причины нарушения обмена веществ в костной ткани и в целом в организме в процессе регенерации. Установление механизма репаративного остеогенеза и причин его нарушения поможет в решении этой проблемы.
Способы и методы стимуляции репаративной регенерации делят на общие и местные. Также они подразделяются на физические (оперативные), химические (медикаментозные) и биологические [3].
В целях изучения стимуляции репаративного остеогенеза с 60-х гг. XX столетия началось активное исследование физических методов, без применения дорогостоящего оборудования, но дающих хорошие результаты. В настоящее время положительное влияние на репаративный остеогенез оказывают такие методы, как: высокочастотное переменное электромагнитное поле; высокочастотное магнитное поле; постоянный ток; механо-акустические волны; ультразвук; ударно-волновая терапия; низкоинтенсивное лазерное излучение [4].
Ультразвук является перспективным методом стимуляции репаративной регенерации, но недостаточно изученным [4]. J. Harle установил, что ультразвук способствует модулированию аденилатциклазы, простагландина Е, стимулирует экспрессию генов TGF [10]. R. Ramli показал, что ультразвук низкой интенсивности хорошо стимулирует неоангиогенез [13].
F.S. Oliver, Pires-De-Campos и другие зарубежные ученые получили хорошие результаты при использовании ультразвука малыми дозами на регенерирующую костную ткань [8, 12], также хорошие результаты дало применение ультрафонофореза (ультразвуковое воздействие через лекарственный препарат) [9]. Ультразвуковые колебания способствуют усилению проницаемости клеточных мембран и процессов диффузии, что обеспечивает более тщательное распространение лекарственного препарата из контактной среды в ткани [7]. На данный эффект указывают A. Azagury и K. Lii: отмечают возможность применения лекарственных веществ в качестве контактной среды, при этом увеличивается возможность трансдермального введения лекарства [6, 11]. Двойное воздействие лекарственным веществом и ультразвуковой волной улучшает обмен веществ, усиливает репарацию и регенерацию костной ткани [5, 14]. Однако вопросы сочетанного воздействия ультразвука и CaCl2 на регенерацию ампутированной конечности у тритонов исследованы недостаточно.
Цель исследования : установить влияние сочетанного воздействия ультразвука и CaCl 2 на макро- и микроструктуру регенерирующих тканей грудной конечности тритона после ампутации.
Объекты, материалы и методы исследования. Исследования проводились в гистологической лаборатории кафедры анатомии, патологической анатомии и хирургии Института прикладной биотехнологии и ветеринарной медицины Красноярского государственного аграрного университета в 2021 г.
Объектом исследования послужили самки обыкновенного тритона (Triturus vulgaris Linnaeus).
Материалом для исследования послужили ампутированная грудная конечность тритона, отросшая конечность (культя) при разных сроках после ампутации.
Ампутацию грудной конечности проводили на 1–2 мм ниже плечевого сустава. Животное под- вергалось гипотермии, понижению температуры воды с с 23 до 0 °С, тритоны впадали в состояние анабиоза, за счет чего снижалась двигательная активность и чувствительность. Данный способ был выбран как физиологически комфортный и привычный для тритонов [1], и он предотвращал кровопотерю.
В случае использования препаратного наркоза (золетил или рометар) у тритонов открывалось кровотечение в месте ампутации [1].
Исследовали тритонов трех групп, в каждой – по три особи. Первая группа являлась контрольной, после ампутации тритоны регенерировали без каких-либо посторонних воздействий. Вторая группа на 28-й день после ампутации была подвергнута воздействию ультразвука при помощи аппарата «Ретона АУТн-01» в течение 10 дней, экспозиция 30 с. У третьей группы к стимуляции ультразвуком добавляли в воду CаCl 2 по 0,2 г на 10 л воды аквариума в течение 10 дней.
Результаты исследования. На месте ампутации воспалительных процессов не наблюдалось, происходило постепенное формирование регенераторной мозоли, и спустя 14 дней она достигала 2–3 мм (рис. 1, 2). Две недели спустя ампутированная конечность достигла размеров, позволяющих проводить точечное воздействие УЗ (рис. 3).
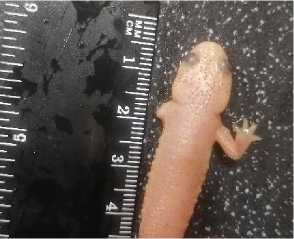
Рис. 1. 14-й день после ампутации

Рис. 2. 28-й день после ампутации

Рис. 3. УЗ-воздействие
Достоверные различия в скорости регенерации конечностей в контрольной и опытных группах наблюдались на 42-е сутки после ампутации. Быстрее грудная конечность отрастала в третьей группе: длина ее составила около 8,97±0,18 мм, что на 27,6 % (Р ≤ 0,05) больше, чем в контрольной группе, при этом видны зачатки пальцев (рис. 4). Во второй группе к этому периоду был сформирован лишь запястный сустав без пальцев, а полная длина регенерирующей конечности составила 7,97±0,11 мм, что по сравнению с контрольной больше на 13,3 % (Р ≤ 0,05) (рис. 5). В первой группе (контрольной) регенерирующая конечность имела клиновидную форму и включала в себя отросшую плечевую кость, локтевой сустав и зачаток костей предплечья без запястья и костей пальцев и составляла 7,03±0,11 мм (рис. 6).

Рис. 4. Третья группа

Рис. 5. Вторая группа

Рис. 6. Первая группа
Ампутированную конечность погружали в 9 % раствор забуференного нейтрального формалина на 3 суток, затем – в 5 % водный раствор азотной кислоты на 5 суток, с ежедневной сменой раствора. Далее следовала промывка в проточной воде и проводка через батарею изопропиловых спиртов возрастающей концентрации и вазелиновое масло (проводка через 4 па- рафина и заливка в парафиновые блоки). Нарезка препарата производилась на микротоме.
Полученные срезы окрашивали: гематокси-лин-эозином, пикро-Маллори и Конго красным (рис. 7). При изучении контрольных препаратов с увеличением объектива 10× хорошо просматриваются все структурные единицы конечности.
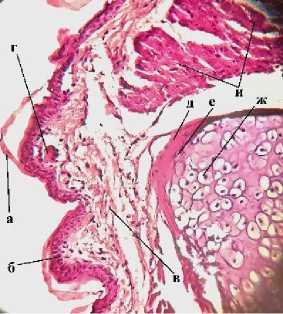
Гематоксилин-эозин
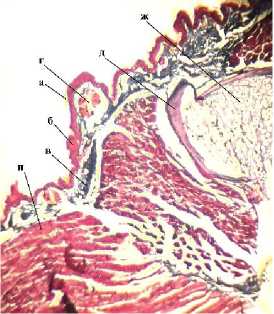
Пикро-Маллори
Рис. 7. Микроструктура регенераторной мозоли: а – ороговевающий эпителий; б – эпителиальные клетки; в – рыхлая соединительная ткань; г – экзокринные железы; д – надхрящница; е – хондроциты; ж – хондробласты; з – межклеточное вещество (матрикс);
и – мышечные волокна
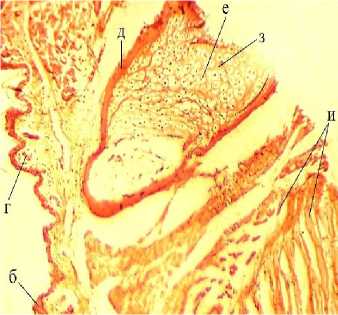
Конго красный
Гистологически кожа представлена орогеве-вающим эпителием, отслоившимся от поверхности. Видны 2–4 ряда эпителиальных клеток с базофильно окрашенным ядром овальной формы. В коже хорошо видны крупные, округлые экзокринные железы, содержащие в себе секрет. Стенки желез выстланы однослойным эпителием. Далее рыхлая соединительная ткань переходит в мышечные волокна. Также при ок- расе пикро-Маллори хорошо просматриваются коллагеновые и эластические волокна, представляющие собой связочный аппарат. Связками мышцы крепятся к надхрящнице, состоящей из единичных хондробластов вытянутой формы с овальным крупным базофильным ядром. В более глубоких участках кости хондробласты становятся хондроцитами – округлыми крупными клетками со смещенными эксцентрично круглыми ядрами. Хондроциты располагаются изогенными группами по 2–4 клетки в группе, пространство между ними заполнено матриксом – хондромукоидом, окрашиваемым окси-фильно.
Наиболее яркая картина формирования хрящевой кости наблюдается на 28-е сутки регенерации грудной конечности (рис. 8).
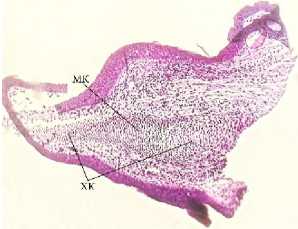
Гематоксилин-эозин
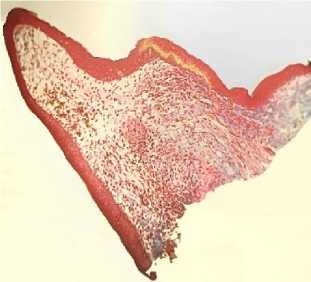
Пикро-Маллори
Рис. 8. Микроструктура регенераторной мозоли: МК – мезенхимные клетки; ХК – хрящевые клетки
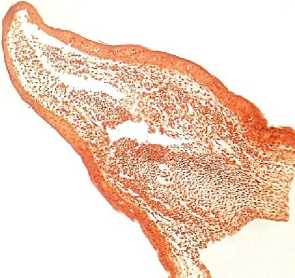
Конго красный
Эпидермис кожи представлен 2–6 рядами округлых эпителиальных клеток с яркобазофильными крупными ядрами. В соединительнотканной дерме обнаруживаются крупные экзокринные железы округлой формы, содержащие вязкий оксифильный секрет. Стенки желез выстланы однослойным низко призматическим эпителием. Глубже рыхлая соединительная ткань гиподермы переходит в эпимизий пучков поперечно-полосатых мышечных волокон, который в области эпифизов переходит в коллагеновые волокна сухожилий. Хрящевая основа культи имеет четко выраженные границы. Клетки в области эпифизарных пластинок на границе суставов активно делятся, образуя точку роста хрящевой ткани, и находятся на высоком уровне метаболизма. Кость растет за счет формирования хрящевой ткани, находящейся в эпифизах. В центре хряща хорошо видны мезенхимные клетки, ориентированные поперек кости, проксимально и дистально мезенхимные клетки переходят в хондробласты и затем в хондроциты, формируя эпифизарные пластинки. Мезенхимные клетки отростчатые, вытянутой веретенообразной формы. Совокупность клеток образует синцитий (соклетие), широкие отростки клеток переходят без заметных границ в отростки смежных клеток. Ядра мезинхимио-цитов вытянуты вдоль длинной оси клетки.
Межклеточное пространство слабовыраженное. В проксимальных и дистальных направлениях мезенхимные клетки округляются, ядра становятся шаровидными, структура синцития исчезает. Клетки отодвигаются друг от друга, между ними появляется хондромукоид, а ткань приобретает вид дефинитивной хрящевой ткани с типичными округлыми хондроцитами, расположенными группами, и межклеточным веществом. По краям эпифизарных пластинок отчетливо различимы хондробласты.
Заключение. После тотальной резекции грудной конечности у самок тритона обыкновенного происходит поэтапная посттравматическая регенерация. Конечность восстанавливается полностью к 85-м суткам и становится физиологически, макро- и микроструктурно равноценной исходной конечности. При стимуляции регенерации сочетанным воздействием ультразвука и CaСl2, добавленного в воду, процесс восстановления конечности протекает интенсивнее и завершается на 2–3 недели раньше, чем в контрольной группе. На 42-е сутки после ампутации длина регенерирующей культи в контрольной группе составляла 7,03±0,11 мм, а во второй группе, где применялся ультразвук, была длиннее, чем в контроле, на 13,3 % (Р ≤ 0,05) и достигала 7,97±0,11 мм. В третьей группе при сочетанном воздействии ультразвука и CaСl2 в тече- ние 10 дней, экспозиция 30 с, длина культи превышала контрольное значение на 27,6 %
(Р ≤ 0,05) и достигала 8,97±0,18 мм. На 42-е сутки на микроструктурном уровне сформированы кожа с ороговевающим эпителием и железами, поперечно-полосатые мышцы и кости представлены хрящевой тканью. При этом наиболее выраженные и завершенные процессы остеогенеза отмечались в группе, где применяли сочетанное воздействие ультразвука и CaCl 2 . Кости грудной конечности тритона после ампутации регенерируют за счет хрящевой ткани эпифизарных пластинок, сформировавшихся на месте мезенхимы. Хрящевая ткань представлена изогенными группами округлых хондроцитов, пространство между которыми заполнено без-волокнистым матриксом – хондромукоидом.
Стимуляция регенерации сочетанным воздействием ультразвука и CaСl 2 ускоряет процесс регенерации, при этом сохраняются общие закономерности развития хрящевой кости в зоне эпифизарных пластинок из мезенхимы.
Список литературы Регенерация ампутированой конечности тритона при воздействии ультразвука и CaCl2
- Донкова Н.В., Рубай А.А. Микроструктура регенерирующих тканей грудной конечности тритона // Вестник КрасГАУ. 2014. № 8 (95). С. 92–96.
- Корж А.А., Белоус А.М., Панков Е.Я. Репаративная регенерация кости. М.: Медицина, 1972. 232 с.
- Методы стимуляции репаративной регенерации при лечении переломов конечностей с применением новых биотехнологий / Г.В. Сорокин [и др.] // Кафедра травматологии и ортопедии. 2012. № 2. С. 36–40.
- Применение физических факторов для оптимизации костной регенерации (обзор литературы) / Л.Б. Резник [и др.] // Гений ортопедии. 2015. № 1. С. 89–95.
- Ушаков Р.В., Ушаков А.Р., Дьяконова М.С. Применение препаратов гиалуроновой кислоты Ревидент в хирургической стоматологии // Медицинский алфавит. 2017. № 24. С. 47–50.
- Azagury A., Kost J., Khoury L., Enden G. Ultra-sound mediated transdermal drug delivery. Advanced Drug Delivery Reviews. 2014; 72(4):127–143
- Biomolecular ultrasound and sonogenetics / D. Maresca [et al.] // Annual Review of Chemical and Biomolecular Engineering. 2018; 9(1):229–252.
- Effect of low level laser therapy (830 nm) with different therapy regimes on the process of tissue repair in partial lesion calcaneous ten-don / F.S. Oliveira [et al.] // Lasers in Surgery and Medicine. 2009 ; 41(4):271–276.
- Enhanced Transdermal Drug Delivery by Sonophoresis and Simultaneous Application of Sonophoresis and Iontophoresis / J. Park [et al.] // AAPS PharmSciTech. 2019;20(3):96. DOI: 10.1208/s12249-019-1309-z.
- Harle J., Mayia F., Olsen I., Salih V. Effects of ultrasound on transforming growth factor-beta genes in bone cells Eur. Cell. Mater, 2005, Vol. 10, pp. 70–76.
- Lee K.L., Zhou Y. Quantitative evaluation of sonophoresis efficiency and its dependence on sonication parameters and particle size // Jour-nal of Ultrasound in Medicine. 2015;34(3):519-526. DOI: 10.7863/ultra.34.3.519.
- Pires-De-Campos M.S.M., De Almeida J., Wolf-Nunes V., Souza-Francesconi E., Grassi-Kassisse D.M. Ultrasound associated with caf-feine increases basal and beta-adrenoceptor response in adipocytes isolated from subcuta-neous adipose tissue in pigs // Journal of Cos-metic and Laser Therapy. 2016;18(2):116–123
- Ramli R., Reher P., Harris M., Meghji S. The effect of ultrasound on angiogenesis: an in vi-vo study using the chick chorioallantoic mem-brane // Int. J. Oral Maxillofac. Implants., 2009, Vol. 24, No. 4, pp. 591–596.
- Ultrasound-enhanced delivery of antibiotics and antiinflammatory drugs into the eye / M. Nabili [et al.] // Ultrasound in Medicine & Biol-ogy. 2013; 39(4): 638–646. DOI: 10.1016/j. ultrasmedbio.2012.11.010.


