Реконструкция грудной стенки с использованием никелида титана у онкологических больных
Автор: Жеравин Александр Александрович, Гюнтер Виктор Эдуардович, Анисеня Илья Иванович, Гарбуков Евгений Юрьевич, Жамгарян Геворк Самвелович, Богоутдинова Анна Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 (69), 2015 года.
Бесплатный доступ
Проведена оценка эффективности реконструкции реберного каркаса с использованием имплантатов из никелида титана. Материал и методы. В период с 2007 по 2014 г. выполнено замещение пострезекционных дефектов грудной стенки с использованием оригинальных конструкций из никелида титана у 21 пациента со злокачественными новообразованиями кожи, мягких тканей, ребер и грудины (саркомы и метастазы). Общее количество выполненных операций - 28, хирургический этап лечения выполнялся с одномоментной (n=19) или отсроченной реконструкцией (n=2). Площадь дефекта в среднем составила 127 см 2(40-323 см 2). результаты исследования. Восстановление спонтанного дыхания без аппаратной поддержки в день операции - в 27 (96,4 %) случаях. Восстановление каркасной функции грудной клетки достигнуто во всех случаях. Снижение амплитуды достигнуто в 10 (36 %) и полное устранение патологической флотации грудной стенки - в 18 (64 %) наблюдениях. Осложнения, потребовавшие хирургической коррекции, - 3 (11 %). В отдаленные сроки живы 10 (47,6 %) пациентов. заключение. Представленная методика, сочетающая использование никелид-титановых конструкций и комплексов аутотканей с осевым типом кровоснабжения, позволяет проводить специальное лечение при злокачественных новообразованиях грудной стенки, имеющих обширное местное распространение, с хорошим функциональным результатом.
Грудная стенка, реконструкция реберного каркаса, никелид титана, эндопротезы ребер
Короткий адрес: https://sciup.org/14056539
IDR: 14056539 | УДК: 616.712-089.844
Текст научной статьи Реконструкция грудной стенки с использованием никелида титана у онкологических больных
Опухоли грудной стенки представляют довольно разнородную группу морфологических форм и вариантов поражения. Выделяют первичные и вторичные опухоли – метастатические и развившиеся вследствие экспансивного роста злокачественных новообразований легкого, молочной железы. При этом на долю первичных опухолей приходится 1–2 % от всех злокачественных новообразований, из них около 45 % составляют саркомы мягких тканей. Вторичное поражение грудной стенки встречается значительно чаще [2, 9, 14].
Основным методом лечения опухолей грудной стенки является хирургическое вмешательство [4, 12, 19]. Возможности современных хирургических методик не ограничиваются резекцией костного каркаса и мягких тканей, но и позволяют выполнять комбинированные расширенные блоковые операции с включением органов средостения, легкого, диафрагмы, печени [16, 25]. Особое значение имеет выбор адекватного метода устранения пострезекционного дефекта грудной стенки с целью сохранения физиологического объема, восстановления непрерывности каркаса, предотвращения парадоксального дыхания, герметизации плевральной полости [5, 7, 8, 20]. Для реконструкции покровных тканей с успехом используются перемещенные и свободные кожно-фасциальные лоскуты, сальник [13, 24]. При этом вопрос адекватного замещения дефектов костного каркаса далек от оптимального решения, широко применяются искусственные материалы: полимерные сетки (полипропиленовая, Gor-Tex – политетрафторэтилен), метилметакрилат, акрил, нержавеющая сталь, титан [17, 21, 23]. В редких случаях используется костная аутопластика [19]. Указанные материалы обеспечивают решение далеко не всех задач, в силу ограниченности прочностных характеристик, интегративных свойств, сложности фиксации к ребрам. Этим обстоятельством определяется ограничение срока службы применяемых конструкций и опасность развития послеоперационных осложнений. Разработка в последние годы титановой системы «STRATOS» с оригинальным муфтообразным способом фиксации к ребрам позволила в значительной степени расширить возможности реконструкции обширных пострезекционных дефектов каркаса грудной стенки [10, 11, 15]. В сочетании с мембраной Dual-Mesh Gore-Tex из политетрафлуороэтилена достигается изоляция внутренних органов и герметизация грудной полости [6, 18, 22]. Вместе с тем следует отметить, что обилие представленных в литературе методик реконструкции грудной стенки свидетель-
ствует, прежде всего, об отсутствии «золотого стандарта», а следовательно, поиск новых материалов и способов их применения, несомненно, является актуальным.
В нашем исследовании представлена методика реконструкции реберного каркаса, разработанная в Томском НИИ онкологии совместно с НИИ медицинских материалов с памятью формы (г. Томск), предусматривающая использование имплантатов из никелида титана (TiNi). К несомненным достоинствам этого отечественного материала следует отнести превосходную биомеханическую совместимость с тканями организма, высокие прочностные и износоустойчивые характеристики, а также значительный интеграционный потенциал [1, 3].
Цель исследования – разработка и оценка эффективности методологии реконструкции обширных пострезекционных дефектов грудной стенки с использованием никелида титана у онкологических больных.
Материал и методы
В отделении общей онкологии Томского НИИ онкологии за период с 2007 по 2014 г. выполнено замещение пострезекционных дефектов грудной стенки с использованием оригинальных конструкций из никелида титана у 21 пациента, из них 11 мужчин и 10 женщин. Средний возраст – 50 лет (34–71 год). Морфологические варианты: рак кожи – 1, саркома мягких тканей – 4 (миксофибросаркома – 1, плеоморфная саркома – 3), костные саркомы – 8 (остеогенная саркома – 2, хондросаркома – 6), костные метастазы – 4 (светлоклеточный почечно-клеточный рак – 3, плоскоклеточный рак – 1), рак молочной железы – 2, десмоид – 1, фиброзная дисплазия – 1. У 10 (48 %) больных были рецидивные опухоли, с проведенным комбинированным лечением в анамнезе. Локализация опухолевого процесса – передне-верхние и боковые отделы грудной стенки. Инфильтрация кожи с изъязвлением, распадом опухоли и присоединением инфекции имелась в 4 (19 %) случаях.
Общее количество выполненных операций – 28. Всем больным выполнен хирургический этап лечения с одномоментной (n=19) или отсроченной реконструкцией (n=2) с использованием никелид-титановых имплантатов (сплавы марок ТН-10 и ТН-1П). Повторные операции выполнялись у 7 пациентов как по поводу рецидива опухоли, так и в связи с послеоперационными осложнениями, в этих случаях также применялись реконструктивные методики с использованием никелида титана.
Рентгенологический контроль за состоянием легких и положением конструкции осуществлялся с первых суток послеоперационного периода. Более детальная оценка состояния грудного каркаса проводилась при помощью СКТ (спиральный компьютерный томограф «Somatom Emotion-6», Siemens, Германия) спустя 3–4 нед после операции и далее по показаниям при контрольных осмотрах больных. Исследование функции внешнего дыхания проводилось через 3 нед и 3 мес после операции (Спирограф «CUSTO VIT M», Германия). Срок наблюдения больных от 6 мес до 4 лет.
Результаты и обсуждение
Удаление опухоли выполнялось в радикальном и условно-радикальном объеме с отступлением от определяемых границ опухоли и включением в блок резекции костных структур (ребер, грудины, ключиц), покровных и мягких тканей, ткани легкого, перикарда (табл. 1). Площадь дефекта реберного каркаса варьировала от 40 до 323 см2, в среднем – 127 см2. В обязательном порядке осуществлялся цитологический контроль с краев резекции. Для реконструкции каркаса использовались оригинальные конструкции из никелида титана, в том числе: пористо-проницаемые пластины, ткань из нити 60 мкм с размером ячеи 100–120 мкм, эндопротезы ребер. Реберный эндопротез состоял из цельнолитого сердечника (марка ТН-10) толщиной 1,4–2 мм, шириной 10 мм, покрытого пористыми пластинами
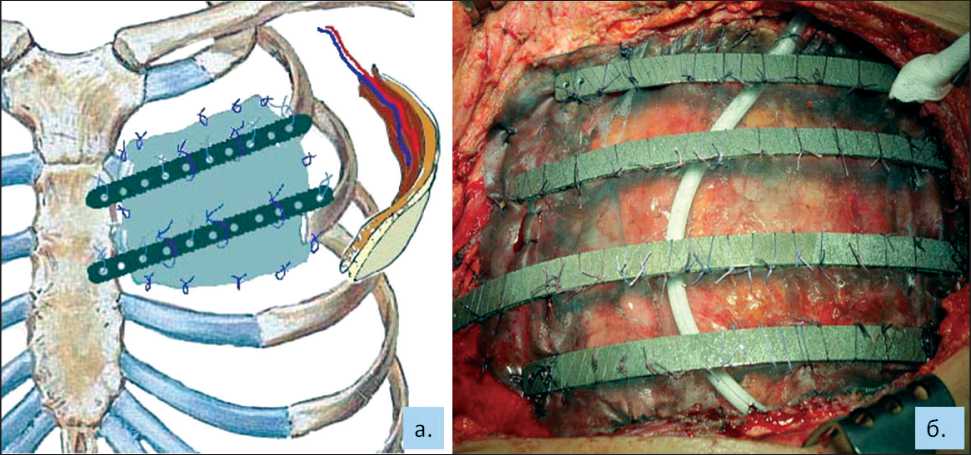
Рис. 1. Реконструкции грудной стенки с использованием тканевого имплантата и реберных эндопротезов из никелида титана. Схема (а). Вид операционной раны (б)
Таблица 1
|
Гистотип опухоли |
Объем резекции |
Размеры костного дефекта, мм |
Реконструкция каркаса (TiNiMo) |
Пластика мягких тканей |
Срок наблюдения, мес |
Повторные операции |
|
Диморфная карцинома |
R-I,II; L-I,II; рукоятка грудины, яремная, подключичная вена |
100×140 |
Ткань + пористые пластины |
ТДЛ |
42 |
1 |
|
Плеоморфная саркома G3 |
L-II,III,IV; 1/3 грудины; легкое |
140×100 |
Ткань + ребра |
ТДЛ |
76 |
2 |
|
Плеоморфная саркома G3 |
R-I,II,III, легкое |
150×120 |
Ребро + спицы |
- |
12 |
- |
|
Плеоморфная саркома G3 |
R-I,II,III; L-I,II,III; ключицы; ½ грудины; диафрагмальный нерв |
130×110 |
Ткань + ребра |
- |
12 |
1 |
|
Дедифференцированная хондросаркома |
Тело грудины |
100×140 |
Ткань + ребра |
- |
11 |
- |
|
Дедифференцированная хондросаркома |
Тело грудины; легкое |
120×100 |
Ткань + пористые пластины |
- |
8 |
- |
|
Остеосаркома |
L-I,II; рукоятка грудины; ключицы; перикард; перевязка наружных яремных вен |
100×110 |
Ткань + пористые пластины |
ТДЛ |
36 |
1 |
|
Хондросаркома |
Тело грудины; перикард |
190×170 |
Ткань + ребра |
ТДЛ |
15 |
- |
|
Остеосаркома |
L- II, III, IV, V; грудина, перикард |
160×150 |
Ткань + ребра |
ТДЛ |
12 |
- |
|
Метастаз рака почки |
R-III |
140×50 |
Ткань + ребра |
- |
12 |
- |
|
Хондросаркома |
L-VI,VII,VIII |
180×120 |
Ткань + ребра |
- |
21 |
1 |
|
Метастаз плоскоклеточного рака |
R-I,II; L-I,II; рукоятка грудины, ключицы |
120×100 |
Ткань + ребра |
ТДЛ |
20 |
- |
|
Метастаз рака почки |
Грудина |
100×140 |
Ткань + ребра |
- |
32 |
- |
|
Рак молочной железы |
L- III, IV, V |
60×68 |
Ткань + ребра |
ТДЛ |
11 |
- |
|
Миксофибросаркома |
R-IV,V,VI |
120×125 |
Ткань + ребра |
ТДЛ |
11 |
1 |
|
Десмоид |
L-II-III; ключица; лопатка, подключичные сосуды |
100×140 |
Ткань+ ребра |
Пластика артерии |
36 |
- |
|
Хондросаркома |
R-VI |
90×50 |
Ткань + полимерное ребро |
- |
8 |
- |
|
Фиброзная дисплазия |
R-II |
80×55 |
Ткань |
- |
6 |
- |
|
Рак молочной железы |
R-III,IV; L- V,VI,VII |
110×90 |
TINI ткань + ребра |
- |
6 |
- |
|
Хондросаркома |
L-II |
90×70 |
ребро |
- |
24 |
- |
|
Метастаз рака почки |
Грудина тело, R-II;III L-II,III; |
100×120 |
TINI ткань + ребра |
- |
7 |
- |
Объем резекции и варианты реконструкции грудной стенки
(марка ТН-1П), закрепленными никелид-титановой нитью. Протез имеет заданную кривизну и длину, изготавливается индивидуально. Применялись следующие варианты реконструкции: тканевой имплантат (n=2), пористые пластины + ткань (n=4), эндопротезы ребер без ткани (n=3), эндопротезы ребер с тканевым имплантатом (n=17) и тканевой имплантат с полимерным эндопротезом ребра (n=1).
В случае использования эндопротезов ребер без ткани фиксация осуществлялась внедрением конструкции в опил ребра и/или грудины, при использовании ткани последняя фиксировалась по периметру костного дефекта лигатурными швами
(викрил 2.0) с умеренным натяжением, далее к ткани подшивались эндопротезы ребер (рис. 1). Это способствовало восстановлению барьерной функции и обеспечивало прочную пространственную ориентацию реберных имплантатов.
Замещение дефектов мягких тканей осуществлялось местными кожно-фасциальными лоскутами или кожно-мышечными лоскутами с осевым кровоснабжением (торако-дорсальный лоскут (ТДЛ) – 8). Благодаря этому достигалась герметизация грудной полости и достаточная изоляция имплантатов. Использование конструкций из никелида титана позволило восстановить кар-
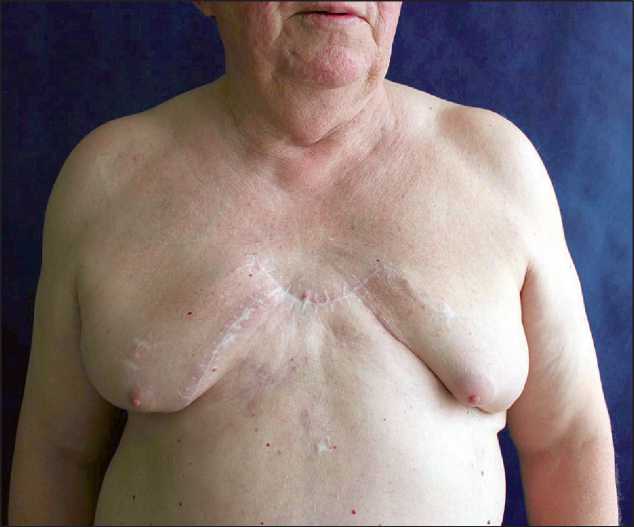
Рис. 2. Внешний вид больного спустя 4 года после реконструкции грудной стенки касную функцию грудной клетки во всех случаях. Отмечалось снижение амплитуды патологической флотации грудной стенки при использовании комбинации «ткань» и «ткань + пористо-проницаемая пластина» в 10 (36 %) наблюдениях. В случаях комбинированной реконструкции по схеме «ткань + эндопротезы ребер» (n=18, 64 %) флотация не определяется (рис. 2).
Течение ближайшего послеоперационного периода в подавляющем числе случаев – 27 (96,4 %) – было гладким. Постнаркозная депрессия купировалась в обычные сроки, при этом больные переводились на спонтанное дыхание без аппаратной поддержки в день операции. В раннем послеоперационном периоде в большинстве случаев признаков вентиляционной недостаточности не отмечалось. Больные активизировались на 2–3-и сут после операции. Все пациенты в послеоперационном периоде сохранили способность к самообслуживанию и выполнению обычной физической нагрузки. Лишь в одном случае в ближайшем послеоперационном периоде потребовалась продленная ИВЛ, связанная с неадекватной реконструкцией каркаса. У больной, перенесшей расширенное удаление грудины с резекцией диафрагмального нерва, в ближайшем послеоперационном периоде развились явления дыхательной недостаточности, обусловленные патологической флотацией грудной стенки и параличом диафрагмы. После установки дополнительных ребер жесткости из никелида титана, выполненной на 4-е сут после первой операции, каркасность грудной стенки удалось восстановить полностью, явления дыхательной недостаточности купированы, больная переведена на спонтанное дыхание.
По данным спирографии в раннем послеоперационном периоде через 3 нед после вмешательства, у 18 (86 %) больных были отмечены рестриктивные нарушения I–II степени; показатели жизненной емкости легких (ЖЕЛ) составили 67,3 ± 2,6 %; спустя 3 мес после операции вентиляционных нарушений выявлено не было; ЖЕЛ – 83,6 ± 2,9 %.
Общее количество послеоперационных осложнений периода составило 7 (25 %) наблюдений (табл. 2). Преобладали осложнения воспалительного характера, обусловленные тяжестью перенесенной операции – плевропневмония в 2 (7 %) случаях. Наиболее значимые осложнения, потребовавшие хирургической коррекции, зафиксированы в 3 (11 %) случаях, в том числе в одном случае выполнялась дополнительная установка эндопротезов ребер с целью купирования дыхательной недостаточности. Удаление имплантатов в отдаленном периоде выполнено в одном случае при нарушении целостности кожи над имплантатом по типу пролежня, что было обусловлено недостаточной толщиной покровных тканей, и в одном случае при смещении эндопротеза ребра в область печени. В случае дислокации реберного эндопротеза использовалась конструкция, состоящая только из цельнолитого сердечника без пористой «рубашки». При установке эндопротезов ребер с пористой оболочкой в сочетании с тканевыми имплантатами отмечалось стабильное положение конструкции на протяжении всего периода наблюдения, подтвержденное рентгенологическим исследованием (рис. 3). Отдельно следует отметить возможности послеоперационной визуализации области реконструкции – материал является амагнитным
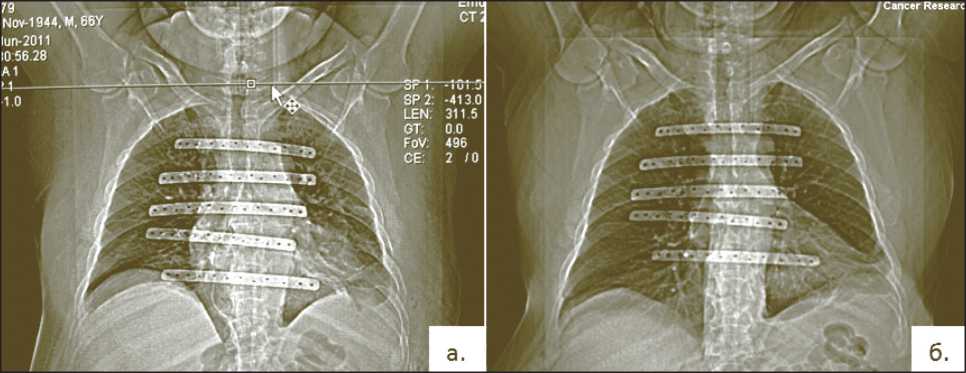
Рис. 3. Послеоперационный контроль. Обзорная рентгенография грудной клетки. Через 4 сут (а). Через 4 года (б)
Таблица 2
Частота послеоперационных осложнений
Развившиеся осложнения мы не связываем с физико-химическими свойствами материала, напротив, в одном случае при формировании дефекта покровных тканей над пористой конструкцией из никелида титана в результате краевого некроза лоскута удалось добиться эпителизации раны консервативно. Следует отметить, что описанные осложнения были выявлены на этапах отработки методики, а именно в тех случаях, когда реконструкция больших по площади дефектов реберного каркаса (≥60 см2) выполнялась с раздельным использованием жестких и тканевых никелид-титановых имплантатов. Варианты комбинированной реконструкции – никелид-титановые «ребра + ткань» в сочетании с кожно-мышечной пластикой позволили достичь формирования стабильного каркаса, адекватной герметизации плевральных полостей и хорошей изоляции имплантатов от внешней среды достаточным объемом мягких тканей, что устранило опасность развития подобных осложнений. Более того, представленная схема реконструкции предполагает малотравматичную установку дополнительных имплантатов, в частности эндопротезов ребер, при необходимости.
Местные рецидивы выявлены у 11 (52 %) больных. В большинстве случаев рецидивы были повторными (8/11, 73 %). Морфологическая структура рецидивных опухолей: саркома мягких тканей (4/4), остеосаркома (2/2), хондросаркома (3/6), рак кожи (1/1), десмоид (1/1). Сроки выявления местных рецидивов варьировали от 5 до 12 мес, в среднем – 9 мес. Во всех случаях тактика ведения больных с рецидивами определялась индивидуально в зависимости от распространенности процесса и гистологического типа опухоли. Хирургическое лечение местных рецидивов выполнено 5 пациентам. В результате прогрессирования опухолевого процесса умерло 11 больных. Живы 10 (48 %) из 21 пролеченного больного. Достаточно большая частота местных рецидивов связана, прежде всего, с наличием у большинства пациентов местнораспространенных высокозлокачественных новооб- разований, подвергшихся исходно нерадикальной операции.
Представленная методика реконструкции «ткань + эндопротезы ребер» имеет ряд весьма значимых преимуществ по сравнению с другими методами (системы «STRATOS», «SYNTHES»): никелид-титановые реберные эндопротезы обладают физическими характеристиками, близкими к характеристикам костной ткани – высокая прочность и упругость материала позволяют сохранять заданную форму неограниченно долго. Особый способ интраоперационной лигатурной фиксации имплантатов абсорбируемым шовным материалом отличается простотой и не требует специального инструментария, в то же время он позволяют достичь первичной стабилизации конструкции без жесткого контакта с ребрами, что, несомненно, снижает травматичность операции. Стабильное положение элементов конструкции в отдаленном послеоперационном периоде свидетельствует о формировании вторичной фиксации за счет прорастания собственных тканей в пористые структуры имплантата. На наш взгляд, подобная схема является наиболее физиологичной, обеспечивающей достаточную свободу экскурсии грудной клетки. Необходимо отметить, что имплантаты, замещающие дефекты реберного каркаса, следует рассматривать как незаменяемые, пожизненные конструкции, поэтому используемые материалы должны отвечать особым требованиям. К ним можно отнести деформационную и коррозионную устойчивость, низкую флагогенность, биологическую совместимость с тканями организма, высокий интеграционный потенциал. Многолетний опыт клинического применения никелида титана в хирургической практике и результаты нашего исследования показывают наличие требуемых свойств у этого материала.
Заключение
Представленная методология, сочетающая использование никелид-титановых конструкций и комплексов аутотканей с осевым типом кровоснабжения, позволяет проводить специальное лечение при первичных и рецидивных злокачественных новообразованиях грудной стенки, имеющих обширное местное распространение, с хорошим функциональным результатом.
Список литературы Реконструкция грудной стенки с использованием никелида титана у онкологических больных
- Гюнтер В.Э., Ходоренко В.Н., Ясенчук Ю.Ф., Чекалкин Т.Л., Овчаренко В.В. Никелид титана. Материал нового поколения. Томск, 2006. 295 с
- Давыдов М.И., Алиев М.Д., Тепляков В.В., Полоцкий Б.Е., Стилиди И.С., Соболевский В.А., Карпенко В.Ю. Лечение местнораспространенных опухолей грудной стенки. Два случая из практики//Вестник РОНЦ им. Н.Н. Блохина РАМН. 2003. № 2-1. С. 93-96
- Ланшаков В.А., Гюнтер В.Э., Плоткин Г.Л., Фомичев Н.Г., Дамбаев Г.Ц. Имплантаты с памятью формы в травматологии и ортопедии. Томск, 2004. С. 144-151
- Тепляков В.В., Карпенко В.Ю., Илюшин А.Л., Донскова Ю.С., Собченко Л.А., Долгова С.Г., Епифанова С.В., Державин В.А., Бухаров А.В., Бондарев А.В. Хирургическое лечение злокачественных опухолей грудной стенки//Хирургия. Журнал им. Н.И. Пирогова. 2010. № 9. С. 36-41
- Abraham V.J., Devgarha S., Mathur R.M., Sisodia A., Yadav A.Dedifferentiated Chondrosarcoma of the Rib Masquerading as a Giant Chest Wall Tumor in a Teenage Girl//Korean J. Thorac. Cardiovasc. Surg. 2014. Vol. 47 (4). P. 427-430 DOI: 10.5090/kjtcs.2014.47.4.427
- Akiba T., Marushima H., Nogi H., Kamiya N., Kinoshita S., Takeyama H., Morikawa T. Chest Wall Reconstruction using Gore-Tex® Dual Mesh//Ann. Thorac. Cardiovasc. Surg. 2012. Vol. 18 (2). P. 166-169
- Bagheri R., Haghi S.Z., Kalantari M.R., Sharifian Attar A., Salehi M., Tabari A., Soudaneh M. Primary malignant chest wall tumors: analysis of 40 patients//J. Cardiothorac. Surg. 2014. Vol. 9. P. 106 DOI: 10.1186/1749-8090-9-106
- Bennett D.T., Weyant M.J. Extended chest wall resection and reconstruction in the setting of lung cancer//Thorac Surg Clin. 2014. Vol. 24 (4). P. 383-390 DOI: 10.1016/j.thorsurg.2014.07.002
- Bernard J. Park, Raja M. Flores. Chest Wall Tumors//General Thoracic Surgery/Ed. by Thomas W. Shields, Joseph LoCicero, Carolyn E. Reed, Richard H. Feins. Lippincott Williams & Wilkins. 2011. P. 669-672
- Berthet J.P., Canaud L., D’Annoville T., Alric P., Marty-Ane C.H. Titanium plates and Dualmesh: a modern combination for reconstructing very large chest wall defects//Ann. Thorac. Surg. 2011. Vol. 91 (6). P. 1709-1716 DOI: 10.1016/j.athoracsur.2011.02.014
- Berthet J.P., D’Annoville T., Canaud L., Marty-Ané C.H. Use of the titanium vertical ribs osteosynthesis system for reconstruction of large posterolateral chest wall defect in lung cancer//Interact. Cardiovasc. Thorac. Surg. 2011. Vol. 13 (2). P. 223-225 DOI: 10.1510/icvts.2011.269175
- Chudacek J., Bohanes T., Szkorupa M., Klein J., Stasek M., Zalesak B., Stehlik D., Ctvrtlík F., Neoral C. Strategies of treatment of chest wall tumors and our experience//Rozhl. Chir. 2015. Vol. 94 (1). P. 17-23
- Daigeler A., Harati K., Goertz O., Hirsch T., Behr B., Lehnhardt M., Kolbenschlag J. Thoracic Wall Reconstruction in Advanced Breast Tumours//Geburtshilfe Frauenheilkd. 2014. Vol. 74 (6). P. 548-556
- David E.A., Marshall M.B. Review of Chest Wall Tumors: A Diagnostic,Therapeutic, and Reconstructive Challenge//Semin. Plast. Surg. 2011. Vol. 25 (1). P. 16-24 DOI: 10.1055/s-0031-1275167
- Gonfiotti A., Santini P.F., Campanacci D., Innocenti M., Ferrarello S., Caldarella A., Janni A. Malignant primary chest-wall tumours: techniques of reconstruction and survival//Eur. J. Cardiothorac. Surg.2010. Vol. 38 (1). P. 39-45 DOI: 10.1016/j.ejcts.2009.12.046
- Kaplan K., Chopra K., Feiner J., Gastman B. Chest wall reconstruction with strattice in an immunosuppressed patient//Eplasty. 2011. Vol. 11: e46
- Khalil el-SA., El-Zohairy M.A., Bukhari M. Reconstruction of Large Full Thickness Chest Wall Defects Following Resection of Malignant Tumors//J. Egypt. Nat. Cancer Inst. 2010. Vol. 22 (1). P. 19-27
- Leuzzi G., Cesario A., Novellis P., Nachira D., Margaritora S., Vita M.L., Granone P. Chest Wall Reconstruction: Impact of GoreTex®Dual-Mesh Prosthesis on Respiratory Function//Ann. Thorac. Cardiovasc. Surg. 2012. Vol. 8 (6). P. 582-583
- Mahabir R.C., Butler C.E. Stabilization of the Chest Wall: Autologous and Alloplastic Reconstructions//Semin. Plast. Surg. 2011. Vol. 25 (1). P. 34-42 DOI: 10.1055/s-0031-1275169
- Mansour K.A., Thourani V.H., Losken A., Reeves J.G., Miller J.I. Jr., Carlson G.W., Jones G.E. Chest wall resections and reconstruction: a 25-year experience//Ann. Thorac. Surg. 2002. Vol. 73 (6). P. 1720-1726
- Matsumoto K., Sano I., Nakamura A., Morino S., Yamasaki N., Tsuchiya T., Miyazaki T., Nagayasu T. Anterior chest wall reconstruction with titanium plate sandwiched between two polypropylene sheets//Gen. Thorac. Cardiovasc. Surg. 2012. Vol. 60 (9). P. 590-592 DOI: 10.1007/s11748-012-0048-9
- Nagayasu T., Yamasaki N., Tagawa T., Tsuchiya T., Miyazaki T., Nanashima A., Obatake M., Yano H. Long-term results of chest wall reconstruction with DualMesh//Interact. Cardiovasc. Thorac. Surg. 2010. Vol. 11 (5). P. 581-584 DOI: 10.1510/icvts.2010.242040
- Nazerali R., Rogers J., Canter R., Hinchcliff K.M., Stevenson T.R. The use of polypropylene mesh in chest wall reconstruction; a novel approach//J. Plast. Reconstr. Aesthet. Surg. 2015. Vol. 68 (2). P. 275-276 DOI: 10.1016/j.bjps.2014.09.036
- Sauerbier M., Dittler S., Kreutzer C. Microsurgical Chest Wall Reconstruction After Oncologic Resections//Semin. Plast. Surg. 2011. Vol. 25 (1). P. 60-69 DOI: 10.1055/s-0031-1275172
- Takahashi N. Reconstructive method after resection of chest wall, diaphragm and pericardium, mainly using Composix-mesh//Kyobu Geka. 2014. Vol. 67 (11). P. 995-1001


